Клеточная модель для тестирования препаратов, аффинных к PD-L1 человека
Цель исследования — создание и испытание клеточной модели, предназначенной для in vitro и in vivo тестирования специфичности препаратов, аффинных к PD-L1 человека.
Материалы и методы. Генно-модифицированные клетки, экспрессирующие PD-L1 человека (штамм CT26-PD-L1), получали методом ретровирусной трансдукции клеток мышиной карциномы CT26. Активность гена PD-L1 оценивали методом полимеразной цепной реакции в режиме реального времени; экспрессию PD-L1 на клетках выявляли с помощью проточной цитофлуориметрии. Испытания клеток проводили с использованием рекомбинантных однодоменных антител (наноантител) против PD-L1 человека, конъюгированных с радиоизотопами 68Ga или 177Lu. In vitro оценивали содержание иммунореактивной фракции и интернализацию клетками радиоконъюгатов. In vivo клетки CT26-PD-L1 трансплантировали мышам; на 9–14-е сутки вводили радиоиммуноконъюгаты; через 1–48 ч извлекали опухоли и проводили их прямую радиометрию. Контролем в экспериментах служили интактные клетки CT26, не экспрессирующие антиген.
Результаты. Создан штамм CT26-PD-L1 опухолевых клеток мышей, экспрессирующих на мембране PD-L1 человека. При трансплантации интактным мышам BALB/c или сублетально облученным мышам F1(DBA×BALB/c) клетки штамма формировали опухоли. Таким образом, существенным достоинством модели стала возможность проведения in vivo тестирования аффинных к PD-L1 человека препаратов на животных в условиях конвенционального вивария. При введении радиоиммуноконъюгатов мышам радионуклиды накапливались в опухолях из трансплантированных клеток CT26-PD-L1, но не из клеток CT26. Клетки CT26-PD-L1 in vitro интернализировали аффинные к PD-L1 наноантитела. Благодаря высокой плотности молекул-мишеней клетки CT26-PD-L1 позволили в рамках одного тестирования подтверждать специфичность препарата и количественно оценивать мишень-связывающую фракцию конъюгатов.
Заключение. Созданные клетки являются первыми отечественными генно-инженерными клетками, предназначенными для оценки препаратов, аффинных к PD-L1 человека. Результаты испытаний подтвердили пригодность модели для in vitro и in vivo тестирования специфичности нацеленных на PD-L1 человека препаратов.
Введение
Среди молекул, участвующих в регуляции иммунного ответа, существенную роль играет пара рецептор–лиганд PD-1/PD-L1. Связывание рецептора PD-1 на мембранах T-лимфоцитов с лигандом PD-L1 антиген-презентирующих клеток приводит к ингибированию пролиферации, продукции цитокинов и цитотоксической функции T-лимфоцитов, что в норме предотвращает развитие аутоиммунных реакций, хронического воспаления, а также ограничивает развитие специфического иммунного ответа при беременности [1–5]. Этот же механизм используется опухолевыми клетками для избегания иммунного ответа. PD-L1 представлен на клетках карциномы легких, опухолей головного мозга, щитовидной железы, тимуса, молочной железы, желудочно-кишечного тракта, печени, поджелудочной железы, почек, коры надпочечников, мочевого пузыря, яичников, плоскоклеточного рака головы и шеи, меланомы [4–8]. Высокой экспрессией PD-L1 обладают клетки солидных опухолей, резистентные к лучевой и химиотерапии [8–11]. На сегодняшний день PD-L1 рассматривают в качестве основной мишени для таргетной терапии различных нозологических форм рака в дополнение к традиционным методам лечения. Однако до сих пор нет стандартной доклинической модели для in vivo и in vitro тестирования специфичности и эффективности разрабатываемых препаратов, аффинных к данному биомаркеру.
Существует две стратегии анти-PD-L1 терапии (PD-L1-направленной терапии). Первая основана на применении антител, их фрагментов и малых молекул, которые специфично взаимодействуют с PD-L1 и предотвращают его связывание с PD-1, что способствует реактивации противоопухолевого иммунного ответа. Вторая заключается в использовании аффинных молекул для адресной доставки в опухоль радионуклидов, токсинов, цитостатиков и т.д. и направлена прежде всего на уничтожение опухолевых клеток, экспрессирующих PD-L1 [12]. От стратегии зависит выбор биологической модели для оценки фармакологического действия лекарственного препарата, направленного на PD-L1. При тестировании иммунотерапевтического потенциала препаратов необходимы иммунокомпетентные животные, в идеале с гуманизированной иммунной системой, однако их использование сильно ограничено сложностью и высокой стоимостью получения таких моделей. Оценка же противоопухолевого действия конъюгатов таргетных молекул с фармакологически активными веществами может проводиться на животных с разным иммунологическим статусом. В этом случае для подтверждения специфической тропности и активности разрабатываемого препарата in vivo достаточно более простых моделей.
В последние годы все более прочное положение занимает неинвазивная диагностика локализации и распространенности опухолевого процесса с помощью аффинных молекул, конъюгированных с радионуклидами. Для этого разрабатываются радиофармакологические препараты, таргетные к разным биомаркерам-мишеням и несущие различные по характеристикам радиоизотопы. В процессе конъюгации с радионуклидами часть аффинных молекул утрачивает способность специфически взаимодействовать с мишенью, что снижает эффективность создаваемого препарата. Таким образом, ключевым этапом при тестировании становится количественная оценка мишень-связывающей фракции препарата [13, 14]. На практике для ее определения in vitro применяют несколько методов. Так, быстрым и воспроизводимым является метод, основанный на использовании магнитных частиц, покрытых молекулами биомаркера [14, 15]. Однако в силу различий в пространственной конфигурации этих молекул на мембране опухолевых клеток и на поверхности магнитных частиц требуется дополнительное подтверждение специфичности препарата с помощью тестирования на клетках. Кроме того, магнитные частицы не могут быть использованы для тестирования препаратов in vivo. Клеточными моделями, применимыми для тестирования конъюгатов аффинных молекул in vitro и in vivo, являются культивируемые линии опухолевых клеток человека. Однако число молекул биомаркеров на их мембране, как правило, невелико, что не позволяет количественно оценивать мишень-связывающую фракцию препарата in vitro [14]. Необходимость использования для прививки иммунодефицитных мышей (BALB/c nude, SCID, NOD-SCID и др.) ограничивает применение клеток человека in vivo. При этом имеется прямая зависимость между выраженностью иммунодефицита у животных и эффективностью трансплантации и роста опухолей [16]. Чем глубже иммунодефицит и чем больше компонентов иммунной системы он затрагивает, тем выше стоимость таких животных, их содержание и проведение экспериментов.
Альтернативными моделями в последние годы стали созданные методами генной инженерии опухолевые клетки мышей, несущие на мембране биомаркеры человека. Реципиентами таких гуманизированных клеток в зависимости от свойств молекул-биомаркеров, а также от использованных мышиных опухолевых клеток могут служить мыши с разным иммунологическим статусом, в том числе полностью иммунокомпетентные животные. Этот подход уже получил признание за рубежом, что подтверждается научными публикациями, а также коммерческими предложениями по продаже культивируемых мышиных клеток, несущих на мембране биомаркеры человека [17–32]. Насколько нам известно, в России пока не созданы генно-инженерные клеточные модели, предназначенные для in vitro и in vivo тестирования препаратов, аффинных к PD-L1 человека.
Цель настоящей работы — создание и испытание клеточной модели, предназначенной одновременно для in vitro и in vivo тестирования специфичности препаратов, аффинных к PD-L1 человека.
Материалы и методы
Клеточные линии и условия культивирования. В работе использованы линии опухолевых клеток человека разного гистогенеза (NC-37, IM-9, RPMI 1788, T2, T24, U-2 OS, R1, EA.hy926, A172, Capan-2, U937, HEPG2, RD, MIA PaCa-2, U266, Kg-1, THP-1, A549, Jurkat, Namalwa, MeWo, CaCo2, Mg-63, SK-N-MC, MCF7, T98G, HL-60, Y79), а также «пакующая» клеточная линия Platinum-E для ретровирусной трансдукции (Cell Biolabs Inc., США). Для создания гуманизированных клеток использовали мышиные клетки линии CT26 (карцинома кишечника мышей BALB/c). Все клеточные культуры хранились в криобанке лаборатории и были протестированы на отсутствие контаминации микоплазмами, бактериями и грибами. Клетки культивировали в планшетах и пластиковых флаконах (Jet Biofil, Китай; Orange Scientific, Бельгия; Nunc, Дания) в термостатах при 37°C, 6% CO2 и 100% влажности. Монослойные культуры выращивали в среде DMEM/F12, DMEM/Glucose 4,5 г/л/HEPES с добавлением L-глутамина («ПанЭко», Россия) или α-MEM («БиолоТ», Россия), суспензионные культуры — в среде RPMI-1640 («ПанЭко», Россия). Полная среда содержала 5–10% сыворотки эмбрионов коров (BioWest, Франция). Клетки Platinum-E выращивали в присутствии селективных антибиотиков: 1 мкг/мл пуромицина и 10 мкг/мл бластицидина для стабильной продукции ретровирусных частиц. При пересеве монослойных культур клетки снимали с поверхности с помощью 0,25% раствора трипсина с версеном («БиолоТ», Россия).
Препараты, аффинные к PD-L1 человека. Аффинные к PD-L1 человека препараты, использованные в работе, представляли собой рекомбинантные однодоменные тяжелоцепные антитела (наноантитела, VHH) («Иннова плюс», Россия) с молекулярной массой 10–15 кДа, синтезированные в клетках Escherichia coli. На их основе в ФГБУ «Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова» были приготовлены радиоконъюгаты с использованием изотопа 68Ga ([68Ga]Ga-VHH-PD-L1) или изотопа 177Lu ([177Lu]Lu-VHH-PD-L1). Радиохимическая чистота препаратов составляла >95%.
Оценка активности гена PD-L1 человека. Из клеток выделяли тотальную РНК с помощью TRIzol Reagent (Life Technologies, США) согласно рекомендациям производителя. На основе полученной РНК проводили синтез кДНК методом обратной транскрипции с помощью random-праймеров и ревертазы вируса мышиной лейкемии M-MuLV RNase(«СибЭнзим», Россия) в соответствии с рекомендациями производителя фермента. Синтезированную кДНК использовали для оценки активности гена PD-L1 человека в клетках методом полимеразной цепной реакции в режиме реального времени, применяя прямые (TGGCATTTGCTGAACGCATTT) и обратные (TGCAGCCAGGTCTAATTGTTTT) праймеры. Уровень активности гена представляли в виде разницы (ΔCt) между пороговым циклом гена PD-L1 и гена сравнения GAPDH, где Ct — пороговый цикл, соответствующий числу циклов амплификации, необходимых для достижения порогового значения флуоресценции.
Получение линии опухолевых клеток мышей, экспрессирующих на мембране PD-L1 человека. Донора нуклеотидной последовательности, кодирующей PD-L1,подбирали среди культур клеток человека, хранившихся в криобанке лаборатории. Амплификацию кДНК PD-L1 проводили с помощью прямого (ATGTCTGCGGCCGCCatgggtgtcaaggtattatttgccctgatatgcattgctgtggcagaggcaTTTACTGTCACGGTTC) и обратного (ATTACTGAATTCGATCAGAAGTTCCAATGCTGG) праймеров (полужирным шрифтом выделены сайты рестрикции нуклеаз; строчными буквами — введенная сигнальная последовательность люциферазы Gaussia princeps для оптимальной экспрессии целевого белка; подчеркнуты последовательности, комплементарные PD-L1). Полученную последовательность клонировали в ретровирусный вектор pQCXIP (Clontech, США), содержащий ген устойчивости к селективному антибиотику пуромицину. Вектором трансфицировали клетки-«упаковщики» вирусных частиц Platinum-E, используя кальций-фосфатный метод. Содержащую ретровирусные частицы культуральную жидкость применяли для трансдукции клеток СТ26. Селекцию клеток, стабильно экспрессирующих на мембране PD-L1, проводили, добавляя в ростовую среду пуромицин.
Проточная цитофлуориметрия. Экспрессию PD-L1 на клеточных мембранах выявляли методом проточной цитофлуориметрии с помощью меченных фикоэритрином антител против PD-L1 человека (BioLegend, США). Клетки анализировали на проточном цитофлуориметре BD FACS AriaIII с использованием программного обеспечения BD FACS Diva software v. 7.0 (BD Biosciences, США).
Определение скорости роста клеточных культур. Для определения скорости роста клеточных культур рассчитывали время удвоения численности клеток (Td) по формуле: Td=dt·ln2/ln(N/N0), где dt — время культивирования клеток от посева до снятия культуры, ч; N — количество клеток при снятии культуры, N0 — количество клеток при посеве культуры. Количество клеток оценивали с помощью кондуктометрического счетчика Z1 Coulter Counter (Beckman Coulter, США).
Оценка интернализации клетками радиоконъюгатов. Клетки наращивали в культуральных флаконах до достижения 70% конфлюента. Затем проводили полную замену ростовой среды и к клеточному монослою добавляли радиоконъюгат на основе наноантител (0,1 мкг наноантител на 2 млн клеток, 50 кБк). Клетки инкубировали в течение 30 или 100 мин при 37°С. По истечении указанного времени отбирали культуральную жидкость и дважды отмывали клетки фосфатно-солевым буфером от несвязавшегося радиоконъюгата. Фракцию препарата, связанную с мембранным рецептором, получали путем инкубации клеток с 50 мМ раствора глицина в фосфатно-солевом буфере, содержащем 0,1 М NaCl (pH=2,8). Интернализованную фракцию собирали после лизиса клеток с использованием 1N раствора NaOH и последующей нейтрализации 1N HCl. Радиоактивность полученных фракций определяли с помощью радиометра Triathler (Hidex Oy, Финляндия). Все значения радиоактивности пересчитывали для времени измерения первого образца (нулевой временной точки) по формуле: A0=At·eλt, где A0 — радиоактивность образца в нулевой точке, Аt — радиоактивность образца, измеренная через t минут после начала измерения (измерения первого образца), λ — постоянная радиоактивного распада. Величину фракций выражали в процентах от общей добавленной к клеткам радиоактивности.
Определение мишень-связывающей (иммунореактивной) фракции радиоконъюгатов. Мишень-связывающую фракцию радиоконъюгатов определяли путем инкубации радиомеченных наноантител (в постоянной концентрации 0,25 мкг/мл) с антиген-экспрессирующими клетками, концентрация которых в суспензиях была переменной величиной (0,3–20 млн/мл). Затем клетки отмывали от несвязавшегося с биомаркером радиоконъюгата, и во всех образцах определяли радиоактивность, как описано выше. Величину иммунореактивной фракции вычисляли как отношение связанной с клетками радиоактивности (B) к исходно внесенной в пробу радиоактивности (T) при достижении избытка антигена и выражали в процентах.
Модель мышиной опухоли, экспрессирующей PD-L1 человека. Эксперименты in vivo выполняли на мышах BALB/c и F1(DBA×BALB/c) обоего пола, которых содержали в стандартных условиях в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. В день начала опыта мышей F1(DBA×BALB/c) облучали на терапевтическом рентгеновском аппарате в дозе 5 Гр. Эта доза облучения снижала иммунореактивность, но не вызывала гибели мышей в течение 6 мес и позволяла содержать животных и проводить эксперименты в условиях конвенционального вивария. При трансплантации контрольные опухолевые клетки, не несущие PD-L1 человека, вводили мышам подкожно в область левой боковой складки, тогда как клетки, экспрессирующие PD-L1, — симметрично в правый бок. Объем опухолей (V) рассчитывали по формуле: V=(L·W·H)·0,52, где L — длина опухоли, W — ширина опухоли, H — высота опухоли [16]. Контроль сохранения биомаркера на клетках опухоли проводили на 13–18-е сутки после инъекции, для чего мышей умерщвляли гуманным способом, извлекали у них опухолевые узлы и выделяли клетки с помощью аппарата BDTM Medimachine System и сменных модулей Medicon, 50 мкм(BD Biosciences, США). Клеточные суспензии фильтровали через фильтр Filcon, 70 мкм (BD Biosciences, США), затем клетки отмывали центрифугированием в фосфатно-солевом буферном растворе, содержащем 3% сыворотки эмбрионов коров и 0,1% азид натрия. Экспрессию PD-L1 человека на клетках определяли сразу после извлечения из опухолевого узла, а также после культивирования в течение 2 нед в отсутствие селективного антибиотика пуромицина. Методом проточной цитофлуориметрии определяли процентное содержание PD-L1+-клеток, а также распределение клеток по интенсивности флуоресценции, что отражало плотность молекул биомаркера на мембранах.
Оценка связывания радиоконъюгатов с генно-модифицированными клетками in vivo. Специфичность связывания радиоконъюгатов с мишенями in vivo оценивали методом прямой радиометрии после внутривенного введения животным наноантител, меченных изотопами (0,6 МБк/мышь). Через 1, 4, 24 и 48 ч после инъекции препарата мышей умерщвляли, извлекали опухоли и определяли их радиоактивность при помощи радиометра Triathler (Hidex Oy, Финляндия). Для контрольных опухолей CT26 и опухолей, несущих PD-L1, рассчитывали накопление радионуклида на 1 г ткани в процентах от введенной активности.
Статистическая обработка данных. При статистической обработке экспериментальных данных использовали пакет программ Statistica 10.0. Данные представлены в виде медианы [Q1; Q3], что было обусловлено малым размером выборок (n<10). Для оценки различий между двумя независимыми выборками использовали U-критерий Манна–Уитни. Значение p<0,05 считали статистически значимым. Все результаты получены не менее чем в трех повторах.
Результаты
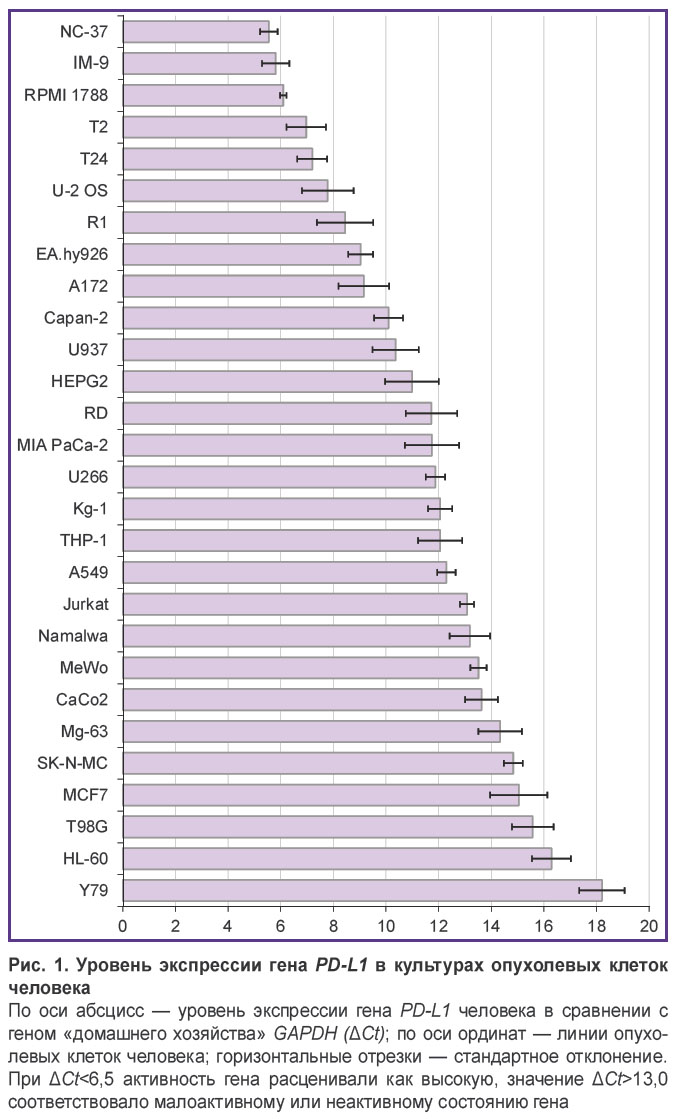
Экспрессия гена PD-L1 была оценена методом полимеразной цепной реакции в режиме реального времени в 28 клеточных линиях опухолей человека, среди которых были опухоли эпителиального, нейронального и соединительно-тканного происхождения (рис. 1). Больше половины исследованных опухолей экспрессировали ген PD-L1; наиболее высокий уровень транскрипциибыл выявлен в B-лимфобластоидных клеточных линиях NC-37, IM-9 и RPMI 1788. Клетки NC-37 послужили источником РНК-матрицы для получения кДНК, кодирующей биомаркер PD-L1.
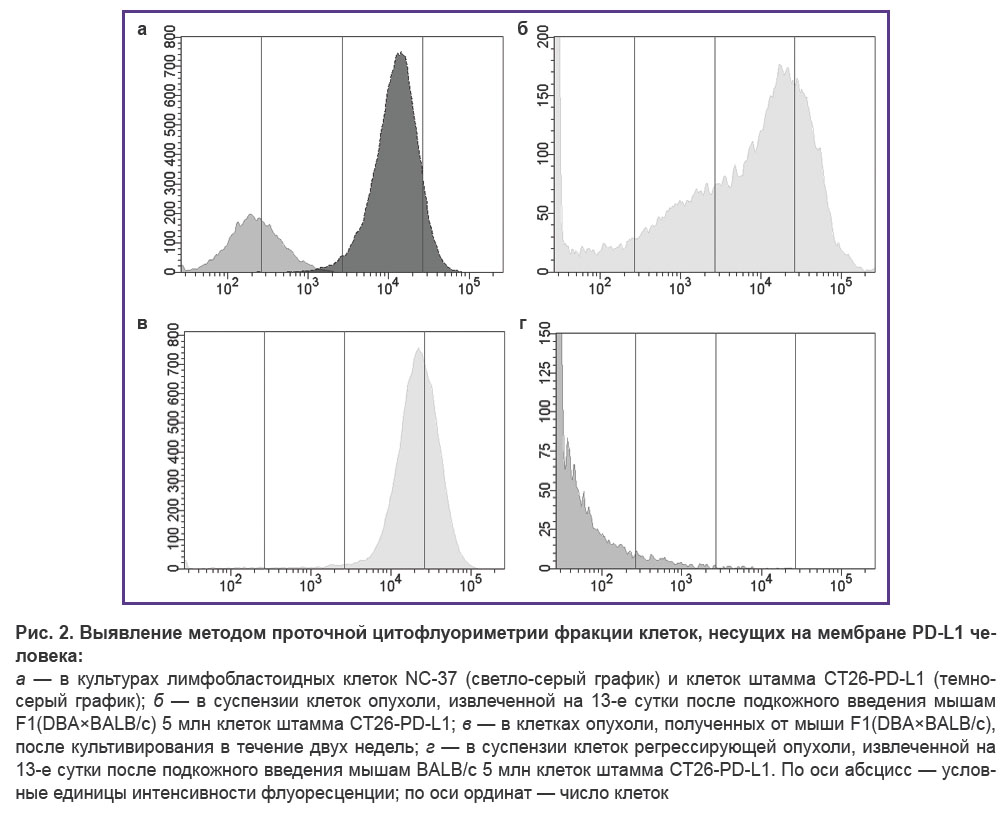
Праймеры, предназначенные для амплификации фрагмента кДНК, кодирующего полноразмерную мембранную форму белка PD-L1, были сконструированы на основе аннотированной нуклеотидной последовательности NM_014143.4 (GenBank NCBI, США). Клетками-реципиентами гена PD-L1 человека служили опухолевые клетки CT26, представлявшие собой карциному кишечника мышей линии BALB/c. Амплифицированную последовательность кДНК PD-L1 человека вводили в клетки CT26 методом ретровирусной трансдукции. Отбор трансдуцированных клеток проводили, добавляя в ростовую среду пуромицин. Клетки полученного штамма, названного СТ26-PD-L1, росли в культуре в виде монослоя и имели фибробластоподобную форму; время удвоения культуры составляло 33,50±5,07 ч. По этим параметрам данные клетки не отличались от родительских клеток CT26. Активность гена PD-L1 в клетках СТ26-PD-L1 (ΔCt=0,36) соответствовала активности гена «домашнего хозяйства» (GAPDH мыши) и на порядок превышала этот показатель для лимфобластоидных клеток NC-37, которые служили донорами гена (ΔCt=5,5). По данным проточной цитофлуориметрии, штамм СТ26-PD-L1 содержал 99,8% клеток, экспрессирующих PD-L1 человека; в культуре NC-37 этот биомаркер имели 40,4% клеток. Медиана интенсивности флуоресценции клеток, являющаяся показателем плотности молекул антигена на мембране, для клеток NC-37 была на два порядка ниже, чем для генно-модифицированных клеток СТ26-PD-L1 (рис. 2, а). Родительские клетки мыши (CT26), на основе которых был создан штамм, не имели на мембране молекул PD-L1 человека и служили отрицательным контролем при постановке экспериментов.
Для оценки стабильности экспрессии биомаркера человека на клетках CT26-PD-L1 популяция клеток 4-го пассажа была разделена на две части. Одну из них культивировали и рассевали в среде, содержащей селективный агент пуромицин, тогда как вторую культивировали в отсутствие антибиотика. На 16-м пассаже культивирования клеток активность гена PD-L1 и экспрессия мембранного биомаркера в обеих клеточных культурах соответствовали исходным показателям, что указывало на стабильность штамма.
Для создания модели опухоли, экспрессирующей PD-L1 человека, клетки CT26-PD-L1 вводили подкожно интактным мышам BALB/c или сублетально облученным мышам F1(DBA×BALB/c). Через 9–13 сут после инъекции 5 млн клеток у 100% облученных мышей F1(DBA×BALB/c) формировались пальпируемые опухолевые образования. У мышей BALB/c эффективность прививки клеток CT26-PD-L1 была существенно ниже; на этот срок прогрессирующий рост опухолей отмечали только у 23% мышей. У остальных животных к 13 сут после введения клеток уже образовавшиеся опухоли претерпевали регресс или формирования опухоли не происходило (69 и 8% мышей соответственно). В случае роста опухолей у мышей BALB/c объем новообразований на 13-е сутки составлял 133,6 [74,9; 243,4] мм3, что существенно меньше объема опухолей у облученных мышей F1(DBA×BALB/c) — 898,6 [393,1; 1755,0] мм3. Исследование методом проточной цитометрии суспензий клеток, полученных из опухолей мышей F1(DBA×BALB/c), показало, что 43,7–49,8% клеток экспрессировали на мембране PD-L1 человека (рис. 2, б). Клеточные суспензии, выделенные из опухолей мышей, эксплантировали в условия культивирования in vitro и через две недели повторно оценивали число клеток, несущих на мембране PD-L1 человека. Содержание PD-L1+-клеток увеличивалось до 98,5%, при этом наблюдали восстановление интенсивности флуоресценции (плотности биомаркера на мембране), свойственное исходным культивируемым клеткам до их трансплантации мышам (рис. 2, в). Это свидетельствовало о стабильном сохранении в созданной in vivo модели экспрессии PD-L1 генно-модифицированными клетками. В регрессирующих опухолях у мышей BALB/c только 4,2% клеток несли на мембране биомаркер (рис. 2, г). Таким образом, воспроизводимый рост опухоли, сохраняющей экспрессию PD-L1 человека, демонстрировал преимущество использования сублетально облученных мышей F1(DBA×BALB/c) по сравнению с интактными мышами BALB/c.
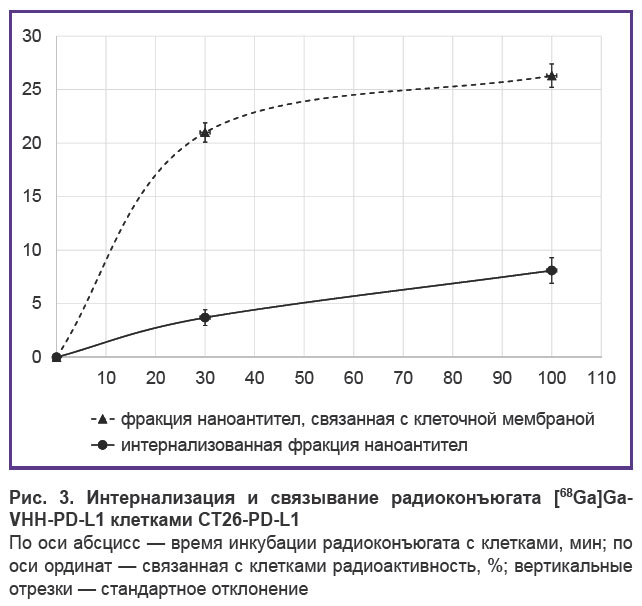
Возможность использования генно-модифицированных клеток для оценки специфичности связывания и интернализации аффинных молекул in vitro исследовали с помощью радиоконъюгата [68Ga]Ga-VHH-PD-L1. Клетки инкубировали с меченными радионуклидом наноантителами в течение 30 или 100 мин при 37°С. Значение поглощенной клетками радиоактивности возросло в 2,2 раза с 30 до 100 мин инкубации, что свидетельствовало об интернализации радиоконъюгата (рис. 3). Специфичность связывания [68Ga]Ga-VHH-PD-L1 с PD-L1, экспрессированным на мембране клеток CT26-PD-L1, подтверждалась фоновыми значениями аналогичных показателей, наблюдаемыми при инкубации этого же радиоконъюгата с контрольными клетками СТ26 (≤0,5%).
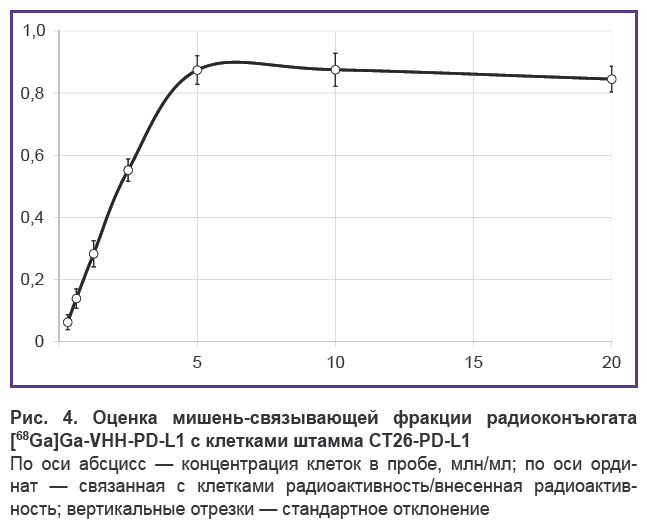
Испытания штамма CT26-PD-L1 для определения фракций радиомеченых наноантител, сохранивших способность связывания с PD-L1 человека, проводили in vitro, используя радиоконъюгаты, меченные изотопами 68Ga или 177Lu. Клетки с радиоконъюгатами в этом случае инкубировали при 4°С, чтобы избежать интернализации. В качестве примера приведены результаты тестирования наноантител против PD-L1, меченных изотопом 68Ga (рис. 4). При концентрации клеток CT26-PD-L1 5 млн/мл было достигнуто связывание с мишенями всех сохранивших специфичность радиомеченых молекул, что соответствовало выходу на плато графика зависимости отношения радиоактивности, связавшейся с клетками CT26-PD-L1, к общей радиоактивности, внесенной в пробу. Таким образом, иммунореактивная фракция препарата составляла 87,4%, что свидетельствовало о значительном сохранении антиген-связывающих свойств исследуемого наноантитела против PD-L1 в процессе конъюгации.
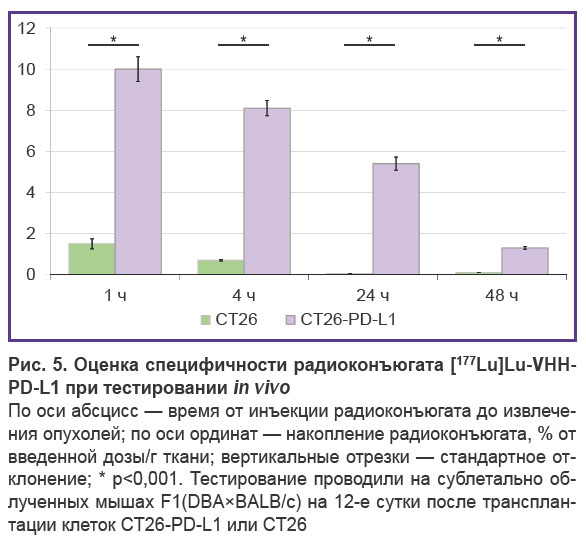
Для оценки в условиях in vivo специфичности связывания конъюгатов молекул, аффинных к PD-L1 человека, клетки CT26-PD-L1 прививали сублетально облученным мышам F1(DBA×BALB/c). Результаты тестирования на этой модели меченных 177Lu радиоконъюгатов наноантител, направленных против PD-L1 (рис. 5), свидетельствовали о высокой специфичности препарата в отношении опухолей, экспрессирующих биомаркер. Препарат быстро накапливался в несущей PD-L1 человека опухоли и сохранялся в ней в течение 2 сут. В контрольной опухоли CT26 накопление препарата соответствовало фоновому значению.
Обсуждение
Мембранный белок PD-L1, экспрессируемый антиген-презентирующими клетками, относится к числу молекул так называемых иммунных контрольных точек, поскольку в здоровом организме связывание его с рецептором PD-1 на T-лимфоцитах препятствует неконтролируемому развитию иммунологических реакций. Данные научных публикаций [6, 33, 34], а также результаты, полученные нами в настоящей работе (см. рис. 1), свидетельствуют о том, что клетки многих опухолей эпителиального, нейронального и соединительно-тканного происхождения имеют активный ген PD-L1. Повышенная экспрессия PD-L1 на мембране опухолевых клеток разного гистогенеза и доминирующая роль в подавлении противоопухолевого иммунного ответа делают его «универсальной» мишенью для терапии широкого спектра злокачественных новообразований [5–7].
На сегодняшний день для использования в клинической практике одобрено три аффинных к PD-L1 препарата: атезолизумаб, дурвалумаб и авелумаб. Все они представляют собой моноклональные антитела, которые предотвращают связывание PD-L1 с PD-1. Фармакологическое действие препаратов направлено на реактивацию противоопухолевого иммунитета. Авелумаб также индуцирует лизис опухолевых клеток, активируя антителозависимую клеточную цитотоксичность. Однако значительное число пациентов не реагирует на иммунотерапию с помощью названных препаратов. Среди причин неэффективности называют недостаток в опухолях цитотоксических Т-лимфоцитов и NK-клеток, первичную или приобретенную резистентность к ингибиторам PD-L1 за счет других иммуносупрессивных механизмов [12, 35]. Эти факты стимулируют создание новых препаратов, направленных прежде всего на непосредственное уничтожение опухолевых клеток, экспрессирующих PD-L1. Одновременно идет поиск подходов к определению уровня экспрессии PD-L1 в злокачественных новообразованиях для отбора пациентов, которым показана терапия ингибиторами иммунологических контрольных точек PD-1/PD-L1 или таргетными к PD-L1 цитотоксическими препаратами. Традиционно используемый метод иммуногистохимии биопсийных образцов ограничен оценкой отдельных фрагментов опухоли. Между тем даже внутри одного опухолевого узла наблюдается высокая степень гетерогенности экспрессии PD-L1 [6, 7, 36, 37]. Оценить распределение белка-биомаркера в организме пациента позволяют методы молекулярной визуализации.
В последние годы все более прочное положение занимает таргетная ядерная медицина, которая использует для диагностики и лечения рака конъюгированные с радионуклидами молекулы, специфически связывающиеся с молекулярными мишенями на опухолевых клетках. На стадии разработки и клинических испытаний находится несколько радиофармпрепаратов на основе молекул, аффинных к PD-L1, предназначенных для диагностики и для терапии [18–22, 38–47].
В отличие от ингибиторов иммунных контрольных точек, требующих обязательной доклинической оценки реактивации иммунного ответа, при разработке радиоконъюгатов достаточно подтверждения специфичности взаимодействия препарата с мишенью и, в случае терапевтического препарата, тестирования его специфического цитотоксического действия в отношении опухолевых клеток, имеющих биомаркер.
В качестве клеточных моделей для тестирования таргетных к биомаркеру PD-L1 радиоконъюгатов наряду с линиями опухолевых клеток человека за рубежом используют генно-инженерные клетки, созданные на основе опухолевых клеток мышей [18–22]. Мы продолжили изучение потенциала гуманизированных мышиных опухолевых клеток в качестве модельных объектов для in vivo и in vitro тестирования препаратов, аффинных к PD-L1 человека. В результате использованного генно-инженерного подхода нами получен штамм клеток, названный CT26-PD-L1, в котором более 99% клеток экспрессировали мембранный PD-L1 человека в высокой плотности. Эти клетки стабильно экспрессировали биомаркер PD-L1 при длительном культивировании in vitro. При оценке туморогенности полученных клеток на иммунокомпетентных сингенных мышах BALB/c прогрессивный рост опухолей был выявлен у 23% мышей. У остальных животных наблюдали регресс опухолей или отсутствие новообразований в течение всего срока наблюдения. Причиной низкой туморогенности клеток у интактных мышей могла быть невысокая гомология аминокислотных последовательностей PD-L1 человека и мыши — около 70% [1]. Развитие иммунного ответа на PD-L1 человека у интактных животных подтверждалось преимущественной селекцией клеток, снизивших или утративших антиген человека, что выражалось в существенно более низком содержании PD-L1+-клеток в регрессирующих опухолях по сравнению с прогрессивно растущими опухолями (4,2 и 50,0% PD-L1+-клеток соответственно). В качестве средства частичной иммуносупрессии в своей работе мы использовали сублетальное рентгеновское облучение мышей-гибридов F1(DBA×BALB/c); поглощенная доза составляла 5 Гр. Такое воздействие позволило снизить иммунореактивность мышей, что обеспечило рост опухолей, экспрессирующих PD-L1 человека, у 100% животных. Рост опухолей у этих мышей не сопровождался увеличением содержания клеток, утративших или уменьшивших экспрессию биомаркера человека, на что указывали данные, полученные после эксплантации и культивирования in vitro клеток, выделенных из растущих опухолей. В то же время уровень иммуносупрессии, индуцированной сублетальным облучением, позволил содержать этих животных и проводить эксперименты в условиях конвенционального вивария, что также явилось преимуществом данной модели по сравнению с моделями, использующими мышей nude, SCID и других. Мы не имели пока возможности привить созданные клетки CT26-PD-L1 иммунодефицитным мышам BALB/c nude, однако опубликованные материалы свидетельствуют о том, что гуманизированные клетки мышей, несущие на мембране PD-L1 человека, ранее имплантировали иммунодефицитным [20–22], гуманизированным [18, 19, 24] или SPF-мышам [17, 23, 25]. Следует отметить, что SPF-мыши так же, как и остальные вышеперечисленные категории животных, требуют содержания в виварии барьерного типа и не являются полностью иммунокомпетентными [48, 49]. Наше исследование дополнило этот список моделей мышами, которые не требуют особых условий содержания.
При оценке полученного штамма CT26-PD-L1 для тестирования аффинных к PD-L1 препаратов in vivo и in vitro были использованы создаваемые в ФГБУ «Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова» таргетные радиоконъюгаты на основе наноантител.
Эффективность использования клеток CT26-PD-L1 в качестве клеточных моделей для оценки специфичности радиоконъюгатов in vitro мы испытали с помощью наноантител, меченных изотопом 68Ga. Специфичность взаимодействия радиоконъюгата с клетками CT26-PD-L1 подтверждалась повышением радиоактивности при увеличении количества клеток в пробе и отсутствием связывания радиоконъюгата с контрольными клетками CT26. Высокая плотность биомаркера на клетках позволила достигнуть насыщения молекул радиоконъюгата молекулами-мишенями и количественно определить содержание в препарате фракции молекул, сохранившей способность связывать PD-L1 после присоединения радионуклида.
Природная рециркуляция молекул PD-L1 между клеточной мембраной и внутренними компартментами клетки дает возможность использования в диагностических и в терапевтических целях аффинных к PD-L1 препаратов, действие которых связано с внутриклеточной локализацией. В этом случае оценка интернализации препарата опухолевыми клетками становится одним из ключевых этапов его разработки. Препараты, проникающие внутрь клетки, дольше удерживаются в опухолевом узле, что приводит к усилению контраста опухоли по отношению к фону при проведении диагностических процедур, например с помощью позитронно-эмиссионной томографии или однофотонной эмиссионной компьютерной томографии [13, 45, 47, 50]. Нам не удалось обнаружить сведений об использовании гуманизированных клеток мыши для оценки интернализации таргетных к PD-L1 радиоконъюгатов. С помощью препарата [68Ga]Ga-VHH-PD-L1 мы показали, что клетки CT26-PD-L1 способны к интернализации биомаркера.
При введении радиоиммуноконъюгатов мышам с опухолями радионуклиды накапливались в опухолях, выросших из трансплантированных клеток CT26-PD-L1, но не из контрольных клеток CT26. Полученный результат подтвердил пригодность предложенной опухолевой модели для тестирования in vivo специфичности нацеленных на PD-L1 человека препаратов.
Заключение
Клетки CT26-PD-L1, созданные нами методом ретровирусной трансдукции на основе клеток CT26 карциномы мышей, несли на мембране молекулы PD-L1 человека с высокой плотностью, обладали значительной стабильностью при культивировании, а при трансплантации интактным мышам BALB/c или сублетально облученным мышам F1(DBA×BALB/c) формировали опухолевые образования. Испытания клеток в качестве биологической модели для оценки in vitro и in vivo специфичности препаратов, мишенью которых является PD-L1 человека, были выполнены с использованием радиоиммуноконъюгатов, содержащих рекомбинантные однодоменные антитела против PD-L1 и радионуклиды 68Ga или 177Lu. В экспериментах, выполненных in vitro, показана возможность использования клеток CT26-PD-L1 при разработке аффинных к PD-L1 препаратов, действие которых связано с интернализацией. Благодаря высокой плотности молекул-мишеней на мембране клетки CT26-PD-L1 позволили в рамках одного тестирования подтверждать специфичность препарата и количественно оценивать мишень-связывающую фракцию конъюгатов. При введении радиоиммуноконъюгатов мышам с опухолями радионуклиды накапливались в опухолях, выросших из трансплантированных клеток CT26-PD-L1, но не из контрольных клеток CT26. Существенным достоинством созданной опухолевой модели явилась возможность проведения тестирования in vivo специфичности аффинных к PD-L1 человека препаратов на животных в условиях конвенционального вивария.
Полученные в настоящей работе клетки, насколько нам известно, являются первыми отечественными генно-инженерными клетками, предназначенными для оценки препаратов, аффинных к PD-L1 человека. Эта клеточная модель может быть использована для оценки специфической активности не только радиоиммуноконъюгатов, но и других аффинных к PD-L1 человека носителей. В целом результаты, приведенные в настоящей работе, служат еще одним подтверждением эффективности использования гуманизированных клеток для тестирования таргетных препаратов.
Финансирование исследования. Работа выполнена в рамках государственного задания Министерства здравоохранения РФ.
Конфликт интересов отсутствует.
Литература
- Freeman G.J., Long A.J., Iwai Y., Bourque K., Chernova T., Nishimura H., Fitz L.J., Malenkovich N., Okazaki T., Byrne M.C., Horton H.F., Fouser L., Carter L., Ling V., Bowman M.R., Carreno B.M., Collins M., Wood C.R., Honjo T. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000; 192(7): 1027–1034, https://doi.org/10.1084/jem.192.7.1027.
- Carter L., Fouser L.A., Jussif J., Fitz L., Deng B., Wood C.R., Collins M., Honjo T., Freeman G.J., Carreno B.M. PD-1:PD-L inhibitory pathway affects both CD4(+) and CD8(+) T cells and is overcome by IL-2. Eur J Immunol 2002; 32(3): 634–643, https://doi.org/10.1002/1521-4141(200203)32:3634::AID-IMMU6343.0.CO;2-9.
- Guleria I., Khosroshahi A., Ansari M.J., Habicht A., Azuma M., Yagita H., Noelle R.J., Coyle A., Mellor A.L., Khoury S.J., Sayegh M.H. A critical role for the programmed death ligand 1 in fetomaternal tolerance. J Exp Med 2005; 202(2): 231–237, https://doi.org/10.1084/jem.20050019.
- Brown J.A., Dorfman D.M., Ma F.R., Sullivan E.L., Munoz O., Wood C.R., Greenfield E.A., Freeman G.J. Blockade of programmed death-1 ligands on dendritic cells enhances T cell activation and cytokine production. J Immunol 2003; 170(3): 1257–1266, https://doi.org/10.4049/jimmunol.170.3.1257.
- Iwai Y., Ishida M., Tanaka Y., Okazaki T., Honjo T., Minato N. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proc Natl Acad Sci U S A 2002; 99(19): 12293–12297, https://doi.org/10.1073/pnas.192461099.
- Dong H., Strome S.E., Salomao D.R., Tamura H., Hirano F., Flies D.B., Roche P.C., Lu J., Zhu G., Tamada K., Lennon V.A., Celis E., Chen L. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med 2002; 8(8): 793–800, https://doi.org/10.1038/nm730.
- Wang X., Teng F., Kong L., Yu J. PD-L1 expression in human cancers and its association with clinical outcomes. Onco Targets Ther 2016; 9: 5023–5039, https://doi.org/10.2147/OTT.S105862.
- Карпенко Т.Д., Козлов Н.А., Любченко Л.Н., Ротобельская Л.Е., Багрова С.Г., Сафронова В.М., Лактионов К.К., Бычков М.Б. Анализ экспрессии белка PD-L1 в клетках злокачественной мезотелиомы плевры. Российский онкологический журнал 2018; 23(1): 4–9, https://doi.org/10.18821/1028-9984-2018-23-1-4-9.
- Pinevich A.A., Vartanyan N.L., Kiseleva L.N., Bode I.I., Krutetskaya I.Yu., Kartashev A.V., Makarov V.E., Poneza T.E., Smirnov I.V., Samoilovich M.P. PD-L1 and PD-L2 gene expression in human glioblastoma cells resistant to chemo- and radiotherapy. Meditsinskaya immunologiya 2023; 25(3): 605–610, https://doi.org/10.15789/1563-0625-PLA-2693.
- Wang J., Xu Y., Rao X., Zhang R., Tang J., Zhang D., Jie X., Zhu K., Wang X., Xu Y., Zhang S., Dong X., Zhang T., Yang K., Xu S., Meng R., Wu G. BRD4-IRF1 axis regulates chemoradiotherapy-induced PD-L1 expression and immune evasion in non-small cell lung cancer. Clin Transl Med 2022; 12(1): e718, https://doi.org/10.1002/ctm2.718.
- Peng J., Hamanishi J., Matsumura N., Abiko K., Murat K., Baba T., Yamaguchi K., Horikawa N., Hosoe Y., Murphy S.K., Konishi I., Mandai M. Chemotherapy induces programmed cell death-ligand 1 overexpression via the nuclear factor-κB to foster an immunosuppressive tumor microenvironment in ovarian cancer. Cancer Res 2015; 75(23): 5034–5045, https://doi.org/10.1158/0008-5472.CAN-14-3098.
- Zanello A., Bortolotti M., Maiello S., Bolognesi A., Polito L. Anti-PD-L1 immunoconjugates for cancer therapy: are available antibodies good carriers for toxic payload delivering? Front Pharmacol 2022; 13: 972046, https://doi.org/10.3389/fphar.2022.972046.
- Pisaneschi F., Viola N.T. Development and validation of a PET/SPECT radiopharmaceutical in oncology. Mol Imaging Biol 2022; 24(1): 1–7, https://doi.org/10.1007/s11307-021-01645-6.
- Sharma S.K., Lyashchenko S.K., Park H.A., Pillarsetty N., Roux Y., Wu J., Poty S., Tully K.M., Poirier J.T., Lewis J.S. A rapid bead-based radioligand binding assay for the determination of target-binding fraction and quality control of radiopharmaceuticals. Nucl Med Biol 2019; 71: 32–38, https://doi.org/10.1016/j.nucmedbio.2019.04.005.
- Avrov K.O., Shatik S.V., Zaitsev V.V., Al-Shehadat R.I., Shashkova O.A., Terekhina L.A., Malakhov I.S., Samoylovich M.P. Application of magnetic particles for fast determination of immunoreactive fraction of 68Ga-labelled VHH antibodies to PD-L1. Sovremennye tehnologii v medicine 2023; 15(3): 26–33, https://doi.org/10.17691/stm2023.15.3.03.
- Stribbling S.M., Ryan A.J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc 2022; 17(9): 2108–2128, https://doi.org/10.1038/s41596-022-00709-3.
- Huang A., Peng D., Guo H., Ben Y., Zuo X., Wu F., Yang X., Teng F., Li Z., Qian X., Qin F.X. A human programmed death-ligand 1-expressing mouse tumor model for evaluating the therapeutic efficacy of anti-human PD-L1 antibodies. Sci Rep 2017; 7: 42687, https://doi.org/10.1038/srep42687.
- Yang Y., Wang C., Wang Y., Sun Y., Huang X., Huang M., Xu H., Fan H., Chen D., Zhao F. Dose escalation biodistribution, positron emission tomography/computed tomography imaging and dosimetry of a highly specific radionuclide-labeled non-blocking nanobody. EJNMMI Res 2021; 11(1): 113, https://doi.org/10.1186/s13550-021-00854-y.
- Qin S., Yu Y., Guan H., Yang Y., Sun F., Sun Y., Zhu J., Xing L., Yu J., Sun X. A preclinical study: correlation between PD-L1 PET imaging and the prediction of therapy efficacy of MC38 tumor with 68Ga-labeled PD-L1 targeted nanobody. Aging (Albany NY) 2021; 13(9): 13006–13022, https://doi.org/10.18632/aging.202981.
- Maute R.L., Gordon S.R., Mayer A.T., McCracken M.N., Natarajan A., Ring N.G., Kimura R., Tsai J.M., Manglik A., Kruse A.C., Gambhir S.S., Weissman I.L., Ring A.M. Engineering high-affinity PD-1 variants for optimized immunotherapy and immuno-PET imaging. Proc Natl Acad Sci U S A 2015; 112(47): E6506–E6514, https://doi.org/10.1073/pnas.1519623112.
- Mayer A.T., Natarajan A., Gordon S.R., Maute R.L., McCracken M.N., Ring A.M., Weissman I.L., Gambhir S.S. Practical immuno-PET radiotracer design considerations for human immune checkpoint imaging. J Nucl Med 2017; 58(4): 538–546, https://doi.org/10.2967/jnumed.116.177659.
- Natarajan A., Patel C.B., Ramakrishnan S., Panesar P.S., Long S.R., Gambhir S.S. A novel engineered small protein for positron emission tomography imaging of human programmed death ligand-1: validation in mouse models and human cancer tissues. Clin Cancer Res 2019; 25(6): 1774–1785, https://doi.org/10.1158/1078-0432.CCR-18-1871.
- Li C.W., Lim S.O., Chung E.M., Kim Y.S., Park A.H., Yao J., Cha J.H., Xia W., Chan L.C., Kim T., Chang S.S., Lee H.H., Chou C.K., Liu Y.L., Yeh H.C., Perillo E.P., Dunn A.K., Kuo C.W., Khoo K.H., Hsu J.L., Wu Y., Hsu J.M., Yamaguchi H., Huang T.H., Sahin A.A., Hortobagyi G.N., Yoo S.S., Hung M.C. Eradication of triple-negative breast cancer cells by targeting glycosylated PD-L1. Cancer Cell 2018; 33(2): 187–201.e10, https://doi.org/10.1016/j.ccell.2018.01.009.
- Du K., Huang H. Development of anti-PD-L1 antibody based on structure prediction of AlphaFold2. Front Immunol 2023; 14: 1275999, https://doi.org/10.3389/fimmu.2023.1275999.
- Sullivan K.M.C., Vilalta M., Ertl L.S., Wang Y., Dunlap C., Ebsworth K., Zhao B.N., Li S., Zeng Y., Miao Z., Fan P., Mali V., Lange C., McMurtrie D., Yang J., Lui R., Scamp R., Chhina V., Kumamoto A., Yau S., Dang T., Easterday A., Liu S., Miao S., Charo I., Schall T.J., Zhang P. CCX559 is a potent, orally-administered small molecule PD-L1 inhibitor that induces anti-tumor immunity. PLoS One 2023; 18(6): e0286724, https://doi.org/10.1371/journal.pone.0286724.
- Ertveldt T., De Beck L., De Ridder K., Locy H., de Mey W., Goyvaerts C., Lecocq Q., Ceuppens H., De Vlaeminck Y., Awad R.M., Keyaerts M., Devoogdt N., D’Huyvetter M., Breckpot K., Krasniqi A. Targeted radionuclide therapy with low and high-dose lutetium-177-labeled single domain antibodies induces distinct immune signatures in a mouse melanoma model. Mol Cancer Ther 2022; 21(7): 1136–1148, https://doi.org/10.1158/1535-7163.MCT-21-0791.
- Zhao H., Wang C., Yang Y., Sun Y., Wei W., Wang C., Wan L., Zhu C., Li L., Huang G., Liu J. ImmunoPET imaging of human CD8+ T cells with novel 68Ga-labeled nanobody companion diagnostic agents. J Nanobiotechnology 2021; 19(1): 42, https://doi.org/10.1186/s12951-021-00785-9.
- Nilofar Danishmalik S., Lee S.H., Sin J.I. Tumor regression is mediated via the induction of HER263-71- specific CD8+ CTL activity in a 4T1.2/HER2 tumor model: no involvement of CD80 in tumor control. Oncotarget 2017; 8(16): 26771–26788, https://doi.org/10.18632/oncotarget.15816.
- Penichet M.L., Challita P.M., Shin S.U., Sampogna S.L., Rosenblatt J.D., Morrison S.L. In vivo properties of three human HER2/neu-expressing murine cell lines in immunocompetent mice. Lab Anim Sci 1999; 49(2): 179–188.
- Shanghai Model Organisms Center, Inc. (SMOC): website. URL: https://www.modelorg.us/Humanized-cells.html.
- Biocytogen: website. URL: https://biocytogen.com/products/humanized-tumor-cell-lines/.
- GenOway: website. URL: https://www.genoway.com/catalog/cells/cl/overview.htm.
- Zheng Y., Fang Y.C., Li J. PD-L1 expression levels on tumor cells affect their immunosuppressive activity. Oncol Lett 2019; 18(5): 5399–5407, https://doi.org/10.3892/ol.2019.10903.
- Chen S., Crabill G.A., Pritchard T.S., McMiller T.L., Wei P., Pardoll D.M., Pan F., Topalian S.L. Mechanisms regulating PD-L1 expression on tumor and immune cells. J Immunother Cancer 2019; 7(1): 305, https://doi.org/10.1186/s40425-019-0770-2.
- Parvez A., Choudhary F., Mudgal P., Khan R., Qureshi K.A., Farooqi H., Aspatwar A. PD-1 and PD-L1: architects of immune symphony and immunotherapy breakthroughs in cancer treatment. Front Immunol 2023; 14: 1296341, https://doi.org/10.3389/fimmu.2023.1296341.
- Ilie M., Long-Mira E., Bence C., Butori C., Lassalle S., Bouhlel L., Fazzalari L., Zahaf K., Lalvée S., Washetine K., Mouroux J., Vénissac N., Poudenx M., Otto J., Sabourin J.C., Marquette C.H., Hofman V., Hofman P. Comparative study of the PD-L1 status between surgically resected specimens and matched biopsies of NSCLC patients reveal major discordances: a potential issue for anti-PD-L1 therapeutic strategies. Ann Oncol 2016; 27(1): 147–153, https://doi.org/10.1093/annonc/mdv489.
- McLaughlin J., Han G., Schalper K.A., Carvajal-Hausdorf D., Pelekanou V., Rehman J., Velcheti V., Herbst R., LoRusso P., Rimm D.L. Quantitative assessment of the heterogeneity of PD-L1 expression in non-small-cell lung cancer. JAMA Oncol 2016; 2(1): 46–54, https://doi.org/10.1001/jamaoncol.2015.3638.
- Radaram B., Glazer S.E., Yang P., Li C.W., Hung M.C., Gammon S.T., Alauddin M., Piwnica-Worms D. Evaluation of 89Zr-labeled anti-PD-L1 monoclonal antibodies using DFO and novel HOPO analogues as chelating agents for immuno-PET. ACS Omega 2023; 8(19): 17181–17194, https://doi.org/10.1021/acsomega.3c01547.
- Jagoda E.M., Vasalatiy O., Basuli F., Opina A.C.L., Williams M.R., Wong K., Lane K.C., Adler S., Ton A.T., Szajek L.P., Xu B., Butcher D., Edmondson E.F., Swenson R.E., Greiner J., Gulley J., Eary J., Choyke P.L. Immuno-PET imaging of the programmed cell death-1 ligand (PD-L1) using a zirconium-89 labeled therapeutic antibody, avelumab. Mol Imaging 2019; 18: 1536012119829986, https://doi.org/10.1177/1536012119829986.
- Bensch F., van der Veen E.L., Lub-de Hooge M.N., Jorritsma-Smit A., Boellaard R., Kok I.C., Oosting S.F., Schröder C.P., Hiltermann T.J.N., van der Wekken A.J., Groen H.J.M., Kwee T.C., Elias S.G., Gietema J.A., Bohorquez S.S., de Crespigny A., Williams S.P., Mancao C., Brouwers A.H., Fine B.M., de Vries E.G.E. 89Zr-atezolizumab imaging as a non-invasive approach to assess clinical response to PD-L1 blockade in cancer. Nat Med 2018; 24(12): 1852–1858, https://doi.org/10.1038/s41591-018-0255-8.
- Broos K., Lecocq Q., Xavier C., Bridoux J., Nguyen T.T., Corthals J., Schoonooghe S., Lion E., Raes G., Keyaerts M., Devoogdt N., Breckpot K. Evaluating a single domain antibody targeting human PD-L1 as a nuclear imaging and therapeutic agent. Cancers (Basel) 2019; 11(6): 872, https://doi.org/10.3390/cancers11060872.
- Christensen C., Kristensen L.K., Alfsen M.Z., Nielsen C.H., Kjaer A. Quantitative PET imaging of PD-L1 expression in xenograft and syngeneic tumour models using a site-specifically labelled PD-L1 antibody. Eur J Nucl Med Mol Imaging 2020; 47(5): 1302–1313, https://doi.org/10.1007/s00259-019-04646-4.
- Zhang Y., Cao M., Wu Y., Malih S., Xu D., Yang E., Younis M.H., Lin W., Zhao H., Wang C., Liu Q., Engle J.W., Rasaee M.J., Guan Y., Huang G., Liu J., Cai W., Xie F., Wei W. Preclinical development of novel PD-L1 tracers and first-in-human study of [68Ga]Ga-NOTA-RW102 in patients with lung cancers. J Immunother Cancer 2024; 12(4): e008794, https://doi.org/10.1136/jitc-2024-008794.
- Bamminger K., Pichler V., Vraka C., Limberger T., Moneva B., Pallitsch K., Lieder B., Zacher A.S., Ponti S., Benčurová K., Yang J., Högler S., Kodajova P., Kenner L., Hacker M., Wadsak W. Development and in vivo evaluation of small-molecule ligands for positron emission tomography of immune checkpoint modulation targeting programmed cell death 1 ligand 1. J Med Chem 2024; 67(5): 4036–4062, https://doi.org/10.1021/acs.jmedchem.3c02342.
- Luna-Gutiérrez M., Cruz-Nova P., Jiménez-Mancilla N., Oros-Pantoja R., Lara-Almazán N., Santos-Cuevas C., Azorín-Vega E., Ocampo-García B., Ferro-Flores G. Synthesis and evaluation of 177Lu-DOTA-PD-L1-i and 225Ac-HEHA-PD-L1-i as potential radiopharmaceuticals for tumor microenvironment-targeted radiotherapy. Int J Mol Sci 2023; 24(15): 12382, https://doi.org/10.3390/ijms241512382.
- He H., Qi X., Fu H., Xu J., Zheng Q., Chen L., Zhang Y., Hua H., Xu W., Xu Z., Chen X., You Q., Lin J., Huang G., Mao Y., Yu C. Imaging diagnosis and efficacy monitoring by [89Zr]Zr-DFO-KN035 immunoPET in patients with PD-L1-positive solid malignancies. Theranostics 2024; 14(1): 392–405, https://doi.org/10.7150/thno.87243.
- Heskamp S., Hobo W., Molkenboer-Kuenen J.D., Olive D., Oyen W.J., Dolstra H., Boerman O.C. Noninvasive imaging of tumor PD-L1 expression using radiolabeled anti-PD-L1 antibodies. Cancer Res 2015; 75(14): 2928–2936, https://doi.org/10.1158/0008-5472.CAN-14-3477.
- Masopust D., Sivula C.P., Jameson S.C. Of mice, dirty mice, and men: using mice to understand human immunology. J Immunol 2017; 199(2): 383–388, https://doi.org/10.4049/jimmunol.1700453.
- Beura L.K., Hamilton S.E., Bi K., Schenkel J.M., Odumade O.A., Casey K.A., Thompson E.A., Fraser K.A., Rosato P.C., Filali-Mouhim A., Sekaly R.P., Jenkins M.K., Vezys V., Haining W.N., Jameson S.C., Masopust D. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature 2016; 532(7600): 512–516, https://doi.org/10.1038/nature17655.
- Lemma E.Y., Letian A., Altorki N.K., McGraw T.E. Regulation of PD-L1 trafficking from synthesis to degradation. Cancer Immunol Res 2023; 11(7): 866–874, https://doi.org/10.1158/2326-6066.CIR-22-0953.