Функциональные связи гиппокампа и когнитивная стабильность при менингиомах хиазмально-селлярной области (исследование с помощью метода «Виртуально вживленный электрод»)
Адаптивные реакции мозга обеспечивают когнитивную стабильность индивида в достаточно большом диапазоне патологических воздействий, но механизмы реализации таких компенсаторных перестроек почти не изучены.
Цель исследования — выявление изменений функциональных связей гиппокампа при его мягкой унилатеральной компрессии в выборке пациентов с менингиомами хиазмально-селлярной области.
Материалы и методы. Исследовали однородную выборку из 28 пациентов с менингиомами хиазмально-селлярной области, прилежащими к гиппокампу. У 16 пациентов диагностировано левостороннее расположение опухоли, а у 12 пациентов — правостороннее. Эти две группы были сопоставимы по морфометрическим характеристикам опухоли и степени компрессии полушария. Контрольную группу составил 31 здоровый испытуемый. Все три группы были сопоставимы по возрастному и гендерному составу. Для описания изменений в сетевой связности мозга использовали метод «Виртуально вживленный электрод». Метод позволяет реконструировать электрическую активность в любом мозговом вокселе с установленными координатами относительно скальповых электродов. Для описания функциональной связности мозга последовательно рассчитываются коэффициенты корреляции между всеми парами выбранных зон интереса.
Результаты. Сопоставление функциональных связей гиппокампа в клинических группах и в группе здоровых участников позволило выделить следующие типы динамики. Первый тип охватывает сильные и устойчивые связи гиппокампа, не подвергшиеся воздействию патологического процесса. Это связи гиппокампа с глубинными стволовыми образованиями, амигдалой, скорлупой, бледным шаром и инсулой. Второй тип характеризуется ослаблением в клинических группах функциональных связей гиппокампа со структурами, преобразующими афферентные потоки информации. Гипотетически такое ослабление может приводить к изменению порогов «маркировки степени новизны» внешних информационных потоков, что является важным способом экономии ресурсов индивида. Третий тип характеризуется усилением в клинических группах функциональных связей гиппокампа со структурами обеспечения управляющих функций, что согласуется с фактами повышения произвольности в реализации когнитивных действий. Компенсаторные процессы мозга не являются симметричными. Левый и правый гиппокамп по-разному организуют функциональные связи в неблагоприятных условиях. Скорее всего, механизм изменения межполушарного взаимодействия также является одним из факторов обеспечения когнитивной стабильности.
Заключение. Изменение функциональных связей гиппокампа, выявленное в клинических группах при помощи метода «Виртуально вживленный электрод», может рассматриваться как адаптивная реакция мозга, направленная на сохранение когнитивной стабильности при менингиомах хиазмально-селлярной области.
Введение
Сетевой принцип мозговой реализации когнитивных явлений [1–4] предполагает наличие согласованной активности в пространственно-разнесенных и спонтанно-осциллирующих церебральных локусах. Такие корреляции рассматриваются как проявление самоорганизации распределенных нейрональных элементов в сеть для переработки информации, востребованной организмом в данный момент времени. Особый интерес вызывают церебральные сети, которые формируются в периоды покоя (без выполнения каких-либо внешних когнитивных задач) [5–7]. Считается, что сети покоя мозга (default mode network, DMN) обеспечивают протекание спонтанных мыслей, не связанных с текущими впечатлениями, но обращенных к прежнему опыту субъекта [8, 9]. При появлении внешней когнитивной задачи эти базисные процессы трансформируются в функциональную систему ее решения [10–13]. У здоровых испытуемых сети покоя характеризуются относительной пространственной стабильностью и воспроизводимой во времени структурой мозговых локусов [8, 14]. Изменение функциональных связей регистрируется при старении [15–17] и при различных патологических состояниях, например шизофрении [18–20], депрессии [21–23], биполярных расстройствах [24, 25]. Однако причинно-следственные отношения между изменением связанности областей мозга и протеканием когнитивных процессов до конца не установлены. Также очень мало известно о механизмах, обеспечивающих когнитивную стабильность человека: регистрируемые в условиях достаточно большого диапазона неблагоприятных воздействий на мозг изменения речи, восприятия, памяти и мышления, несмотря на формирующуюся вариабельность, продолжают обеспечивать адаптивное поведение человека в социуме.
Одной из ключевых структур сетей покоя является гиппокамп [26–29]. Его важная роль в когнитивных процессах никогда не подвергалась сомнению [16, 30–33]. При этом роль функциональных связей гиппокампа в адаптивных перестройках практически не исследована. Ранее [34] нами изучена группа пациентов с менингиомами хиазмально-селлярной области, прилежащими к гиппокампу и оказывающими на него мягкое компримирующее воздействие. Эти внемозговые доброкачественные новообразования располагаются на основании мозга, в непосредственной близости к медио-базальным отделам левой или правой височной доли. Показано, что опухоли не инфильтрируют вещество мозга, т.е. сдавление одного из полушарий происходит без видимых повреждений макроструктур. Медленный рост этих новообразований способствует компенсаторным перестройкам, объясняющим длительное отсутствие клинической и нейропсихологической симптоматики. Мы предполагаем, что описание функциональных связей гиппокампа в данной выборке позволит выявить механизмы компенсаторных перестроек с его участием.
Описание функциональных связей происходит при установлении степени взаимовлияния колебаний в любом из узлов функционирующей сети на колебания в других ее узлах. Такие корреляции вычисляются при помощи разных методов (фМРТ, фНИРС, МЭГ, ЭЭГ), однако единых общепринятых стандартов регистрации сетевого обеспечения когнитивных процессов пока не существует [35–39]. Принципиально новые возможности в изучении сетевой связности мозга представляет метод «Виртуально вживленный электрод» [40–42]. По скальповой ЭЭГ метод позволяет реконструировать электрическую активность в любом мозговом вокселе с установленными координатами относительно скальповых электродов. Пространственная фильтрация сигнала из заданной области осуществляется на основе скоррелированности изменений сигнала по отведениям. Полученные результаты интерпретируются в качестве электрической активности «локального поля» при «вживлении» виртуального электрода в соответствующую точку мозга. Метод можно применять к одним и тем же ЭЭГ-данным неограниченное число раз, независимо тестируя различные области мозга. Для описания функциональной связности последовательно рассчитываются коэффициенты корреляции между всеми парами (до 820 пар) выбранных зон интереса [42].
Цель исследования — выявление изменений функциональных связей гиппокампа при его мягкой унилатеральной компрессии в выборке пациентов с менингиомами хиазмально-селлярной области.
Задачи исследования:
1) описать сеть функциональных связей гиппокампа с использованием метода «Виртуально вживленный электрод» в норме;
2) выявить особенности функциональных связей гиппокампа при его мягкой унилатеральной компрессии у пациентов;
3) проанализировать роль изменений функциональных связей гиппокампа в поддержании когнитивной стабильности у пациентов клинической выборки.
Материалы и методы
Исследовали однородную выборку из 28 пациентов с менингиомами хиазмально-селлярной области в возрасте от 32 до 68 лет (М±SD — 51,03±13,33); 75% группы составили женщины. Во всех случаях диагноз «доброкачественная менингиома» был установлен на основании типичной клинической картины и данных нейровизуализации. У 16 пациентов диагностировано левостороннее расположение опухоли (далее в тексте это группа грЛВ), а у 12 пациентов — правостороннее (грПР). Группы были сопоставимы по морфометрическим характеристикам опухоли и степени компрессии полушария. Ни у кого из пациентов ранее в анамнезе не было лучевой терапии и нейрохирургических вмешательств.
Всем больным проводили топометрическую МРТ головы в аксиальной проекции в режиме 3D SPGR (до и после введения контрастного вещества с толщиной срезов 1,0 мм) и в режиме Т2 (до введения контраста, с толщиной срезов 2,0 мм). Для точной оценки объема опухоли и ее пространственного расположения выполняли ручную сегментацию опухоли и гиппокампа в системе дозиметрического планирования iPlan (BrainLab). Оконтуривание гиппокампа проводили на основании протокола RTOG 0933 и работы B.S. Chera с соавт. [43] на аксиальных изображениях последовательно, на каждом срезе, с использованием всех доступных модальностей. На рис. 1 представлена схема расположения опухоли и основных критических структур. Исследование проводили до начала лучевого лечения в отделении радиотерапии Национального медицинского исследовательского центра нейрохирургии имени академика Н.Н. Бурденко (Москва).
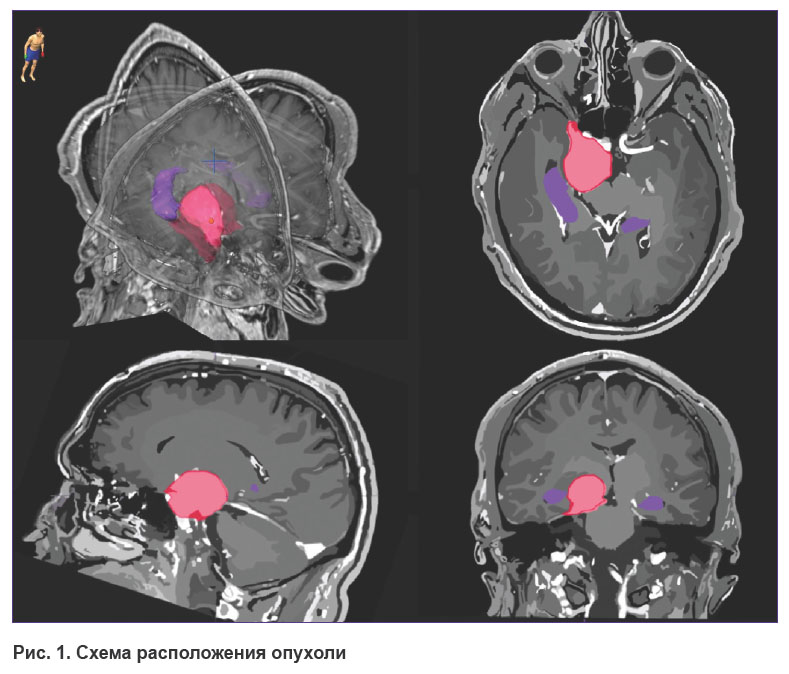 |
Рис. 1. Схема расположения опухоли |
Контрольную группу составил 31 здоровый испытуемый. Все три группы были сопоставимы по возрастному и гендерному составу. Все участники были правшами.
Пациенты клинических групп (грЛВ и грПР) вели активный образ жизни, продолжали работать в соответствии с возрастом и профессиональными возможностями, самостоятельно приехали в Москву и прошли необходимые диагностические исследования. Помимо традиционных нейропсихологических методик А.Р. Лурия эти пациенты прошли исследование по авторской методике с условным названием «методика АВП» (по ключевым словам своей направленности «айтрекинг–внимание–память»). Процесс узнавания в методике АВП моделирует участие гиппокампа в мнестических процессах [44–48]. В первой точке наблюдения (до начала лучевой терапии) показатели тестирования у пациентов с менингиомами хиазмально-селлярной области находились в нормативном диапазоне, что позволяет рассматривать данную клиническую выборку перед началом лучевого лечения как находящуюся в состоянии когнитивной стабильности [49].
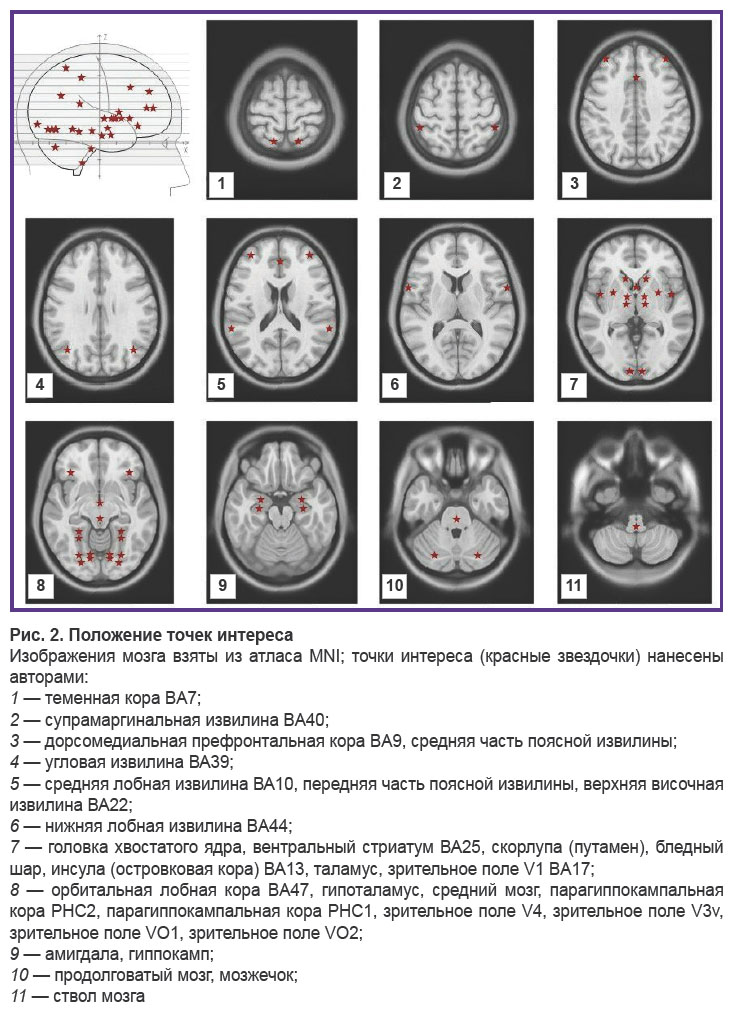
Выполняли ЭЭГ в состоянии спокойного бодрствования, сидя, с закрытыми глазами. Использовали электроэнцефалограф «Нейро-КМ» («Статокин», Россия) с частотой дискретизации 1000 Гц и полосой пропускания от 0,3 до 30,0 Гц. Запись осуществляли по 19 отведениям в соответствии с международной схемой 10–20%. Обработку выполняли с помощью лицензионного программного обеспечения BrainSys (BrainWin). С помощью метода «Виртуально вживленный электрод» [40–42] реконструировали активность в 53 зонах интереса (рис. 2) и вычисляли меру их функциональной связанности.
Исследование проведено в соответствии с положениями Хельсинкской декларации (2013) и одобрено локальным этическим комитетом Национального медицинского исследовательского центра нейрохирургии имени академика Н.Н. Бурденко (Москва). От всех испытуемых получено письменное информированное согласие на участие в исследовании.
Статистический анализ. Сила связи между выделенными локусами интереса с коэффициентом корреляции, бόльшим по модулю, чем 0,4, признавалась значимой. Поскольку расчет коэффициентов корреляции выполняли для выборок большого объема (при частоте оцифровки в 1 мс за 1 мин сравнивались 60 000 случаев), все выборочные коэффициенты корреляции по формальным критериям всегда значимо различались на уровне Р=0 (таблиц значимости для коэффициентов корреляции на выборках большого объема не существует), и даже введение поправок на множественные сравнения не изменило факта всеобщих различий всех полученных коэффициентов. Для содержательного анализа такое положение не представлялось корректным. С целью уменьшения риска ложноотрицательных результатов было решено статистически оценить количество действительно независимых сравнений на основе факторного анализа. Число независимых сравнений в таких условиях можно определить по числу главных компонент, объясняющих значительную часть изменчивости данных. Таким образом, критерием для определения статистической значимости различий с учетом поправки на множественные сравнения будет значение αGWAS=α/ncomponents, где n — количество выделяемых компонент. Использовалось значение 0,05/n (в нашем случае это 0,017).
Сравнение функциональной связанности исследованных мозговых структур между группами испытуемых проводили с помощью t-критерия Стьюдента в программе Statistica (StatSoft Inc., США). Для оценки нормальности распределения использовали критерий Шапиро–Уилка (W-критерий). Дополнительно также использовали непараметрический критерий (U-критерий), результаты выделения значимо различающихся связей по t-критерию и U-критерию совпадают.
Результаты
Для обоснования однородности и сопоставимости клинических групп были просчитаны объемы гиппокампов и определена топография опухоли по отношению к основным критическим структурам. Для всей выборки средний объем ипсилатерального гиппокампа составил 3,2 (2,2–4,0) см3, контралатерального — 3,2 (2,4–3,9) см3. Статистически значимые различия между грЛВ и грПР отсутствовали.
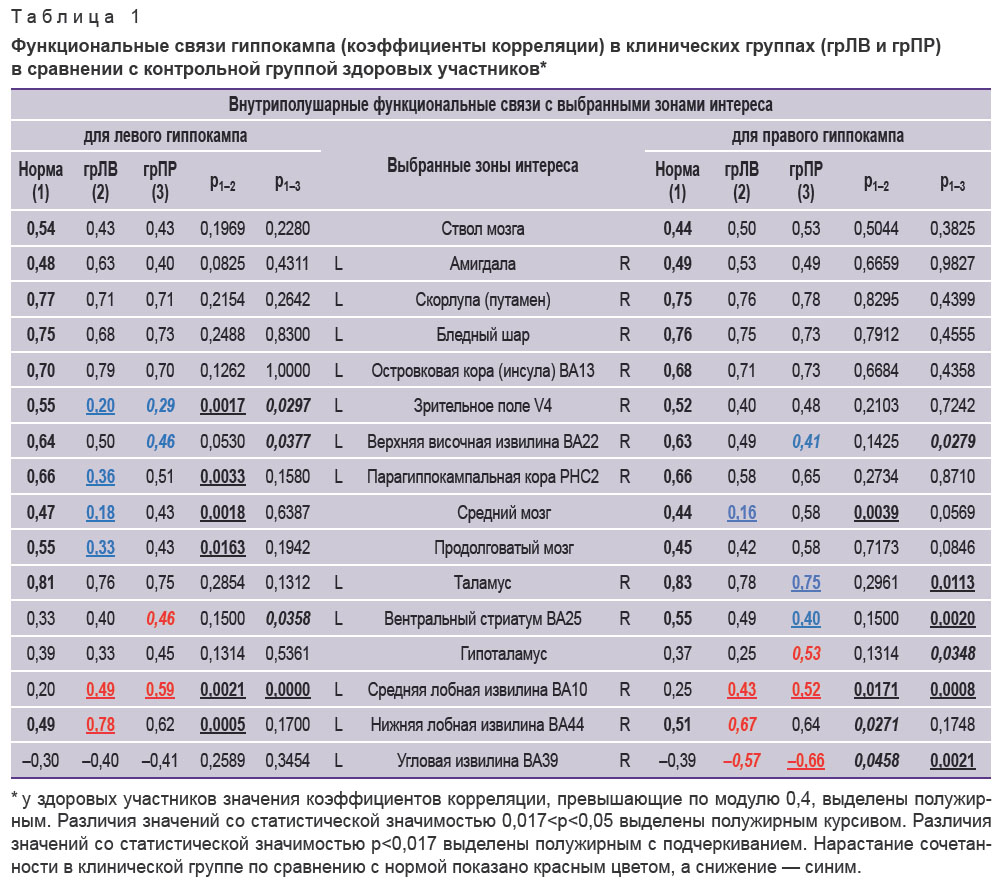
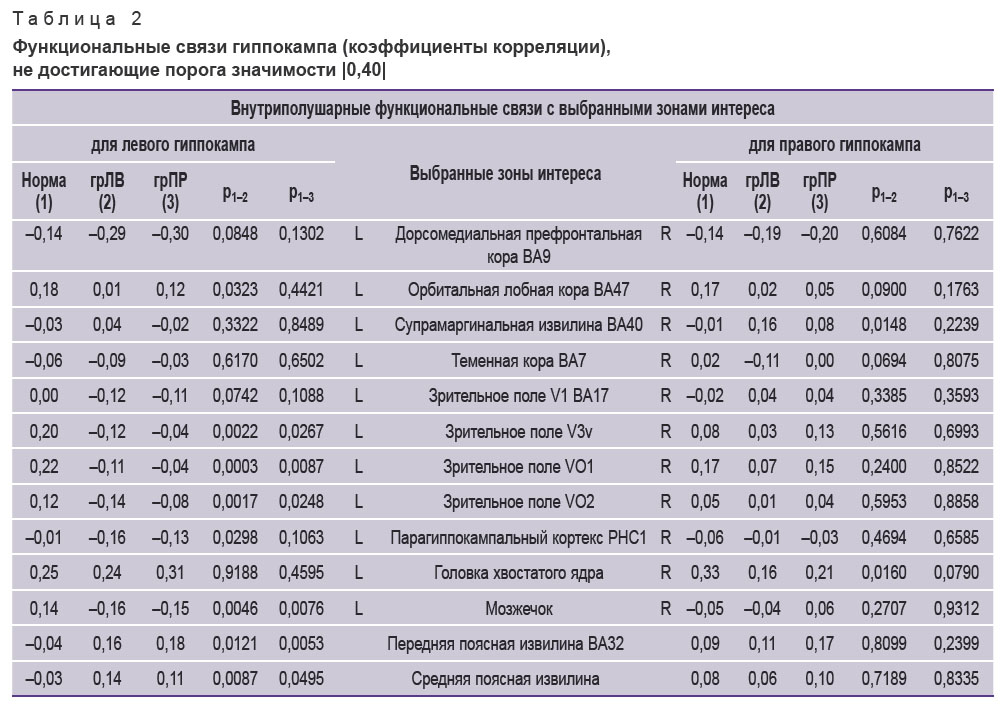
Из 53 выбранных зон интереса с применением метода «Виртуально вживленный электрод» 28 структур продемонстрировали значимые внутриполушарные корреляции функциональной активности с гиппокампом (табл. 1). Остальные 24 выбранных области значимых функциональных связей с гиппокампом не продемонстрировали (они для ознакомления представлены в табл. 2). Не достигли заданного уровня значимости и межполушарные (перекрестные) связи гиппокампа.
|
Таблица 1. Функциональные связи гиппокампа (коэффициенты корреляции) в клинических группах (грЛВ и грПР) в сравнении с контрольной группой здоровых участников* |
|
Таблица 2. Функциональные связи гиппокампа (коэффициенты корреляции), не достигающие порога значимости |0,40| |
В табл. 1 представлены показатели внутриполушарных функциональных связей гиппокампа с 28 церебральными структурами, из которых 12 являются парными образованиями, а 4 расположены по средней линии. Данные каждой клинической группы попарно сравниваются с показателями здоровых участников. Сила некоторых связей в случае нормы и в клинических группах была неизменной (межгрупповые различия не достигали уровня статистической значимости). Это связи гиппокампа со стволом мозга, с амигдалой, скорлупой, бледным шаром и инсулой.
Другие мозговые локусы демонстрировали ослабление функциональных связей с гиппокампом в клинических группах по сравнению с контрольной. Так, в обеих клинических группах снижалась функциональная связанность гиппокампа и зрительного поля V4 в левом полушарии (в грЛВ p<0,017; в грПР p<0,05). В грЛВ наблюдалось снижение сочетанности гиппокампа и парагиппокампальной коры PHC2 в левом полушарии (p<0,017), ослабление функциональной связанности среднего мозга с левым и правым гиппокампом (p<0,017), уменьшение когерентности левого гиппокампа с продолговатым мозгом (p<0,017). В грПР ослаблялась функциональная связь гиппокампа и верхней височной извилины в левом (p<0,05) и в правом (p<0,05) полушарии и гиппокампа с таламусом в правом полушарии (p<0,017).
Функциональная связанность гиппокампа и вентрального стриатума в контрольной группе асимметрична, усиливается в правом полушарии. У пациентов грЛВ тенденция сохраняется (асимметрия сглаживается, но не достигает уровня статистической значимости). У пациентов грПР в левом полушарии связь с гиппокампом усиливается (p<0,05), а в правом — ослабевает (p<0,017).
По отдельным мозговым структурам наблюдается усиление функциональных связей с гиппокампом по сравнению с группой контроля. Так, в обеих клинических группах возрастает связанность средней лобной извилины с левым (p<0,017) и правым гиппокампом (в грЛВ p<0,05; в грПР p<0,017). В правом полушарии отмечается повышение (по модулю) функциональной связанности угловой извилины с правым гиппокампом (в грЛВ p<0,05; в грПР p<0,017). В грЛВ усиливается когерентность нижней лобной извилины с левым (p<0,017) и правым гиппокампом (p<0,05); в грПР усиливается связанность правого гиппокампа с гипоталамусом (p<0,05).
Обсуждение
Рассмотрим полученные данные в аспекте когнитивной стабильности, характеризующей изучаемую клиническую выборку. Представленные в табл. 1 результаты позволяют выделить три типа изменений функционального коннектома гиппокампа в клинических группах по сравнению с контрольной группой здоровых испытуемых.
Первый тип изменений коннектома охватывает сильные и устойчивые связи (не подвергшиеся воздействию патологического процесса). Это связи гиппокампа с глубинными стволовыми образованиями, амигдалой, скорлупой, бледным шаром и инсулой. Они демонстрировали значимые коэффициенты корреляции и в контроле, и в клинических группах, и не имели межгрупповых различий. Такая устойчивость связей, безусловно, является одним из факторов когнитивной стабильности.
Второй типизменений коннектома распространяется на связи, характеризующиеся частичным ослаблением в клинических группах по сравнению с нормой. Известно, что гиппокамп выполняет функции компаратора впечатлений [47, 50, 51]. Любые впечатления текущего опыта проходят сравнение с впечатлениями предыдущего опыта. Они могут быть оценены как принципиально новые, могут — как сходные, но отличающиеся важными признаками, или же как полностью повторяющие прежний опыт (отличающиеся неважными признаками). Возможности мультивоксельной магнитно-резонансной спектроскопии высокого разрешения позволили описать функциональную включенность гиппокампа в эти процессы [44, 45]. Доказательством участия гиппокампа в оценке новизны окружающей среды также являются исследования, проведенные на модельных животных [33]. При перемещении животного в пространстве окружающая среда постоянно изменяется. Но этот контекст воспринимается постоянным, пока не превышен определенный порог или не пересечена какая-то граница. Мозг генерирует адаптивное поведение особи, которое остается постоянным в определенном диапазоне изменений входных сигналов от окружающей среды. Гиппокамп непрерывно отслеживает эти изменения контекста, функционируя в режиме континуума. Особи могут обнаруживать как сходство, так и различие входной информации, генерируя адаптивный физиологический ответ. Рекуррентные нейронные сети гиппокампа способны к самоорганизации, так что они не требуют априорного обучения для формирования пространственно-временного паттерна. Активность постоянно циркулирует по нейронным петлям. Информация из любого источника накладывается на текущую активность и взаимодействует с ней таким образом, что может усилить текущую траекторию или значительно изменить ее, постоянно «гоняясь за собственным хвостом». Гиппокамп обеспечивает непрерывность контекста за счет наличия вложенных друг в друга анатомических нейронных петель, что позволяет системе в значительной степени управлять собой и поддерживать надежную циркуляцию информации [33].
Вместе с тем континуум гиппокампальной маркировки впечатлений по степени их новизны не является постоянным. Он зависит от текущих физических (физиологических) возможностей особи к ассимиляции изменений окружающей среды. Снижение функциональных резервов организма приводит к повышению порогов различения контекста и его оценки как нового. Эти изменения особенно заметны с возрастом. Экспериментально установлено, что и на уровне поведенческих реакций, и по картине мультивоксельного паттерна в гиппокампе для оценки стимулов как похожих, но не идентичных, в пожилом возрасте требуется значительно бóльшая степень различий между ними по сравнению с молодым [52, 53]. Пожилые люди нуждаются в большем, чем молодые, несходстве входной информации, чтобы принять решение о различии с ранее встречавшейся аналогичной информацией. У них наблюдается сдвиг маркировки информации в сторону ее обобщения и генерализации, тогда как у молодых — в сторону дискриминации стимулов [45, 52, 54, 55].
В наших клинических группах адаптивное изменение порогов новизны для внешних информационных потоков, возможно, происходило за счет ослабления функциональных связей гиппокампа со зрительной корой, верхней височной извилиной, таламусом и другими мозговыми локусами (см. табл. 1).
Третий тип изменений коннектома связан с повышением сочетанности гиппокампа со структурами, традиционно соотносимыми с реализацией управляющих функций. Особое место в этом пуле занимает средняя лобная извилина. В группе контроля коэффициенты функциональной корреляции этого локуса с гиппокампом не достигают статистической значимости, однако в клинических группах функциональная связь гиппокампа со средней лобной извилиной усиливается и на высоком уровне статистической значимости (p<0,017) отличается от таковых в контрольной группе. Усиление функциональной сочетанности произошло билатерально в обеих клинических группах (см. табл. 1). Такое изменение свидетельствует об усилении факторов произвольности и контроля в реализации поведенческих решений и когнитивном функционировании. Наши пациенты отмечали, что многие задачи, которые раньше решались ими «мимоходом, без всякого напряжения», теперь требуют специальных усилий и самостоятельного контроля и только при таком «сосредоточении» могут быть выполнены безошибочно.
В литературе неоднократно приводились факты усиления когерентных связей гиппокампа со средней лобной извилиной при патологических состояниях. Например, у студентов с синдромом субклинической депрессии при фМРТ в состоянии покоя регистрировалось нарастание функциональной связности этих структур [23]. Проводилось сравнение с группой здоровых испытуемых студентов. Кроме того, наблюдалась сильная положительная корреляция между показателями опросника депрессии Бека и показателями функциональной связанности в состоянии покоя гиппокампа и средней лобной извилины. Можно предположить, что усиление фактора произвольности в когнитивном функционировании при субклинической депрессии становится востребованным для «отстройки» от депрессивных мыслей и переживаний, которые интерферируют и затрудняют решение текущих жизненных задач.
Коэффициенты корреляции функциональной активности гиппокампа с угловой извилиной оказались единственными отрицательными значениями во всех трех группах. Можно предположить, что такие отрицательные значения обусловлены смещением фазы синусоидального сигнала.
Исследования с точечной имплантацией электродов в определенные области гиппокампа у человека стали возможны благодаря бурному развитию технологий в нейрохирургии. Такое вмешательство осуществляется по медицинским показаниям у пациентов с фармакорезистентной эпилепсией. Когда перцептивные сигналы достигают гиппокампа и запускают процесс припоминания, на интракраниальной ЭЭГ вначале регистрируется гиппокампальный ответ в высокочастотном гамма-диапазоне (от 55 до 110 Гц), причем начиная с 500 мс этот сигнал различается при успешном и неуспешном припоминании. За этим гамма-всплеском при успешном припоминании начиная примерно с 800 мс следует относительное снижение мощности в альфа-диапазоне. Оно представляет собой целый каскад отзывов в разных мозговых локусах: начиная примерно с 800 мс оно регистрируется в медиальной височной области, через 900 мс вовлекается задняя теменная кора. Авторы [56] предполагают, что всплеск гамма-активности гиппокампа соответствует моменту сличения образов восприятия и памяти. В последующем происходит преобразование этого сигнала в височно-теменных отделах.
Если в группе здоровых испытуемых практически все коэффициенты корреляции левого и правого гиппокампов с выбранными зонами интереса были симметричны (статистически значимо не различались), то в клинических группах эта симметрия нарушилась. Полученные данные показывают, что левый и правый гиппокамп по-разному меняют свою коннективность в ответ на компрессионное воздействие. Очевидно, эти данные в дальнейшем позволят пролить свет на полушарные особенности обеспечения когнитивной стабильности, но пока обобщающаяся трактовка асимметричных реакций гиппокампа на компрессию у нас отсутствует.
Известно, что структурные повреждения левого гиппокампа опосредуют поведенческие проявления более однозначно. Лазерная резекция части гиппокампа у больных с эпилепсией приводит к формированию дефицитов в полях зрения, при этом структурное повреждение левого гиппокампа сопровождается более частыми и отчетливыми симптомами, чем резекция правого [57]. У пациентов с височной эпилепсией размер гиппокампа всегда уменьшался на стороне поражения, однако выраженность дефектов памяти коррелировала с объемом левого гиппокампа и не коррелировала с объемом правого [58]. При облучении левого гиппокампа регистрировалось дозозависимое ухудшение отсроченного вербального воспроизведения, тогда как правый гиппокамп не демонстрировал прямых корреляций когнитивных тестов с дозой облучения [59, 60]. Особенности паттерна ЭЭГ при разной латерализации компрессионных воздействий на гиппокамп свидетельствовали о преобладании ирритативно-эпилептиформных знаков в левом полушарии [61]. Разная степень опосредованности когнитивных процессов клеточной и нейрогуморальной составляющими работы мозга [62] в сочетании с перечисленными фактами может служить одной из гипотез, объясняющих несимметричные изменения коннективности при унилатеральных воздействиях на гиппокамп.
Заключение
В достаточно большом диапазоне патологических воздействий на мозг и связанной с ними вариативности когнитивных процессов человек в целом сохраняет независимое и социально адаптивное поведение. Сетевой принцип реализации когнитивных явлений предполагает, что одним из возможных механизмов такой когнитивной стабильности является перестройка функциональных связей мозга. Изучение этих процессов было проведено в группах с унилатеральной компрессией гиппокампа и прилежащих медиобазальных отделов височной доли. Менингиомы не инфильтрировали мозг, воздействие осуществлялось без видимого повреждения на макроструктурном уровне. Изменение функциональных связей гиппокампа, выявленное при помощи метода «Виртуально вживленный электрод», продемонстрировало следующие особенности.
Происходит ослабление функциональных связей гиппокампа со структурами, преобразующими афферентные потоки информации, что, возможно, является механизмом изменения порогов «маркировки степени новизны» информации. Такое изменение порогов новизны внешних информационных потоков может приводить к экономии ресурсов индивида.
Усиление функциональных связей гиппокампа со структурами обеспечения управляющих функций может свидетельствовать о нарастании произвольности в реализации когнитивных явлений. Перевод когнитивных действий на произвольный уровень может рассматриваться как один из способов достижения нужного результата при формировании затруднений.
Левый и правый гиппокамп по-разному изменяют свои функциональные связи в меняющихся условиях. Компенсаторные процессы мозга не являются симметричными. В литературе все чаще рассматривается гипотеза о механизме межполушарного взаимодействия в качестве одного из существенных факторов обеспечения когнитивной стабильности.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда в рамках научного проекта №23-15-00018.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Friston K.J., Kahan J., Biswal B., Razi A. A DCM for resting state fMRI. Neuroimage 2014; 94(100): 396–407, https://doi.org/10.1016/j.neuroimage.2013.12.009.
- Kawagoe T., Onoda K., Yamaguchi S. Subjective memory complaints are associated with altered resting-state functional connectivity but not structural atrophy. Neuroimage Clin 2019; 21: 101675, https://doi.org/10.1016/j.nicl.2019.101675.
- Анохин К.В. Когнитом: в поисках фундаментальной нейронаучной теории сознания. Журнал высшей нервной деятельности им. И.П. Павлова 2021; 71(1): 39–71, https://doi.org/10.31857/s0044467721010032.
- Proshina E.A., Deynekina T.S., Martynova O.V. Neurogenetics of brain connectivity: current approaches to the study (review). Sovremennye tehnologii v medicine 2024; 16(1): 66–76, https://doi.org/10.17691/stm2024.16.1.07.
- Fox M.D., Raichle M.E. Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging. Nat Rev Neurosci 2007; 8(9): 700–711, https://doi.org/10.1038/nrn2201.
- Yeshurun Y., Nguyen M., Hasson U. The default mode network: where the idiosyncratic self meets the shared social world. Nat Rev Neurosci 2021; 22(3): 181–192, https://doi.org/10.1038/s41583-020-00420-w.
- Damulin I.V., Strutzenko A.A. Contemporary concept about organization of central nervous system: human connectome and neural networks. Medical alphabet 2021; 22: 42–47, https://doi.org/10.33667/2078-5631-2021-22-42-47.
- Raichle M.E. The brain’s default mode network. Annu Rev Neurosci 2015; 38: 433–447, https://doi.org/10.1146/annurev-neuro-071013-014030.
- Konishi M., McLaren D.G., Engen H., Smallwood J. Shaped by the past: The default mode network supports cognition that is independent of immediate perceptual input. PLoS One 2015; 10(6): e0132209, https://doi.org/10.1371/journal.pone.0132209.
- Chen T., Cai W., Ryali S., Supekar K., Menon V. Distinct global brain dynamics and spatiotemporal organization of the salience network. PLoS Biol 2016; 14(6): e1002469, https://doi.org/10.1371/journal.pbio.1002469.
- Курганский А.В. Функциональная организация мозга человека в состоянии покоя. Журнал высшей нервной деятельности им. И.П. Павлова 2018; 68(5): 567–580, https://doi.org/10.1134/S004446771805009X.
- Фекличева И.В., Чипеева Н.А., Захаров И.М., Исматуллина В.И., Масленникова Е.П., Табуева А.О., Солдатова Е.Л., Малых С.Б. Взаимосвязь интеллекта и функциональной связанности мозга в состоянии покоя. Теоретическая и экспериментальная психология 2020; 13(3): 65–78.
- Chenot Q., Lepron E., De Boissezon X., Scannella S. Functional connectivity within the fronto-parietal network predicts complex task performance: a fNIRS study. Front Neuroergon 2021; 2: 718176, https://doi.org/10.3389/fnrgo.2021.718176.
- Буккиева Т.А., Чегина Д.С., Ефимцев А.Ю., Левчук А.Г., Исхаков Д.К., Соколов А.В., Фокин В.А., Труфанов Г.Е. Функциональная МРТ покоя. Общие вопросы и клиническое применение. Russian Electronic Journal of Radiology 2019; 9(2): 150–170, https://doi.org/10.21569/2222-7415-2019-9-2-150-170.
- Westlye E.T., Lundervold A., Rootwelt H., Lundervold A.J., Westlye L.T. Increased hippocampal default mode synchronization during rest in middle-aged and elderly APOE ε4 carriers: relationships with memory performance. J Neurosci 2011; 31(21): 7775–7783, https://doi.org/10.1523/JNEUROSCI.1230-11.2011.
- Li Q., Tavakol S., Royer J., Larivière S., Vos De Wael R., Park Bo-yong, Paquola C., Zeng D., Caldairou B., Bassett D.S., Bernasconi A., Bernasconi N., Frauscher B., Smallwood J., Caciagli L., Li S., Bernhardt B.C. Human brain function during pattern separation follows hippocampal and neocortical connectivity gradients. bioRxiv 2020, https://doi.org/10.1101/2020.06.22.165290.
- Wales R.M., Leung H.C. The effects of amyloid and tau on functional network connectivity in older populations. Brain Connect 2021; 11(8): 599–612, https://doi.org/10.1089/brain.2020.0902.
- Zhang Y., Gong X., Yin Z., Cui L., Yang J., Wang P., Zhou Y., Jiang X., Wei S., Wang F., Tang Y. Association between NRGN gene polymorphism and resting-state hippocampal functional connectivity in schizophrenia. BMC Psychiatry 2019; 19(1): 108, https://doi.org/10.1186/s12888-019-2088-5.
- Gao S., Ming Y., Wang J., Gu Y., Ni S., Lu S., Zhang R., Sun J., Zhang N., Xu X. Enhanced prefrontal regional homogeneity and its correlations with cognitive dysfunction/psychopathology in patients with first-diagnosed and drug-naive schizophrenia. Front Psychiatry 2020; 11: 580570, https://doi.org/10.3389/fpsyt.2020.580570.
- Wang X., Yin Z., Sun Q., Jiang X., Chao L., Dai X., Tang Y. Comparative study on the functional connectivity of amygdala and hippocampal neural circuits in patients with first-episode schizophrenia and other high-risk populations. Front Psychiatry 2021; 12: 627198, https://doi.org/10.3389/fpsyt.2021.627198.
- Geerlings M.I., Gerritsen L. Late-life depression, hippocampal volumes, and hypothalamic-pituitary-adrenal axis regulation: a systematic review and meta-analysis. Biol Psychiatry 2017; 82(5): 339–350, https://doi.org/10.1016/j.biopsych.2016.12.032.
- Zhu Y., Qi S., Zhang B., He D., Teng Y., Hu J., Wei X. Connectome-based biomarkers predict subclinical depression and identify abnormal brain connections with the lateral habenula and thalamus. Front Psychiatry 2019; 10: 371, https://doi.org/10.3389/fpsyt.2019.00371.
- Zhang B., Qi S., Liu S., Liu X., Wei X., Ming D. Altered spontaneous neural activity in the precuneus, middle and superior frontal gyri, and hippocampus in college students with subclinical depression. BMC Psychiatry 2021; 21(1): 280, https://doi.org/10.1186/s12888-021-03292-1.
- Qiu S., Chen F., Chen G., Jia Y., Gong J., Luo X., Zhong S., Zhao L., Lai S., Qi Z., Huang L., Wang Y. Abnormal resting-state regional homogeneity in unmedicated bipolar II disorder. J Affect Disord 2019; 256: 604–610, https://doi.org/10.1016/j.jad.2019.06.037.
- Perry A., Roberts G., Mitchell P.B., Breakspear M. Connectomics of bipolar disorder: a critical review, and evidence for dynamic instabilities within interoceptive networks. Mol Psychiatry 2019; 24(9): 1296–1318, https://doi.org/10.1038/s41380-018-0267-2.
- Brunec I.K., Bellana B., Ozubko J.D., Man V., Robin J., Liu Z.X., Grady C., Rosenbaum R.S., Winocur G., Barense M.D., Moscovitch M. Multiple scales of representation along the hippocampal anteroposterior axis in humans. Curr Biol 2018; 28(13): 2129–2135.e6, https://doi.org/10.1016/j.cub.2018.05.016.
- Velichkovsky B.M., Krotkova O.A., Sharaev M.G., Ushakov V.L. In search of the “I”: Neuropsychology of lateralized thinking meets dynamic causal modeling. Psychology in Russia: State of the Art 2017; 10(3): 7–27, https://doi.org/10.11621/pir.2017.0301.
- Velichkovsky B.M., Krotkova O.A., Kotov A.A., Orlov V.A., Verkhlyutov V.M., Ushakov V.L., Sharaev M.G. Consciousness in a multilevel architecture: evidence from the right side of the brain. Conscious Cogn 2018; 64: 227–239, https://doi.org/10.1016/j.concog.2018.06.004.
- Sun W., Advani M., Spruston N., Saxe A., Fitzgerald J.E. Organizing memories for generalization in complementary learning systems. Nat Neurosci 2023; 26(8): 1438–1448, https://doi.org/10.1038/s41593-023-01382-9.
- Виноградова О.С. Гиппокамп и память. М: Наука; 1975.
- Zeidman P., Maguire E.A. Anterior hippocampus: the anatomy of perception, imagination and episodic memory. Nat Rev Neurosci 2016; 17(3): 173–182, https://doi.org/10.1038/nrn.2015.24.
- Voss J.L., Bridge D.J., Cohen N.J., Walker J.A. A closer look at the hippocampus and memory. Trends Cogn Sci 2017; 21(8): 577–588, https://doi.org/10.1016/j.tics.2017.05.008.
- Maurer A.P., Nadel L. The continuity of context: a role for the hippocampus. Trends Cogn Sci 2021; 25(3): 187–199, https://doi.org/10.1016/j.tics.2020.12.007.
- Galkin M.V., Danilov G.V., Kaverina M.Y., Strunina Y.V., Krotkova O.A. Hippocampal dosimetry and mnemonic function changes after stereotactic irradiation of cavernous sinus meningiomas. Cureus 2021; 13(12):e20252, https://doi.org/10.7759/cureus.20252.
- Gonzalez-Castillo J., Kam J.W.Y., Hoy C.W., Bandettini P.A. How to interpret resting-state fMRI: ask your participants. J Neurosci 2021; 41(6): 1130–1141, https://doi.org/10.1523/JNEUROSCI.1786-20.2020.
- Hou X., Zhang Z., Zhao C., Duan L., Gong Y., Li Z., Zhu C. NIRS-KIT: a MATLAB toolbox for both resting-state and task fNIRS data analysis. Neurophotonics 2021; 8(1): 010802, https://doi.org/10.1117/1.NPh.8.1.010802.
- Arun K.M., Smitha K.A., Sylaja P.N., Kesavadas C. Identifying resting-state functional connectivity changes in the motor cortex using fNIRS during recovery from stroke. Brain Topogr 2020; 33(6): 710–719, https://doi.org/10.1007/s10548-020-00785-2.
- Das A., de Los Angeles C., Menon V. Electrophysiological foundations of the human default-mode network revealed by intracranial-EEG recordings during resting-state and cognition. Neuroimage 2022; 250: 118927, https://doi.org/10.1016/j.neuroimage.2022.118927.
- Abdulaev S.K., Tarumov D.A., Bogdanovskaya A.S. Resting state functional magnetic resonance imaging: an analysis of the connectivity of brain large-scale networks. Medical Visualization 2023; 28(1): 45–56, https://doi.org/10.24835/1607-0763-1374.
- Vartanov A.V. A new method of localizing brain activity using the scalp EEG data. Procedia Comput Sci 2022; 213: 41–48, https://doi.org/10.1016/j.procs.2022.11.036.
- Вартанов А.В. Новый подход к пространственной локализации электрической активности по данным ЭЭГ. Эпилепсия и пароксизмальные состояния 2023; 15(4): 326–338, https://doi.org/10.17749/2077-8333/epi.par.con.2023.177.
- Вартанов А.В. Способ исследования мозговой активности по данным скальповой электроэнцефалограммы. А.С. 278526 РФ, МПКA61B5372. 2022.
- Chera B.S., Amdur R.J., Patel P., Mendenhall W.M. A radiation oncologist’s guide to contouring the hippocampus. Am J Clin Oncol 2009; 32(1): 20–22, https://doi.org/10.1097/COC.0b013e318178e4e8.
- Leal S.L., Yassa M.A. Integrating new findings and examining clinical applications of pattern separation. Nat Neurosci 2018; 21(2): 163–173, https://doi.org/10.1038/s41593-017-0065-1.
- Stark S.M., Kirwan C.B., Stark C.E.L. Mnemonic similarity task: a tool for assessing hippocampal integrity. Trends Cogn Sci 2019; 23(11): 938–951, https://doi.org/10.1016/j.tics.2019.08.003.
- Riphagen J.M., Schmiedek L., Gronenschild E.H.B.M., Yassa M.A., Priovoulos N., Sack A.T., Verhey F.R.J., Jacobs H.I.L. Associations between pattern separation and hippocampal subfield structure and function vary along the lifespan: a 7 T imaging study. Sci Rep 2020; 10(1): 7572, https://doi.org/10.1038/s41598-020-64595-z.
- Stevenson R.F., Reagh Z.M., Chun A.P., Murray E.A., Yassa M.A. Pattern separation and source memory engage distinct hippocampal and neocortical regions during retrieval. J Neurosci 2020; 40(4): 843–851, https://doi.org/10.1523/JNEUROSCI.0564-19.2019.
- Krotkova O.A., Kuleva A.Y., Galkin M.V., Kaverina M.Y., Strunina Y.V., Danilov G.V. memory modulation factors in hippocampus exposed to radiation. Sovremennye tehnologii v medicine 2021; 13(4): 6–13, https://doi.org/10.17691/stm2021.13.4.01.
- Krotkova O.A., Danilov G.V., Galkin M.V., Kuleva A.Yu., Kaverina M.Yu., Enikolopova E.V., Strunina Yu.V., Enikolopov G.N. Dissociation of cognitive changes under unilateral exposure of the hippocampus to radiation. Human Physiology 2024; 50(2): 87–98, https://doi.org/10.1134/s0362119723600546.
- Lisman J., Buzsáki G., Eichenbaum H., Nadel L., Ranganath C., Redish A.D. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nat Neurosci 2017; 20(11): 1434–1447, https://doi.org/10.1038/nn.4661.
- Biderman N., Bakkour A., Shohamy D. What are memories for? The hippocampus bridges past experience with future decisions. Trends Cogn Sci 2020; 24(7): 542–556, https://doi.org/10.1016/j.tics.2020.04.004.
- Yassa M.A., Stark C.E. Pattern separation in the hippocampus. Trends Neurosci 2011; 34(10): 515–525, https://doi.org/10.1016/j.tins.2011.06.006.
- Tolentino J.C., Pirogovsky E., Luu T., Toner C.K., Gilbert P.E. The effect of interference on temporal order memory for random and fixed sequences in nondemented older adults. Learn Mem 2012; 19(6): 251–255, https://doi.org/10.1101/lm.026062.112.
- Yassa M.A., Lacy J.W., Stark S.M., Albert M.S., Gallagher M., Stark C.E. Pattern separation deficits associated with increased hippocampal CA3 and dentate gyrus activity in nondemented older adults. Hippocampus 2011; 21(9): 968–979, https://doi.org/10.1002/hipo.20808.
- Creer D.J., Romberg C., Saksida L.M., van Praag H., Bussey T.J. Running enhances spatial pattern separation in mice. Proc Natl Acad Sci U S A 2010; 107(5): 2367–2372, https://doi.org/10.1073/pnas.0911725107.
- Treder M.S., Charest I., Michelmann S., Martín-Buro M.C., Roux F., Carceller-Benito F., Ugalde-Canitrot A., Rollings D.T., Sawlani V., Chelvarajah R., Wimber M., Hanslmayr S., Staresina B.P. The hippocampus as the switchboard between perception and memory. Proc Natl Acad Sci U S A 2021; 118(50): e2114171118, https://doi.org/10.1073/pnas.2114171118.
- Donos C., Rollo P., Tombridge K., Johnson J.A., Tandon N. Visual field deficits following laser ablation of the hippocampus. Neurology 2020; 94(12): e1303–e1313, https://doi.org/10.1212/WNL.0000000000008940.
- Reyes A., Holden H.M., Chang Y.A., Uttarwar V.S., Sheppard D.P., DeFord N.E., DeJesus S.Y., Kansal L., Gilbert P.E., McDonald C.R. Impaired spatial pattern separation performance in temporal lobe epilepsy is associated with visuospatial memory deficits and hippocampal volume loss. Neuropsychologia 2018; 111: 209–215, https://doi.org/10.1016/j.neuropsychologia.2018.02.009.
- Ma T.M., Grimm J., McIntyre R., Anderson-Keightly H., Kleinberg L.R., Hales R.K., Moore J., Vannorsdall T., Redmond K.J. A prospective evaluation of hippocampal radiation dose volume effects and memory deficits following cranial irradiation. Radiother Oncol 2017; 125(2): 234–240, https://doi.org/10.1016/j.radonc.2017.09.035.
- Haldbo-Classen L., Amidi A., Lukacova S., Wu L.M., Oettingen G.V., Lassen-Ramshad Y., Zachariae R., Kallehauge J.F., Høyer M. Cognitive impairment following radiation to hippocampus and other brain structures in adults with primary brain tumours. Radiother Oncol 2020; 148: 1–7, https://doi.org/10.1016/j.radonc.2020.03.023.
- Boldyreva G.N., Kuleva A.Yu., Sharova E.V., Galkin M.V., Masherov E.L., Krotkova O.A. Search for functional markers of the hippocampus involvement in the pathological process. Human Physiology 2023; 49(2): 95–106, https://doi.org/10.1134/s0362119722700153.
- Кроткова О.А. Психофизическая проблема и асимметрия полушарий мозга. Вестник Московского университета. Серия 14. Психология 2014; 3: 47–62.