Использование синтетического гидроксиапатита, получаемого разными методами: особенности метаболизма и микроархитектуры (обзор)
Проанализированы литературные данные об особенностях микроархитектуры и метаболизма синтетического гидроксиапатита, полученного различными методами. Установлено, что между способом получения гидроксиапатита и его микроархитектурой существует прямая зависимость. В свою очередь микроархитектура гидроксиапатита во многом определяет особенности его метаболизма (ряд процессов, связанных с обменом кальция и фосфора). И поэтому уже в контексте метаболизма синтетического гидроксиапатита с различной микроархитектурой выполнен анализ взаимодействия этого материала с клетками иммунной системы.
Особое внимание уделено особенностям взаимодействия гидроксиапатита с иммунной системой реципиента, обусловленным микроархитектурой этого материала. Оценена возможность участия в метаболизме синтетического гидроксиапатита митохондрий клеток. Выполнено сравнение результатов исследований иммунной реакции реципиента in vivo и in vitro в зависимости от наноразмерной морфологии гидроксиапатита.
Выводы обзора подчеркивают необходимость дальнейших исследований иммунологически обусловленного метаболизма гидроксиапатита, предназначенного для костных имплантатов, в том числе развития методов исследования in vitro для более глубокого понимания свойств этого материала. Показан потенциал синтетического гидроксиапатита для лечения костных дефектов, отмечены значимость исследований in vivo для развития костной хирургии и реконструктивной медицины.
Введение
Фундаментом современных медицинских технологий улучшения регенерации костной ткани является повсеместное широкое применение как трансплантатов, так и имплантатов на основе гидроксиапатита. Разнообразие используемых материалов является отражением множества патологических состояний костной ткани. Трансплантаты в соответствии с источником получения делятся на аутологичные (аутогенные), аллогенные и ксеногенные. В свою очередь имплантаты для костной регенерации можно условно разделить по происхождению материала для их изготовления. Ключевое значение для производства костных имплантатов имеет синтетический гидроксиапатит, изготовленный методом химического синтеза. В то же время используется множество материалов на основе переработанного гидроксиапатита биогенного происхождения, полученного с применением различных методов обработки.
Общепризнанным «золотым стандартом» костной пластики служит использование аутологичных костных трансплантатов. В клинической практике аутологичная трансплантация успешно применяется уже столетие [1, 2]. Однако, несмотря на то, что аутологичный пересадочный материал является эталонным, количество исследований, направленных на поиск альтернативных материалов, продолжает расти. Это связано с принципиальными недостатками методов получения аутологичного материала: во-первых, ограниченный объем трансплантационного материала [3, 4]; во-вторых, возможность развития осложнений со стороны донорского участка [5, 6]. Общий список осложнений включает инфекции, гематомы, хроническую боль, переломы, а также повреждение сосудов и нервов [7]. Объем изымаемого трансплантационного материала коррелирует с риском развития осложнений [8], что существенно ограничивает применение аутологичной костной трансплантации. В связи с этим чрезвычайно актуальным является использование альтернативных трансплантационных материалов, среди которых выделяются аллогенные [9–11] и ксеногенные [10, 12], что обусловило их широкое изучение.
Функционально наиболее близким к аутологичным трансплантационным материалам из всех перечисленных альтернативных материалов является аллогенный. Основное его преимущество — относительно высокая доступность [13]. Поэтому он уже много лет используется в клинической практике для реконструкции обширных костных повреждений. Как и аутогенный, аллогенный трансплантационный материал имеет высокую степень сходства со структурой нативной кости. Он обладает аналогичными механическими свойствами, остеоиндуктивными и остеокондуктивными свойствами, в определенной степени биосовместим. Указанные свойства ограничены в связи с необходимостью децеллюляризации трансплантационного материала [11]. Как отмечают некоторые авторы, основными проблемами этого метода являются отсутствие единых протоколов децеллюляризации и потенциальный риск передачи инфекционных заболеваний [14].
Категория ксеногенных костных трансплантатов имеет ряд сходств с аллогенными материалами. Например, существуют данные, подтверждающие высокие остеокондуктивные свойства ксеногенного бычьего костного материала [15]. Однако самостоятельное использование ксеногенного трансплантата, несмотря на положительный послеоперационный исход в отдельных случаях [16], демонстрирует низкое качество клинических результатов [17, 18]. Основными негативными результатами ксенотрансплантации являются фиброзная инкапсуляция трансплантата [19], неправильное сращение кости и болевой синдром [20]. Кроме того, из-за чрезвычайно высокой продолжительности интеграции ксенотрансплантата (57 нед) по сравнению с аллотрансплантатом (16 нед) многие исследователи ставят под сомнение возможность самостоятельного использования ксеногенных трансплантатов [17].
Таким образом, решение проблем стандартизации и повышенного риска передачи инфекционных агентов при трансплантации аллогенного [21, 22] или ксеногенного [23] костных материалов сохраняет свою актуальность. Необходимо также учитывать высокий риск развития повышенного иммунного ответа при аллогенной и ксеногенной костной пластике [24, 25]. Представленные трудности в использовании аллогенных и ксеногенных костных трансплантатов обусловливают необходимость разработки более безопасных, доступных и сравнительно эффективных альтернативных методов.
В связи с этим использование синтетического гидроксиапатита в качестве основы для имплантатов, способных выступать в роли функциональных альтернатив костных трансплантатов, становится высоко целесообразным. Это подтверждается опытом клинического использования гидроксиапатита [26–29]. Его популярность объясняется тем, что гидроксиапатит является нативной формой кальция костной ткани и занимает 70–90% объема ее матрикса. В костной ткани гидроксиапатит представлен в форме кристаллов малого размера и характеризуется стехиометрической формулой Ca10(PO4)6(OH)2 [30]. Особое внимание привлекает композитная форма использования синтетического гидроксиапатита, поскольку нативная кость также является композитной структурой [31, 32].
Показано, что гидроксиапатит способствует регенерации костной ткани, создавая благоприятное остеоиммунное микроокружение [33]. Тем не менее даже при использовании материалов, наиболее подходящих для получения костных имплантатов, требуется предварительный детальный анализ иммунной реакции. В данном контексте чрезвычайную важность приобретают ряд уникальных иммунологических параметров материалов на основе гидроксиапатита [34, 35]. Современные литературные данные [33, 36, 37] демонстрируют иммуномодулирующее действие материалов на основе гидроксиапатита. Так, выделен макрофаг-опосредованный регенеративный эффект гидроксиапатита, связанный с метаболизмом материала имплантата [33]. Такие сведения дают возможность манипулировать данными параметрами, настраивая структурные и текстурные характеристики материала и включая разнообразные функциональные компоненты. Открытым вопросом на данный момент остается связь наноструктурных параметров синтетического гидроксиапатита и его иммуномодулирующих свойств [33]. Остаются невыясненными параметры метаболизма гидроксиапатита на клеточном уровне и роль моноцитов/макрофагов в частности [33, 38].
Методология поиска источников
Поиск литературы для обзора осуществляли в системах MEDLINE (PubMed) и Google Scholar по ключевым словам и их сочетаниям: hydroxyapatite bone grafts, hydroxyapatite nanoparticles, nanostructured hydroxyapatite, bone grafts for biomedical applications, hydroxyapatite synthesis for bone grafts, hydroxyapatite for biomedical applications, hydroxyapatite production for bone grafting, biogenic hydroxyapatite, dry method hydroxyapatite production, dry method of hydroxyapatite production, chemical method of hydroxyapatite production, osteoclast response to synthetic hydroxyapatite, response to synthetic hydroxyapatite, properties of nanostructured hydroxyapatite, osteogenic potential of hydroxyapatite, osteoconductive potential of hydroxyapatite.
Сбор доступной научной информации проводили до 28 ноября 2023 г. Выбор статей осуществляли два соавтора независимо друг от друга посредством ручного поиска. Все разногласия устранялись путем обсуждения авторским коллективом, а также при консультации с третьим специалистом. Всего было отобрано 133 научные статьи.
Способы получения синтетического гидроксиапатита и особенности его наноструктуры
Существуют две основные категории способов получения гидроксиапатита: твердофазные методы и методы с применением растворителей [39].
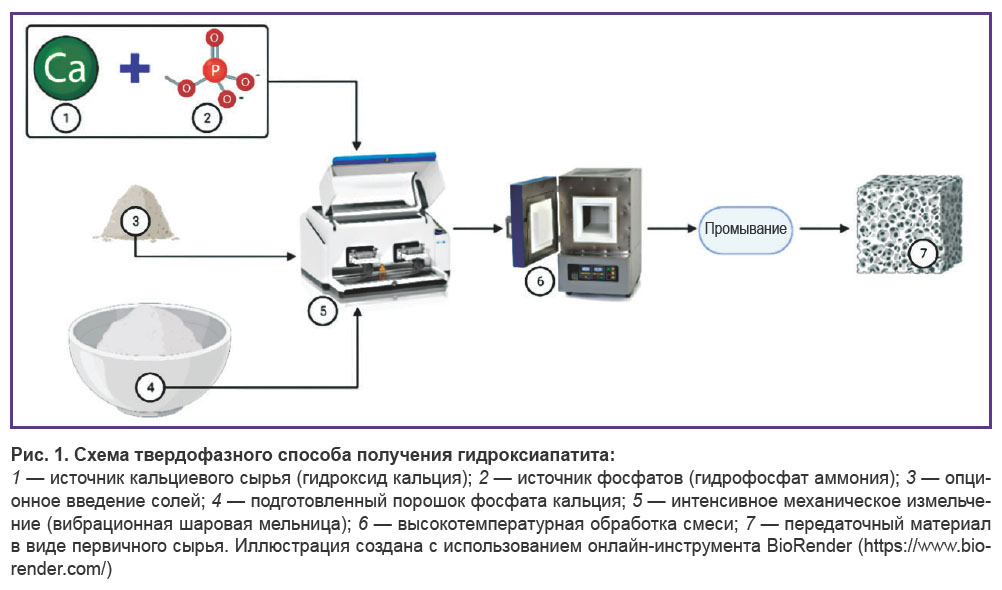
Твердофазные методы характеризуются использованием механического воздействия и относительно высоких температур (рис. 1).
Данные методы не нуждаются в использовании растворителя [40, 41]. Твердофазная технология имеет низкую чувствительность к производственным условиям [42, 43] и генерирует продукт с высокой кристаллизацией [39, 44]. Однако такой гидроксиапатит зачастую включает промежуточные фазы [45] и обладает низкими биомиметическими свойствами [46]. С другой стороны, получение такого материала легко масштабировать, используя оптимальную температуру 1050°C. Столь высокие температуры для производства гидроксиапатита намного снижают его пористость [45], что является значительным ограничением его использования в качестве материала для костной имплантации.
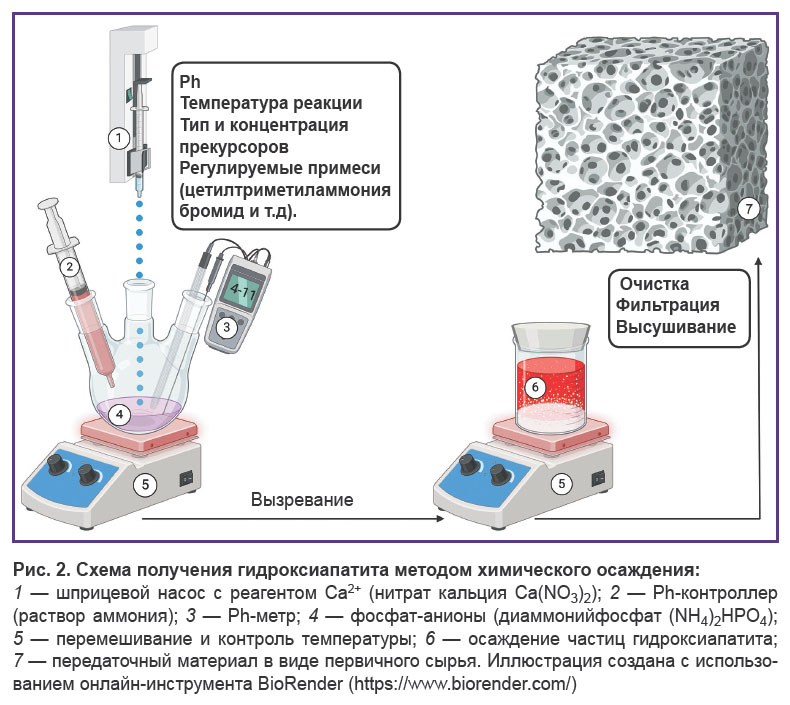
Методы химического осаждения характеризуются применением растворителей — источников кальция и фосфатов [39] — в присутствии добавок [47, 48, 49, 50] в кислой или основной средах (рис. 2). Диапазон производственных условий данных методов крайне разнообразен: отмечается большая вариабельность значений pH (3–12) [51, 52] и температур (25–90°C) [39, 53].
Осаждение позволяет получать частицы гидроксиапатита с нативной морфологией (игольчатой) [54] и дает возможность манипулировать ею [40]. Осаждение обеспечивает получение материала с желаемым ионным замещением магнием [47], стронцием, литием [55], марганцем [48], алюминием [49], цинком [55, 56], селеном [50] и другими металлами [57, 58].
Химическим осаждением можно получать композитный материал [59], формируя покрытия для полимерных [60–62], металлических [63, 64] и комбинированных подложек [65, 66]. Таким образом могут быть получены композитные пористые мицеллы [67], наночастицы [68], нанотрубки [69] и наностержни [70]. Гидроксиапатит, полученный химическим осаждением, имеет низкую кристалличность [40]. Несмотря на то, что химическое осаждение не требует высоких температур, для реализации данного метода нужен строгий контроль условий синтеза. С одной стороны, это снижает масштабируемость производства гидроксиапатита данным методом, но, с другой стороны, позволяет тонко регулировать морфологию и размер частиц гидроксиапатита [53]. Это, несомненно, является значимым преимуществом использования данного метода в исследовательской практике.
Основой для электрохимического метода служат водные растворы [71]. Данный метод позволяет формировать равномерные покрытия при невысоких температурах, обеспечивая прочную интеграцию гидроксиапатита в пористые носители [71, 72]. Ярким примером является метод импульсного электроосаждения, который снижает выделение газообразного водорода, улучшая интеграцию гидроксиапатита [71]. Как и в случае химического осаждения, метод электроосаждения используется для создания композитных структур гидроксиапатита с самой разнообразной морфологией и составом [73]. Такие структуры могут включать различные сплавы [74–76], в том числе алюминиевые [77], и полимерные основы [78]. Упомянутому электроосаждению также присуще морфологическое разнообразие: гидроксиапатитовые нанотрубки [79], наночастицы [80] и другие дисперсные формы гидроксиапатита [81, 82, 57].
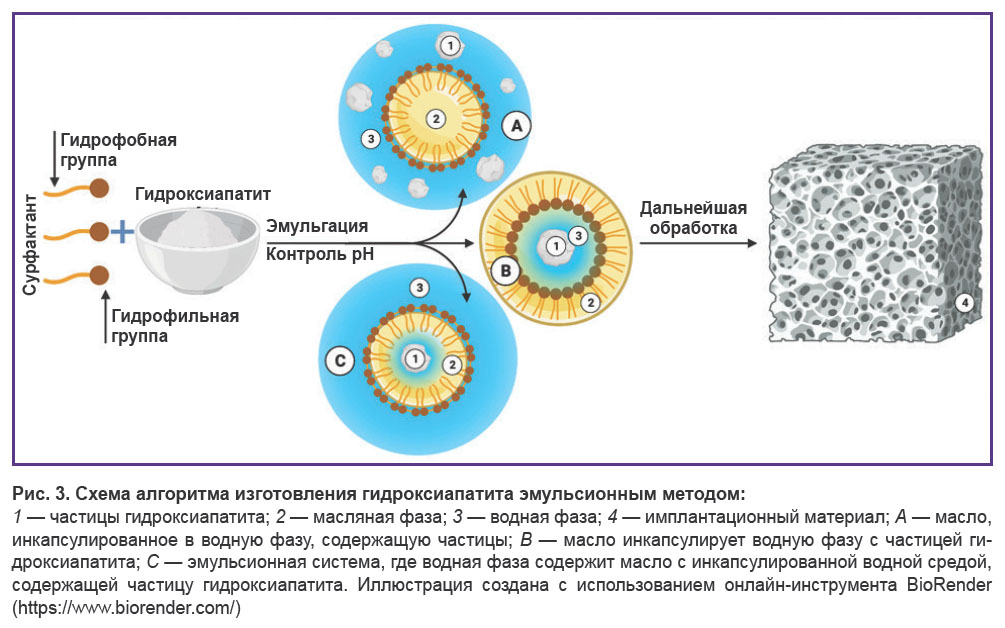
Эмульсионный метод, относящийся ко 2-й категории методов, является одним из наиболее эффективных для получения наноструктурного порошка гидроксиапатита (рис. 3). Частицы порошка формируются в дисперсной среде двух несмешивающихся растворителей, стабилизируемых поверхностно-активными веществами (ПАВ). Способ получения эмульсии определяется концентрацией и природой ПАВ [83]. Эмульсия создает благоприятную среду для регулирования роста частиц. В свою очередь гидрофобные ПАВ легко удаляются прокаливанием [84, 85].
Преимущество эмульсионного метода заключается в строгом контроле морфологических параметров наночастиц, благодаря чему метод часто используется для создания пористых материалов. Источниками кальция и фосфата могут быть нитрат кальция и фосфорная кислота. В качестве ПАВ могут использоваться диоктилсульфосукцинат натрия, додецилфосфат, полиоксиэтилен, неполифеноловый эфир, полиоксиэтиленовый эфир, цетилтриметиламмония бромид и додецилсульфат натрия. Помимо характеристик ПАВ конечные параметры гидроксиапатита могут определяться температурой, соотношением водной и органической фаз, рН и концентрацией прекурсоров [39].
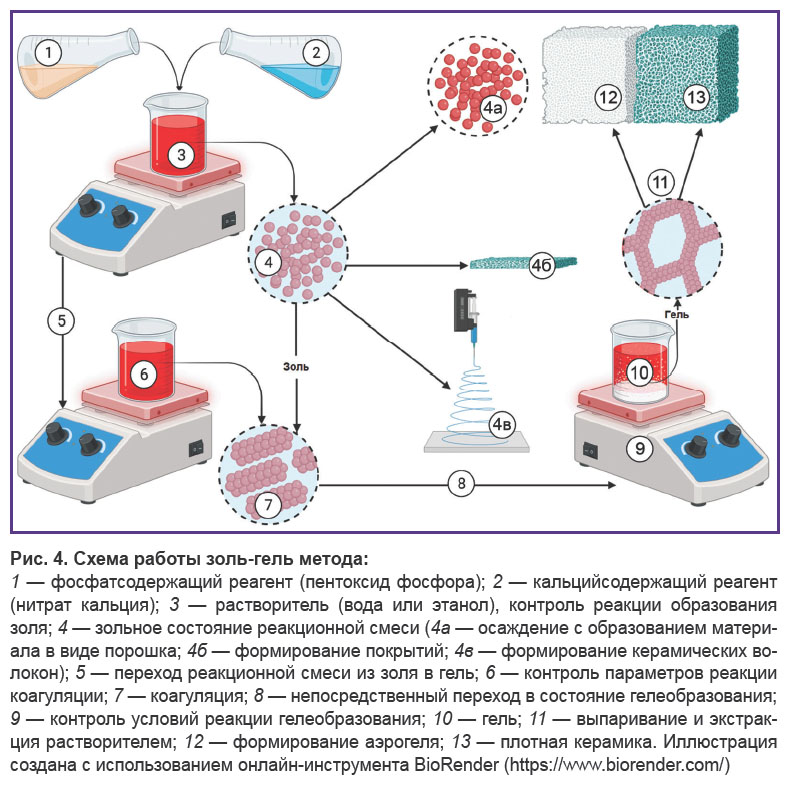
Золь-гель метод является относительно популярным методом получения гидроксиапатита (рис. 4). В качестве прекурсоров могут быть использованы хлорид кальция и различные органические фосфиты [86]. Он удобен для получения пленочных покрытий [87, 88] и аэрогелевых структур [39]. Данный метод предполагает гидролиз прекурсоров с образованием мицелл, связанных с шаблонами в водной или органической среде. Это обеспечивает высокую химическую однородность гидроксиапатита [89], подходящую стехиометрию и минимальную размерную кластеризацию. Дополнительно отмечены высокие показатели удельной площади поверхности и доступного мезопористого объема гидроксиапатита, полученного данным методом [90]. Исследования in vitro подтверждают хорошие показатели биодеградации материала, полученного этим методом [40]. Однако он имеет ограниченный потенциал масштабирования по причине низкой доступности прекурсоров. Более того, недостаточный производственный контроль может способствовать образованию вторичных фаз в виде CaO, Ca2P2O7, Ca3(PO4)2 и CaCO3 [39].
Каждый из представленных методов обладает своими преимуществами и недостатками, поэтому наиболее логичным шагом для улучшения качества синтетического гидроксиапатита может служить комбинирование описанных способов его получения. Так, например, продукт эмульсионного метода подвергается высокотемпературной обработке [84], которая зачастую является заключительным этапом комбинированных технологий, повышая кристалличность материала [85]. Существуют две основные вариации высокотемпературной обработки в качестве отдельных методов. Это метод пиролитического распыления и метод напыления. В первом случае в высокотемпературную печь распыляется раствор солей кальция и фосфора с последующим испарением воды и образованием кристаллов гидроксиапатита. Второй метод предполагает высокотемпературное покрытие мишени гидроксиапатитом. В обоих случаях морфология и размер частиц могут регулироваться, так как данные параметры напрямую зависят от характеристик распыляемых или напыляемых капель [40].
Биогенные источники гидроксиапатита
Рассмотрим наиболее распространенные методы получения гидроксиапатита из биогенных источников, популярным сырьем для которых являются биологические отходы: кости крупного рогатого скота [91, 92], яичная скорлупа [93, 94], морские организмы [95–98] и растения. Последние могут быть использованы для извлечения гидроксиапатита [99] или в качестве растворителя [100, 101]. Помимо этого они применяются как источники кальция [102] и фосфата [103, 104]. В литературе демонстрируется возможность использования наноструктурированного гидроксиапатита растительного [105] и грибного [106] происхождения.
Основным требованием к этому типу сырья является возможность удаления органических остатков, что достигается температурной обработкой [93], обработкой субкритической водой [107, 108], щелочным термическим гидролизом [108] и ферментативными методами [109].
Природный гидроксиапатит имеет различную степень замещения таких элементов, как Na+, Zn2+, Mg2+, K+, Si2+, Ba2+, F– и CO32– [110]. Этим объясняется разнообразие функций нативного гидроксиапатита костной ткани. Описана высокая биомиметичность полученного гидроксиапатита и минеральной фазы кости человека [93]. Это подтверждается и данными, свидетельствующими о сходстве ведущих морфологических и микроархитектурных параметров гидроксиапатита, обработанного при высоких температурах [111]. Так, удельная поверхность и морфология частиц синтезированного гидроксиапатита находятся в диапазоне значений, характерных для нативной костной ткани [112–115]. Подчеркнем, что биогенный гидроксиапатит может выступать как источник сырья для множества методов производства синтетического гидроксиапатита (см. таблицу [92, 93, 95, 96, 98, 115–123]).
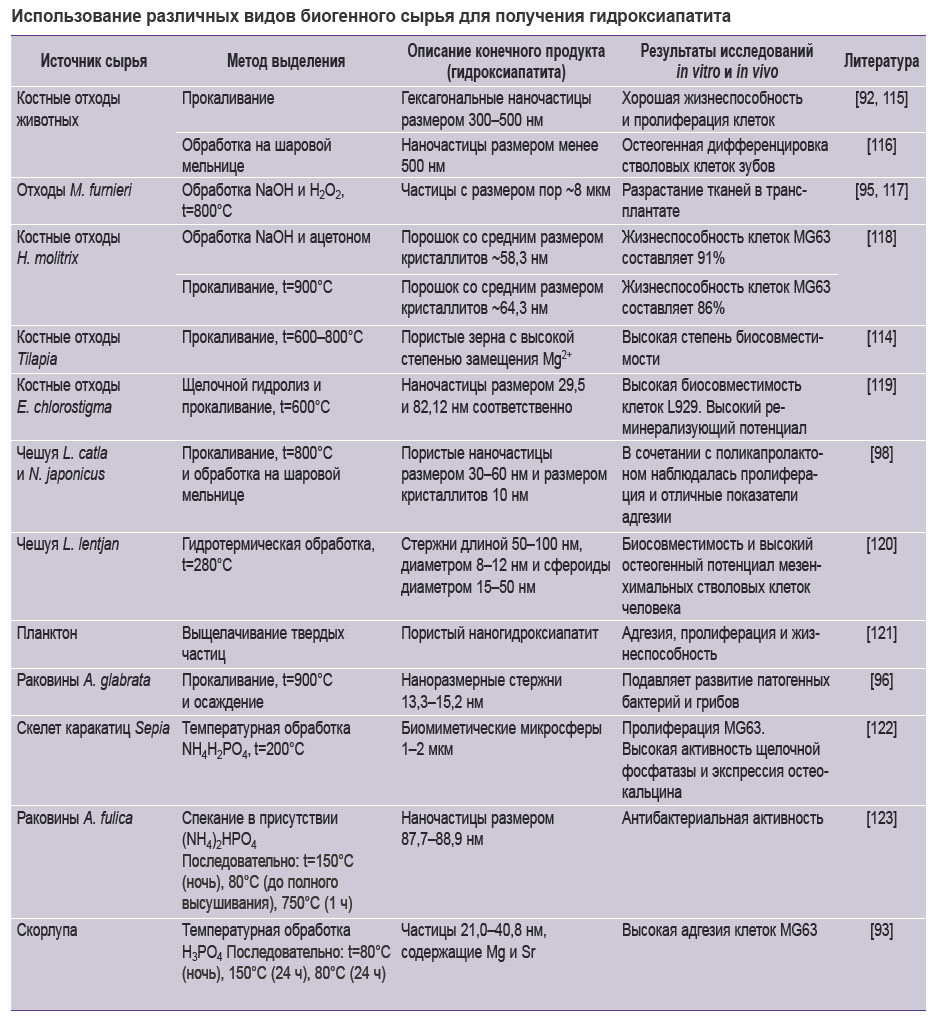
|
Использование различных видов биогенного сырья для получения гидроксиапатита |
Наличие большого разнообразия альтернативных методов получения синтетического гидроксиапатита с использованием самых разнообразных прекурсоров предоставляет большие возможности для производства костных имплантатов с различными наноструктурными параметрами. Это обусловлено описанной выше зависимостью наноархитектуры гидроксиапатита от методов его получения. Разнообразие наноструктуры является важным условием для выбора исследовательских и терапевтических стратегий применения костных имплантатов.
Особенности метаболизма и взаимодействия с иммунной системой реципиента
Большинство имплантатов, используемых для регенерации костной ткани, являются временными структурами, которые обеспечивают структурную поддержку, способствуют восстановлению кости и направляют ее рост. Полусинтетические и синтетические материалы доступны и могут быть модифицированы (например, подтверждается положительная динамика формирования новой кости на основе гидроксиапатитового скаффолда) [124].
Среди наиболее популярных синтетических костных заменителей выделяется группа кальций-фосфатной керамики, в которую входят гидроксиапатит, бета-трикальцийфосфат и альфа-трикальцийфосфат, сульфат кальция, а также биоактивные стекла и полимеры [125]. Гидроксиапатит имеет ряд особенностей в сравнении с другими синтетическими костными заменителями. По сравнению с бета-трикальцийфосфатом карбонат-замещенный гидроксиапатит [126, 127] обладает повышенной растворимостью в условиях, имитирующих лакуны Хаушипа (резорбционные ямки) [128]. Последние структуры являются результатом активности остеокластов и играют важную роль в процессе ремоделирования кости [129]. Резорбция бета-трикальцийфосфата максимальна в физиологически нормальных условиях [128]. Еще более высокая резорбция в физиологических условиях отмечена для альфа-трикальцийфосфата [130]. Дополнительно заметим, что замещенный магнием гидроксиапатит по сравнению с полугидратом сульфата кальция демонстрирует более низкую резорбцию в костных дефектах [131]. В свою очередь сульфат кальция демонстрирует неполный остеогенный ответ по сравнению с бета-трикальцийфосфатом/апатитом [132, 133].
При сравнении гидроксиапатита и биоактивных стекол отметим яркий остеокондуктивный ответ последних [125]. Это обусловлено образованием на их поверхностях аморфного слоя, формирующего условия для концентрации структурных белков и факторов роста [134]. Сравнительный анализ гидроксиапатита, биоактивного стекла и композитов, содержащих оба материала, показал увеличение остеокондуктивного потенциала при добавлении гидроксиапатита [135]. Помимо этого имплантаты на основе композитных материалов из гидроксиапатита и биостекла демонстрируют более высокую механическую устойчивость после имплантации в сравнении с чистым материалом биостекла [135, 136].
Сравнение результатов имплантации гидроксиапатита и биоактивного стекла демонстрирует большую площадь новообразованной кости и большее количество TRAP-положительных (TRAP — тартрат-резистентная кислая фосфатаза) клеток при использовании гидроксиапатита [137]. TRAP-положительные клетки в большей степени представлены остеокластами и макрофагами [138, 139].
Отличительной особенностью поведения гидроксиапатита в условиях костного ремоделирования на фоне, описанном в работах [137, 139], можно назвать особую связь этого материала с активностью остеокластов.
Для полимерных синтетических костных заменителей наблюдается аналогичная тенденция к увеличению остеогенного потенциала при условии включения в их состав гидроксиапатита [140]. При использовании полиуретанового композита с добавлением 40% гидроксиапатита отмечают увеличение способности к биоминерализации и остеогенной дифференцировке in vitro. Аналогично показано формирование заметного объема васкуляризированной костной ткани в исследованиях in vivo [141]. Идентичная тенденция наблюдается при включении гидроксиапатита в состав полиэтиленгликольдиакрилата: отмечается улучшение механических свойств и биосовместимости [142, 143].
Приведенные данные позволяют говорить о взаимодействии гидроксиапатита с TRAP-положительными клетками [137, 144–146], в частности с остеокластами и их иммунными предшественниками [138, 139]. Связь между гидроксиапатитом и выраженным острым иммунным ответом у реципиента подтверждается асептическим разрушением и остеолизом костной ткани в ответ на имплантацию материала. Возникновение этой реакции напрямую зависит от присутствия частиц гидроксиапатита размером менее 53 мкм, снижающих жизнеспособность остеобластов и остеокластов [147]. Указанная реакция на малоразмерный гидроксиапатит характерна для различных клеток, включая опухолевые. Частицы гидроксиапатита подавляют их пролиферацию за счет ингибирования синтеза белка, блокируя доступность рибосом для мРНК [148]. Дополнительно отметим, что наноразмерный гидроксиапатит инициирует селективный апоптоз [36] и блокирует рост меланомы [149]. Это связано в первую очередь с нарушением клеточного гомеостаза кальция и активацией эндогенных митохондриальных стимулов апоптоза [81], что выглядит интригующе в контексте гипотезы митохондриальной минерализации костной ткани [38]. Более того, гидроксиапатит способен инициировать уплощение моноцитов и дифференциацию макрофагов в остеокласт-ассоциированный фенотип. Воздействие гидроксиапатита стимулирует экспрессию активатора лиганда ядерного фактора каппа-В и формирование подосомного пояса в моноцитах/макрофагах, при этом модулируется активность остеокластов [150, 151].
Необходимо отметить, что гидроксиапатит, обработанный методом растворения и осаждения, в сравнении с необработанным гидроксиапатитом способствует росту площади TRAP-положительного окрашивания. Данный показатель ассоциирован с активностью остеокластов. Наблюдаемые различия объясняются наличием наноразмерного гидроксиапатита в обработанном материале, в то время как необработанный материал демонстрирует крупнозернистую структуру [152]. Это хорошо согласуется с тем фактом, что пластинчатая наноструктура гидроксиапатита ассоциируется с активной пролиферацией клеток на ранних стадиях коинкубации. Напротив, для гидроксиапатита с игольчатой наноструктурой высокая пролиферация клеток отмечается только на поздних стадиях эксперимента. Пластинчатая микроструктура гидроксиапатита также связана с большим количеством уплощенных макрофагов [153].
Получены убедительные доказательства в пользу влияния морфологии частиц гидроксиапатита на синтез цитокинов дендритными клетками мыши. Самые высокие показатели секреции интерлейкина 1β (IL-1β) были обнаружены в ответ на использование гидроксиапатита игольчатой формы. Напротив, способность усиливать синтез IL-1β не обнаружена для сферических частиц размером ~100 мкм. Ожидаемо, что при внутрибрюшинном введении частицы гидроксиапатита игольчатой формы вызывают более сильный воспалительный ответ по сравнению со своими сферическими аналогами. В клетках перитонеального экссудата мыши, стимулированных игольчатыми частицами размером ~5 мкм, обнаружены более высокие уровни фактора некроза опухоли α (TNF-α) в ответ на повторную стимуляцию. Все образцы экссудата, за исключением тех, которые стимулировались сферическими частицами размером ~100 мкм, демонстрировали сниженную выработку IL-10. Это в сочетании с динамикой инфильтрации тучными клетками и макрофагами свидетельствует о меньшей воспалительной реакции на крупные сферические частицы по сравнению с игольчатыми [37]. Более того, морфология частиц материала играет ключевую роль для формирования остеокондуктивных свойств за счет регуляции скорости резорбции материала TRAP-положительными остеокластоподобными клетками [154].
Сравнительно более поздние исследования также подтверждают особую важность наноуровневой морфологии материала имплантата на основе гидроксиапатита. Например, гидроксиапатит с микрожелобчатой структурой в сравнении с контрольным гидроксиапатитом способствует лучшему прикреплению макрофагов и снижает выработку провоспалительных цитокинов TNF-α, IL-1β и IL-6. Данное явление обусловлено снижением накопления активных форм кислорода (АФК) за счет модуляции функций митохондрий. Однако никакого воздействия на характер и динамику поляризации макрофагов не выявлено [155], хотя более поздние исследования сообщают о такой возможности [35]. С другой стороны, при воздействии наноструктурного гидроксиапатита в макрофагах наблюдают увеличение синтеза TNF-α, IL-6, аденозинтрифосфата, никотинамидадениндинуклеотида и АФК [156]. В то же время CD8-положительные T-клетки демонстрируют повышенную экспрессию IFN-γ и CD107α [157]. Напротив, микрожелобчатая структура снижает экспрессию IL-6 за счет ингибирования miR-214 и тем самым способствует выживанию мезенхимальных стволовых клеток костного мозга [155]. Способность палочкообразного гидроксиапатита влиять на функциональность митохондрий подтверждается механизмом его противоопухолевого действия. Например, при интернализации наностержневого гидроксиапатита высвобождаются митохондриальные АФК и катепсин B [157]. Гидроксиапатит с указанной морфологией демонстрирует заметные иммуномодулирующие [33, 36] и проапоптотические [36] свойства.
Следующий литературный пример [148] демонстрирует разницу свойств гидроксиапатита с различной морфологией в in vivo и in vitro условиях. В исследованиях in vivo наблюдается сравнимый остеогенный потенциал как для наноструктурного гидроксиапатита, так и для субмикронного гидроксиапатита. Более того, наноструктурный гидроксиапатит демонстрирует больший остеогенный потенциал. Одновременно с этим авторы подчеркивают связь остеогенеза и остеокластогенеза. Однако в опытах in vitro наноструктурный гидроксиапатит оказывает ингибирующий эффект в отношении ранней дифференциации и выживаемости остеокластов. Он снижает экспрессию специфических маркеров остеокластогенеза, а также активность TRAP, включая АФК-генерирующую активность. В связи с данным наблюдением стоит отметить сообщения о рибосомальных и митохондриальных механизмах ингибирования активности клеток гидроксиапатитом [36, 148]. В то же время субмикронный гидроксиапатит в опытах in vitro способен оказывать стимулирующее действие в отношении дифференциации и активности остеокластов [133].
В завершение необходимо отметить, что анализ содержания Ca2+ указывает на пониженный остеокластогенез на ранних стадиях инкубации клеток RAW 264.7 с наноструктурным гидроксиапатитом. Однако на 14-е сутки исследователи фиксируют постепенное увеличение и сохранение данного показателя остеокластогенеза. При этом в аналогичном опыте для субмикронного гидроксиапатита на 14-е сутки фиксируется резкое падение данного показателя остеокластогенеза, что может быть обусловлено апоптозом остеокластов.
Существуют исследования, которые демонстрируют активирующие свойства наноструктурного гидроксиапатита в отношении остеокластов [152]. Наблюдаемое противоречие может быть обусловлено различиями в параметрах инфильтрации иммунных клеток в опытах in vivo и in vitro (например, динамикой инфильтрации макрофагов и тучных клеток при имплантации наноструктурного гидроксиапатита [37]). Не исключено, что наблюдаемое явление имеет АФК-зависимое митохондриальное происхождение и связано с апоптозом. Из этого мы можем предположить комплексную природу анализируемого явления, поскольку влияние различий в параметрах стабильности инфильтрации иммунных клеток не исключает АФК-зависимого митохондриального механизма апоптоза остеокластов. Таким образом, дальнейший прогресс в понимании данного явления требует комплексных исследований, включающих оценку таких молекулярных механизмов, как АФК-зависимые митохондриальные каскады апоптоза.
Заключение
Согласно представленным данным, синтетический гидроксиапатит в качестве материала костных имплантатов обладает высоким остеогенным потенциалом и способностью стимулировать активность остеокластов. Сравнительный анализ показывает, что использование гидроксиапатита в качестве компонента композитных материалов повышает механическую устойчивость и остеокондуктивные свойства имплантатов.
Существует гипотеза, описывающая минерализацию костной ткани как энергозависимое перемещение катионов кальция и фосфат-анионов сыворотки крови в митохондрии остеобластов с последующим отложением аморфных микропакетов фосфата кальция. Данная гипотеза удачно соотносится с литературными данными, которые подтверждают важную роль митохондрий в метаболизме как синтетического, так и нативного гидроксиапатита. С другой стороны, синтетический и нативный гидроксиапатиты оказывают значительное влияние на митохондриальные АФК-зависимые функции. В то же время характер такого влияния напрямую зависит от микроархитектуры гидроксиапатита. Представленные факты позволяют выделить главное направление будущих исследований. Например, необходимо выявить конкретные механизмы метаболизма синтетического гидроксиапатита костных имплантатов, определив роль митохондриального аппарата клеток.
Приведенные литературные данные формируют достаточно полную картину различий между результатами in vivo и in vitro исследований синтетического гидроксиапатита с различной наноразмерной морфологией. Прежде всего они позволяют сделать вывод, что адекватная оценка гидроксиапатита как имплантационного материала с наноразмерной морфологией на данном этапе возможна только при относительно постоянной и длительной инфильтрации иммунных клеток. Эти условия в полной мере могут быть достигнуты в исследованиях in vivo. Тем не менее мы понимаем необходимость проверки данного заявления посредством дальнейших целевых исследований.
Кроме того, среди ключевых особенностей гидроксиапатита как материала костных имплантатов выделяется особый характер его взаимодействия с моноцитами/макрофагами, остеокластами и Т-клетками организма реципиента. Более того, это свойство может напрямую регулироваться наноразмерной морфологией материала при условии сохранения его макроскопической структуры. В этом контексте особый интерес вызывает способность наноструктурного гидроксиапатита воздействовать на рибосомы и митохондрии многих клеток, включая опухолевые клетки. В сочетании с удовлетворительными механическими свойствами, высоким потенциалом масштабируемости и унификацией процесса производства этот материал может использоваться для лечения обширных костных дефектов. Отдельно необходимо отметить дефекты, полученные в результате удаления опухолей, что обусловлено противоопухолевым эффектом наноструктурного гидроксиапатита. Тем не менее данный вопрос также необходимо конкретизировать с помощью целевых исследований.
Вклад авторов. В.А. Маркелов, А.Р. Билялов — разработка концепции исследования; В.А. Маркелов, В.А. Солнцев — поиск и сбор литературы; В.А. Маркелов, К.В. Данилко, С.В. Пятницкая — написание текста статьи; В.А. Маркелов, К.В. Данилко — методология; В.А. Маркелов, В.А. Солнцев — визуализация; К.В. Данилко, С.В. Пятницкая, А.Р. Билялов — формальный анализ; В.А. Маркелов, К.В. Данилко, С.В. Пятницкая, А.Р. Билялов, В.А. Солнцев — научное редактирование; А.Р. Билялов, К.В. Данилко, С.В. Пятницкая — общее руководство. Все авторы прочитали текст и согласились с опубликованной версией рукописи.
Источник финансирования. Исследование выполнено при поддержке Российского научного фонда (грант №23-15-20042).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Schmidt A.H. Autologous bone graft: is it still the gold standard? Injury 2021; 52(Suppl 2): S18–S22, https://doi.org/10.1016/j.injury.2021.01.043.
- Dissaux C., Ruffenach L., Bruant-Rodier C., George D., Bodin F., Rémond Y. Cleft alveolar bone graft materials: literature review. Cleft Palate Craniofac J 2022; 59(3): 336–346, https://doi.org/10.1177/10556656211007692.
- Kobbe P., Laubach M., Hutmacher D.W., Alabdulrahman H., Sellei R.M., Hildebrand F. Convergence of scaffold-guided bone regeneration and RIA bone grafting for the treatment of a critical-sized bone defect of the femoral shaft. Eur J Med Res 2020; 25(1): 70, https://doi.org/10.1186/s40001-020-00471-w.
- Ehredt D.J. Jr, Rogers B., Takhar J., Payton P., Siesel K. Percutaneous harvest of calcaneal bone autograft: quantification of volume and definition of anatomical safe zone. J Foot Ankle Surg 2022; 61(1): 27–31, https://doi.org/10.1053/j.jfas.2021.06.001.
- van de Wall B.J.M., Beeres F.J.P., Rompen I.F., Link B.C., Babst R., Schoeneberg C., Michelitsch C., Nebelung S., Pape H.C., Gueorguiev B., Knobe M. RIA versus iliac crest bone graft harvesting: a meta-analysis and systematic review. Injury 2022; 53(2): 286–293, https://doi.org/10.1016/j.injury.2021.10.002.
- Laubach M., Weimer L.P., Bläsius F.M., Hildebrand F., Kobbe P., Hutmacher D.W. Complications associated using the reamer-irrigator -aspirator (RIA) system: a systematic review and meta-analysis. Arch Orthop Trauma Surg 2023; 143(7): 3823–3843, https://doi.org/10.1007/s00402-022-04621-z.
- Dimitriou R., Mataliotakis G.I., Angoules A.G., Kanakaris N.K., Giannoudis P.V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury 2011; 42(Suppl 2): S3–S15, https://doi.org/10.1016/j.injury.2011.06.015.
- Suda A.J., Schamberger C.T., Viergutz T. Donor site complications following anterior iliac crest bone graft for treatment of distal radius fractures. Arch Orthop Trauma Surg 2019; 139(3): 423–428, https://doi.org/10.1007/s00402-018-3098-3.
- Li G., Li P., Chen Q., Thu H.E., Hussain Z. Current updates on bone grafting biomaterials and recombinant human growth factors implanted biotherapy for spinal fusion: a review of human clinical studies. Curr Drug Deliv 2019; 16(2): 94–110, https://doi.org/10.2174/1567201815666181024142354.
- Smeets R., Matthies L., Windisch P., Gosau M., Jung R., Brodala N., Stefanini M., Kleinheinz J., Payer M., Henningsen A., Al-Nawas B., Knipfer C. Horizontal augmentation techniques in the mandible: a systematic review. Int J Implant Dent 2022; 8(1): 23, https://doi.org/10.1186/s40729-022-00421-7.
- Sharifi M., Kheradmandi R., Salehi M., Alizadeh M., Ten Hagen T.L.M., Falahati M. Criteria, challenges, and opportunities for acellularized allogeneic/xenogeneic bone grafts in bone repairing. ACS Biomater Sci Eng 2022; 8(8): 3199–3219, https://doi.org/10.1021/acsbiomaterials.2c00194.
- Salem D., Alshihri A., Arguello E., Jung R.E., Mohmed H.A., Friedland B. Volumetric analysis of allogenic and xenogenic bone substitutes used in maxillary sinus augmentations utilizing cone beam CT: a prospective randomized pilot study. Int J Oral Maxillofac Implants 2019; 34(4): 920–926, https://doi.org/10.11607/jomi.7318.
- Lomas R., Chandrasekar A., Board T.N. Bone allograft in the U.K.: perceptions and realities. Hip Int 2013; 23(5): 427–433, https://doi.org/10.5301/hipint.5000018.
- Scheufler K.M., Diesing D. Use of bone graft replacement in spinal fusions. Orthopade 2015; 44(2): 146–153, https://doi.org/10.1007/s00132-014-3069-5.
- Tawil G., Barbeck M., Unger R., Tawil P., Witte F. Sinus floor elevation using the lateral approach and window repositioning and a xenogeneic bone substitute as a grafting material: a histologic, histomorphometric, and radiographic analysis. Int J Oral Maxillofac Implants 2018; 33(5): 1089–1096, https://doi.org/10.11607/jomi.6226.
- Ding Y., Wang L., Su K., Gao J., Li X., Cheng G. Horizontal bone augmentation and simultaneous implant placement using xenogeneic bone rings technique: a retrospective clinical study. Sci Rep 2021; 11(1): 4947, https://doi.org/10.1038/s41598-021-84401-8.
- Shibuya N., Holloway B.K., Jupiter D.C. A comparative study of incorporation rates between non-xenograft and bovine-based structural bone graft in foot and ankle surgery. J Foot Ankle Surg 2014; 53(2): 164–167, https://doi.org/10.1053/j.jfas.2013.10.013.
- Shibuya N., Jupiter D.C. Bone graft substitute: allograft and xenograft. Clin Podiatr Med Surg 2015; 32(1): 21–34, https://doi.org/10.1016/j.cpm.2014.09.011.
- Schwarz F., Ferrari D., Balic E., Buser D., Becker J., Sager M. Lateral ridge augmentation using equine- and bovine-derived cancellous bone blocks: a feasibility study in dogs. Clin Oral Implants Res 2010; 21(9): 904–912, https://doi.org/10.1111/j.1600-0501.2010.01951.x.
- Ledford C.K., Nunley J.A. 2nd, Viens N.A., Lark R.K. Bovine xenograft failures in pediatric foot reconstructive surgery. J Pediatr Orthop 2013; 33(4): 458–463, https://doi.org/10.1097/BPO.0b013e318287010d.
- Ruffilli A., Barile F., Fiore M., Manzetti M., Viroli G., Mazzotti A., Govoni M., De Franceschi L., Dallari D., Faldini C. Allogenic bone grafts and postoperative surgical site infection: are positive intraoperative swab cultures predictive for a higher infectious risk? Cell Tissue Bank 2023; 24(3): 627–637, https://doi.org/10.1007/s10561-022-10061-1.
- Singh S., Verma A., Jain A., Goyal T., Kandwal P., Arora S.S. Infection and utilization rates of bone allografts in a hospital-based musculoskeletal tissue bank in north India. J Clin Orthop Trauma 2021; 23: 101635, https://doi.org/10.1016/j.jcot.2021.101635.
- Van Der Merwe W., Lind M., Faunø P., Van Egmond K., Zaffagnini S., Marcacci M., Cugat R., Verdonk R., Ibañez E., Guillen P., Marcheggiani Muccioli G.M. Xenograft for anterior cruciate ligament reconstruction was associated with high graft processing infection. J Exp Orthop 2020; 7(1): 79, https://doi.org/10.1186/s40634-020-00292-0.
- Graham S.M., Leonidou A., Aslam-Pervez N., Hamza A., Panteliadis P., Heliotis M., Mantalaris A., Tsiridis E. Biological therapy of bone defects: the immunology of bone allo-transplantation. Expert Opin Biol Ther 2010; 10(6): 885–901, https://doi.org/10.1517/14712598.2010.481669.
- Hinsenkamp M., Muylle L., Eastlund T., Fehily D., Noël L., Strong D.M. Adverse reactions and events related to musculoskeletal allografts: reviewed by the World Health Organisation Project NOTIFY. Int Orthop 2012; 36(3): 633–641, https://doi.org/10.1007/s00264-011-1391-7.
- Pang Y.X., Liu X.W., Huang J.L., Zuo H.J., Xu X., Pei X.F. Identification of the strain which highly produces protease and β-D-glucosidase isolated from shuidouchi produced in sichuan and evaluating its ability of producing protease. Sichuan Da Xue Xue Bao Yi Xue Ban 2019; 50(5): 714–719.
- George S.M., Nayak C., Singh I., Balani K. Multifunctional hydroxyapatite composites for orthopedic applications: a review. ACS Biomater Sci Eng 2022; 8(8): 3162–3186, https://doi.org/10.1021/acsbiomaterials.2c00140.
- Zaed I., Cardia A., Stefini R. From reparative surgery to regenerative surgery: state of the art of porous hydroxyapatite in cranioplasty. Int J Mol Sci 2022; 23(10): 5434, https://doi.org/10.3390/ijms23105434.
- Sobczyk-Guzenda A., Boniecka P., Laska-Lesniewicz A., Makowka M., Szymanowski H. Micro- and nanoparticulate hydroxyapatite powders as fillers in polyacrylate bone cement-a comparative study. Materials (Basel) 2020; 13(12): 2736, https://doi.org/10.3390/ma13122736.
- Giordana A., Malandrino M., Zambon A., Lusvardi G., Operti L., Cerrato G. Biostimulants derived from organic urban wastes and biomasses: an innovative approach. Front Chem 2023; 11: 969865, https://doi.org/10.3389/fchem.2023.969865.
- Gao C., Peng S., Feng P., Shuai C. Bone biomaterials and interactions with stem cells. Bone Res 2017; 5: 17059, https://doi.org/10.1038/boneres.2017.59.
- Zimmermann E.A., Ritchie R.O. Bone as a structural material. Adv Health Mater 2015; 4(9): 1287–1304, https://doi.org/10.1002/adhm.201500070.
- Shang L., Shao J., Ge S. Immunomodulatory properties: the accelerant of hydroxyapatite-based materials for bone regeneration. Tissue Eng Part C Methods 2022; 28(8): 377–392, https://doi.org/10.1089/ten.TEC.2022.00111112.
- Mahon O.R., Browe D.C., Gonzalez-Fernandez T., Pitacco P., Whelan I.T., Von Euw S., Hobbs C., Nicolosi V., Cunningham K.T., Mills K.H.G., Kelly D.J., Dunne A. Nano-particle mediated M2 macrophage polarization enhances bone formation and MSC osteogenesis in an IL-10 dependent manner. Biomaterials 2020; 239: 119833, https://doi.org/10.1016/j.biomaterials.2020.119833.
- Wang R., Hua Y., Wu H., Wang J., Xiao Y.C., Chen X., Ao Q., Zeng Q., Zhu X., Zhang X. Hydroxyapatite nanoparticles promote TLR4 agonist-mediated anti-tumor immunity through synergically enhanced macrophage polarization. Acta Biomater 2023; 164: 626–640, https://doi.org/10.1016/j.actbio.2023.04.027.
- Zhang K., Zhou Y., Xiao C., Zhao W., Wu H., Tang J., Li Z., Yu S., Li X., Min L., Yu Z., Wang G., Wang L., Zhang K., Yang X., Zhu X., Tu C., Zhang X. Application of hydroxyapatite nanoparticles in tumor-associated bone segmental defect. Sci Adv 2019; 5(8): eaax6946, https://doi.org/10.1126/sciadv.aax6946.
- Lebre F., Sridharan R., Sawkins M.J., Kelly D.J., O’Brien F.J., Lavelle E.C. The shape and size of hydroxyapatite particles dictate inflammatory responses following implantation. Sci Rep 2017; 7(1): 2922, https://doi.org/10.1038/s41598-017-03086-0.
- Indurkar A., Choudhary R., Rubenis K., Locs J. Role of carboxylic organic molecules in interfibrillar collagen mineralization. Front Bioeng Biotechnol 2023; 11: 1150037, https://doi.org/10.3389/fbioe.2023.1150037.
- Kien P.T., Phu H.D., Linh N.V.V., Quyen T.N., Hoa N.T. recent trends in hydroxyapatite (HA) synthesis and the synthesis report of nanostructure HA by hydrothermal reaction. Adv Exp Med Biol 2018; 1077: 343–354, https://doi.org/10.1007/978-981-13-0947-2_18.
- Sadiq T.O., Sudin I., Idris J., Fadil N.A. Synthesis techniques of bioceramic hydroxyapatite for biomedical applications. Journal of Biomimetics, Biomaterials and Biomedical Engineering 2023; 59: 59–80, https://doi.org/10.4028/p-yqw75e.
- Clabel H.J.L., Awan I.T., Pinto A.H., Nogueira I.C., Bezzon V.D.N., Leite E.R., Balogh D., Mastelaro V., Ferreira S., Marega E. Insights on the mechanism of solid state reaction between TiO2 and BaCO3 to produce BaTiO3 powders: the role of calcination, milling, and mixing solvent. Ceramics International 2020; 46(3): 2987–3001, https://doi.org/10.1016/j.ceramint.2019.09.296.
- Szcześ A., Hołysz L., Chibowski E. Synthesis of hydroxyapatite for biomedical applications. Adv Colloid Interface Sci 2017; 249: 321–330, https://doi.org/10.1016/j.cis.2017.04.007.
- Chesley M., Kennard R., Roozbahani S., Kim S.M., Kukk K., Mason M. One-step hydrothermal synthesis with in situ milling of biologically relevant hydroxyapatite. Mater Sci Eng C Mater Biol Appl 2020; 113: 110962, https://doi.org/10.1016/j.msec.2020.110962.
- Sathiyavimal S., Vasantharaj S., LewisOscar F., Pugazhendhi A., Subashkumar R. Biosynthesis and characterization of hydroxyapatite and its composite (hydroxyapatite-gelatin-chitosan-fibrin-bone ash) for bone tissue engineering applications. Int J Biol Macromol 2019; 129: 844–852, https://doi.org/10.1016/j.ijbiomac.2019.02.058.
- Fihri A., Len C., Varma R.S., Solhy A. Hydroxyapatite: a review of syntheses, structure and applications in heterogeneous catalysis. Coordination Chemistry Reviews 2017; 347: 48–76, https://doi.org/10.1016/j.ccr.2017.06.009.
- Qi M.L., He K., Huang Z.N., Shahbazian-Yassar R., Xiao G.Y., Lu Y.P., Shokuhfar T. Hydroxyapatite fibers: a review of synthesis methods. JOM 2017; 69(8): 1354–1360, https://doi.org/10.1007/s11837-017-2427-2.
- Andrés N.C., D’Elía N.L., Ruso J.M., Campelo A.E., Massheimer V.L., Messina P.V. Manipulation of Mg2+-Ca2+ switch on the development of bone mimetic hydroxyapatite. ACS Appl Mater Interfaces 2017; 9(18): 15698–15710, https://doi.org/10.1021/acsami.7b02241.
- Lala S., Ghosh M., Das P.K., Kar T., Pradhan S.K. Mechanical preparation of nanocrystalline biocompatible single-phase Mn-doped A-type carbonated hydroxyapatite (A-cHAp): effect of Mn doping on microstructure. Dalton Trans 2015; 44(46): 20087–20097, https://doi.org/10.1039/c5dt03398e.
- Wang M., Wang L., Shi C., Sun T., Zeng Y., Zhu Y. The crystal structure and chemical state of aluminum-doped hydroxyapatite by experimental and first principles calculation studies. Phys Chem Chem Phys 2016; 18(31): 21789–21796, https://doi.org/10.1039/c6cp03230c.
- Kolmas J., Kuras M., Oledzka E., Sobczak M. A solid-state NMR study of selenium substitution into nanocrystalline hydroxyapatite. Int J Mol Sci 2015; 16(5): 11452–11464, https://doi.org/10.3390/ijms160511452.
- Lin D.J., Lin H.L., Haung S.M., Liu S.M., Chen W.C. Effect of pH on the in vitro biocompatibility of surfactant-assisted synthesis and hydrothermal precipitation of rod-shaped nano-hydroxyapatite. Polymers (Basel) 2021; 13(17): 2994, https://doi.org/10.3390/polym13172994.
- Le H.R., Chen K.Y., Wang C.A. Effect of pH and temperature on the morphology and phases of co-precipitated hydroxyapatite. Journal of Sol-Gel Science and Technology 2011; 61(3): 592–599, https://doi.org/10.1007/s10971-011-2665-7.
- Lee I.H., Lee J.A., Lee J.H., Heo Y.W., Kim J.J. Effects of pH and reaction temperature on hydroxyapatite powders synthesized by precipitation. Journal of the Korean Ceramic Society 2019; 57(1): 56–64, https://doi.org/10.1007/s43207-019-00004-0.
- Wijesinghe W.P., Mantilaka M.M., Premalal E.V., Herath H.M., Mahalingam S., Edirisinghe M., Rajapakse R.P., Rajapakse R.M. Facile synthesis of both needle-like and spherical hydroxyapatite nanoparticles: effect of synthetic temperature and calcination on morphology, crystallite size and crystallinity. Mater Sci Eng C Mater Biol Appl 2014; 42: 83–90, https://doi.org/10.1016/j.msec.2014.05.032.
- Boyd A.R., Rutledge L., Randolph L.D., Meenan B.J. Strontium-substituted hydroxyapatite coatings deposited via a co-deposition sputter technique. Mater Sci Eng C Mater Biol Appl 2015; 46: 290–300, https://doi.org/10.1016/j.msec.2014.10.046.
- Robinson L., Salma-Ancane K., Stipniece L., Meenan B.J., Boyd A.R. The deposition of strontium and zinc Co-substituted hydroxyapatite coatings. J Mater Sci Mater Med 2017; 28(3): 51, https://doi.org/10.1007/s10856-017-5846-2.
- Gu M., Li W., Jiang L., Li X. Recent progress of rare earth doped hydroxyapatite nanoparticles: luminescence properties, synthesis and biomedical applications. Acta Biomater 2022; 148: 22–43, https://doi.org/10.1016/j.actbio.2022.06.006.
- Lakrat M., Jodati H., Mejdoubi E.M., Evis Z. Synthesis and characterization of pure and Mg, Cu, Ag, and Sr doped calcium-deficient hydroxyapatite from brushite as precursor using the dissolution-precipitation method. Powder Technology 2023; 413: 118026, https://doi.org/10.1016/j.powtec.2022.118026.
- Shah R.K., Fahmi M.N., Mat A.H., Zainal A.A. The synthesis of hydroxyapatite through the precipitation method. Med J Malaysia 2004; 59(Suppl B): 75–76.
- Chen W., Nichols L., Brinkley F., Bohna K., Tian W., Priddy M.W., Priddy L.B. Alkali treatment facilitates functional nano-hydroxyapatite coating of 3D printed polylactic acid scaffolds. Mater Sci Eng C Mater Biol Appl 2021; 120: 111686, https://doi.org/10.1016/j.msec.2020.111686.
- Enami H., Nakahara I., Ando W., Uemura K., Hamada H., Takao M., Sugano N. Osteocompatibility of Si3N4-coated carbon fiber-reinforced polyetheretherketone (CFRP) and hydroxyapatite-coated CFRP with antibiotics and antithrombotic drugs. J Artif Organs 2023; 26(2): 144–150, https://doi.org/10.1007/s10047-022-01340-5.
- Laschke M.W., Strohe A., Menger M.D., Alini M., Eglin D. In vitro and in vivo evaluation of a novel nanosize hydroxyapatite particles/poly(ester-urethane) composite scaffold for bone tissue engineering. Acta Biomater 2010; 6(6): 2020–2027, https://doi.org/10.1016/j.actbio.2009.12.004.
- Chen J., Yang Y., Etim I.P., Tan L., Yang K., Misra R.D.K., Wang J., Su X. Recent advances on development of hydroxyapatite coating on biodegradable magnesium alloys: a review. Materials (Basel) 2021; 14(19): 5550, https://doi.org/10.3390/ma14195550.
- Kalpana M., Nagalakshmi R. Nano hydroxyapatite for biomedical applications derived from chemical and natural sources by simple precipitation method. Appl Biochem Biotechnol 2023; 195(6): 3994–4010, https://doi.org/10.1007/s12010-022-03968-8.
- Kuśmierczyk F., Fiołek A., Łukaszczyk A., Kopia A., Sitarz M., Zimowski S., Cieniek Ł., Moskalewicz T. Microstructure and selected properties of advanced biomedical n-HA/ZnS/Sulfonated PEEK coatings fabricated on zirconium alloy by duplex treatment. Int J Mol Sci 2022; 23(6): 3244, https://doi.org/10.3390/ijms23063244.
- Hu H., Lin C., Leng Y. An investigation of HAP/organic polymer composite coatings prepared by electrochemical co-deposition technique. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi 2003; 20(1): 4–7.
- Zhang Y., Dong K., Wang F., Wang H., Wang J., Jiang Z., Diao S. Three dimensional macroporous hydroxyapatite/chitosan foam-supported polymer micelles for enhanced oral delivery of poorly soluble drugs. Colloids Surf B Biointerfaces 2018; 170: 497–504, https://doi.org/10.1016/j.colsurfb.2018.06.053.
- Sivasankari S., Kalaivizhi R., Gowriboy N., Ganesh M.R., Shazia Anjum M. Hydroxyapatite integrated with cellulose acetate/polyetherimide composite membrane for biomedical applications. Polymer Composites 2021; 42(10): 5512–5526, https://doi.org/10.1002/pc.26242.
- Akiyama N., Patel K.D., Jang E.J., Shannon M.R., Patel R., Patel M., Perriman A.W. Tubular nanomaterials for bone tissue engineering. J Mater Chem B 2023; 11(27): 6225–6248, https://doi.org/10.1039/d3tb00905j.
- Adamu D.B., Zereffa E.A., Segne T.A., Razali M.H., Lemu B.R. Synthesis and characterization of bismuth-doped hydroxyapatite nanorods for fluoride removal. Environmental Advances 2023; 12: 100360, https://doi.org/10.1016/j.envadv.2023.100360.
- Asri R.I., Harun W.S., Hassan M.A., Ghani S.A., Buyong Z. A review of hydroxyapatite-based coating techniques: sol-gel and electrochemical depositions on biocompatible metals. J Mech Behav Biomed Mater 2016; 57: 95–108, https://doi.org/10.1016/j.jmbbm.2015.11.031.
- Kuo M.C., Yen S.K. The process of electrochemical deposited hydroxyapatite coatings on biomedical titanium at room temperature. Materials Science and Engineering: C 2002; 20(1–2): 153–160, https://doi.org/10.1016/s0928-4931(02)00026-7.
- Kumar S., Gupta R.K., Archana K., Kumari R. Development of ternary hydroxyapatite-Al2O3-TiO2 nanocomposite coating on Mg alloy by electrophoretic deposition method. Journal of Materials Engineering and Performance 2023; 33(10): 5075–84, https://doi.org/10.1007/s11665-023-08290-w.
- Baheti W., Lv S., Mila, Ma L., Amantai D., Sun H., He H. Graphene/hydroxyapatite coating deposit on titanium alloys for implant application. J Appl Biomater Funct Mater 2023; 21: 22808000221148104, https://doi.org/10.1177/22808000221148104.
- Quraishi M.A., Chauhan D.S. Recent trends in the development of corrosion inhibitors. In: Kamachi Mudali U., Subba Rao T., Ningshen S., Pillai R.G., George R.P., Sridhar T.M. (eds). A treatise on corrosion science, engineering and technology. Indian Institute of Metals series. Springer, Singapore; 2002, https://doi.org/10.1007/978-981-16-9302-1_40.
- Li G., Song Y., Chen X., Xu W., Tong G., Zhang L., Li J., Zhu X. Preparation, corrosion behavior and biocompatibility of MgFe-layered double hydroxides and calcium hydroxyapatite composite films on 316L stainless steel. Materials Today Communications 2023; 34: 105195, https://doi.org/10.1016/j.mtcomm.2022.105195.
- Sundaramali G., Aiyasamy J.P., Karthikeyan S., Kandavel T.K., Arulmurugan B., Rajkumar S., Sharma S., Li C., Dwivedi S., Kumar A., Singh R., Eldin S. Experimental investigations of electrodeposited Zn–Ni, Zn–Co, and Ni–Cr–Co–based novel coatings on AA7075 substrate to ameliorate the mechanical, abrasion, morphological, and corrosion properties for automotive applications. Reviews on Advanced Materials Science 2023; 62(1), https://doi.org/10.1515/rams-2022-0324.
- Al-Noaman A., Rawlinson S.C.F. Polyether ether ketone coated with nanohydroxyapatite/graphene oxide composite promotes bioactivity and antibacterial activity at the surface of the material. Eur J Oral Sci 2023; 131(5–6): e12946, https://doi.org/10.1111/eos.12946.
- Gao Q., Zhang L., Chen Y., Nie H., Zhang B., Li H. Interfacial design and construction of carbon fiber composites by strongly bound hydroxyapatite nanobelt-carbon nanotubes for biological applications. ACS Appl Bio Mater 2023; 6(2): 874–882, https://doi.org/10.1021/acsabm.2c01028.
- Park S.J., Jang J.M. Electrodeposition of hydroxyapatite nanoparticles onto ultra-fine TiO2 nanotube layer by electrochemical reaction in mixed electrolyte. J Nanosci Nanotechnol 2011; 11(8): 7167–7171, https://doi.org/10.1166/jnn.2011.4865.
- Zhang Q., Qiang L., Liu Y., Fan M., Si X., Zheng P. Biomaterial-assisted tumor therapy: a brief review of hydroxyapatite nanoparticles and its composites used in bone tumors therapy. Front Bioeng Biotechnol 2023; 11: 1167474, https://doi.org/10.3389/fbioe.2023.1167474.
- Kargozar S., Mollazadeh S., Kermani F., Webster T.J., Nazarnezhad S., Hamzehlou S., Baino F. Hydroxyapatite nanoparticles for improved cancer theranostics. J Funct Biomater 2022; 13(3): 100, https://doi.org/10.3390/jfb13030100.
- Gómora-Figueroa A.P., Camacho-Velázquez R.G., Guadarrama-Cetina J., Guerrero-Sarabia T.I. Oil emulsions in naturally fractured Porous Media. Petroleum 2019; 5(3): 215–226, https://doi.org/10.1016/j.petlm.2018.12.004.
- Liang Q., Liu X., Zeng G., Liu Z., Tang L., Shao B., Zengc Z., Zhangb W., Liua Y., Chenga M., Tanga W., Gongd S. Surfactant-assisted synthesis of photocatalysts: mechanism, synthesis, recent advances and environmental application. Chemical Engineering Journal 2019; 372: 429–451, https://doi.org/10.1016/j.cej.2019.04.168.
- Sadat-Shojai M., Khorasani M.T., Dinpanah-Khoshdargi E., Jamshidi A. Synthesis methods for nanosized hydroxyapatite with diverse structures. Acta Biomater 2013; 9(8): 7591–7621, https://doi.org/10.1016/j.actbio.2013.04.012.
- Ioiţescu A., Vlase G., Vlase T., Ilia G., Doca N. Synthesis and characterization of hydroxyapatite obtained from different organic precursors by sol-gel method. Journal of Thermal Analysis and Calorimetry 2009; 96(3): 937–942, https://doi.org/10.1007/s10973-009-0044-1.
- Yun Y.H., Lee J.K. Sol-gel coating of hydroxyapatite on zirconia substrate. J Nanosci Nanotechnol 2021; 21(8): 4169–4173, https://doi.org/10.1166/jnn.2021.19375.
- Jaafar A., Hecker C., Árki P., Joseph Y. Sol-gel derived hydroxyapatite coatings for titanium implants: a review. Bioengineering (Basel) 2020; 7(4): 127, https://doi.org/10.3390/bioengineering7040127.
- Ishikawa K., Garskaite E., Kareiva A. Sol-gel synthesis of calcium phosphate-based biomaterials — a review of environmentally benign, simple, and effective synthesis routes. Journal of Sol-Gel Science and Technology 2020; 94(3): 551–572, https://doi.org/10.1007/s10971-020-05245-8.
- Molino G., Palmieri M.C., Montalbano G., Fiorilli S., Vitale-Brovarone C. Biomimetic and mesoporous nano-hydroxyapatite for bone tissue application: a short review. Biomed Mater 2020; 15(2): 022001, https://doi.org/10.1088/1748-605X/ab5f1a.
- Hernández-Barreto D.F., Hernández-Cocoletzi H., Moreno-Piraján J.C. Biogenic hydroxyapatite obtained from bone wastes using CO2-assisted pyrolysis and its interaction with glyphosate: a computational and experimental study. ACS Omega 2022; 7(27): 23265–23275, https://doi.org/10.1021/acsomega.2c01379.
- Amna T. Valorization of bone waste of saudi arabia by synthesizing hydroxyapatite. Appl Biochem Biotechnol 2018; 186(3): 779–788, https://doi.org/10.1007/s12010-018-2768-5.
- Wu S.C., Hsu H.C., Wang H.F., Liou S.P., Ho W.F. Synthesis and characterization of nano-hydroxyapatite obtained from eggshell via the hydrothermal process and the precipitation method. Molecules 2023; 28(13): 4926, https://doi.org/10.3390/molecules28134926.
- Patel D.K., Jin B., Dutta S.D., Lim K.T. Osteogenic potential of human mesenchymal stem cells on eggshells-derived hydroxyapatite nanoparticles for tissue engineering. J Biomed Mater Res B Appl Biomater 2020; 108(5): 1953–1960, https://doi.org/10.1002/jbm.b.34536.
- Prado J.P.D.S., Yamamura H., Magri A.M.P., Ruiz P.L.M., Prado J.L.D.S., Rennó A.C.M., Ribeiro D.A., Granito R.N. In vitro and in vivo biological performance of hydroxyapatite from fish waste. J Mater Sci Mater Med 2021; 32(9): 109, https://doi.org/10.1007/s10856-021-06591-x.
- Ahmed H.Y., Safwat N., Shehata R., Althubaiti E.H., Kareem S., Atef A., Qari S.H., Aljahani A.H., Al-Meshal A.S., Youssef M., Sami R. Synthesis of natural nano-hydroxyapatite from snail shells and its biological activity: antimicrobial, antibiofilm, and biocompatibility. Membranes (Basel) 2022; 12(4): 408, https://doi.org/10.3390/membranes12040408.
- Granito R.N., Muniz Renno A.C., Yamamura H., de Almeida M.C., Menin Ruiz P.L., Ribeiro D.A. Hydroxyapatite from fish for bone tissue engineering: a promising approach. Int J Mol Cell Med 2018; 7(2): 80–90, https://doi.org/10.22088/IJMCM.BUMS.7.2.80.
- Kodali D., Hembrick-Holloman V., Gunturu D.R., Samuel T., Jeelani S., Rangari V.K. Influence of fish scale-based hydroxyapatite on forcespun polycaprolactone fiber scaffolds. ACS Omega 2022; 7(10): 8323–8335, https://doi.org/10.1021/acsomega.1c05593.
- Shaltout A.A., Allam M.A., Moharram M.A. FTIR spectroscopic, thermal and XRD characterization of hydroxyapatite from new natural sources. Spectrochim Acta A Mol Biomol Spectrosc 2011; 83(1): 56–60, https://doi.org/10.1016/j.saa.2011.07.036.
- Pradeep S., Jain A.S., Dharmashekara C., Prasad S.K., Akshatha N., Pruthvish R., Amachawadi R.G., Srinivasa C., Syed A., Elgorban A.M., Al Kheraif A.A., Ortega-Castro J., Frau J., Flores-Holguín N., Shivamallu C., Kollur S.P., Glossman-Mitnik D. Synthesis, computational pharmacokinetics report, conceptual DFT-based calculations and anti-acetylcholinesterase activity of hydroxyapatite nanoparticles derived from acorus calamus plant extract. Frontiers in Chemistry 2021; 9, https://doi.org/10.3389/fchem.2021.741037.
- Ghate P., Prabhu S.D., Murugesan G., Goveas L.C., Varadavenkatesan T., Vinayagam R., Lan Chi N.T., Pugazhendhi A., Selvaraj R. Synthesis of hydroxyapatite nanoparticles using Acacia falcata leaf extract and study of their anti-cancerous activity against cancerous mammalian cell lines. Environ Res 2022; 214(Pt 2): 113917, https://doi.org/10.1016/j.envres.2022.113917.
- Susanto H., Taufiq A., Sunaryono, Imam Mawardi A., Hariyanto Y.A., Nicholas Gerry A., Tri Yunisa D., Rufiandita F., Faris, Nizarghazi, Alifi G., Lita Neldya P., Sinta Dewi M. The characterization of green materials of Moringa oleifera leaf powder (MOLP) from Madura Island with different preparation methods. IOP Conference Series: Earth and Environmental Science 2019; 276(1): 012005, https://doi.org/10.1088/1755-1315/276/1/012005.
- Domene-López D., Delgado-Marín J.J., Martin-Gullon I., García-Quesada J.C., Montalbán M.G. Comparative study on properties of starch films obtained from potato, corn and wheat using 1-ethyl-3-methylimidazolium acetate as plasticizer. Int J Biol Macromol 2019; 135: 845–854, https://doi.org/10.1016/j.ijbiomac.2019.06.004.
- Khlestkin V.K., Rozanova I.V., Efimov V.M., Khlestkina E.K. Starch phosphorylation associated SNPs found by genome-wide association studies in the potato (Solanum tuberosum L.). BMC Genet 2019; 20(Suppl 1): 29, https://doi.org/10.1186/s12863-019-0729-9.
- Luo M., Li Z., Su M., Gadd G.M., Yin Z., Benton M.J., Pan Y., Zheng D., Zhao T., Li Z., Chen Y. Fungal-induced fossil biomineralization. Curr Biol 2023; 33(12): 2417–2424.e2, https://doi.org/10.1016/j.cub.2023.04.067.
- Alorku K., Manoj M., Yuan A. A plant-mediated synthesis of nanostructured hydroxyapatite for biomedical applications: a review. RSC Adv 2020; 10(67): 40923–40939, https://doi.org/10.1039/d0ra08529d.
- Shi D., Tong H., Lv M., Luo D., Wang P., Xu X., Han Z. Optimization of hydrothermal synthesis of hydroxyapatite from chicken eggshell waste for effective adsorption of aqueous Pb(II). Environ Sci Pollut Res Int 2021; 28(41): 58189–58205, https://doi.org/10.1007/s11356-021-14772-y.
- Barakat N.A.M., Khalil K.A., Sheikh F.A., Omran A.M., Gaihre B., Khil S.M., Kim H.Y. Physiochemical characterizations of hydroxyapatite extracted from bovine bones by three different methods: extraction of biologically desirable HAp. Materials Science and Engineering: C 2008; 28(8): 1381–1387, https://doi.org/10.1016/j.msec.2008.03.003.
- Boudreau S., Hrapovic S., Liu Y., Leung A.C.W., Lam E., Kerton F.M. Isolation of hydroxyapatite from Atlantic salmon processing waste using a protease and lipase mixture. RSC Sustainability 2023; 1(6): 1554–1564, https://doi.org/10.1039/d3su00102d.
- Mohd Pu’ad N.A.S., Koshy P., Abdullah H.Z., Idris M.I., Lee T.C. Syntheses of hydroxyapatite from natural sources. Heliyon 2019; 5(5): e01588, https://doi.org/10.1016/j.heliyon.2019.e01588.
- Forero-Sossa P.A., Salazar-Martínez J.D., Giraldo-Betancur A.L., Segura-Giraldo B., Restrepo-Parra E. Temperature effect in physicochemical and bioactive behavior of biogenic hydroxyapatite obtained from porcine bones. Sci Rep 2021; 11(1): 11069, https://doi.org/10.1038/s41598-021-89776-2.
- Horta M.K. dos S., Westin C., da Rocha D.N., Campos J.B. de, Souza R.F.M. de, Aguilar M.S., Moura F.J. Hydroxyapatite from biowaste for biomedical applications: obtainment, characterization and in vitro assays. Materials Research 2023; 26, https://doi.org/10.1590/1980-5373-mr-2022-0466.
- Joschek S., Nies B., Krotz R., Göferich A. Chemical and physicochemical characterization of porous hydroxyapatite ceramics made of natural bone. Biomaterials 2000; 21(16): 1645–1658, https://doi.org/10.1016/s0142-9612(00)00036-3.
- Cao X., Zhu J., Zhang C., Xian J., Li M., Nath Varma S., Qin Z., Deng Q., Zhang X., Yang W., Liu C. Magnesium-rich calcium phosphate derived from tilapia bone has superior osteogenic potential. J Funct Biomater 2023; 14(7): 390, https://doi.org/10.3390/jfb14070390.
- Gani M.A., Budiatin A.S., Lestari M.L.A.D., Rantam F.A., Ardianto C., Khotib J. Fabrication and characterization of submicron-scale bovine hydroxyapatite: a top-down approach for a natural biomaterial. Materials (Basel) 2022; 15(6): 2324, https://doi.org/10.3390/ma15062324.
- Lee M.C., Seonwoo H., Jang K.J., Pandey S., Lim J., Park S., Kim J.E., Choung Y.H., Garg P., Chung J.H. Development of novel gene carrier using modified nano hydroxyapatite derived from equine bone for osteogenic differentiation of dental pulp stem cells. Bioact Mater 2021; 6(9): 2742–2751, https://doi.org/10.1016/j.bioactmat.2021.01.020.
- Yamamura H., da Silva V.H.P., Ruiz P.L.M., Ussui V., Lazar D.R.R., Renno A.C.M., Ribeiro D.A. Physico-chemical characterization and biocompatibility of hydroxyapatite derived from fish waste. J Mech Behav Biomed Mater 2018; 80: 137–142, https://doi.org/10.1016/j.jmbbm.2018.01.035.
- Acharya P., Kupendra M., Fasim A., Anantharaju K.S., Kottam N., Murthy V.K., More S.S. Synthesis of nano hydroxyapatite from Hypopthalmichthys molitrix (silver carp) bone waste by two different methods: a comparative biophysical and in vitro evaluation on osteoblast MG63 cell lines. Biotechnol Lett 2022; 44(10): 1175–1188, https://doi.org/10.1007/s10529-022-03292-5.
- Mathirat A., Dalavi P.A., Prabhu A., Devi G.V.Y., Anil S., Senthilkumar K., Seong G.H., Sargod S.S., Bhat S.S., Venkatesan J. Remineralizing potential of natural nano-hydroxyapatite obtained from epinephelus chlorostigma in artificially induced early enamel lesion: an in vitro study. Nanomaterials (Basel) 2022; 12(22): 3993, https://doi.org/10.3390/nano12223993.
- Athinarayanan J., Periasamy V.S., Alshatwi A.A. Simultaneous fabrication of carbon nanodots and hydroxyapatite nanoparticles from fish scale for biomedical applications. Mater Sci Eng C Mater Biol Appl 2020; 117: 111313, https://doi.org/10.1016/j.msec.2020.111313.
- Baek J.W., Kim K.S., Park H., Kim B.S. Marine plankton exoskeletone-derived hydroxyapatite/polycaprolactone composite 3D scaffold for bone tissue engineering. Biomater Sci 2022; 10(24): 7055–7066, https://doi.org/10.1039/d2bm00875k.
- Palaveniene A., Tamburaci S., Kimna C., Glambaite K., Baniukaitiene O., Tihminlioğlu F., Liesiene J. Osteoconductive 3D porous composite scaffold from regenerated cellulose and cuttlebone-derived hydroxyapatite. J Biomater Appl 2019; 33(6): 876–890, https://doi.org/10.1177/0885328218811040.
- Fatimah I., Hidayat H., Purwiandono G., Khoirunisa K., Zahra H.A., Audita R., Sagadevan S. Green synthesis of antibacterial nanocomposite of silver nanoparticle-doped hydroxyapatite utilizing Curcuma longa leaf extract and land snail (Achatina fulica) shell waste. J Funct Biomater 2022; 13(2): 84, https://doi.org/10.3390/jfb13020084.
- Mebarki M., Coquelin L., Layrolle P., Battaglia S., Tossou M., Hernigou P., Rouard H., Chevallier N. Enhanced human bone marrow mesenchymal stromal cell adhesion on scaffolds promotes cell survival and bone formation. Acta Biomater 2017; 59: 94–107, https://doi.org/10.1016/j.actbio.2017.06.018.
- Ferraz M.P. Bone grafts in dental medicine: an overview of autografts, allografts and synthetic materials. Materials (Basel) 2023; 16(11): 4117, https://doi.org/10.3390/ma16114117.
- Gibson I.R., Bonfield W. Novel synthesis and characterization of an AB-type carbonate-substituted hydroxyapatite. J Biomed Mater Res 2002; 59(4): 697–708, https://doi.org/10.1002/jbm.10044.
- Siddiqi S.A., Azhar U. Carbonate substituted hydroxyapatite. In: Khan A.S., Chaudhry A.A. (eds). Handbook of ionic substituted hydroxyapatites. Woodhead Publishing; 2020; p. 149–173, https://doi.org/10.1016/b978-0-08-102834-6.00006-9.
- Ishikawa K., Miyamoto Y., Tsuchiya A., Hayashi K., Tsuru K., Ohe G. Physical and histological comparison of hydroxyapatite, carbonate apatite, and β-tricalcium phosphate bone substitutes. Materials (Basel) 2018; 11(10): 1993, https://doi.org/10.3390/ma11101993.
- Everts V., Delaissé J.M., Korper W., Jansen D.C., Tigchelaar-Gutter W., Saftig P., Beertsen W. The bone lining cell: its role in cleaning Howship’s lacunae and initiating bone formation. J Bone Miner Res 2002; 17(1): 77–90, https://doi.org/10.1359/jbmr.2002.17.1.77.
- Carrodeguas R.G., De Aza S. α-tricalcium phosphate: synthesis, properties and biomedical applications. Acta Biomater 2011; 7(10): 3536–3546, https://doi.org/10.1016/j.actbio.2011.06.019.
- Crespi R., Capparè P., Gherlone E. Magnesium-enriched hydroxyapatite compared to calcium sulfate in the healing of human extraction sockets: radiographic and histomorphometric evaluation at 3 months. J Periodontol 2009; 80(2): 210–218, https://doi.org/10.1902/jop.2009.080400.
- Atilgan S., Yaman F., Yilmaz U., Görgün B., Ünlü G. An experimental comparison of the effects of calcium sulfate particles and β-tricalcium phosphate/hydroxyapatite granules on osteogenesis in internal bone cavities. Biotechnology & Biotechnological Equipment 2007; 21(2): 205–210, https://doi.org/10.1080/13102818.2007.10817446.
- Chen F., Wang M., Wang J., Chen X., Li X., Xiao Y., Zhang X. Effects of hydroxyapatite surface nano/micro-structure on osteoclast formation and activity. J Mater Chem B 2019; 7(47): 7574–7587, https://doi.org/10.1039/c9tb01204d.
- Matsumoto M.A., Caviquioli G., Biguetti C.C., Holgado Lde A., Saraiva P.P., Rennó A.C., Kawakami R.Y. A novel bioactive vitroceramic presents similar biological responses as autogenous bone grafts. J Mater Sci Mater Med 2012; 23(6): 1447–1456, https://doi.org/10.1007/s10856-012-4612-8.
- Bellucci D., Anesi A., Salvatori R., Chiarini L., Cannillo V. A comparative in vivo evaluation of bioactive glasses and bioactive glass-based composites for bone tissue repair. Mater Sci Eng C Mater Biol Appl 2017; 79: 286–295, https://doi.org/10.1016/j.msec.2017.05.062.
- Bellucci D., Braccini S., Chiellini F., Balasubramanian P., Boccaccini A.R., Cannillo V. Bioactive glasses and glass-ceramics versus hydroxyapatite: comparison of angiogenic potential and biological responsiveness. J Biomed Mater Res A 2019; 107(12): 2601–2609, https://doi.org/10.1002/jbm.a.36766.
- Souza E.Q.M., Costa Klaus A.E., Espósito Santos B.F., Carvalho da Costa M., Ervolino E., Coelho de Lima D., Fernandes L.A. Evaluations of hydroxyapatite and bioactive glass in the repair of critical size bone defects in rat calvaria. J Oral Biol Craniofac Res 2020; 10(4): 422–429, https://doi.org/10.1016/j.jobcr.2020.07.014.
- Hayman A.R. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity 2008; 41(3): 218–223, https://doi.org/10.1080/08916930701694667.
- de Melo Pereira D., Davison N., Habibović P. Human osteoclast formation and resorptive function on biomineralized collagen. Bioact Mater 2021; 8: 241–252, https://doi.org/10.1016/j.bioactmat.2021.06.036.
- Tayton E., Purcell M., Aarvold A., Smith J.O., Briscoe A., Kanczler J.M., Shakesheff K.M., Howdle S.M., Dunlop D.G., Oreffo R.O. A comparison of polymer and polymer-hydroxyapatite composite tissue engineered scaffolds for use in bone regeneration. An in vitro and in vivo study. J Biomed Mater Res A 2014; 102(8): 2613–2624, https://doi.org/10.1002/jbm.a.34926.
- Yang W., Both S.K., Zuo Y., Birgani Z.T., Habibovic P., Li Y., Jansen J.A., Yang F. Biological evaluation of porous aliphatic polyurethane/hydroxyapatite composite scaffolds for bone tissue engineering. J Biomed Mater Res A 2015; 103(7): 2251–2259, https://doi.org/10.1002/jbm.a.35365.
- Deng X., Huang B., Hu R., Chen L., Tang Y., Lu C., Chen Z., Zhang W., Zhang X. 3D printing of robust and biocompatible poly(ethylene glycol)diacrylate/nano-hydroxyapatite composites via continuous liquid interface production. J Mater Chem B 2021; 9(5): 1315–1324, https://doi.org/10.1039/d0tb02182b.
- Ielo I., Calabrese G., De Luca G., Conoci S. Recent advances in hydroxyapatite-based biocomposites for bone tissue regeneration in orthopedics. Int J Mol Sci 2022; 23(17): 9721, https://doi.org/10.3390/ijms23179721.
- Nakamura M., Hiratai R., Hentunen T., Salonen J., Yamashita K. Hydroxyapatite with high carbonate substitutions promotes osteoclast resorption through osteocyte-like cells. ACS Biomater Sci Eng 2016; 2(2): 259–267, https://doi.org/10.1021/acsbiomaterials.5b00509.
- Heinemann C., Heinemann S., Rößler S., Kruppke B., Wiesmann H.P., Hanke T. Organically modified hydroxyapatite (ormoHAP) nanospheres stimulate the differentiation of osteoblast and osteoclast precursors: a co-culture study. Biomed Mater 2019; 14(3): 035015, https://doi.org/10.1088/1748-605X/ab0fad.
- Costa-Rodrigues J., Silva A., Santos C., Almeida M.M., Costa M.E., Fernandes M.H. Complex effect of hydroxyapatite nanoparticles on the differentiation and functional activity of human pre-osteoclastic cells. J Biomed Nanotechnol 2014; 10(12): 3590–3600, https://doi.org/10.1166/jbn.2014.1873.
- Sun J.S., Lin F.H., Hung T.Y., Tsuang Y.H., Chang W.H.S., Liu H.C. The influence of hydroxyapatite particles on osteoclast cell activities. J Biomed Mater Res 1999; 45(4): 311–321, https://doi.org/10.1002/(sici)1097-4636 (19990615)45:4311::aid-jbm53.0.co;2-9
- Han Y., Li S., Cao X., Yuan L., Wang Y., Yin Y., Qiu T., Dai H., Wang X. Different inhibitory effect and mechanism of hydroxyapatite nanoparticles on normal cells and cancer cells in vitro and in vivo. Sci Rep 2014; 4: 7134, https://doi.org/10.1038/srep07134.
- Chen Z., Deng J., Cao J., Wu H., Feng G., Zhang R., Ran B., Hu K., Cao H., Zhu X., Zhang X. Nano-hydroxyapatite-evoked immune response synchronized with controllable immune adjuvant release for strengthening melanoma-specific growth inhibition. Acta Biomater 2022; 145: 159–171, https://doi.org/10.1016/j.actbio.2022.04.002.
- Narducci P., Nicolin V. Differentiation of activated monocytes into osteoclast-like cells on a hydroxyapatite substrate: an in vitro study. Ann Anat 2009; 191(4): 349–355, https://doi.org/10.1016/j.aanat.2009.02.009.
- Veillat V., Spuul P., Daubon T., Egaña I., Kramer I., Génot E. Podosomes: multipurpose organelles? Int J Biochem Cell Biol 2015; 65: 52–60, https://doi.org/10.1016/j.biocel.2015.05.020.
- Ding X., Takahata M., Akazawa T., Iwasaki N., Abe Y., Komatsu M., Murata M., Ito M., Abumi K., Minami A. Improved bioabsorbability of synthetic hydroxyapatite through partial dissolution-precipitation of its surface. J Mater Sci Mater Med 2011; 22(5): 1247–1255, https://doi.org/10.1007/s10856-011-4291-x.
- Mestres G., Espanol M., Xia W., Persson C., Ginebra M.P., Ott M.K. Inflammatory response to nano- and microstructured hydroxyapatite. PLoS One 2015; 10(3):e0120381, https://doi.org/10.1371/journal.pone.0120381.
- Ghanaati S., Udeabor S.E., Barbeck M., Willershausen I., Kuenzel O., Sader R.A., Kirkpatrick C.J. Implantation of silicon dioxide-based nanocrystalline hydroxyapatite and pure phase beta-tricalciumphosphate bone substitute granules in caprine muscle tissue does not induce new bone formation. Head Face Med 2013; 9: 1, https://doi.org/10.1186/1746-160X-9-1.
- Li C., Yang L., Ren X., Lin M., Jiang X., Shen D., Xu T., Ren J., Huang L., Qing W., Zheng J., Mu Y. Groove structure of porous hydroxyapatite scaffolds (HAS) modulates immune environment via regulating macrophages and subsequently enhances osteogenesis. J Biol Inorg Chem 2019; 24(5): 733–745, https://doi.org/10.1007/s00775-019-01687-w.
- Zeng Q., Wang R., Hua Y., Wu H., Chen X., Xiao Y.C., Ao Q., Zhu X., Zhang X. Hydroxyapatite nanoparticles drive the potency of Toll-like receptor 9 agonist for amplified innate and adaptive immune response. Nano Res 2022; 15(10): 9286–9297, https://doi.org/10.1007/s12274-022-4683-x.
- Zhang L., Liang Z., Chen C., Yang X., Fu D., Bao H., Li M., Shi S., Yu G., Zhang Y., Zhang C., Zhang W., Xue C., Sun B. Engineered hydroxyapatite nanoadjuvants with controlled shape and aspect ratios reveal their immunomodulatory potentials. ACS Appl Mater Interfaces 2021; 13(50): 59662–59672, https://doi.org/10.1021/acsami.1c17804.