Модель болезни Крона на крупных лабораторных животных — свиньях
Неудовлетворенность результатами лечения воспалительных заболеваний кишечника требует разработки современных методов терапии.
Цель исследования — создание модели болезни Крона на крупных животных, у которых возможно формирование язвенных дефектов, для апробации новых методов лечения и оценки их эффективности эндоскопическими и морфологическими методами.
Материалы и методы. Модель отрабатывали на свиньях (помесь породы визенау с вьетнамской черной вислобрюхой) в количестве 12 особей — кастрированных самцов в возрасте 6 мес. Манипуляции с животными проводили под общей седацией в условиях операционной SPF-вивария для содержания крупных лабораторных животных Приволжского исследовательского медицинского университета (Н. Новгород). Для формирования дефектов применяли эндоскопический метод и высокочастотный электрохирургический аппарат. Полученные результаты оценивали эндоскопически, а также с использованием гистологических и морфометрических методов на 7, 14 и 21-е сутки.
Результаты. Морфологическое исследование слизистой оболочки прямой кишки свиньи выявило характерные для болезни Крона признаки, что доказало возможность использования свиней в качестве модели язвенных дефектов при болезни Крона.
Заключение. Данная модель болезни Крона на крупных животных (в частности, свиньях) значительно расширяет границы использования новых методов лечения в доклинической стадии, что позволит повысить эффект терапии пациентов с болезнью Крона, снижая риск хирургического вмешательства.
Введение
Болезнь Крона и язвенный колит являются двумя основными фенотипами воспалительного заболевания кишечника (ВЗК) и хронического идиопатического воспалительного заболевания желудочно-кишечного тракта [1–3]. Пациенты страдают непрерывно-рецидивирующим течением болезни, вследствие чего часто назначается лечение иммуномодуляторами и/или моноклональными антителами для устранения симптомов [4–7]. Однако зачастую наблюдаются отсутствие первичного ответа, потеря вторичного ответа и повышенный риск серьезных оппортунистических инфекций. Кроме того, несмотря на появление новой генно-инженерной терапии, до 30% пациентов с язвенным колитом и 80% пациентов с болезнью Крона по-прежнему нуждаются в хирургическом вмешательстве для облегчения симптомов, обусловленных прогрессирующим повреждением стенки кишечника [8, 9].
Болезнь Крона характеризуется хроническим и/или рецидивирующим воспалением кишечного тракта. Ее патогенез до конца не ясен. Предполагается, что нарушение регуляции врожденной и адаптивной иммунной системы, генетические влияния и факторы окружающей среды вмешиваются в развитие заболевания [10]. При существующих методах лечения все еще остается значительная часть пациентов, у которых не удается достичь ремиссии. Неудовлетворенные потребности в лечении ВЗК обусловливают необходимость разработки новых методов [11, 12].
Таким образом, в связи с ростом заболеваемости ВЗК, с утяжелением течения болезни, а также с увеличением количества пациентов, которые нуждаются в хирургическом вмешательстве, встает вопрос о необходимости изучения альтернативных методов лечения данного заболевания. Решение этой задачи обусловило создание моделей болезни на животных, особенно крупных, у которых можно формировать язвенные дефекты, исследовать новые методы лечения и оценивать их эффективность эндоскопическими и морфологическими методами.
В литературе описаны методики создания модели ВЗК у животных преимущественно химическим путем; по эндоскопической картине они в большей степени могут соответствовать язвенному колиту. Так, было разработано несколько типов фармакологически индуцированных моделей колита у животных: модели, индуцированные декстрана сульфатом (DSS), тринитробензолсульфоновой кислотой (TNBS) или уксусной кислотой (AA) [13, 14]. Часто в таких моделях DSS и TNBS используются в сочетании с этанолом [15]. Химически индуцированные модели ВЗК относительно просты и могут быть реализованы на различных типах животных. В то же время химическое повреждение кишечного барьера приводит к самоограничивающейся воспалительной реакции — острому течению, а не к хронической форме. Таким образом, эти модели более актуальны для использования в исследованиях острого воспаления. Они могут предоставить лишь ограниченную информацию о патогенезе ВЗК; с их помощью можно провести достаточно условную экстраполяцию результатов на процессы, протекающие у человека [14].
Использование уксусной кислоты — одна из наиболее широко применяемых методик моделирования эрозивно-язвенного поражения слизистой оболочки кишечника. В результате ректального введения в полость кишечника 1 мл 4% AA на глубину 8 см наблюдаются клинические (кровавая диарея, потеря веса) и морфологические признаки (интенсивный воспалительный ответ, характеризующийся масштабным кровотечением, изъязвлениями, истончением кишечной стенки, уменьшением количества крипт, нейтрофильной инфильтрацией) [16, 17]. Однако, как и при других методиках химического воздействия, получается модель, которая характеризуется непрерывным поражением, что более свойственно для язвенного колита.
Кроме того, представленные химические модели язвенных дефектов наиболее часто используются при исследованиях на мелких лабораторных животных, в основном грызунах [18, 19]. Это делает невозможным выполнение прижизненного эндоскопического обследования и оценки эффективности предлагаемых методов лечения язвенных дефектов в динамике, в том числе морфологической.
Цель работы — создание модели язвенных дефектов кишечной стенки, характерных для болезни Крона, на крупных животных с возможностью эндоскопического и морфологического наблюдения за процессом заживления.
Материалы и методы
Исследование одобрено локальным этическим комитетом Приволжского исследовательского медицинского университета (Н. Новгород) 14 марта 2022 г. (протокол №04). Содержание животных и проведение экспериментов осуществляли в соответствии с этическими принципами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006).
Манипуляции с животными проводили в условиях операционной SPF-вивария для содержания крупных лабораторных животных Приволжского исследовательского медицинского университета.
Используемые препараты:
Zoletil 100 (Virbac Sante Animale, Франция);
XylaVet 2% (Pharmamagist Kft., Венгрия);
Propofol-Lipuro 5 мг/кг (B. Braun Melsungen AG, Германия);
10% забуференный формалин (рН=7,2–7,4) (ООО «ЭргоПродакшн», Россия).
Используемое оборудование:
станция для окраски гематоксилином и эозином Gemini AS (Thermo Fisher Scientific, США);
стационарный УЗИ-аппарат Mindray Veta 5 (Mindray, Китай);
ветеринарный монитор пациента Mindray uMEC12 Vet Advance (Mindray, Китай);
видеоколоноскоп Fujinon ЕС-530WL (Fujifilm, Япония);
эндоскопическая стойка Fujinon System4400 Processor (Fujifilm, Япония);
высокочастотный электрохирургический аппарат BOWA 901-011 (BOWA-electronic, Германия);
видеорегистратор TEAC UR-4MD (TEAC Corporation, Япония);
биопсийные щипцы MTW (MTW Endoskoрie, Германия);
эндоскопическая петля для полипэктомии MTW (MTW Endoskoрie, Германия);
инжектор MTW (MTW Endoskoрie, Германия);
электронож Olympus UES-10 (Olympus, Япония);
морфометрический комплекс Leica DMR (Leica Microsystems, Германия);
аппарат Excelsior ES (Thermo Fisher Scientific, США);
заливочная станция HistoStar (Thermo Fisher Scientific, США);
микротом Microm HM 325 (Thermo Fisher Scientific, США);
микроскоп Nikon Eclipse E400 (Nikon, Япония) с цифровой камерой Nikon DXM1200 (Nicon, Япония) и программным обеспечением АСТ-1 v. 2.12 и «Видеотест-Морфология 5.0» (ООО «ВидеоТест», Россия);
гистосканер Pannoramic (3DHISTECH, Венгрия).
Животные. В эксперименте использовали свиней — помесь породы визенау с вьетнамской черной вислобрюхой, кастрированных самцов в возрасте 6 мес; количество особей — 12.
Седация животных. Формирование дефекта слизистой оболочки, эндоскопическое исследование и забор материала для морфологического исследования проводили под комбинированным обезболиванием. Седацию животных осуществляли внутримышечным введением Zoletil 100 в дозе 6 мг/кг и XylaVet 2% в дозе 0,3 мг/кг. После седации выполняли интубацию с последующей синхронизированной вентиляцией легких (SIMV), а также инфузионную поддержку с использованием Propofol-Lipuro в дозе 5 мг/кг и Zoletil 100 в дозе 2 мг/кг.
Контроль состояния животных осуществляли профессиональные анестезиологи-реаниматологи. На протяжении всего эндоскопического вмешательства проводили мониторирование артериального давления, частоты сердечных сокращений, парциального напряжения кислорода в крови, контроль дыхания и вентиляции легких с помощью стационарного УЗИ-аппарата и ветеринарного монитора.
Гистологические исследования. Биопсийный материал, полученный при эндоскопическом исследовании, фиксировали в 10% забуференном формалине (рН=7,2–7,4) и подвергали стандартной гистологической обработке (дегидратация, депарафинирование) на аппарате Excelsior ES. После проводки изготовляли парафиновые блоки с использованием заливочной станции HistoStar. Серийные срезы толщиной 4–6 мкм получали на микротоме Microm HM 325 с дальнейшим окрашиванием гематоксилином и эозином. Просмотр и фотографирование гистологических препаратов осуществляли на микроскопе Nikon Eclipse E400 с использованием цифровой камеры Nikon DXM1200, программного обеспечения АСТ-1 v. 2.12 и «Видеотест-Морфология 5.0».
Для объективного исследования структуры слизистой оболочки прямой кишки применяли морфометрический метод. Подсчет клеток осуществляли в 10 полях зрения при увеличении объектива 90 и окуляра — 10, затем вычисляли абсолютное число клеток на 1 мм2.
Формирование язвенных дефектов кишечной стенки. Выполняли седацию животного. До создания модели проводили эндоскопическое исследование прямой кишки свиньи с оценкой состояния слизистой оболочки и взятием биопсийного материала. Перед анестезиологическим пособием подготовку свиньи не выполняли. У животных был обычный режим еды и питья, без очистки кишечника с помощью клизм. Ручным способом (с помощью пальцев) осуществляли механическую очистку прямой кишки на глубину 8–10 см. Затем под эндоскопическим контролем выбирали участок нативной слизистой оболочки и осуществляли ее захват с помощью эндоскопической петли при перистальтике. Далее выполняли отсечение и коагуляцию кишечной стенки глубиной до мышечного слоя в смешанном режиме электроэксцизии (сила тока — 5,0–6,0 А). Под действием тока формировали язвенные дефекты кишечной стенки, соответствующие по глубине и наличию четких границ типичной картине язвенных дефектов кишечной стенки при болезни Крона.
Статистический анализ проводили с помощью компьютерной программы для статистической обработки данных SPSS Statistics v. 23.0 (StatSoft Inc., США). Принадлежность выборки к закону распределения оценивали с помощью критерия Колмогорова–Смирнова, который для части исследуемых групп составил менее 0,05; коэффициентов асимметрии и эксцесса. Для описания данных использовали медиану, нижний и верхний квартили (Ме [Q1; Q3]). Первоначально результаты исследования обработаны с помощью непараметрического критерия Фридмана для оценки статистической значимости между группами сравнения, затем использован непараметрический критерий Манна–Уитни для попарного сравнения данных между группой с адаптационной нормой (здоровые животные) и четырьмя группами различных сроков наблюдения. С учетом поправки Бонферрони принят стандартный критический уровень значимости p<0,0125.
Результаты
Результаты формирования язвенных дефектов у всех 12 животных были сопоставимы. В качестве примера мы приводим подробное описание полученных результатов формирования дефектов у двух свиней.
Примеры использованных способов создания модели болезни Крона на крупных лабораторных животных — свиньях
Пример 1. Самец свиньи, помесь породы визенау с вьетнамской черной вислобрюхой, возраст 6 мес, кастрированный, масса — 28 900 г.
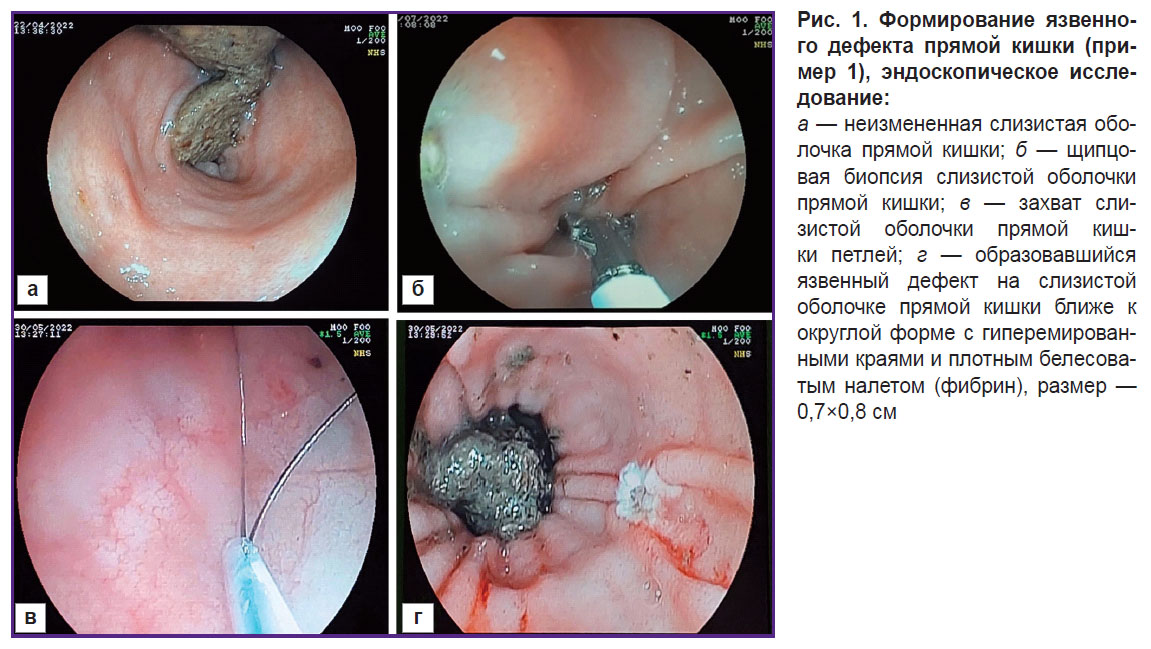
Проводили седацию животного без предварительной подготовки, как описано выше, ручным способом выполняли очищение прямой кишки (удаление каловых масс) на глубину 10 см. При эндоскопическом исследовании очищение прямой кишки было оценено как удовлетворительное (рис. 1, а). Затем проводили забор биопсии с неизмененной слизистой оболочки прямой кишки (рис. 1, б) при помощи петли на перистальтике с захватом оболочки диаметром 10 мм. Осуществляли затягивание петли, отсечение участка слизистой оболочки и последующее воздействие на поврежденный участок силой тока в 5 А (рис. 1, в). Проводили осмотр слизистой оболочки прямой кишки с целью обнаружения полученного язвенного дефекта (рис. 1, г), а также удаления отсеченного участка. Размер язвенного дефекта равнялся 10 мм. На следующий день (1-е сутки) после моделирования язвенного дефекта слизистой оболочки толстого кишечника забирали биопсийный материал для морфологической оценки полученной модели.
Внешний вид биоптата слизистой оболочки на следующий день после формирования дефекта выглядел таким образом:
поверхностный эпителий отсутствовал;
определялись эрозивные дефекты;
были видны крипты с нерегулярным расположением, число их уменьшено, количество бокаловидных клеток в части крипт резко снижено вплоть до полного их исчезновения;
в собственной пластинке слизистой оболочки отмечалась диффузная резко выраженная лимфоплазмоцитарная инфильтрация с присутствием значительного числа нейтрофильных лейкоцитов, формирующих фокусы скопления, в том числе с их интраэпителиальным распространением в эпителий многих крипт и формированием крипт-абсцессов с последующим разрушением части крипт;
стенки сосудов микроциркуляции были разрыхлены, с набухшими эндотелиоцитами, частью — с инфильтрацией нейтрофилами, последние в том числе определялись в просвете некоторых сосудов;
мышечная пластинка в части полей была фрагментирована, местами с фокусами нейтрофильной инфильтрации;
в подслизистой основе выявлялась выраженная воспалительная инфильтрация с нахождением значительного числа нейтрофилов;
обнаруживались сосуды с набухшими эндотелиоцитами, просвет отдельных сосудов был расширен и содержал нейтрофилы.
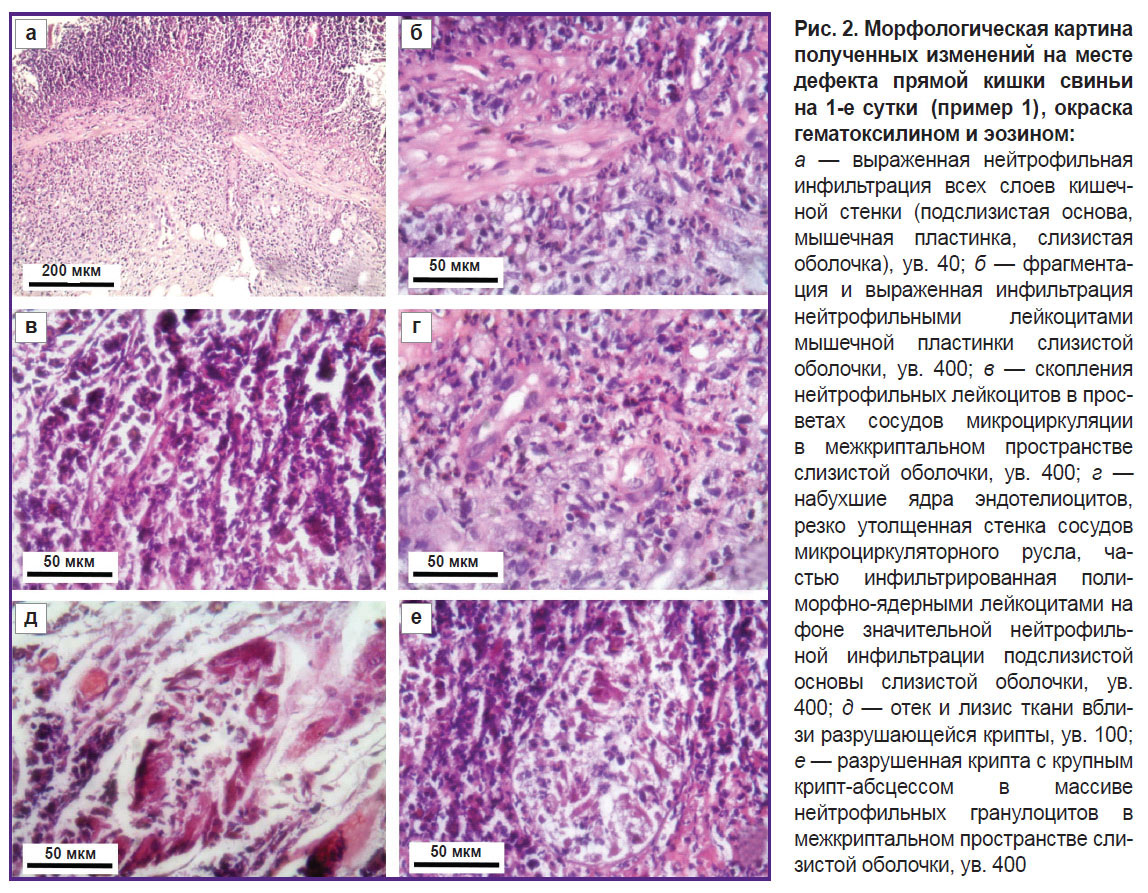
Морфологическая картина полученных изменений на месте дефекта была следующей: нейтрофильная инфильтрация всех слоев кишечной стенки (рис. 2, а), фрагментация и выраженная инфильтрация нейтрофильными лейкоцитами мышечной пластинки слизистой оболочки (рис. 2, б), сосуды микроциркуляторного русла со значительным содержанием нейтрофилов в просветах сосудов (рис. 2, в), набухший эндотелий, утолщенная сосудистая стенка сосудов микроциркуляторного русла в окружении резкой воспалительной инфильтрации (рис. 2, г), отек и лизис ткани вблизи разрушающейся крипты (рис. 2, д), разрушенная крипта с крупным крипт-абсцессом в массиве нейтрофильных гранулоцитов межкриптального пространства слизистой оболочки (рис. 2, е).
Морфологическая картина по всем параметрам соответствовала морфологической картине язвенных дефектов при болезни Крона [20, 21].
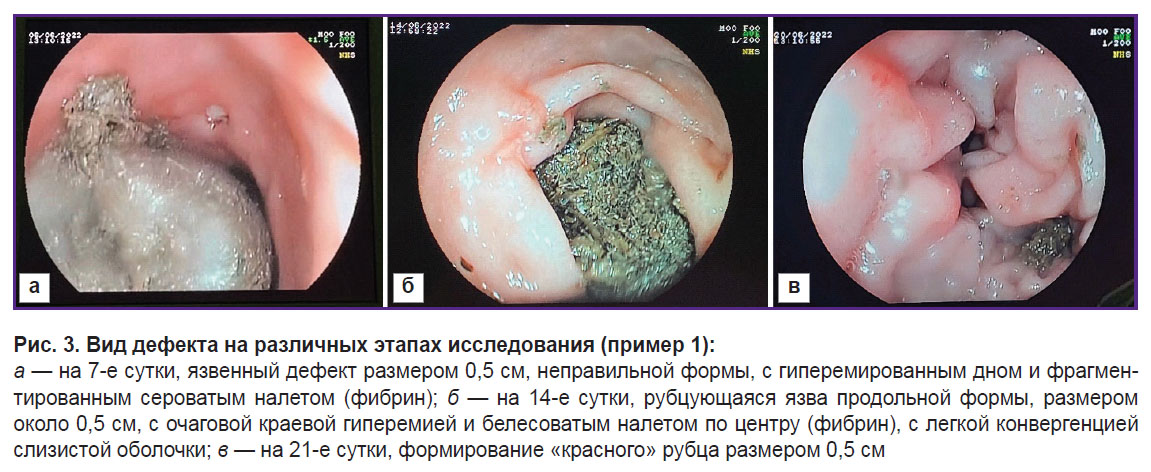
Контроль дефекта осуществляли на 7, 14 и 21-е сутки (рис. 3). На рисунке наглядно видно, что за время исследования на 21-е сутки на месте язвенного дефекта образовался нежный рубец.
Состояние животного в течение эксперимента было удовлетворительным, ухудшения аппетита и характера стула не наблюдалось.
Пример 2. Самец свиньи, помесь породы визенау с вьетнамской черной вислобрюхой, возраст 6 мес, кастрированный, масса — 22 850 г.
Без предварительной подготовки животному давали общий наркоз препаратом Zoletil 100, проводили очищение кишки на глубину 8 см (удаление каловых масс ручным способом), вводили эндоскоп. Когда эндоскопическое исследование показало, что очищение прямой кишки удовлетворительное, выполняли захват слизистой оболочки эндоскопической петлей (рис. 4, а). В смешанном режиме электроэксцизии силой тока 6,0 А осуществляли отсечение и коагуляцию кишечной стенки глубиной до мышечного слоя. Полученный в результате манипуляций дефект соответствовал 11 мм (рис. 4, б).
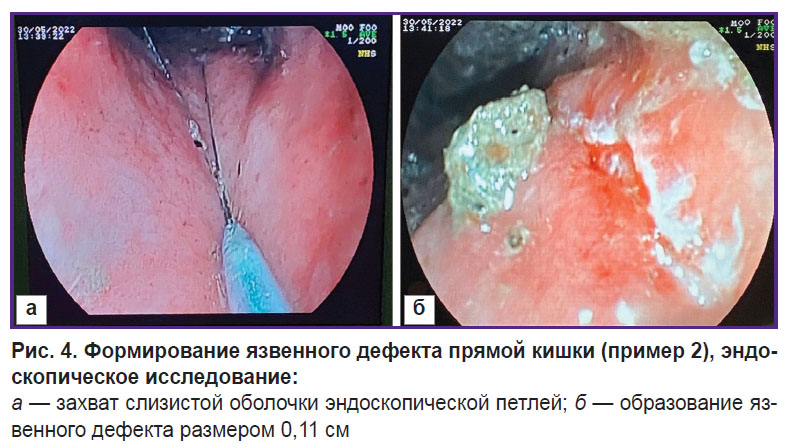
|
Рис. 4. Формирование язвенного дефекта прямой кишки (пример 2), эндоскопическое исследование: а — захват слизистой оболочки эндоскопической петлей; б — образование язвенного дефекта размером 0,11 см |
На следующий день после моделирования язвенного дефекта слизистой оболочки толстого кишечника брали биопсийный материал для морфологической оценки. Биоптат слизистой оболочки после формирования дефекта выглядел следующим образом:
покровный эпителий по большей части с эрозивными изменениями, отмечено отсутствие бокаловидных клеток;
криптальный слой резко сужен, вплоть до полного исчезновения крипт;
в собственной пластинке слизистой оболочки отмечалась диффузная резко выраженная лимфоплазмоцитарная инфильтрация со значительным присутствием полиморфно-ядерных лейкоцитов;
сосуды микроциркуляции были с набухшим эндотелием, просвет многих содержал нейтрофильные лейкоциты;
в подслизистой основе обнаруживалась диффузная выраженная воспалительная инфильтрация и присутствие в части полей зрения значительного числа полиморфно-ядерных лейкоцитов с их проникновением в мышечную пластинку.
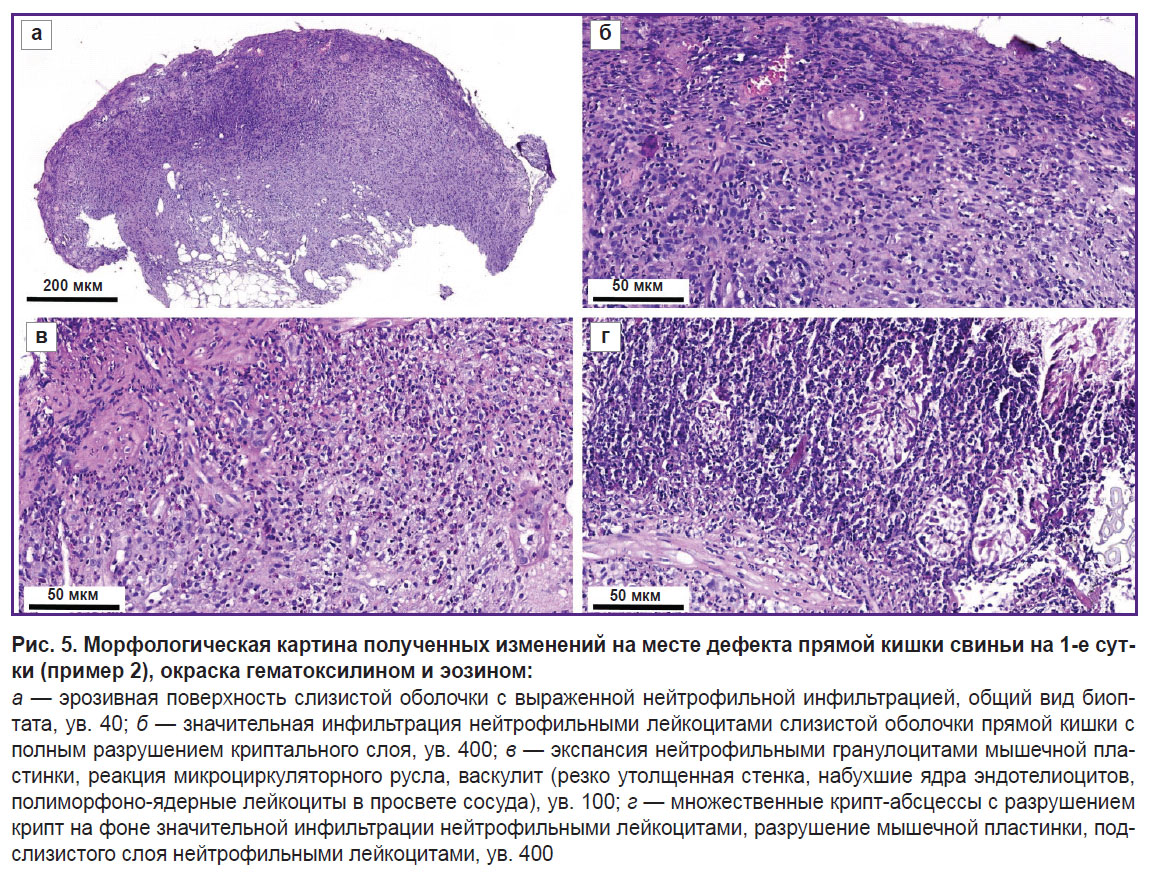
На рис. 5 представлены эрозивная поверхность слизистой оболочки с выраженной нейтрофильной инфильтрацией всех слоев кишечной стенки (рис. 5, а); клетки воспалительного инфильтрата, разрушающие крипты (рис. 5, б); воспалительная инфильтрация мышечной пластинки с проникновением в подслизистую основу, васкулит (рис. 5, в); множественные крипт-абсцессы с разрушением крипт, а также разрушение и лизис мышечной пластинки, подслизистого слоя на фоне значительной инфильтрации нейтрофильными лейкоцитами (рис. 5, г).
Результаты морфологического исследования слизистой оболочки выявили характерные для болезни Крона [20] признаки: наличие глубоких эрозивно-язвенных дефектов, распространяющихся на все слои кишечной стенки; наличие в подслизистой основе выраженной воспалительной инфильтрации и присутствие значительного числа полиморфно-ядерных лейкоцитов с их проникновением в мышечную пластинку, а также отсутствие бокаловидных клеток.
На этом фоне обнаружено заметное снижение количества клеток фибробластического дифферона. Кроме того, практически в 2 раза уменьшилось количество клеток тучно-клеточной популяции с преобладанием молодых клеточных форм, обладающих низкой синтетической активностью. При этом отмечалось большее в сравнении с нормой содержание макрофагов, которые в этом случае обеспечивают элиминацию дегенерировавших компонентов собственной пластинки слизистой оболочки (СПСО) и экстрацеллюлярного матрикса.
При анализе микроциркуляторного русла в СПСО прямой кишки свиньи на 1-е сутки наблюдения обращает на себя внимание резкое нарушение кровообращения. Так, сосуды СПСО подвергались редуцированию как в поверхностных, так и в глубоких отделах.
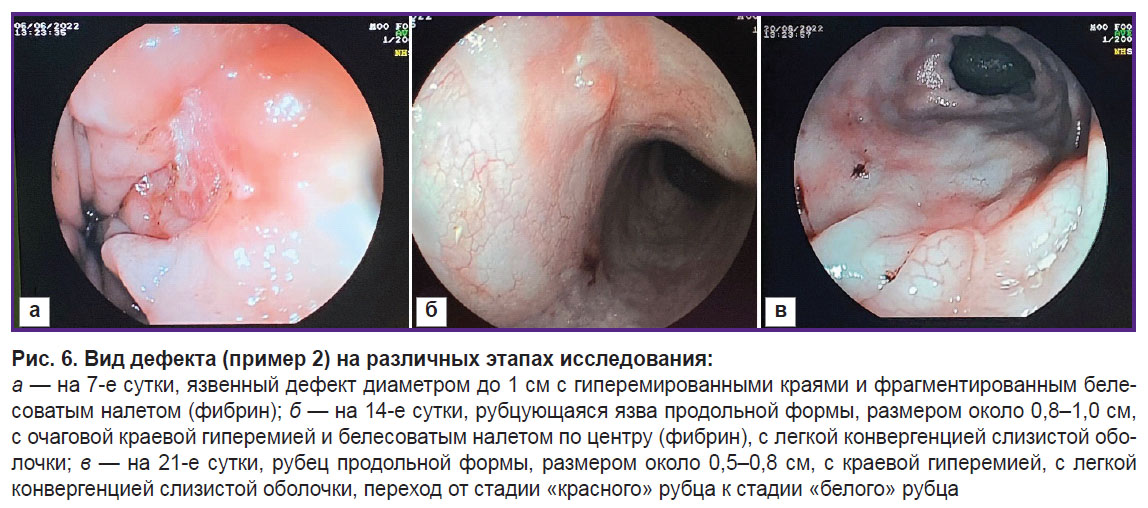
Эндоскопический и морфологический контроль, как и в первом случае, проводили на 7, 14, 21-е сутки эксперимента (рис. 6). Через 3 нед после моделирования дефекта сохранился небольшой рубчик на месте исходного дефекта (рис. 6, в).
Состояние животного в течение эксперимента было удовлетворительным, ухудшения аппетита, характера стула не наблюдалось.
Результаты анализа гистологического материала в динамике
Анализ гистологического материала на 7-е сутки наблюдения показал, что у всех опытных животных отмечалась картина выраженной воспалительной реакции (см. таблицу). Так, плотность клеточного инфильтрата по сравнению с нормой увеличилась более чем в 1,5 раза и достигла максимума за счет резкого повышения числа клеток лимфоплазмоцитарного ряда с присутствием значительного количества полиморфно-ядерных лейкоцитов. Количество клеток лимфоплазмоцитарного ряда было увеличено более чем в 2,6 раза, а число полиморфно-ядерных лейкоцитов было почти в 3 раза выше относительно неизмененной слизистой оболочки. Установлены явления активного неоангиогенеза с появлением множественных тонкостенных сосудов капиллярного типа.
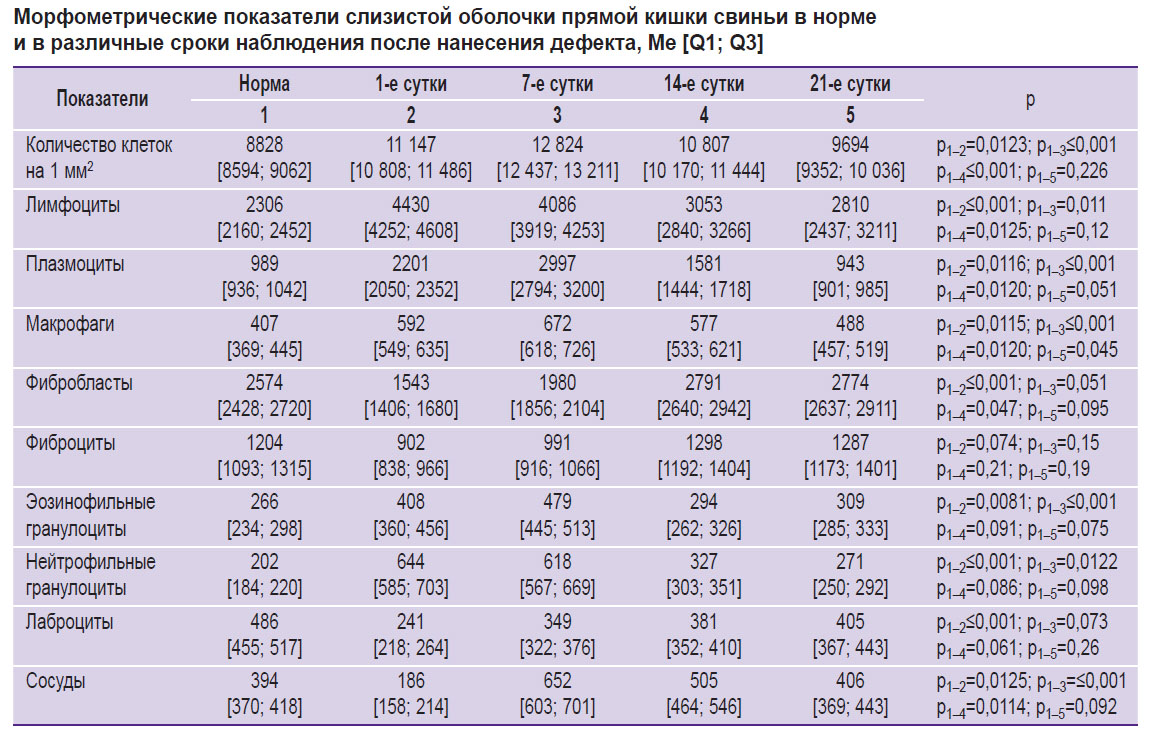
|
Морфометрические показатели слизистой оболочки прямой кишки свиньи в норме и в различные сроки наблюдения после нанесения дефекта, Me [Q1; Q3] |
К исходу 14-х суток и к наступлению 21-х суток в микропрепаратах слизистой оболочки прямой кишки в СПСО наблюдалось постепенное снижение плотности клеточного инфильтрата. Это явление было обусловлено уменьшением количества плазматических клеток, лимфоцитов, а также сокращением количества клеток с агрессивным потенциалом: снижением в 1,8 раза числа полиморфно-ядерных лейкоцитов и последовательным увеличением числа клеток фибробластического ряда и тучно-клеточной популяции с нарастанием активных зрелых клеточных форм. На этом фоне число сосудов микроциркуляции имело тенденцию к уменьшению и достигало показателей, приближенных к варианту адаптационной нормы (см. таблицу).
Преимущества модели
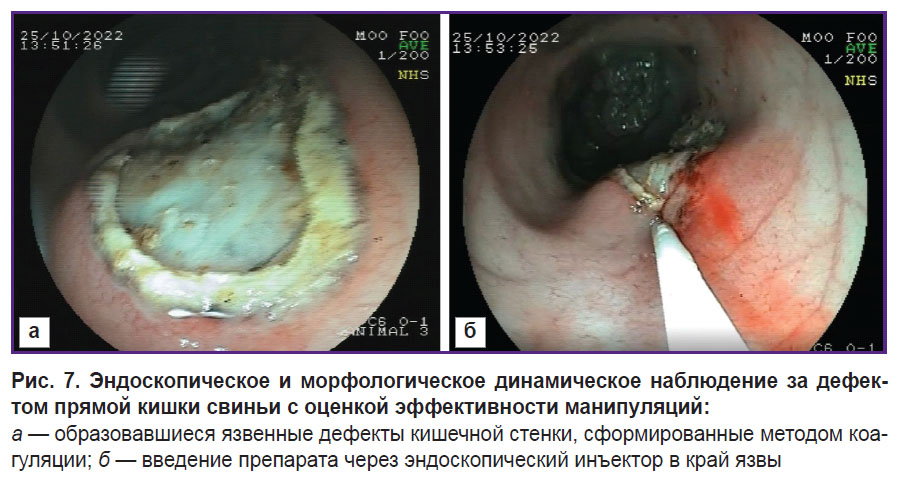
Представленная модель позволяет сформировать язвенные дефекты кишечника, соответствующие морфологической картине болезни Крона. Следует отметить, что формирование дефекта с четкими границами за счет использования эндоскопической петли позволяет облегчить его поиск и визуализацию при последующих исследованиях (рис. 7, а). Дефект диаметром порядка 10 мм достаточен для испытаний лекарственных средств и препаратов на протяжении 3 нед после его образования (см. рис. 3, в; см. рис. 6, в). Кроме того, возможно эндоскопическое и морфологическое динамическое наблюдение за дефектом с оценкой эффективности манипуляций (например, на рис. 7, б показано введение препарата через эндоскопический инъектор в край язвы). Более того, дефект сохраняется на протяжении 3 нед, в течение которых можно проводить оценку состояния язвы (см. рис. 3, в; см. рис. 6, в).
Заключение
Предложенный способ позволяет формировать язвенные дефекты кишечной стенки, соответствующие по глубине (до мышечной стенки) и наличию четких границ типичной картине язвенных дефектов кишечной стенки, характерных для болезни Крона, а именно: изолированных язв с четкими краями, иногда подрытых, на неизмененной слизистой оболочке. Характерные морфологические признаки таких язв: наличие глубоких эрозивно-язвенных дефектов, распространяющихся на все слои кишечной стенки; присутствие в подслизистой основе выраженной воспалительной инфильтрации с обнаружением значительного числа полиморфно-ядерных лейкоцитов с их проникновением в мышечную пластинку, а также отсутствие бокаловидных клеток.
Наличие четких контуров дефектов в представленной модели облегчает возможность введения лекарственных средств и контроля за их эффективностью в процессе регенерации. Данная модель на крупных животных значительно расширяет границы внедрения новых методов лечения в доклинической стадии их разработки и позволяет повысить эффект терапии пациентов с болезнью Крона, тем самым снизив риск хирургического вмешательства.
Финансирование исследования. Работа выполнена за счет средств, выделяемых на осуществление проекта «Приоритет-2030».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Bharadwaj S., Narula N., Tandon P., Yaghoobi M. Role of endoscopy in inflammatory bowel disease. Gastroenterol Rep (Oxf) 2018; 6(2): 75–82, https://doi.org/10.1093/gastro/goy006.
- Domènech E., Mañosa M., Cabré E. An overview of the natural history of inflammatory bowel diseases. Dig Dis 2014; 32(4): 320–327, https://doi.org/10.1159/000358131.
- Wang J.Q., Huang Y. Serological markers of inflammatory bowel disease. World Chinese J Dig 2013; 21(36): 4110, https://doi.org/10.11569/wcjd.v21.i36.4110.
- Gajendran M., Loganathan P., Catinella A.P., Hashash J.G. A comprehensive review and update on Crohn’s disease. Dis Mon 2018; 64(2): 20–57, https://doi.org/10.1016/j.disamonth.2017.07.001.
- Iborra M., Maroto N., Navarro-Cortes P., Beltran B., Boscá-Watts M., Ferrer I., Garcia-Morales N., Sáez-González E., Hinojosa J., Minguez M., Nos P. P714 vedolizumab, an adequate option in medically refractory and thiopurine-intolerant inflammatory bowel disease patients. Journal of Crohn’s and Colitis 2018; 12: S472–S473, https://doi.org/10.1093/ecco-jcc/jjx180.841.
- Gutiérrez A., Sempere L., Belvis M., Vázquez J.M., Laveda R., García M., Argüelles-Arias F., Pallarés H., Castro L., Gómez E., Maldonado B. P381 predictors of vedolizumab response to induction: real-life experience. Journal of Crohn’s and Colitis 2018; 12: S297–S297, https://doi.org/10.1093/ecco-jcc/jjx180.508.
- Iborra M., Beltrán B., Maroto N., Navarro-Cortés P., Boscá-Watts M., Ferrer-Bradley I., García-Morales N., Sáez-González E., Hinojosa J., Mínguez M., Nos P. Vedolizumab, an option in patients with inflammatory bowel disease intolerant to thiopurines and refractory to biological agents. Gastroenterol Hepatol 2018; 41(9): 535–543, https://doi.org/10.1016/j.gastrohep.2018.06.001.
- Li Y., Altemus J., Lightner A.L. Mesenchymal stem cells and acellular products attenuate murine induced colitis. Stem Cell Res Ther 2020; 11(1): 515, https://doi.org/10.1186/s13287-020-02025-7.
- Baik S.H., Kim W.H. A comprehensive review of inflammatory bowel disease focusing on surgical management. J Korean Soc Coloproctol 2012; 28(3): 121–131, https://doi.org/10.3393/jksc.2012.28.3.121.
- Alemany-Cosme E., Sáez-González E., Moret I., Mateos B., Iborra M., Nos P., Sandoval J., Beltrán B. Oxidative stress in the pathogenesis of Crohn’s disease and the interconnection with immunological response, microbiota, external environmental factors, and epigenetics. Antioxidants (Basel) 2021; 10(1): 64, https://doi.org/10.3390/antiox10010064.
- D’Haens G.R., Sartor R.B., Silverberg M.S., Petersson J., Rutgeerts P. Future directions in inflammatory bowel disease management. Journal of Crohn’s and Colitis 2014; 8: 726–734, https://doi.org/10.1016/j.crohns.2014.02.025.
- Martín Arranz E., Martín Arranz M.D., Robredo T., Mancheño-Corvo P., Menta R., Alves F.J., Suárez de Parga J.M., Mora Sanz P., de la Rosa O., Büscher D., Lombardo E., de Miguel F. Endoscopic submucosal injection of adipose-derived mesenchymal stem cells ameliorates TNBS-induced colitis in rats and prevents stenosis. Stem Cell Res Ther 2018; 9(1): 95, https://doi.org/10.1186/s13287-018-0837-x.
- Bernardi L., Santos C.H.M.D., Pinheiro V.A.Z., Oliveira R.J., Antoniolli-Silva A.C.M.B. Transplantation of adipose-derived mesenchymal stem cells in refractory Crohn’s disease: systematic review. Arq Bras Cir Dig 2019; 32(4): e1465, https://doi.org/10.1590/0102-672020190001e1465.
- Liu Y., Wang X., Hu C.A. Therapeutic potential of amino acids in inflammatory bowel disease. Nutrients 2017; 9(9): 920, https://doi.org/10.3390/nu9090920.
- da Costa Melo N.M., Almeida M.V.S., de Oliveira Campos D.M., de Oliveira C.B.S., Oliveira J.I.N. Animal models for inducing inflammatory bowel diseases: integrative review. REVISTA CIÊNCIAS EM SAÚDE 2021; 11(1): 80–87, https://doi.org/10.21876/rcshci.v11i1.1056.
- Low D., Nguyen D.D., Mizoguchi E. Animal models of ulcerative colitis and their application in drug research. Drug Des Devel Ther 2013; 7: 1341–1357, https://doi.org/10.2147/DDDT.S40107.
- Martin J.C., Bériou G., Josien R. Dextran sulfate sodium (DSS)-induced acute colitis in the rat. Methods Mol Biol 2016; 1371: 197–203, https://doi.org/ 10.1007/978-1-4939-3139-2_12.
- Waldner M.J., Neurath M.F. Chemically induced mouse models of colitis. Curr Protoc Pharmacol 2009; 1–15, https://doi.org/10.1002/0471141755.ph0555s46.
- Kolios G. Animal models of inflammatory bowel disease: how useful are they really? Curr Opin Gastroenterol 2016; 32(4): 251–257, https://doi.org/10.1097/MOG.0000000000000287.
- Головенко О.В., Хомерики С.Г., Иванова Е.В., Федоров Е.Д., Лоранская И.Д., Ситкин С.И., Белоусова Е.А., Головенко А.О. Воспалительные заболевания кишечника: клинические, эндоскопические, морфологические аспекты диагностики, принципы современной терапии. М: Прима Принт; 2022; 258 с.
- Zheng J.J., Cu X.Q., Shi X.H., Wang Y.M., Jia L.M., Zhou X.L., Wang F.M. Colonoscopic and histologic features of colonic Crohn’s disease in Chinese patients. J Dig Dis 2007; 8(1): 35–41, https://doi.org/10.1111/j.1443-9573.2007.00281.x.