Тотальная панкреатэктомия с аутотрансплантацией островков поджелудочной железы (TPIAT) как способ лечения хронического идиопатического панкреатита: анализ первого опыта
Хронический панкреатит (ХП) является достаточно распространенным заболеванием и достигает в России до 30 новых случаев на 100 000 человек, за рубежом — 9,6 случаев на 100 000 в год. Идиопатический панкреатит, связанный с генетическими мутациями, занимает второе место по частоте. При неэффективности консервативной терапии рассматривается возможность хирургического вмешательства. Тотальная панкреатэктомия снижает болевой синдром, но приводит к панкреатогенному сахарному диабету. В случаях наследственного панкреатита, вызванного мутациями в генах PRSS1, CFTR, SPINK1, панкреатэктомия становится целесообразной, в том числе для профилактики развития рака поджелудочной железы.
Технология выделения островков Лангерганса из удаленной поджелудочной железы и их аутотрансплантация (total pancreatectomy with islet autotransplantation, TPIAT) расширяют возможности лечения. В России подобные операции пока не проводятся.
Цель исследования — оценка эффективности тотальной панкреатэктомии с последующим восстановлением толерантности к глюкозе при лечении больных с хроническим генетически детерминированным болевым панкреатитом.
Материалы и методы. Два пациента с хроническим болевым панкреатитом с генетическими мутациями SPINK1 и PRSS1 прошли обследование и получили хирургическое лечение в объеме тотальной панкреатэктомии. Из удаленных желез были выделены островки и имплантированы в печень. Послеоперационный мониторинг включал оценку качества жизни и интенсивности болевого синдрома с помощью опросников, а также определение уровня гликемии.
Результаты. После тотальной панкреатодуоденэктомии и аутотрансплантации наблюдались значительное снижение болевого синдрома и улучшение качества жизни. Отмечена низкая функция трансплантированных островков, связанная с их недостаточным количеством, что потребовало введения экзогенного инсулина.
Заключение. Представленный опыт демонстрирует эффективность TPIAT в лечении хронического панкреатита, что может стать основой для дальнейших исследований и внедрения данной технологии в отечественную клиническую практику.
Введение
Распространенность хронического панкреатита (ХП) в России достигает до 30 новых случаев на 100 000 человек [1], в мире — 9,6 случаев на 100 000 в год [2]. Идиопатический панкреатит является вторым по частоте и обусловлен в основном генетическими причинами — ассоциирован с мутациями в генах PRSS1, CFTR, SPINK1 и CTRC [3, 4].
Комплексная лекарственная терапия пациентов с ХП зачастую неэффективна. В особо тяжелых случаях возникает необходимость применения препаратов опиоидного ряда, которые при длительном приеме приводят к тяжелым побочным эффектам [5]. Согласно современным клиническим рекомендациям, при неэффективности консервативной терапии рассматривается вопрос об оперативном лечении. Резекционные или дренирующие вмешательства не показаны при отсутствии расширения главного панкреатического протока и тотальном фиброзе ткани поджелудочной железы без наличия в ней очаговой патологии [6, 7]. Тотальная панкреатэктомия в этих ситуациях эффективна для снижения уровня болевого синдрома, но приводит к развитию панкреатогенного сахарного диабета. Хирургу сложно решиться на эту операцию без достаточного основания.
При доказанном идиопатическом наследственном панкреатите и выявленных мутациях в генах PRSS1, CFTR, SPINK1 или CTRC панкреатэктомия становится обоснованной, особенно при угрозе развития протоковой аденокарциномы [8,9].
Выделение островков Лангерганса (ОЛ) из удаленной поджелудочной железы и их последующее введение пациенту значительно расширило возможности применения панкреатэктомии. Панкреатэктомия с аутотрансплантацией островков поджелудочной железы (total pancreatectomy with islet autotransplantation, TPIAT) наиболее эффективна при лечении пациентов с наследственным панкреатитом [10, 11]. TPIAT активно применяется в педиатрической практике, поскольку операцию следует проводить как можно раньше, до развития фиброза железы, что существенно влияет на получаемую дозу и качество островков. Абсолютное большинство зарубежных центров демонстрируют нулевую летальность после операции; при общем анализе она не превышает 1% [12]. Результаты подобных вмешательств оцениваются с учетом изменений качества жизни, включая устранение болевого синдрома и снижение потребности в опиоидах. Кроме того, важным аспектом TPIAT является профилактика гипогликемий [13]. Достижение инсулинонезависимости при этом не является самоцелью.
Несмотря на стойкую тенденцию к увеличению числа подобных оперативных вмешательств за рубежом, в России такой опыт отсутствует. В представленной работе продемонстрирован первый опыт тотального удаления поджелудочной железы как источника стойкого болевого синдрома с последующей аутотрансплантацией ОЛ для лечения наследственного ХП.
Цель исследования — оценка эффективности тотальной панкреатэктомии с последующим восстановлением толерантности к глюкозе при лечении больных с хроническим генетически детерминированным болевым панкреатитом.
Материалы и методы
Исследование одобрено локальным этическим комитетом Приволжского исследовательского медицинского университета (протокол №10 от 24 июня 2022 г.) и проведено в соответствии с Хельсинкской декларацией. Пациенты подписали информированное добровольное согласие на проведение лечения в объеме тотальной панкреатэктомии и последующей аутотрансплантации ОЛ.
Исследование состояло из нескольких этапов.
Обследование пациента. На этом этапепроводиликомплексное обследование, включая общеклинические, лабораторные и инструментальные исследования, генетические тесты, определение базальных уровней инсулина и С-пептида, а также тестирование на толерантность к глюкозе.
Хирургический этап. Панкреатэктомию выполняли в объеме пилоруссохраняющей тотальной панкреатодуоденэктомии, так как задачей являлось полное удаление паренхимы поджелудочной железы, что не подразумевает сохранение двенадцатиперстной кишки ввиду нарушения ее кровоснабжения. Особенностью панкреатэктомии было максимально длительное сохранение кровоснабжения железы в процессе операции. Артерии пересекались непосредственно перед изъятием железы. Операция завершалась стандартной реконструкцией на одной петле с установкой дренажей. Параллельно проводилась процедура back table.
Процедура back table. Панкреатодуоденальный комплекс помещали в емкость с холодным физраствором (+4ºС) со льдом. Двенадцатиперстную кишку отделяли от поджелудочной железы (рис. 1); небольшой фрагмент железы брали для гистологического исследования. Затем поджелудочную железу пересекали по перешейку. Визуализировался панкреатический проток, в проксимальной и дистальной частях которого фиксировали катетеры из поливинилхлорида. В катетер вводили раствор Кустодиола под давлением (рис. 2). Железу после промывки помещали в стерильный транспортировочный термоконтейнер с раствором Кустодиола. Термоконтейнер с железой в кратчайшие сроки доставляли в клеточную лабораторию.
|
Рис. 1. Отделение двенадцатиперстной кишки от поджелудочной железы |
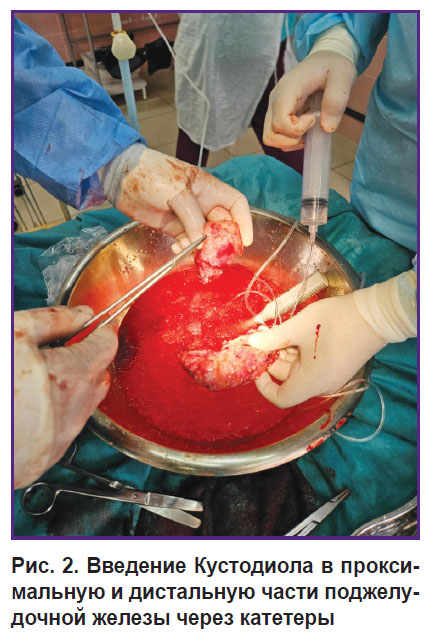 |
Рис. 2. Введение Кустодиола в проксимальную и дистальную части поджелудочной железы через катетеры |
Клеточный этап. Выделение островков Лангерганса. Выделение ОЛ проводили в соответствии с описанным нами ранее протоколом [14] с небольшими модификациями. Выделенные островки поддерживали в культуральной среде RPMI (Gibco, Великобритания) c низким уровнем глюкозы с добавлением L-глутамина (0,58 мг/мл; «ПанЭко», Россия), 10% аутологичной сыворотки человека, антибиотика-антимикотика (Antibiotic-Antimycotic Х100; Thermo Scientific, США) при температуре 37°C и 5% СО2. Перед трансплантацией островки отмывали от культуральной среды и помещали в инфузионный пакет для отправки в клинику.
Для подтверждения принадлежности очищенных клеток к ОЛ и оценки чистоты итогового препарата проводили окрашивание дитизоном (к 0,5 мл суспензии ОЛ добавляли 20 мкл свежеприготовленного 1% раствора дитизона). Визуализацию чистоты ОЛ осуществляли под микроскопом Leica DM2500 (Leica Microsystems, Германия), подсчитывая процент окрашенных ОЛ относительно общего числа клеточных скоплений.
Для оценки жизнеспособности выделенных островковых клеток проводили окрашивание трипановым синим (к 800 мкл суспензии ОЛ добавляли 200 мкл 0,4% раствора трипанового синего). Жизнеспособность определяли под микроскопом Leica DM2500 (Leica Microsystems, Германия) путем подсчета процента неокрашенных клеток ОЛ относительно всех клеток.
С целью оценки бактериальной обсемененности отбирали пробу клеточной суспензии ОЛ (1 мл) и передавали ее в бактериологическую лабораторию для анализа.
Гистологическое исследование. Биоптат поджелудочной железы (~1 см³) фиксировали в формалине и заливали в парафин. Срезы поджелудочной железы толщиной 7 мкм окрашивали гематоксилином и эозином по стандартному протоколу.
Иммунофлюоресцентное окрашивание выполняли на срезах толщиной 4 мкм. Иммунофлюоресцентное двойное окрашивание проводили с использованием первичных моноклональных антител к глюкагону (1:100; Invitrogen, США) и моноклональных антител к инсулину (1:100; Invitrogen, США) в течение 12 ч при 4°C. Ядра клеток контрастно окрашивали DAPI (1:1000; BioLegend, США) в соответствии с протоколом производителя. Каждую эндокринную экспрессирующую клетку визуализировали с помощью конфокального микроскопа LSM 880 (Carl Zeiss, Германия) и анализировали с использованием программного обеспечения ImageJ 1.43u (NIH, США). Данные представляли в виде средних значений ± SEM, отражающих дисперсию в пределах островков для каждого образца.
Аутотрансплантация островков Лангерганса. Островки вводили в воротную вену, используя различные методики. Общим был прямой доступ в воротную вену с постоянным прямым мониторингом портального давления. Повышения давления более 16 мм рт. ст. во время введения не отмечено. В первом клиническом случае применяли рентгенохирургический метод для введения островков через чрескожный и чреспеченочный доступ в воротную вену; во втором — введение островков в портальный кровоток осуществляли интраоперационно путем имплантации катетера в воротную вену через ее ветвь. Инвазию взвеси ОЛ в портальный кровоток предваряли введением гепарина из расчета 50 МЕ/кг массы тела для профилактики активации свертывания крови и системы комплемента, что в свою очередь может приводить к повреждению островков [15].
Эндокринология. Для оценки эндокринной функции до операции проводили тест толерантности к глюкозе (ГТТ), а также исследовали базальные уровни секреции инсулина и С-пептида. На протяжении всего периода госпитализации осуществляли непрерывный мониторинг глюкозы (НМГ) системой FreeStyle Libre 2 (Abbott, Франция). Интраоперационно и в раннем послеоперационном периоде гликемию контролировали с помощью НМГ, а также глюкометра ежечасно и анализа глюкозы плазмы 1 раз в 4–6 ч. При выявлении гликемии выше 8 ммоль/л инициировали инсулинотерапию. Во время первого и второго этапов операции (панкреатэктомии и введения ОЛ), а также в раннем послеоперационном периоде проводили непрерывную внутривенную инфузию инсулина (НВИИ) с помощью инфузомата по протоколу, предложенному G.P. Forlenza и коллегами [16], а также протоколу А.Н. Лебедевой и В.А. Вишневского [17]. Целевыми значениями гликемии считали 5,6–6,7 ммоль/л. Через 4–6 дней пациентов переводили на подкожную базис-болюсную терапию инсулином. Для оценки функционального состояния имплантированных островков исследовали уровень базального С-пептида.
После введения островков в воротную вену возникает мгновенная опосредованная воспалительная реакция в крови, вследствие чего часть трансплантированных островков погибает [14]. Для минимизации потерь проводится иммуносупрессивная терапия препаратами противовоспалительного действия: ингибитором фактора некроза опухоли альфа (этанерцепт, 50 мг в/в за 1 ч до трансплантации, затем 25 мг п/к на 3, 7 и 10-й дни после трансплантации) и антагонистом рецепторов IL-1 (анакинра, 100 мг п/к в день трансплантации и далее по 100 мг п/к в течение 7 дней).
Оценка болевого синдрома. До и после процедуры TPIAT проводили оценку болевого синдрома и качества жизни. Для этой цели пациентам дважды предлагалось заполнить следующие опросники: визуальная аналоговая шкала (ВАШ); опросник боли Мак-Гилла, где оценивали ранговый индекс боли общий (РИБ), сенсорный РИБ (сРИБ), аффективный РИБ (аРИБ), эвалюативный РИБ (эРИБ) и индекс числа выбранных дескрипторов (ИЧВД); краткий опросник боли с оценкой индекса тяжести боли (pain severity index — PSI) и индекса интерференции/воздействия (pain interference index — PII); а также опросник качества жизни SF-36 для исследования параметров физического функционирования (PF); ролевого функционирования, обусловленного физическим состоянием (RP); интенсивности боли (BP); общего состояния здоровья (GH); жизненной активности (VT); социального функционирования (SF); ролевого функционирования, обусловленного эмоциональным состоянием (RE); психического здоровья (MH); суммарных показателей физического (РНs) и психического здоровья (MНs).
Результаты
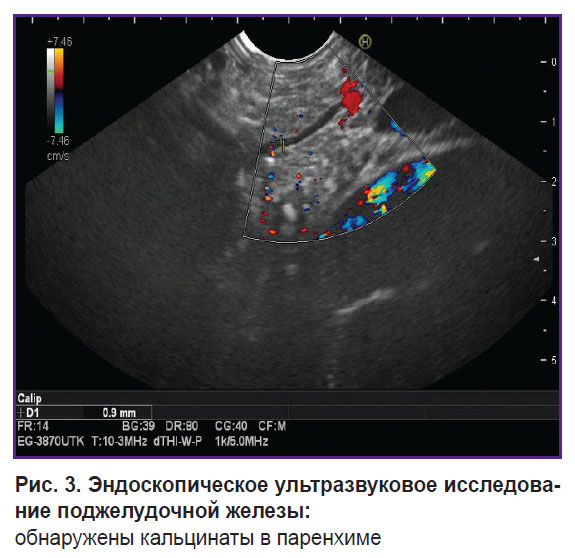
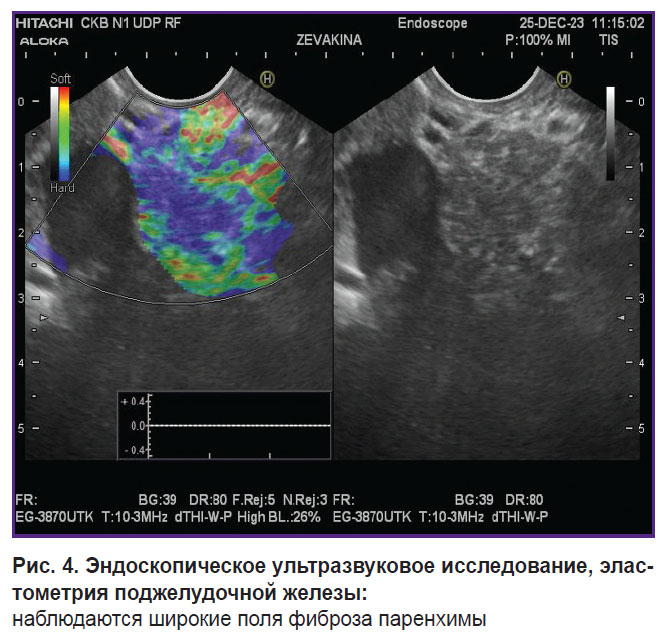
Клинический случай 1. Пациентка 19 лет с жалобами на боли в эпигастрии опоясывающего характера, тошноту, запоры. Из анамнеза: ХП в течение 10 лет. Первый приступ со стационарным лечением в 2015 г., после этого — неоднократные госпитализации в стационары в связи с выраженным болевым синдромом (каждые 3 мес). По результатам спиральной компьютерной томографии и эндоскопического УЗИ: кальцинаты в фиброзированной паренхиме поджелудочной железы, главный панкреатический проток незначительно расширен — до 3–4 мм (рис. 3, 4). В 2023 г. неоднократно проводили стентирование главного и добавочного панкреатических протоков; после этого болевой синдром, со слов пациентки, усиливался.
|
Рис. 3. Эндоскопическое ультразвуковое исследование поджелудочной железы: обнаружены кальцинаты в паренхиме |
|
Рис. 4. Эндоскопическое ультразвуковое исследование, эластометрия поджелудочной железы:
наблюдаются широкие поля фиброза паренхимы |
В 2022 г. пациентка потеряла около 12 кг массы тела за полгода, из-за чего развилась вторичная аменорея; в 2023 г. — частично набрала потерянную массу тела.
В декабре 2023 г. в связи с выраженным болевым синдромом выполнена диагностическая лапароскопия (подозрение на перфорацию полого органа). При генетическом дообследовании обнаружена гомозиготная мутация c.101A>G(p/Asn34Ser) гена SPINK1.
Исследование эндокринной функции поджелудочной железы до операции не выявило нарушений гликемии. По результатам ГТТ гликемия натощак составляла 5,2 ммоль/л, через 1 ч после нагрузки глюкозой — 6,91 ммоль/л, через 2 ч после нагрузки глюкозой — 3,32 ммоль/л. Базальные уровни инсулина и С-пептида также были в пределах нормальных значений — 6,65 мкЕД/мл и 1,42 нг/мл соответственно. Гликированный гемоглобин до операции — 4,19%. Индекс НОМА1 составил 48,9 и соответствовал нормальной функции β-клеток; НОМА1-IR — 1,54 и соответствовал нормальной чувствительности к инсулину. При этом индекс QUICKI, равный 0,36, указывал на наличие ранней инсулинорезистентности.
Инструментальные методы исследований (КТ органов грудной клетки, ЭФГДС, УЗИ, ЭКГ, КТ брюшной полости с в/в контрастированием) отклонений не выявили.
Пациентка была включена в исследование 05.04.2024 г. с диагнозом «наследственный кальцифицирующий панкреатит (гомозиготная мутация c.101A>G гена SPINK1), клинический фенотип — рецидивирующий острый панкреатит».
Тотальная панкреатодуоденэктомия выполнена 09.10.2024 г. согласно описанному выше протоколу.
Скорость введения инсулина при НВИИ составила 0,5 [0,2; 1,2] ЕД/ч. Суточная доза инсулина в интраоперационном периоде — 20 [18; 22] ЕД/сут. Гликемия — 6,2 [5,4; 7,4] ммоль/л. НВИИ проводили в течение первых 6 дней.
Внутрипортальное введение взвеси островков проведено 10.10.2024 г. под комбинированным обезболиванием (непосредственная локальная анестезия и местная анестезия 0,5% раствором новокаина, 20 мл). Под контролем УЗИ иглой CHIBA 20 G через 8-е межреберье справа по передней аксилярной линии выполнена пункция сегментарной ветви воротной вены правой доли печени. Портография показала, что портальный кровоток не компрометирован. По проводнику в просвет воротной вены, в зоне спленомезентериального соустья, устанавливали гидрофильный армированный интродьюсер Flexof 5 Fr (COOK Medical, Ирландия). Вводили гепарин в дозе 3500 ЕД. Выполнена манометрия в системе воротной вены (среднее давление составило 13–15 мм рт. ст.). Далее со скоростью 400 мл/ч в течение 30 мин проводили последовательную инфузию 200 мл суспензии островковых клеток. Выполнена контрольная манометрия в бассейне воротной вены (давление составило 16–17 мм рт. ст.). На контрольной портографии кровоток не компрометирован. С целью гемостаза осуществляли пломбировку пункционного канала пеной из гемостатической губки. Через 15 мин после удаления интродьюсера, по данным УЗИ, в области печени и брюшной полости не определялись гематомы и свободная жидкость.
Послеоперационный период осложнился явлениями механической желтухи, развившейся на фоне сужения гепатикоеюноанастомоза. Выполнено наружное дренирование желчных протоков под УЗ-флюоро-навигацией. Через 4 дня проведена замена наружной холангиостомы на наружно-внутреннюю. На 20-е сутки пациентка выписана в удовлетворительном состоянии.
Клинический случай 2. Пациентка 28 лет. Из анамнеза: ХП в течение 23 лет. Первый приступ со стационарным лечением в 5 лет, в последующем неоднократные госпитализации до 4 раз в год. В 2022 и 2023 гг. проводились эндоскопическая ретроградная холангиопанкреатография и эндоскопическая папилосфинктеротомия, которые привели к минимальному положительному эффекту. За 2024 г. было 4 госпитализации в стационар с приступами острого панкреатита. При генетическом исследовании в гене PRSS1 обнаружен полиморфизм R122H в гетерозиготной форме, что свидетельствует о бесперспективности консервативной терапии и высоком риске малигнизации. Пациентка постоянно принимала Эрмиталь до 150 000 ЕД/сут, Дюспаталин, Гептор, Разо, Даларгин. Частые, интенсивные боли купировала приемом анальгетиков и Октреотида.
По результатам ГТТ уровень гликемии натощак составил 5,34 ммоль/л, через 2 ч — 8,01 ммоль/л. Данные уровни гликемии указывают на исходное наличие нарушения толерантности к глюкозе. Предоперационные уровни инсулина и С-пептида были в пределах нормы — 15,64 мкЕД/мл и 1,7 нг/мл соответственно. Гликированный гемоглобин — 4,81%. Индекс НОМА1 до операции составил 170, что соответствует нормальной функции β-клеток. На наличие инсулинорезистентности указывали значения НОМА1-IR — 3,71 и QUICKI — 0,31.
Пациентка была включена в исследование 16.09.2024 г. с диагнозом «наследственный панкреатит, болевая форма (гетерозиготная мутация гена PRSS1) непрерывно рецидивирующего течения (7 и более обострений в год с 2001 по 2024 гг.)».
Эндоскопическая папилосфинктеротомия проведена 5.04.2022 г. и 30.11.2023 г.
Оперативное лечение выполнено 18.09.2024 г. в объеме тотальной дуоденопанкреатэктомии по описанной выше методике. Внутрипортальное введение островков — 19.09.2024.
Была проведена релапаротомия с удалением послеоперационных швов. Визуализирована ветвь средней ободочной вены; выполнена ее канюляция катетером Fr7, проведенным в просвет воротной вены. Введено 3500 ЕД гепарина. Выполнена манометрия в системе воротной вены (среднее давление составило 13 мм рт. ст.). Затем в течение 30 мин со скоростью 400 мл/ч проведена последовательная инфузия 200 мл суспензии островковых клеток. Каждые 10 мин осуществляли манометрию в бассейне воротной вены; при контрольной манометрии давление составило 13–15 мм рт. ст. Рана ушита.
В послеоперационном периоде отмечены явления гастростаза, скорректирована нутритивная поддержка. На 14-е сутки наблюдалась положительная динамика в виде полного купирования явлений гастростаза. На 19-е сутки пациентка выписана в удовлетворительном состоянии.
Эндокринология. Скорость инсулина при НВИИ составила 0,5 [0,2; 1,2] ЕД/ч — клинический случай 1 и 1,0 [0,5; 1,5] ЕД/ч — клинический случай 2. Суточная доза инсулина в интраоперационном периоде — 20 [18; 22] и 20 [18; 35] ЕД/сут соответственно. Медиана гликемии — 6,2 [5,4; 7,4] и 7,7 [6,0; 8,7] ммоль/л. Непрерывная инфузия инсулина проводилась в течение первых 5–6 дней. Примечательно, что в первом случае при контроле гликемии с помощью системы FreeStyle Libre 2 (Abbott, Франция) в интраоперационном и раннем послеоперационном периоде часто фиксировался низкий уровень сахара крови, что не было подтверждено исследованием капилярной и венозной крови. Это заставило отказаться от НМГ в первые дни после операции и использовать для оценки гликемии глюкометр. Вероятно, это может быть обусловлено известными артефактами [18], а также нарушением периферического кровообращения в раннем послеоперационном периоде и, соответственно, сопровождаться низкими значениями гликемии в интерстициальной жидкости. Во втором случае не наблюдалось различий между показаниями FreeStyle Libre 2 (Abbott, Франция) и глюкометром, что позволило значимо сократить использование глюкометра и эффективно оценивать колебания гликемии, а также подбирать дозы инсулина с помощью НМГ.
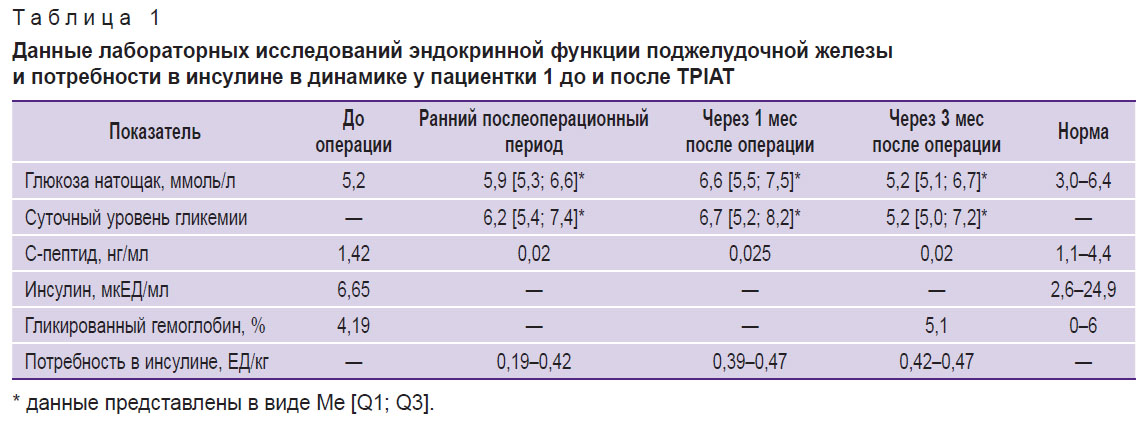
У обеих пациенток на 3-и послеоперационные сутки была диагностирована кетонурия (0,5 ммоль/л), связанная с недостаточностью питания в раннем послеоперационном периоде (табл. 1), которая была купирована внутривенным ведением 5% раствора глюкозы.
|
Таблица 1. Данные лабораторных исследований эндокринной функции поджелудочной железы и потребности в инсулине в динамике у пациентки 1 до и после TPIAT |
После перевода пациенток на базис-болюсную терапию инсулином начальная потребность в инсулине при поддержании нормогликемии составила 0,19 и 0,28 ЕД/кг для первого и второго случая соответственно. При расширении диеты у первой пациентки в течение 1-го месяца потребность в инсулине увеличилась до 0,42 и 0,50 ЕД/кг, а через 6 мес составляла 0,47–0,50 ЕД/кг. Дозы болюсных инъекций инсулина во время утреннего приема пищи рассчитывали в соотношении 1 ХЕ:1,5 ЕД, в обед и ужин — 1 ХЕ:1 ЕД. Обе пациентки были обучены правилам подбора и корректировки доз инсулина. Графики непрерывного мониторирования глюкозы системой FreeStyle Libre 2 (Abbott, Франция) в период стационарного лечения представлены на рис. 5 и 6. За время пребывания в стационаре средний уровень глюкозы в первом случае составил 5,4, ммоль/л, во втором — 7,4 ммоль/л. Время в целевом диапазоне — 85 и 79% соответственно; гипогликемия в диапазоне 3,0–3,8 ммоль/л — 4%. Гипогликемий ниже 3 ммоль/л не отмечено.
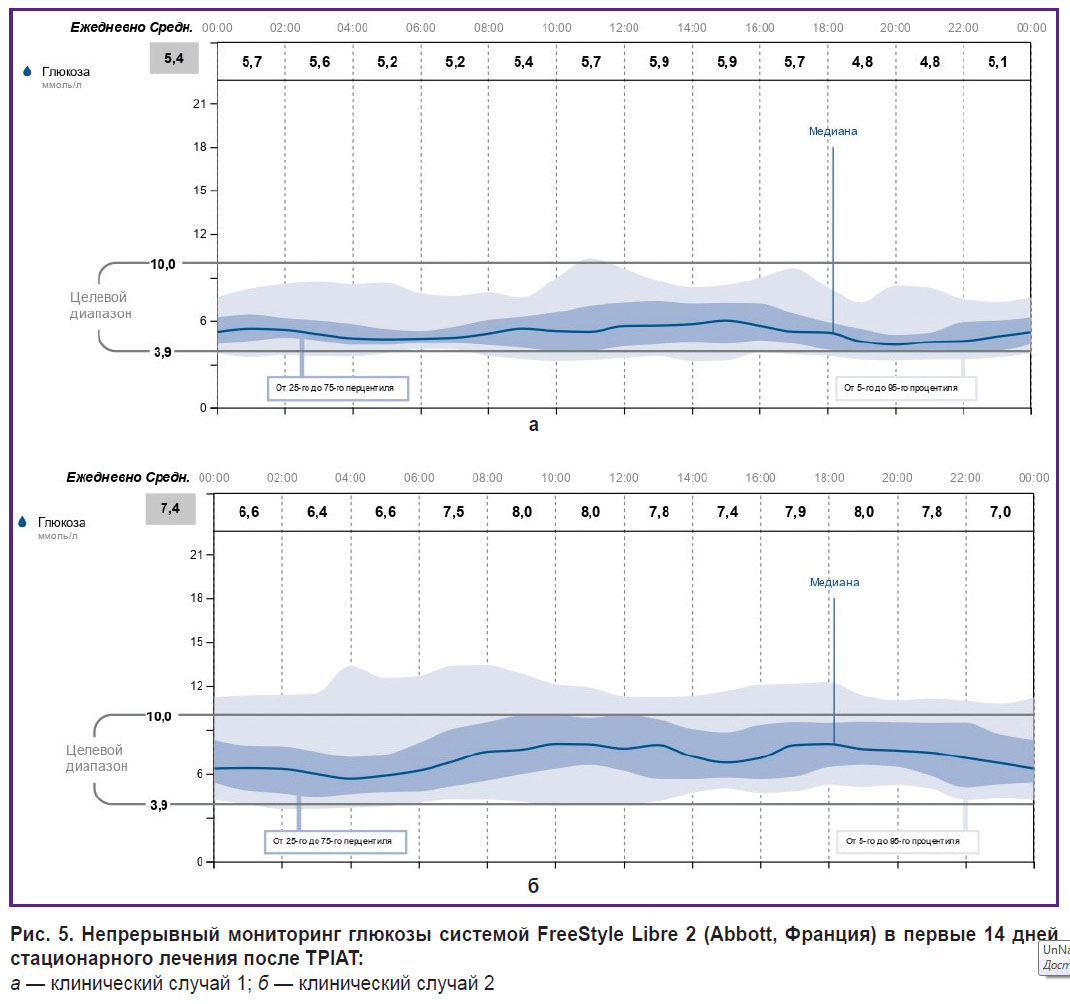
|
Рис. 5. Непрерывный мониторинг глюкозы системой FreeStyle Libre 2 (Abbott, Франция) в первые 14 дней стационарного лечения после TPIAT:
а — клинический случай 1; б — клинический случай 2 |
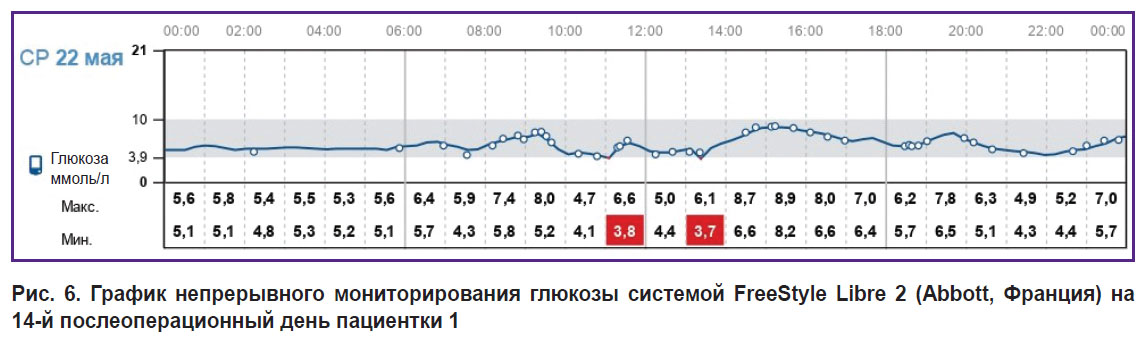
|
Рис. 6. График непрерывного мониторирования глюкозы системой FreeStyle Libre 2 (Abbott, Франция) на 14-й послеоперационный день пациентки 1 |
Через месяц после операции при самоконтроле гликемия натощак была 6,6 [5,5; 7,5] и 7,7 [5,0; 8,8] ммоль/л, через 2 ч после еды достигала 5,2 [5,0; 7,2] и 7,9 [6,4; 9,4] ммоль/л соответственно для первой и второй пациенток. Однако, по данным FreeStyle Libre 2 (Abbott, Франция), у второй пациентки через 6 мес после TPIAT средний уровень гликемии составлял 10,3 ммоль/л, а время в целевом диапазоне — 47%. Данный факт может указывать на необходимость повторного обучения пациента, в том числе в школе диабета, а также служить основанием для постановки вопроса о назначении помповой инсулинотерапии.
Уровни базального С-пептида в динамике после первого и второго этапов операции в обоих случаях оставались ниже нормы и составили 0,01 и 0,02 нг/мл соответственно. Данные углеводного обмена и показателей эндокринной функции поджелудочной железы 1-й пациентки в динамике представлены в табл. 1.
Была подобрана адекватная заместительная ферментная терапия Креоном в общей дозе до 250 000 и 200 000 ЕД/сут соответственно для первой и второй пациенток.
Оценка болевого синдрома. По результатам заполнения опросников для оценки динамики боли и качества жизни отмечено, что обе пациентки до операции оценивали свою боль как сильную (10 баллов по ВАШ); кроме того, индексы РИБ, сРИБ, аРИБ, эРИБ согласно опроснику Мак-Гилла, а также PSI и PII по краткому опроснику боли были высокими. Через месяц после операции пациентки практически не предъявляли жалоб на боли и отмечали улучшение качества жизни (табл. 2); все показатели опросника ВАШ, краткого опросника боли и опросника Мак-Гилла значительно снизились. При оценке качества жизни по опроснику SF-36 обращало на себя внимание улучшение значений ролевого функционирования, общего состояния здоровья, жизненной активности, социального функционирования и психического здоровья в динамике после операции.
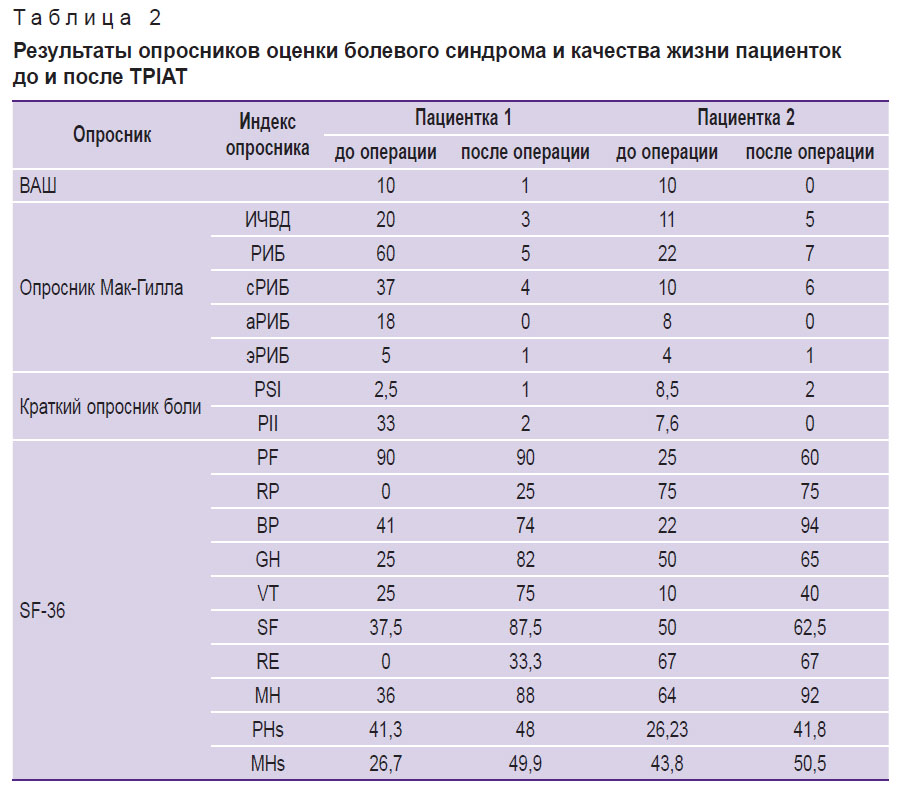
|
Таблица 2. Результаты опросников оценки болевого синдрома и качества жизни пациенток до и после TPIAT |
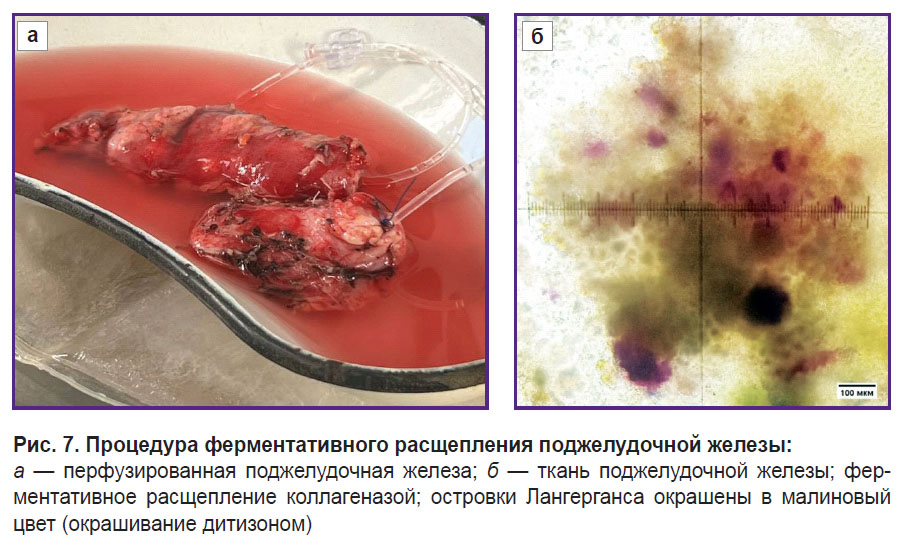
Клеточный этап. Выделение островков Лангерганса. После тотальной панкреатэктомии, проведенной с использованием описанного метода, из поджелудочных желез (141 г — пациентка 1; 80 г — пациентка 2) были успешно выделены островковые клетки человека, свободные от ацинарной ткани (рис. 7).
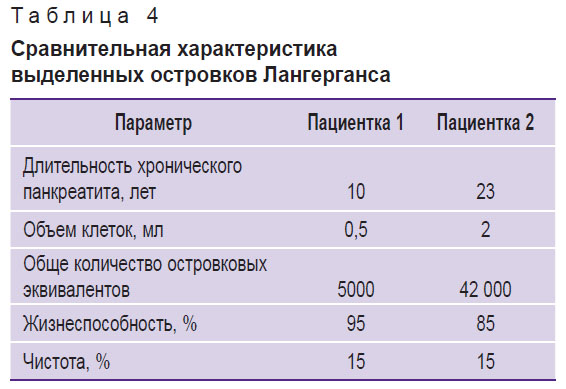
Для первой пациентки объем полученной клеточной суспензии составил 0,5 мл, в ней содержалось 5000 островковых эквивалентов (IEQ); для второй пациентки — 2 мл клеточной суспензии, содержащей 42 000 IEQ. Итоговое количество IEQ для второй пациентки было выше по сравнению с первой, что может быть обусловлено менее выраженным фиброзированием поджелудочной железы. Оценку количества эквивалентов проводили, опираясь на количество и размеры островков (табл. 3). Это количество является важным показателем для оценки качества и количества выделенных ОЛ, которые отвечают за выработку инсулина и других гормонов, регулирующих уровень глюкозы в крови.
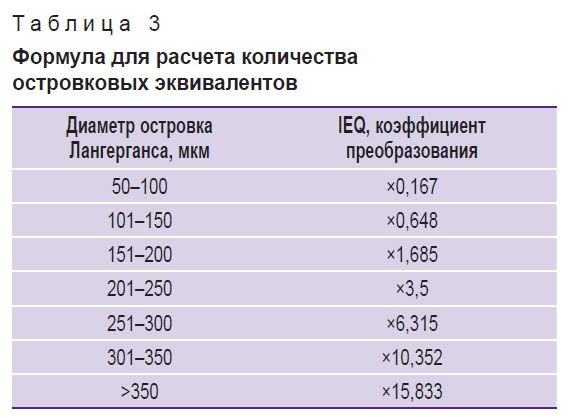
|
Таблица 3. Формула для расчета количества островковых эквивалентов |
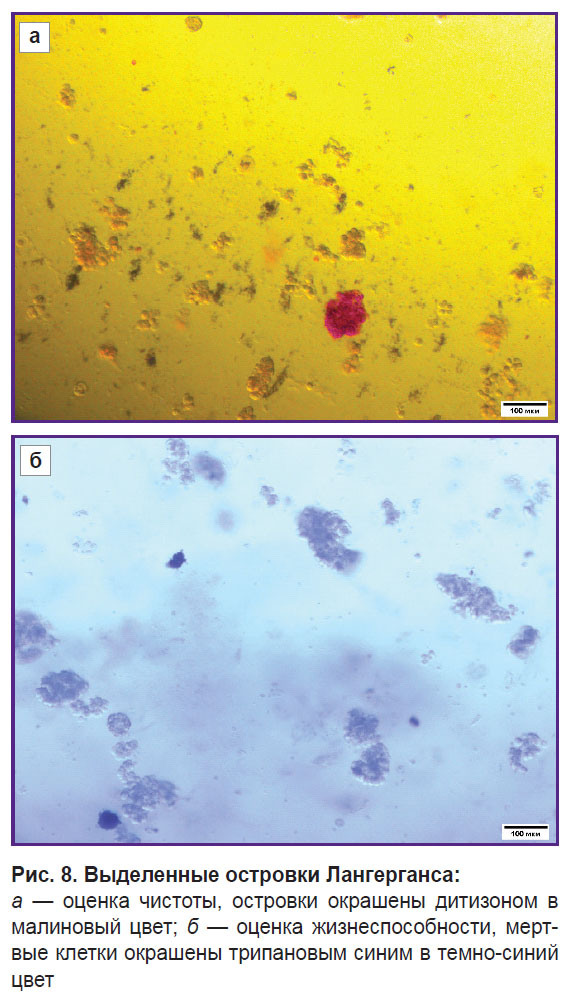
Итоговая чистота взвеси препаратов ОЛ составила 15%, что указывает на присутствие других клеточных компонентов в суспензии (рис. 8, а). Однако высокая выживаемость (рис. 8, б) ОЛ после выделения, составившая 95% в первом случае и 85% во втором, свидетельствует о том, что метод экстракции был эффективным и минимально травмирующим для клеток (табл. 4).
|
Рис. 8. Выделенные островки Лангерганса: а — оценка чистоты, островки окрашены дитизоном в малиновый цвет; б — оценка жизнеспособности, мертвые клетки окрашены трипановым синим в темно-синий цвет |
|
Таблица 4. Сравнительная характеристика выделенных островков Лангерганса |
Бактериологический анализ подтвердил стерильность выделенных островков, что является критически важным фактором для их дальнейшего клинического применения.
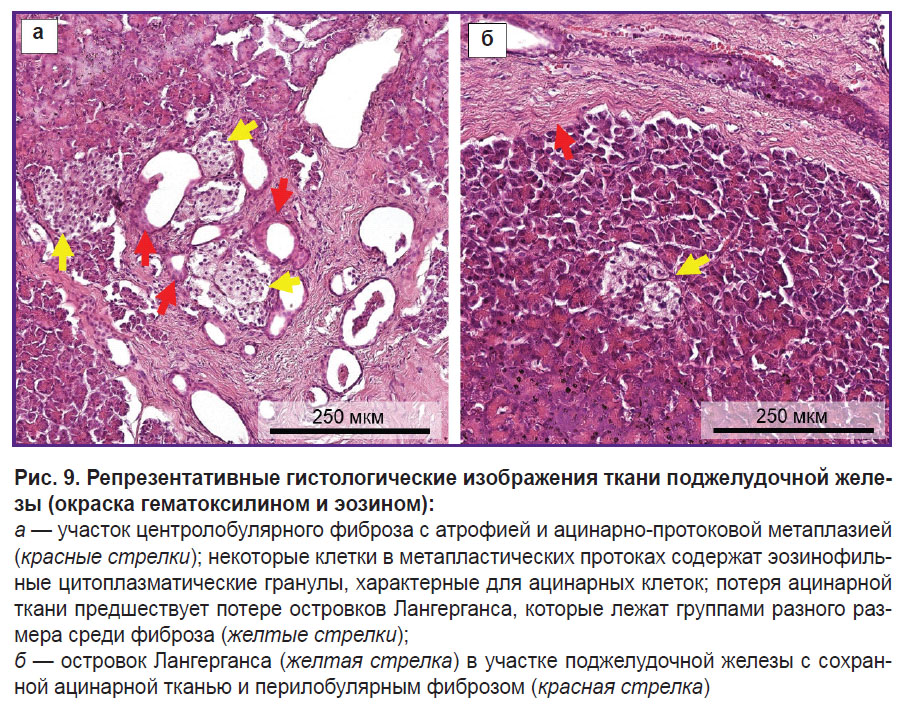
Гистологическое исследование. Для оценки качества поджелудочной железы проведено гистологическое исследование, которое продемонстрировало картину ХП. Поджелудочная железа была представлена участками с выраженным междольковым (перилобулярным) и внутридольковым (интралобулярным) фиброзом. Наблюдалась значительная потеря ацинарной ткани в результате атрофии и ацинарно-протоковой метаплазии (рис. 9, а). Внутридольковые протоки деформированы, эпителий протоков атрофичен, некоторые из них содержат эозинофильные белковые пробки в просвете. В областях с фиброзом присутствуют остаточные элементы в виде ОЛ, кровеносных сосудов, нервных пучков. Остаточные островки образуют группы разного размера и в среднем содержат более мелкие клетки, чем нормальные островки, что может свидетельствовать о пролиферации А- и РР-клеток при ХП [19]. В участках с сохранной ацинарной тканью (рис. 9, б) присутствует небольшое количество ОЛ, которые имеют структуру, близкую к нормальной. Присутствует также умеренный диффузный хронический воспалительный инфильтрат.
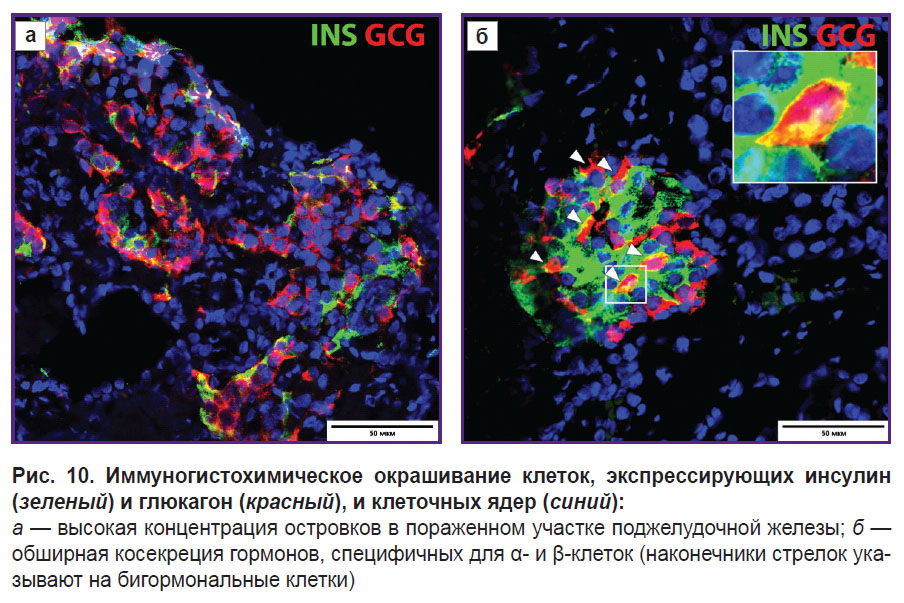
Иммунофлюоресцентное окрашивание поджелудочной железы выявило 16,35±2,93% эндокринных клеток, преимущественно в 4/10 островков, которые были бигормональными, коэкспрессируя как инсулин, так и глюкагон (рис. 10).
Обсуждение
Аутотрансплантация ОЛ после тотальной панкреатэктомии (TPIAT) при ХП осуществляется во многих центрах по всему миру. Отмечается тенденция к формированию high volume-центров для увеличения потоков и улучшения результатов [20, 21]. TPIAT рекомендована при хронических болевых панкреатитах, так как достаточно безопасна, даже в случае недостижения инсулинонезависимости значительно снижает риск осложнений от резких гипергликемических состояний и существенно улучшает качество жизни [22]. При ХП получение островков и посттрансплантационная эндокринная функция зависят от степени фиброза и перенесенных ранее операций на поджелудочной железе [23]. Следовательно, мировая тенденция к смещению технологии в педиатрическую практику выглядит логично.
Пациенты, включенные в наше исследование, имели генетически детерминированные панкреатиты тяжелого течения с вероятностью развития рака поджелудочной железы и бесперспективностью лекарственного лечения. Гомозиготная мутация гена SPINK1 и гетерозиготная мутация гена PRSS1 встречаются наиболее часто. Клинически у обеих пациенток заболевание характеризовалось ранним началом, необычно тяжелым и упорным течением с частыми рецидивами, что и послужило основанием для проведения углубленного исследования на наличие генетических мутаций.
Проведенные ранее выделения ОЛ в рамках наших предыдущих исследований [14] показали их функциональную состоятельность.
Аутотрансплантация ОЛ выполнялась нами как малоинвазивно, так и «открыто». В литературе не указано какой-то предпочтительной технологии. По-видимому, выбор того или иного метода является больше традицией клиники.
После выполнения процедуры TPIAT у обеих пациенток отмечалось значительное снижение интенсивности болевого синдрома. Незначительный болевой синдром сохранялся у них в течение первого месяца, что чаще было связано с хирургическим вмешательством и абдоминальным дискомфортом при подборе адекватных доз ферментативной заместительной терапии. Со слов пациенток, они не принимали каких-либо анальгетиков после операции, что сопоставимо с результатами зарубежных исследований [24]. Главное, что, согласно результатам опросника SF-36, у них зарегистрировано улучшение качества жизни (согласуется с данными коллег) [21]. При этом у первой пациентки наблюдалось улучшение всех параметров и это касалось общего состояния здоровья, жизненной активности и психического здоровья, тогда как у второй пациентки эти параметры возрастали, но в меньшей степени, а ролевое функционирование после операции не изменилось. Данный факт может быть связан с более длительным течением ХП во втором случае.
Наследственный/генетический панкреатит (HGP) — это особый вид ХП, который служит показанием для TPIAT. Известно, что у пациентов с наследственным панкреатитом или мутациями гена PRSS1 отмечается повышенный риск развития рака поджелудочной железы. Целью TPIAT для таких пациентов является удаление поджелудочной железы как потенциального источника протоковой аденокарциномы.
Наследственный/генетический панкреатит вызывается мутацией в гене, кодирующем катионный трипсиноген (протеаза серин 1, или PRSS1) и картированном в области 7q35 длинного плеча человеческой хромосомы 7. Патогенные мутации в PRSS1 связаны с более чем 80% вероятностью рецидивирующего острого и/или хронического панкреатита, а также исключительно высоким пожизненным риском (оценивается в 40%) развития протоковой аденокарциномы поджелудочной железы. TPIAT показан молодым пациентам (часто <10 лет) при первых симптомах. Таким образом, у пациентов с HGP целью TPIAT является не только облегчение боли и повышение качества жизни, но и снижение риска развития рака поджелудочной железы.
Обнаружена прямая зависимость между продолжительностью HGP и развитием клинической картины диабета. При сравнении пациентов с HGP и пациентов без известных генетических мутаций первые демонстрировали наличие более выраженного фиброзного изменения ткани поджелудочной железы, меньшую массу островков и значительно более низкую вероятность достижения независимости от инсулина в будущем по сравнению с негенетическими вариантами ХП. Исследование S. Chinnakotla и соавт. [25], включающее 80 пациентов с HGP, показало, что TPIAT у пациентов с HGP обеспечивает долгосрочное облегчение боли (90%) и сохранение функции β-клеток.
Пациенты с HGP и высоким риском развития рака поджелудочной железы должны рассматриваться на более раннем сроке для TPIAT, до того, как воспаление поджелудочной железы приведет к высокой степени фиброза паренхимы и потере функции ОЛ. Поэтому эти пациенты, как правило, моложе по сравнению с пациентами, перенесшими TPIAT по другим показаниям. Исследование M.D. Bellin и соавт. [26], включающее 64 пациента с HGP, показало, что на послеоперационный результат неблагоприятно влияли пожилой возраст и длительность заболевания. В частности, масса островков была ниже, а риск диабета выше у пожилых пациентов с длительным панкреатическим анамнезом. Это следует учитывать при консультировании подгруппы потенциальных реципиентов TPIAT.
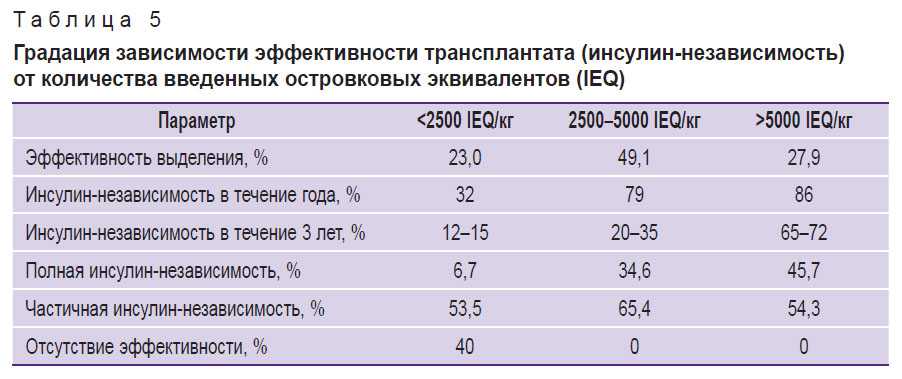
Возникновение диабета при ХП связано с разрушением ОЛ под воздействием воспалительных процессов в поджелудочной железе. Уровень выработки инсулина после TPIAT, как правило, коррелирует с массой пересаженных островков (табл. 5) и с предоперационными анализами метаболической функции и HbA1c. Преимущественно об эффективной трансплантации сообщают при подсадке более 5000 IEQ/кг [23, 27–28], однако существуют примеры достижения инсулинонезависимости после трансплантации менее 1000 IEQ/кг [29]. Нами было проведено 2 процедуры TPIAT, при этом в первом случае было подсажено 83 IEQ/кг, а во втором — 553 IEQ/кг. Низкое количество подсаженных ОЛ может объяснить полученные отрицательные результаты по функции трансплантатов. Собранная и систематизированная нами информация по зависимости клинической эффективности функции пересаженных островков от их количества представлена в табл. 5.
|
Таблица 5. Градация зависимости эффективности трансплантата (инсулин-независимость) от количества введенных островковых эквивалентов (IEQ) |
Однако даже корреляция между массой пересаженных островков и успехом трансплантации несовершенна. C.A. Beamish с соавт. предполагают, что различия в функции ОЛ до и после TPIAT могут быть связаны с изменениями в идентичности β-клеток у пациентов с ХП [23]. Как и в наших случаях, авторами было обнаружено повышенное содержание бигормональных клеток. Кроме того, C.A. Beamish с соавт. провели дополнительные исследования и показали возможную корреляцию дедифференцированных эндокринных клеток у пациентов с длительным ХП и снижением эффективности аутотрансплантации. Распространенность бигормональных клеток, по-видимому, не связана с клиническими параметрами и уровнем глюкозы до трансплантации. Однако предоперационное повышение уровня проинсулина, инсулина и соотношения проинсулина/инсулина у лиц без диабета, вероятно, соответствовало гистологическим данным о клеточной дедифференциации. Это наблюдение вместе с недавно зафиксированными случаями дедифференциации у реципиентов аллотрансплантата островков и связью этого явления с процессом изоляции ОЛ [30] подчеркивает необходимость дальнейшего изучения статуса дедифференциации трансплантированных островков при выполнении TPIAT, а также оценки и клинической полезности аутотрансплантации ОЛ.
Как в первом, так и во втором случае нами было выявлено наличие инсулинорезистентности, которое также может послужить препятствием для нормализации гликемии. Инсулинорезистентность у таких пациентов чаще всего имеет печеночный генез и возникает при длительно текущем ХП за счет сокращения числа РР-клеток и, соответственно, снижения синтеза панкреатического полипептида [31].
Заключение
Продемонстрирован первый в России опыт лечения хронического панкреатита путем тотального удаления поджелудочной железы как источника стойкого болевого синдрома с последующей аутотрансплантацией выделенных островков Лангерганса. Этот метод безопасен для пациентов и высокоэффективен для снижения болевого синдрома, а также для профилактики развития рака поджелудочной железы.
Анализ возможных причин функциональной недостаточности трансплантированных островков Лангерганса в нашем исследовании позволяет сделать вывод о необходимости более раннего применения технологии TPIAT при генетически детерминированных панкреатитах, когда сохранено достаточное количество функционирующих островков в воспаленной железе. Своевременная диагностика генетически обусловленных панкреатитов в молодом возрасте позволит избежать длительного бесперспективного и неэффективного лечения.
Финансирование. Работа выполнена за счет средств проекта «Приоритет 2030» Приволжского исследовательского медицинского университета.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов.
Литература
- Ивашкин В.Т., Кригер А.Г., Охлобыстин А.В., Анищенко М.А., Кардашева С.С., Алексеенко С.А., Багненко С.Ф., Быков М.И., Будзинский C.А., Буриев И.М., Вишневский В.А., Гальперин Э.И., Глабай В.П., Гольцов В.Р., Дюжева Т.Г., Кармазановский Г.Г., Королев М.П., Красильников Д.М., Кучерявый Ю.А., Маев И.В., Майстренко Н.А., Осипенко М.Ф., Прудков М.И., Симаненков В.И., Солоницин Е.Г., Федоров А.В., Федоров Е.Д., Хлынов И.Б., Чикунова М.В., Шабунин А.В., Шаповальянц С.Г., Шептулин А.А., Шифрин О.С. Клинические рекомендации Российского общества хирургов, Российской гастроэнтерологической ассоциации, Ассоциации хирургов-гепатологов и Эндоскопического общества «РЭндО» по диагностике и лечению хронического панкреатита. Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2022; 32(2): 99–156, https://doi.org/10.22416/1382-4376-2022-32-2-99-156.
- Xiao A.Y., Tan M.L., Wu L.M., Asrani V.M., Windsor J.A., Yadav D., Petrov M.S. Global incidence and mortality of pancreatic diseases: a systematic review, meta-analysis, and meta-regression of population-based cohort studies. Lancet Gastroenterol Hepatol 2016; 1(1): 45–55, https://doi.org/10.1016/S2468-1253(16)30004-8.
- Маев И.В., Кучерявый Ю.А. Роль мутаций гена катионического трипсиногена (PRSS1-гена) в патогенезе хронического панкреатита. Клиническая медицина 2004; 82(10): 12–17.
- Кучерявый Ю.А., Петрова Н.В., Тибилова З.Ф., Смирнов А.В., Оганесян Т.С., Казюлин А.Н., Маев И.В. Мутации гена панкреатического секреторного ингибитора трипсина N34S у больных хроническим идиопатическим панкреатитом. Экспериментальная и клиническая гастроэнтерология 2011; 7: 7–12.
- Coluzzi M., Takita M., Saracino G., Rub Hakim Mohammed A., Darden C.M., Testa G., Beecherl E., Onaca N., Naziruddin B. Improved quality of life among chronic pancreatitis patients undergoing total pancreatectomy with islet autotransplantation-single center experience with large cohort of patients. Transpl Int 2023; 36: 11409, https://doi.org/10.3389/ti.2023.11409.
- Министерство здравоохранения Российской Федерации. Клинические рекомендации «Хронический панкреатит». 2020. URL: https://sudact.ru/law/klinicheskie-rekomendatsii- khronicheskii-pankreatit-utv-minzdravom- rossii/klinicheskie-rekomendatsii/.
- Whitcomb D.C.; North American Pancreatitis Study Group Pancreatitis: TIGAR-O Version 2 risk/etiology checklist with topic reviews, updates, and use primers. Clin Transl Gastroenterol 2019; 10(6): e00027, https://doi.org/10.14309/ctg.0000000000000027.
- Kumar S., Ooi C.Y., Werlin S., Abu-El-Haija M., Barth B., Bellin M.D., Durie P.R., Fishman D.S., Freedman S.D., Gariepy C., Giefer M.J., Gonska T., Heyman M.B., Himes R., Husain S.Z., Lin T.K., Lowe M.E., Morinville V., Palermo J.J., Pohl J.F., Schwarzenberg S.J., Troendle D., Wilschanski M., Zimmerman M.B., Uc A. Risk factors associated with pediatric acute recurrent and chronic pancreatitis: lessons from INSPPIRE. JAMA Pediatr 2016; 170(6): 562–569, https://doi.org/10.1001/jamapediatrics.2015.4955.
- Schwarzenberg S.J., Bellin M., Husain S.Z., Ahuja M., Barth B., Davis H., Durie P.R., Fishman D.S., Freedman S.D., Gariepy C.E., Giefer M.J., Gonska T., Heyman M.B., Himes R., Kumar S., Morinville V.D., Lowe M.E., Nuehring N.E., Ooi C.Y., Pohl J.F., Troendle D., Werlin S.L., Wilschanski M., Yen E., Uc A. Pediatric chronic pancreatitis is associated with genetic risk factors and substantial disease burden. J Pediatr 2015; 166(4): 890–896.e1, https://doi.org/10.1016/j.jpeds.2014.11.019.
- McEachron K.R., Bellin M.D. Total pancreatectomy and islet autotransplantion for chronic and recurrent acute pancreatitis. Curr Opin Gastroenterol 2018; 34(5): 367–373, https://doi.org/10.1097/MOG.0000000000000458.
- Nathan J.D., Yang Y., Eaton A., Witkowski P., Wijkstrom M., Walsh M., Trikudanathan G., Singh V.K., Schwarzenberg S.J., Pruett T.L., Posselt A., Naziruddin B., Mokshagundam S.P., Morgan K., Lara L.F., Kirchner V., He J., Gardner T.B., Freeman M.L., Ellery K., Conwell D.L., Chinnakotla S., Beilman G.J., Ahmad S., Abu-El-Haija M., Hodges J.S., Bellin M.D. Surgical approach and short-term outcomes in adults and children undergoing total pancreatectomy with islet autotransplantation: a report from the prospective observational study of TPIAT. Pancreatology 2022; 22(1): 1–8, https://doi.org/10.1016/j.pan.2021.09.011.
- Bellin M.D., Beilman G.J., Sutherland D.E., Ali H., Petersen A., Mongin S., Kirchner V., Schwarzenberg S.J., Trikudanathan G., Freeman M.L., Pruett T.L., Chinnakotla S. How durable is total pancreatectomy and intraportal islet cell transplantation for treatment of chronic pancreatitis? J Am Coll Surg 2019; 228(4): 329–339, https://doi.org/10.1016/j.jamcollsurg.2018.12.019.
- Bachul P.J., Grybowski D.J., Anteby R., Basto L., Perea L., Golab K., Wang L.J., Tibudan M., Perez-Gutierrez A., Komorniczak M., Nagpal S., Lucander A., Fung J., Matthews J.B., Witkowski P. Total pancreatectomy with islet autotransplantation in diabetic and pre-diabetic patients with intractable chronic pancreatitis. J Pancreatol 2020; 3(2): 86–92, https://doi.org/10.1097/jp9.0000000000000048.
- Загайнов В.Е., Кучин Д.М., Ермакова П.С., Васильчикова Е.А., Луговая Л.А., Наралиев Н.У., Кашина А.В. Выделение островковых клеток из поджелудочной железы после панкреатэктомии. Показания, методика, оценка результатов. Анналы хирургической гепатологии 2022; 27(3): 46–54, https://doi.org/10.16931/1995-5464.2022-3-46-54.
- Bennet W., Sundberg B., Groth C.G., Brendel M.D., Brandhorst D., Brandhorst H., Bretzel R.G., Elgue G., Larsson R., Nilsson B., Korsgren O. Incompatibility between human blood and isolated islets of Langerhans: a finding with implications for clinical intraportal islet transplantation? Diabetes 1999; 48(10): 1907–1914, https://doi.org/10.2337/diabetes.48.10.1907.
- Forlenza G.P., Chinnakotla S., Schwarzenberg S.J., Cook M., Radosevich D.M., Manchester C., Gupta S., Nathan B., Bellin M.D. Near-euglycemia can be achieved safely in pediatric total pancreatectomy islet autotransplant recipients using an adapted intravenous insulin infusion protocol. Diabetes Technol Ther 2014; 16(11): 706–713, https://doi.org/10.1089/dia.2014.0061.
- Лебедева А.Н., Вишневский В.А. Эндокринологические аспекты ведения пациентов после дуоденопанкреатэктомии. Анналы хирургической гепатологии 2020; 25(3): 96–111, https://doi.org/10.16931/1995-5464.2020396-111.
- Siegmund T., Heinemann L., Kolassa R., Thomas A. Discrepancies between blood glucose and interstitial glucose-technological artifacts or physiology: implications for selection of the appropriate therapeutic target. J Diabetes Sci Technol 2017; 11(4): 766–772, https://doi.org/10.1177/1932296817699637.
- Klöppel G. Chronic pancreatitis, pseudotumors and other tumor-like lesions. Mod Pathol 2007; 20(Suppl 1): S113–S131, https://doi.org/10.1038/modpathol.3800690.
- Yamane K., Anazawa T., Nagai K., Ito T., Hatano E. Current status of total pancreatectomy with islet autotransplantation for chronic and recurrent acute pancreatitis. Ann Gastroenterol Surg 2023; 8(3): 401–412, https://doi.org/10.1002/ags3.12767.
- Takaki T., Chujo D., Kurokawa T., Kawabe A., Takahashi N., Ito K., Maruyama K., Inagaki F., Shinohara K., Ajima K., Yamashita Y., Kajio H., Yanase M., Hinohara C., Tokuhara M., Uemura Y., Edamoto Y., Takemura N., Kokudo N., Matsumoto S., Shimoda M. Quality of life after total pancreatectomy with islet autotransplantation for chronic pancreatitis in Japan. Islets 2023; 15(1): 2202092, https://doi.org/10.1080/19382014.2023.2202092.
- Aleotti F., Nano R., Piemonti L., Falconi M., Balzano G. Total pancreatectomy sequelae and quality of life: results of islet autotransplantation as a possible mitigation strategy. Updates Surg 2021; 73(4): 1237–1246, https://doi.org/10.1007/s13304-021-01129-w.
- Beamish C.A., Gaber A.O., Afshar S.F., Fraga D.W., Hamilton D.J., Sabek O.M. Variability in endocrine cell identity in patients with chronic pancreatitis undergoing islet autotransplantation. Am J Transplant 2019; 19(5): 1568–1576, https://doi.org/10.1111/ajt.15154.
- Bellin M.D., Forlenza G.P., Majumder K., Berger M., Freeman M.L., Beilman G.J., Dunn T.B., Pruett T.L., Murati M., Wilhelm J.J., Cook M., Sutherland D.E., Schwarzenberg S.J., Chinnakotla S. Total pancreatectomy with islet autotransplantation resolves pain in young children with severe chronic pancreatitis. J Pediatr Gastroenterol Nutr 2017; 64(3): 440–445, https://doi.org/10.1097/MPG.0000000000001314.
- Chinnakotla S., Beilman G.J., Dunn T.B., Bellin M.D., Freeman M.L., Radosevich D.M., Arain M., Amateau S.K., Mallery J.S., Schwarzenberg S.J., Clavel A., Wilhelm J., Robertson R.P., Berry L., Cook M., Hering B.J., Sutherland D.E., Pruett T.L. Factors predicting outcomes after a total pancreatectomy and islet autotransplantation lessons learned from over 500 cases. Ann Surg 2015; 262(4): 610–622, https://doi.org/10.1097/SLA.0000000000001453.
- Bellin M.D., Prokhoda P., Hodges J.S., Schwarzenberg S.J., Freeman M.L., Dunn T.B., Wilhelm J.J., Pruett T.L., Kirchner V.A., Beilman G.J., Chinnakotla S. Age and disease duration impact outcomes of total pancreatectomy and islet autotransplant for prss1 hereditary pancreatitis. Pancreas 2018; 47(4): 466–470, https://doi.org/10.1097/MPA.0000000000001028.
- Chhabra P., Brayman K.L. Overcoming barriers in clinical islet transplantation: current limitations and future prospects. Curr Probl Surg 2014; 51(2): 49–86, https://doi.org/10.1067/j.cpsurg.2013.10.002.
- Beamish C.A., Gaber A.O., Fraga D.W., Hamilton D.J., Sabek O.M. Pretransplant HOMA-β is predictive of insulin independence in 7 patients with chronic pancreatitis undergoing islet autotransplantation. Transplant Direct 2022; 8(10): e1367, https://doi.org/10.1097/TXD.0000000000001367.
- Bottino R., Trucco M. Clinical implementation of islet transplantation: a current assessment. Pediatr Diabetes 2015; 16(6): 393–401, https://doi.org/10.1111/pedi.12287.
- Anderson S.J., White M.G., Armour S.L., Maheshwari R., Tiniakos D., Muller Y.D., Berishvili E., Berney T., Shaw J.A.M. Loss of end-differentiated β-cell phenotype following pancreatic islet transplantation. Am J Transplant 2018; 18(3): 750–755, https://doi.org/10.1111/ajt.14521.
- Аметов А.С., Пашкова Е.Ю., Ерохина А.Г., Амикишиева К.А. Сахарный диабет в исходе заболеваний поджелудочной железы — недостающее звено между сахарным диабетом 1 и 2 типов. Доктор.Ру 2023; 22(4): 29–35, https://doi.org/10.31550/1727-2378-2023-22-4-29-35.