Спектроскопическое исследование взаимодействия метиленового синего с коферментами и его влияния на метаболизм опухоли
Цель исследования — изучить взаимодействие метиленового синего (МС) с коферментами НАДН, ФАДН2 и лактатом, а также оценить долгосрочное влияние МС на метаболизм опухоли in vivo при его внутривенном и пероральном введении.
Материалы и методы. Взаимодействие МС с коферментами НАДН, ФАДН2 и лактатом исследовали с использованием абсорбционной спектрофотометрии. Долгосрочное влияние МС на метаболизм опухоли in vivo изучали на мышиной модели карциномы Эрлиха. Оценку влияния МС на метаболизм опухоли in vivo осуществляли с помощью времяразрешенной флуоресцентной микроскопии по времени жизни кофермента НАДН.
Результаты. Установлено, что НАДН является основным коферментом, с которым взаимодействует МС. Уменьшение количества лактата опосредовано сдвигом метаболизма опухоли в результате взаимодействия МС с коферментом НАДН. В экспериментах in vivo, в группах с внутривенным введением МС, существенного уменьшения скорости роста опухолей по сравнению с контролем не обнаружено. Для группы, получавшей МС с питьевой водой, наблюдалось уменьшение скорости роста опухоли, снижение уровня оксигенации и метаболического индекса a1/a2, что свидетельствует о сдвиге от гликолиза к окислительному фосфорилированию.
Заключение. Продемонстрирована возможность использования МС для коррекции метаболизма опухоли и уменьшения скорости ее роста, однако необходимо оптимизировать время терапии и концентрацию МС для получения выраженного терапевтического эффекта.
Введение
Метиленовый синий (МС) — тиазиновый краситель, впервые синтезированный в 1876 г. Изначально МС использовался в микроскопии как красящее вещество [1]. Благодаря окислительно-восстановительным свойствам он долгое время применялся в качестве антидота при отравлении цианидом, угарным газом и сероводородом [2–4], а также для лечения метгемоглобинемии [5, 6]. С появлением других антидотов интерес к МС на долгое время угас.
В последние годы растет интерес к использованию окислительно-восстановительных свойств МС при лечении нейродегенеративных заболеваний [7], характеризующихся метаболической дисфункцией, в частности болезни Альцгеймера, Паркинсона, Хантингтона и бокового амиотрофического склероза. Способность МС генерировать активные формы кислорода вместе с малым размером молекулы делает этот краситель привлекательным для использования в качестве фотосенсибилизатора при фотодинамической терапии [8, 9].
Механизм действия МС в качестве антидота и при нейродегенеративных заболеваниях схож: в низких дозах МС стимулирует митохондриальное дыхание, поставляя электроны в цепь переноса электронов. При этом МС может получать электрон от НАДН в присутствии комплекса I и отдавать его цитохрому с, обеспечивая альтернативный путь переноса электронов, минуя комплексы II и III. В результате МС способен увеличивать потребление кислорода, снижать гликолиз и увеличивать усвоение глюкозы in vitro. Кроме того, МС может выступать акцептором электронов, вытекающих из комплексов II и III, и таким образом минимизировать образование супероксид-аниона и других активных форм кислорода и снижать окислительный стресс [10].
Перепрограммирование энергетического метаболизма является общей чертой нейродегенеративных заболеваний и рака. Появляется все больше доказательств того, что рак и нейродегенеративные заболевания могут иметь общие терапевтические мишени [11]. Одной из них является кофермент НАДН [12]. Метаболизм раковых клеток предполагает увеличенное потребление глюкозы и преобладание аэробного гликолиза для производства аденозинтрифосфата даже в присутствии достаточного количества кислорода [13, 14]. Такое перепрограммирование энергетического метаболизма может быть использовано в качестве отличительного признака рака [15]. В работе [16] показано, что увеличение окислительного фосфорилирования подавляет рост рака in vitro и in vivo.
Повышенная гликолитическая активность способствует усиленному производству лактата, который играет важную сигнальную роль в метаболизме опухоли и может участвовать в подавлении противоопухолевого иммунитета [17, 18]. Кроме того, преимущественное использование гликолиза приводит к повышению соотношения восстановленной и окисленной форм кофермента НАДН/НАД+ в раковых клетках по сравнению с нормальными клетками [19, 20]. Учитывая способность МС взаимодействовать с НАДН, можно предположить, что применение МС будет также перспективно и для терапии опухолей. Кроме того, в литературе имеются данные о взаимодействии МС с лактатом. В пионерских работах по исследованию МС в качестве антидота предполагалось, что его способность увеличивать потребление кислорода тканями пропорциональна скорости продукции ими лактата [21]. Однако детального изучения взаимодействия МС с коферментами не проводилось. В данной работе мы исследовали взаимодействие МС с НАДН, ФАДН2 и лактатом, которые были выбраны исходя из ключевых особенностей метаболизма опухоли.
Эффективность использования МС для противоопухолевой терапии продемонстрирована на клеточных культурах in vitro. На клетках крови показано, что МС уменьшает образование молочной кислоты, и это косвенно указывает на переключение метаболизма с гликолиза на окислительное фосфорилирование [22]. В исследовании на клетках глиобластомы продемонстрировано, что МС увеличивает скорость потребления кислорода, снижает выработку молочной кислоты и скорость внеклеточного закисления и подавляет пролиферацию [23].
Несмотря на перспективность результатов, полученных in vitro, требуется проведение исследований in vivo, так как опухоль представляет собой сложную гетерогенную структуру, включающую в себя не только раковые, но и иммунокомпетентные клетки и внеклеточный матрикс. Наши исследования продемонстрировали влияние МС на оксигенацию опухоли на мышиной модели карциномы Льюиса при внутривенном введении: после кратковременного снижения наблюдался рост оксигенации выше начального значения [24, 25]. При помощи времяразрешенной флуоресцентной микроскопии (FLIM — fluorescence lifetime imaging microscopy) показано, что уже через 5 мин после введения МС наблюдался сдвиг на метаболической траектории НАДН в сторону окислительного фосфорилирования.
В данной работе проведено исследование долгосрочного влияния МС на метаболизм опухоли in vivo на мышиной модели карциномы Эрлиха при внутривенном и пероральном введении препарата. При помощи FLIM проанализированы времена жизни флуоресценции свободной и связанной форм кофермента НАДН, участвующих в гликолизе и окислительном фосфорилировании. Изучена возможность подавления роста опухоли за счет коррекции метаболического статуса.
Материалы и методы
Используемые реактивы. Для исследований использовали 1% водный раствор метиленового синего (действующее вещество — метилтиониния хлорид; ОАО «Самарамедпром», Россия). Для приготовления раствора кофермента НАДН применяли динатриевую соль НАДН (100%, сорт 1; Merk, Германия); для приготовления раствора кофермента ФАДН2 — гидрат динатриевой соли ФАД (Sigma-Aldrich, США); для приготовления раствора лактата — лактат натрия (Sigma-Aldrich, США). Измерения проводили в дистиллированной воде («ПанЭко», Россия).
Абсорбционная спектроскопия. Регистрацию спектров поглощения в диапазоне 200–1000 нм осуществляли при помощи спектрофотометра Hitachi U3400 (Hitachi, Япония) в кварцевых кюветах с длиной оптического пути 2 мм. Анализ спектров поглощения позволяет исследовать переход основной формы МС в его восстановленную лейкоформу при взаимодействии с другими веществами. Лактат использовали в концентрации 10 мМ (физиологическая концентрация при патологических состояниях). Концентрация коферментов НАДН и ФАДН2 в исследуемых растворах составляла 0,25 мг/мл; концентрация МС — 0,01 мг/мл. Спектры поглощения регистрировали сразу после смешивания растворов коферментов и лактата с МС и через 20 мин.
Оценка влияния МС на метаболизм опухоли in vivo. В экспериментах использовали мышей-самцов линии BALB/c массой тела 25–30 г в возрасте 8–10 нед. Мышей содержали в стандартных клетках при температуре 21°C с 12-часовым циклом день–ночь и свободным доступом к стандартному лабораторному корму и воде. В качестве модельной опухоли использовали карциному Эрлиха. Эксперименты проводили на 12-й день после внутримышечной перевивки опухоли на правую заднюю лапу.
Эксперименты на животных были одобрены комитетом по этике НМИЦ онкологии им. Н.Н. Блохина (Москва, Россия). Содержание животных и проведение экспериментов осуществляли в соответствии с этическими принципами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006).
Мыши были разделены на три экспериментальные группы в зависимости от концентрации МС и способа введения. Первую и вторую группу составляли мыши с внутривенным введением МС в дозе 10 и 20 мг/кг соответственно на 1-й и 7-й дни эксперимента. Третья группа получала МС перорально с питьевой водой из расчета суточной дозы 10 мг/кг в течение 2 нед. В качестве группы сравнения использовали отрицательный контроль — опухоль без введения МС.
Степень оксигенации гемоглобина in vivo оценивали при помощи метода измерения оптического поглощения гемоглобина [26] с галогеновой лампой в качестве источника света. Для регистрации спектров диффузного отражения использовали волоконно-оптический спектрометр LESA-01-Biospec («БИОСПЕК», Россия). Степень оксигенации гемоглобина рассчитывали как отношение поглощения оксигенированного гемоглобина к общему поглощению гемоглобина, полученному из спектра поглощения. Измерения оксигенации проводили в пяти точках как в опухолевой, так и в нормальной мышечной ткани для каждой мыши.
Мышей умерщвляли на 14-й день эксперимента. Опухоли вместе с подкожной клетчаткой, кожей и мышцами вырезали единым блоком и замораживали. С помощью замораживающего микротома Microm HM 560 Cryostat (Thermo Scientific, США) готовили криосрезы. Срезы толщиной 50 мкм исследовали на лазерном сканирующем конфокальном микроскопе LSM-710-NLO (Carl Zeiss, Германия).
Изображения с временным разрешением для автофлуоресценции кофермента НАДН и флуоресценции МС регистрировали при двухфотонном возбуждении с длиной волны 740 нм с помощью фемтосекундного лазера Chameleon Ultra II (Coherent, США) с длительностью импульса 140 фс и частотой повторения 80 МГц. Оптические полосовые фильтры FB450-40 (Thorlabs, США) и BP 640/30 (Carl Zeiss, Германия) применяли для выделения сигналов флуоресценции от НАДН и MС соответственно. Изображения обрабатывали с помощью программного обеспечения SPCImage 8.0 (Becker & Hickl GmbH, Германия). Для оценки изменения метаболизма использовали метаболический индекс a1/a2, рассчитанный как отношение коэффициентов экспонент короткого и длинного времени жизни НАДН.
Статистическая обработка данных. Для статистического анализа полученных результатов использовали тест Шапиро–Уилка, чтобы определить, соответствовала ли выборка нормальному распределению. После подтверждения нормального распределения проводили двухвыборочный t-тест. Для сравнения групп применяли критерий Стьюдента. Данные считали статистически значимыми при p<0,05.
Результаты
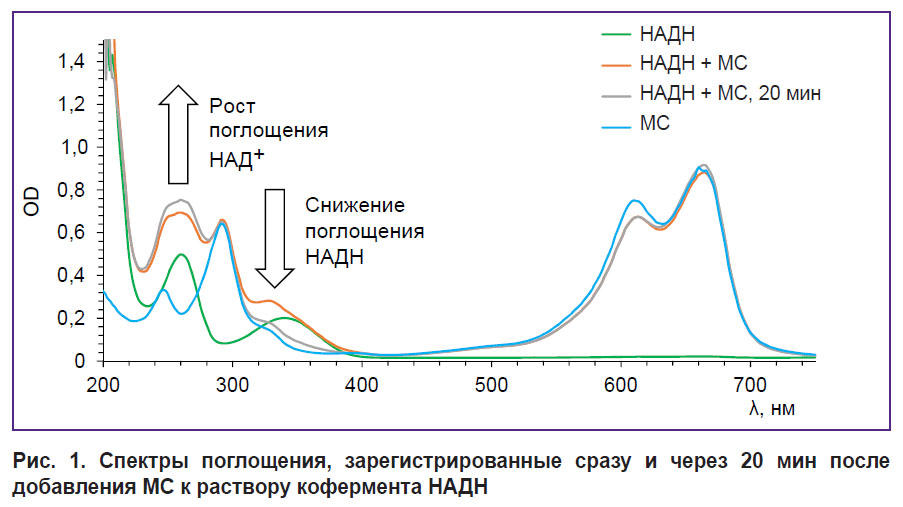
Исследование взаимодействия МС с коферментами НАДН, ФАДН2 и лактатом. Спектры поглощения, зарегистрированные после добавления МС к раствору кофермента НАДН, приведены на рис. 1. Видно, что с течением времени наблюдается уменьшение поглощения в области 340 нм, соответствующей поглощению НАДН, и рост поглощения в области 260 нм, соответствующей поглощению НАД+. Это говорит о том, что в растворе происходит окислительно-восстановительная реакция между МС и НАДН, в которой НАДН выступает донором электронов, а МС — акцептором. В результате происходит окисление НАДН до НАД+. Интересно отметить, что не наблюдается уменьшение поглощения МС, обусловленное переходом в бесцветную лейкоформу. Данный эффект связан с проведением эксперимента в аэробных условиях. При этом происходит быстрое повторное окисление лейкоформы в МС кислородом, в результате чего количество МС в растворе остается постоянным и поглощение не меняется [27].
|
Рис. 1. Спектры поглощения, зарегистрированные сразу и через 20 мин после добавления МС к раствору кофермента НАДН |
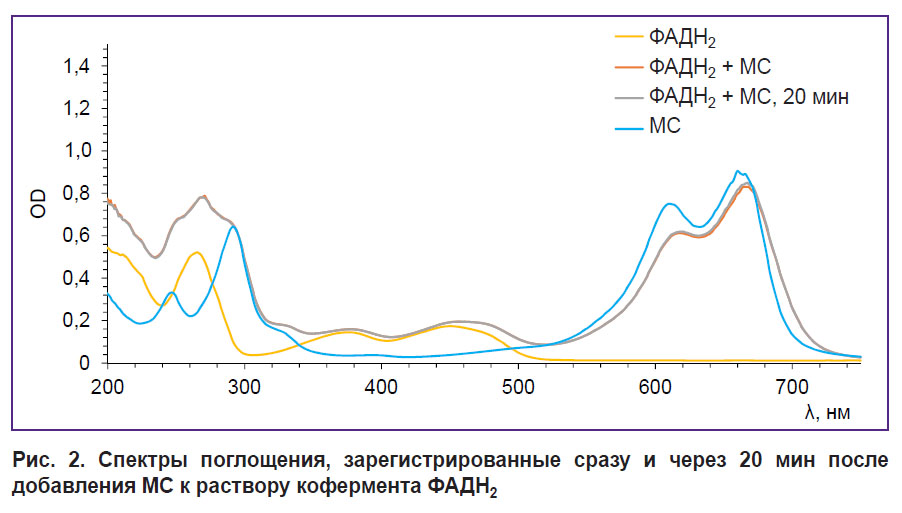
Спектры поглощения, зарегистрированные после добавления МС к раствору кофермента ФАДН2, приведены на рис. 2. На полученных спектрах видно, что при взаимодействии МС и кофермента ФАДН2 изменения формы спектра в области, соответствующей поглощению ФАДН2, не наблюдается. Кроме того, форма спектра в области поглощения ФАДН2 не изменяется с течением времени. Однако отмечается сдвиг максимума положения МС в красной части спектра, который не регистрировался в экспериментах in vivo [24, 25]. Это свидетельствует о том, что реакция с коферментом ФАДН2 не является ключевым механизмом воздействия МС на метаболизм опухоли.
|
Рис. 2. Спектры поглощения, зарегистрированные сразу и через 20 мин после добавления МС к раствору кофермента ФАДН2 |
Похожий результат был получен при исследовании взаимодействия МС с лактатом. Спектры поглощения, зарегистрированные после добавления МС к раствору лактата, приведены на рис. 3. Изменения формы спектра, свидетельствующего о протекании реакции, не наблюдается. С течением времени спектр также не изменяется.
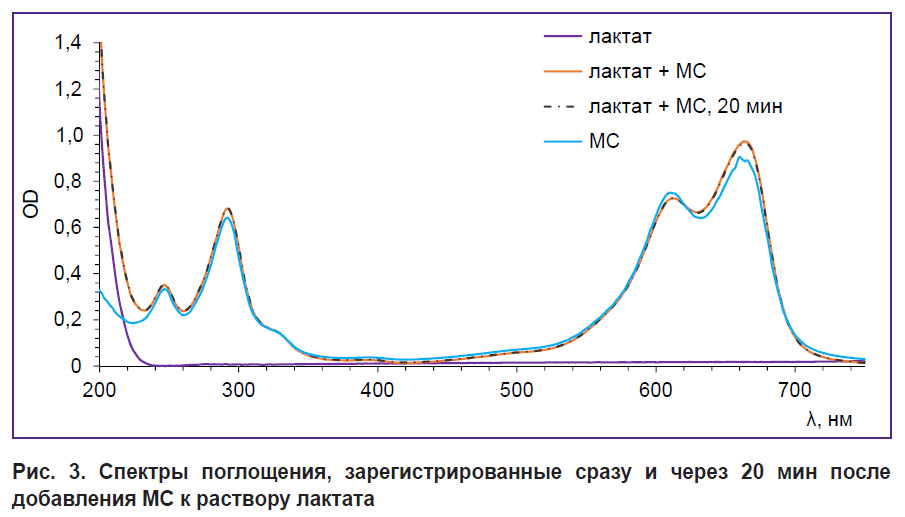
|
Рис. 3. Спектры поглощения, зарегистрированные сразу и через 20 мин после добавления МС к раствору лактата |
Таким образом, из результатов спектроскопического исследования МС с коферментами и лактатом можно сделать вывод, что НАДН является основным коферментом, с которым взаимодействует МС.
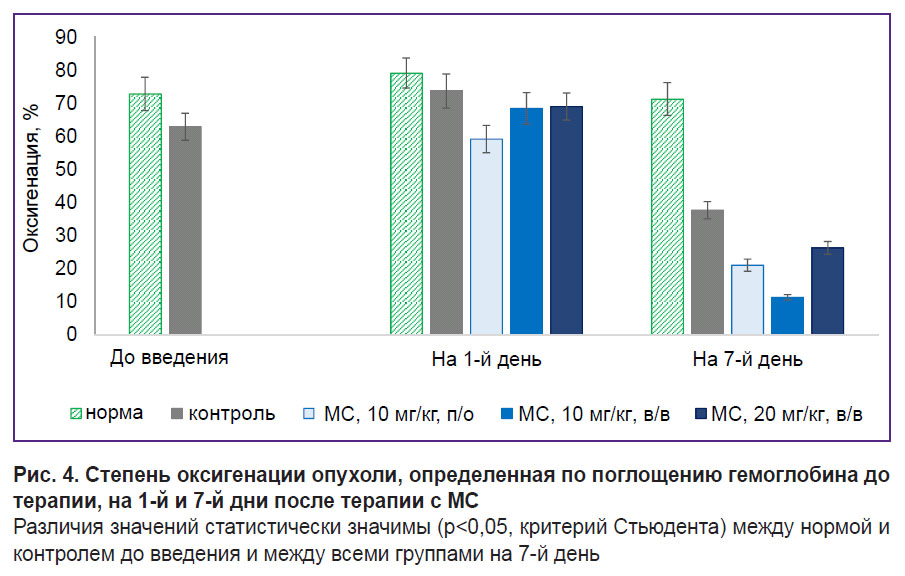
Влияние МС на метаболизм опухоли in vivo: оценка оксигенации и времяразрешенная флуоресцентная микроскопия. До начала терапии отличия в оксигенации между нормой и опухолью (70 и 60% соответственно) были небольшими, так как все опухоли имели достаточно маленький размер, но статистически значимыми (рис. 4). На 1-й день терапии практически не наблюдалось различий в оксигенации между группами. Отмечено снижение оксигенации в группе, получавшей МС с водой, что, возможно, обусловлено началом накопления МС в опухоли при пероральном введении. На 7-й день оксигенация опухоли в контрольной группе существенно снизилась относительно нормы, что связано с прогрессией опухоли. В группах с МС оксигенация была ниже, чем в контрольной группе.
Самый быстрый рост опухолей наблюдался в контрольной группе; уже на 10-й день объем опухоли превышал 1,5 см3. Для групы, получавшей МС с питьевой водой, отмечалось уменьшение скорости роста опухоли по сравнению с контрольной группой, при этом объем 1,5 см3 был достигнут на 14-й день эксперимента. В группах с внутривенным введением существенного уменьшения скорости роста опухолей по сравнению с контролем не установлено. Мы предполагаем, что при двукратном введении МС (на 1-й и 7-й дни) его действие слишком непродолжительно для эффективного терапевтического эффекта на опухоль. Следует также отметить, что при внутривенном введении МС высокой концентрации (20 мг/кг) также наблюдался выраженный сосудистый эффект; у некоторых мышей в группе отмечался тромбоз хвостовых вен.
Мы предполагаем, что полученный результат обусловлен влиянием МС на метаболизм опухоли. Согласно результатам наших экспериментов [24, 25], через 5 мин после внутривенного введения МС наблюдаются увеличение потребления кислорода опухолью и снижение уровня оксигенации. Наряду с этим регистрируется сдвиг метаболизма в сторону окислительного фосфорилирования. Спустя час после введения МС оксигенация возрастает выше начального значения.
Таким образом, в данном эксперименте, пока МС воздействует на опухоль, измеряемая оксигенация ниже, однако рост опухоли может быть медленнее за счет метаболического сдвига относительно контрольной группы без воздействия.
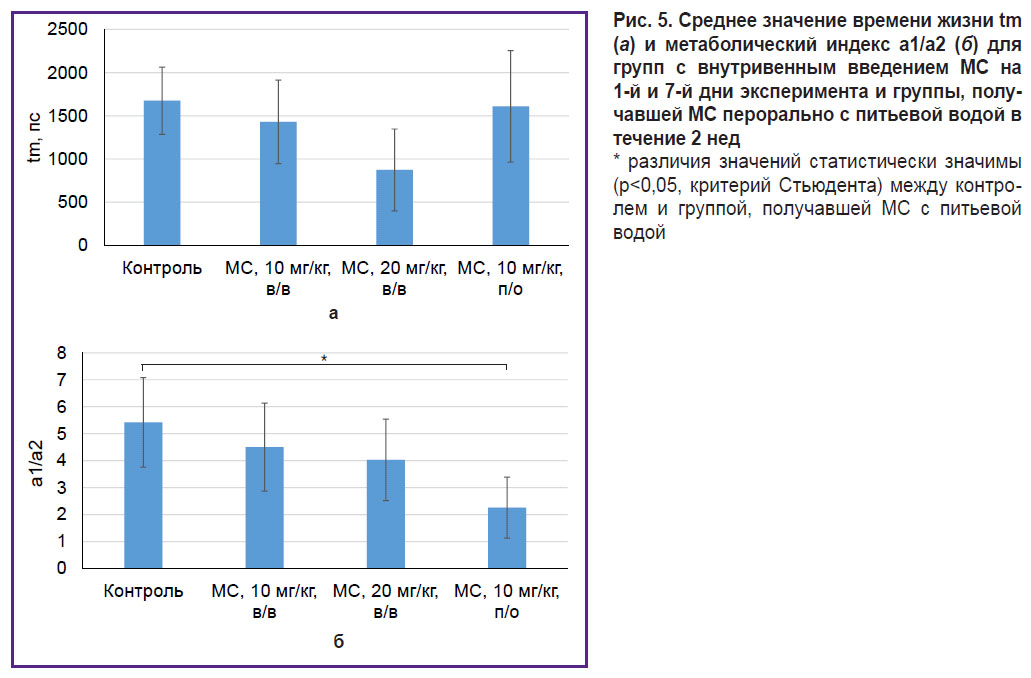
Проверку данной гипотезы проводили при помощи FLIM-микроскопии. Для оценки изменения метаболизма использовали среднее значение времени жизни tm и метаболический индекс a1/a2, рассчитанный как отношение коэффициентов экспонент короткого и длинного времени жизни НАДН (рис. 5).
Для среднего времени жизни tm статистически значимых отличий между группами не установлено. Для метаболического индекса a1/a2 отмечалось снижение в группах, получавших терапию МС; статистически значимое снижение по сравнению с контролем наблюдалось для группы, получавшей МС с питьевой водой в течение 2 нед. Уменьшение метаболического индекса свидетельствует о сдвиге от гликолиза к окислительному фосфорилированию. Данный результат подтверждает сделанное ранее предположение о пролонгированном воздействии МС на опухоль в случае перорального введения, которое выражается в изменении уровня оксигенации, сдвиге метаболизма в сторону окислительного фосфорилирования и уменьшении скорости прогрессирования опухоли. Несмотря на перспективность полученных результатов, необходимо оптимизировать время терапии и концентрацию МС для получения выраженного терапевтического эффекта.
Обсуждение
Кофермент НАДН является жизненно важной молекулой во всех организмах и ключевым компонентом в получении энергии клеткой из питательных веществ, а также в сигнальных путях. НАДН-зависимые сигнальные пути многочисленны и разнообразны, они регулируют транскрипцию, репарацию ДНК, апоптоз и метаболизм. Многие из этих процессов связаны с развитием опухоли, поэтому коррекция метаболизма НАДН представляется перспективной терапевтической концепцией для лечения рака [12, 19, 20].
Одним из интересных подходов являются разработка и изучение нанозимов — наноструктур, которые имитируют каталитические свойства природных ферментов. Большинство нанозимов могут катализировать деградацию пероксидов и активно используются для генерации кислорода in situ [28]. Растет интерес к разработке нанозимов для других коферментов, участвующих в клеточных метаболических окислительно-восстановительных реакциях, таких как НАДН/НАД+ [29]. Известные окислительно-восстановительные красители, например МС, могут использоваться для тех же целей. При этом небольшая молекулярная масса позволяет МС быстро доставляться в ткани; при внутривенном введении повышенная концентрация МC наблюдалась в мозге. Это указывает на то, что МС может проходить через гематоэнцефалический барьер [30]. Такая высокая проникающая способность делает МС перспективным с точки зрения накопления в опухолях с нарушенной сосудистой сетью, а также в некротическом центре быстрорастущих солидных опухолей, доступ питательных веществ в которые зачастую сильно ограничен.
Большим преимуществом является то, что МС достаточно хорошо изучен и уже применяется в клинической практике, соответственно не требуется проведения масштабных токсикологических исследований, как в случае с наночастицами. В настоящее время МС одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для внутривенного и перорального введения при терапии метгемоглобинемии и в качестве хирургического красителя. По состоянию на 2025 г. во всем мире было зарегистрировано 281 интервенционное исследование (clinicaltrials.gov) для изучения клинической полезности МС в областях от онкологии до депрессии, 74 из них — в области онкологии, 141 клиническое испытание было завершено. Нельзя не отметить также низкую стоимость препарата и экономическую эффективность его использования.
Полученные нами результаты продемонстрировали эффективное взаимодействие МС с коферментом НАДН. Интересно, что прямого взаимодействия с лактатом не наблюдалось. Мы предполагаем, что уменьшение количества лактата и скорости внеклеточного закисления при введении МС, о котором сообщается в литературе [31], является вторичным эффектом, опосредованным сдвигом метаболизма в сторону окислительного фосфорилирования в результате взаимодействия МС с коферментом НАДН.
Другим важным результатом проведенного исследования является демонстрация возможности использования МС для коррекции метаболизма опухоли и уменьшения скорости ее роста. Несмотря на перспективность полученных результатов, необходимо оптимизировать время терапии и концентрацию МС для получения выраженного терапевтического эффекта.
Заключение
Проведено исследование взаимодействия МС с коферментами НАДН и ФАДН2, а также лактатом. Установлено что НАДН является основным коферментом, с которым взаимодействует МС.
Изучено влияние МС на метаболизм опухоли in vivo и возможности подавления роста опухоли. В группах с внутривенным введением существенного уменьшения скорости роста опухолей по сравнению с контролем не наблюдалось. Для группы, получавшей МС с питьевой водой, отмечалось уменьшение скорости роста опухоли по сравнению с контрольной группой, а также снижение уровня оксигенации. Полученный результат обусловлен влиянием МС на метаболизм опухоли. Для метаболического индекса a1/a2 зарегистрировано статистически значимое снижение по сравнению с контролем для группы, получавшей МС с питьевой водой в течение 2 нед, свидетельствующее о сдвиге от гликолиза к окислительному фосфорилированию. Соответственно, пока МС воздействует на опухоль, измеряемая оксигенация ниже, однако рост опухоли при этом медленнее за счет метаболического сдвига относительно контрольной группы без воздействия.
Финансирование. Работа выполнена при финансовой поддержке гранта Российского научного фонда №22-72-10117 («Разработка методов контроля оксигенации опухолей и повышения эффективности фотодинамической терапии при помощи метиленового синего»).
Конфликт интересов отсутствует.
Литература
- Schirmer R.H., Adler H., Pickhardt M., Mandelkow E. “Lest we forget you —methylene blue...”. Neurobiol Aging 2011; 32(12): 2325.e7–2325.e2.325E16, https://doi.org/10.1016/j.neurobiolaging.2010.12.012.
- Haouzi P., Gueguinou M., Sonobe T., Judenherc-Haouzi A., Tubbs N., Trebak M., Cheung J., Bouillaud F. Revisiting the physiological effects of methylene blue as a treatment of cyanide intoxication. Clin Toxicol (Phila) 2018; 56(9): 828–840, https://doi.org/10.1080/15563650.2018.1429615.
- Brooks M.M. Methylene blue as antidote for cyanide and carbon monoxide poisoning. JAMA 1933; 100(1): 59, https://doi.org/10.1001/jama.1933.02740010061028.
- Shiva S., Brookes P.S., Patel R.P., Anderson P.G., Darley-Usmar V.M. Nitric oxide partitioning into mitochondrial membranes and the control of respiration at cytochrome c oxidase. Proc Natl Acad Sci U S A 2001; 98(13): 7212–7217, https://doi.org/10.1073/pnas.131128898.
- Herman M.I., Chyka P.A., Butler A.Y., Rieger S.E. Methylene blue by intraosseous infusion for methemoglobinemia. Ann Emerg Med 1999; 33(1): 111–113, https://doi.org/10.1016/s0196-0644(99)70427-0.
- Wendel W.B. The control of methemoglobinemia with methylene blue. J Clin Invest 1939; 18(2): 179–185, https://doi.org/10.1172/JCI101033.
- Howland R.H. Methylene blue: the long and winding road from stain to brain: Part 1. J Psychosoc Nurs Ment Health Serv 2016; 54(9): 21–24, https://doi.org/10.3928/02793695-20160818-01.
- Tardivo J.P., Del Giglio A., de Oliveira C.S., Gabrielli D.S., Junqueira H.C., Tada D.B., Severino D., de Fátima Turchiello R., Baptista M.S. Methylene blue in photodynamic therapy: from basic mechanisms to clinical applications. Photodiagnosis Photodyn Ther 2005; 2(3): 175–191, https://doi.org/10.1016/S1572-1000(05)00097-9.
- Taldaev A., Terekhov R., Nikitin I., Melnik E., Kuzina V., Klochko M., Reshetov I., Shiryaev A., Loschenov V., Ramenskaya G. Methylene blue in anticancer photodynamic therapy: systematic review of preclinical studies. Front Pharmacol 2023; 14: 1264961, https://doi.org/10.3389/fphar.2023.1264961.
- Privistirescu A.I., Sima A., Duicu O.M., Timar R., Roşca M.G., Sturza A., Muntean D.M. Methylene blue alleviates endothelial dysfunction and reduces oxidative stress in aortas from diabetic rats. Can J Physiol Pharmacol 2018; 96(10): 1012–1016, https://doi.org/10.1139/cjpp-2018-0119.
- Yang S.H., Li W., Sumien N., Forster M., Simpkins J.W., Liu R. Alternative mitochondrial electron transfer for the treatment of neurodegenerative diseases and cancers: methylene blue connects the dots. Prog Neurobiol 2017; 157: 273–291, https://doi.org/10.1016/j.pneurobio.2015.10.005.
- Chiarugi A., Dölle C., Felici R., Ziegler M. The NAD metabolome — a key determinant of cancer cell biology. Nat Rev Cancer 2012; 12(11): 741–752, https://doi.org/10.1038/nrc3340.
- Vander Heiden M.G., Cantley L.C., Thompson C.B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science 2009; 324(5930): 1029–1033, https://doi.org/10.1126/science.1160809.
- Warburg O. On respiratory impairment in cancer cells. Science 1956; 124(3215): 269–270, https://doi.org/10.1126/science.124.3215.269.
- Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell 2011; 144(5): 646–674, https://doi.org/10.1016/j.cell.2011.02.013.
- Schulz T.J., Thierbach R., Voigt A., Drewes G., Mietzner B., Steinberg P., Pfeiffer A.F., Ristow M. Induction of oxidative metabolism by mitochondrial frataxin inhibits cancer growth: Otto Warburg revisited. J Biol Chem 2006; 281(2): 977–981, https://doi.org/10.1074/jbc.M511064200.
- Colegio O.R., Chu N.Q., Szabo A.L., Chu T., Rhebergen A.M., Jairam V., Cyrus N., Brokowski C.E., Eisenbarth S.C., Phillips G.M., Cline G.W., Phillips A.J., Medzhitov R. Functional polarization of tumour-associated macrophages by tumour-derived lactic acid. Nature 2014; 513(7519): 559–563, https://doi.org/10.1038/nature13490.
- Huber V., Camisaschi C., Berzi A., Ferro S., Lugini L., Triulzi T., Tuccitto A., Tagliabue E., Castelli C., Rivoltini L. Cancer acidity: an ultimate frontier of tumor immune escape and a novel target of immunomodulation. Semin Cancer Biol 2017; 43: 74–89, https://doi.org/10.1016/j.semcancer.2017.03.001.
- DeBerardinis R.J., Lum J.J., Hatzivassiliou G., Thompson C.B. The biology of cancer: metabolic reprogramming fuels cell growth and proliferation. Cell Metab 2008; 7(1): 11–20, https://doi.org/10.1016/j.cmet.2007.10.002.
- Heikal A.A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomark Med 2010; 4(2): 241–263, https://doi.org/10.2217/bmm.10.1.
- Barron E.S. The catalytic effect of methylene blue on the oxygen consumption of tumors and normal tissues. J Exp Med 1930; 52(3): 447–456, https://doi.org/10.1084/jem.52.3.447.
- Harrop G.A., Barron E.S. Studies on blood cell metabolism: I. The effect of methylene blue and other dyes upon the oxygen consumption of mammalian and avian erythrocytes. J Exp Med 1928; 48(2): 207–223, https://doi.org/10.1084/jem.48.2.207.
- Poteet E., Choudhury G.R., Winters A., Li W., Ryou M.G., Liu R., Tang L., Ghorpade A., Wen Y., Yuan F., Keir S.T., Yan H., Bigner D.D., Simpkins J.W., Yang S.H. Reversing the Warburg effect as a treatment for glioblastoma. J Biol Chem 2013; 288(13): 9153–9164, https://doi.org/10.1074/jbc.M112.440354.
- Pominova D., Ryabova A., Skobeltsin A., Markova I., Linkov K., Romanishkin I. The use of methylene blue to control the tumor oxygenation level. Photodiagnosis Photodyn Ther 2024; 46: 104047, https://doi.org/10.1016/j.pdpdt.2024.104047.
- Pominova D.V., Ryabova A.V., Skobeltsin A.S., Markova I.V., Romanishkin I.D., Loschenov V.B. Spectroscopic study of methylene blue in vivo: effects on tissue oxygenation and tumor metabolism. Biomedical Photonics 2023; 12(1): 4–13, https://doi.org/10.24931/2413-9432-2023-12-1-4-13.
- Stratonnikov A.A., Loschenov V.B. Evaluation of blood oxygen saturation in vivo from diffuse reflectance spectra. J Biomed Opt 2001; 6(4): 457–467, https://doi.org/10.1117/1.1411979.
- Sevcik P., Dunford H.B. Kinetics of the oxidation of NADH by methylene blue in a closed system. J Phys Chem 1991; 95(6): 2411–2415, https://doi.org/10.1021/j100159a054.
- Chu C., Lin H., Liu H., Wang X., Wang J., Zhang P., Gao H., Huang C., Zeng Y., Tan Y., Liu G., Chen X. Tumor microenvironment-triggered supramolecular system as an in situ nanotheranostic generator for cancer phototherapy. Adv Mater 2017; 29(23): 10.1002/adma.201605928, https://doi.org/10.1002/adma.201605928.
- Sharick J.T., Favreau P.F., Gillette A.A., Sdao S.M., Merrins M.J., Skala M.C. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Sci Rep 2018; 8(1): 5456, https://doi.org/10.1038/s41598-018-23691-x.
- Peter C., Hongwan D., Küpfer A., Lauterburg B.H. Pharmacokinetics and organ distribution of intravenous and oral methylene blue. Eur J Clin Pharmacol 2000; 56(3): 247–250, https://doi.org/10.1007/s002280000124.
- Tranquada R.E., Bernstein S., Grant W.J. Intravenous methylene blue in the therapy of lactic acidosis. Arch Intern Med 1964; 114: 13–25, https://doi.org/10.1001/archinte.1964.03860070059003.