Одновременное применение двух фотосенсибилизаторов — метиленового синего и хлорина е6: исследование на культуре клеток
Применение фотосенсибилизаторов для подавления окислительного фосфорилирования с целью временного снижения потребления кислорода опухолевыми клетками в ходе фотодинамической терапии (ФДТ) вызывает растущий интерес.
Цель. Исследование направлено на преодоление гипоксии опухолей для дальнейшего проведения фотодинамической терапии при одновременном использовании двух фотосенсибилизаторов: метиленового синего (МС) и хлорина e6, относящихся к I и II типам соответственно.
Материалы и методы. Проведено исследование фотодинамической активности МС и МС в комбинации с хлорином е6 на культуре клеток HeLa и оценено их влияние на клеточный метаболизм при совместном накоплении и последующем облучении.
Результаты. МС в клетках генерирует активные формы кислорода, в отличие от хлорина е6, который продуцирует синглетный кислород. Кроме того, при невысоких концентрациях в процессе дезоксигенации МС переходит в бесцветную лейкоформу. Инкубация клеток с МС одновременно с хлорином е6 приводит к большей флуоресценции его внутри клеток по сравнению с инкубацией клеток только с МС. Концентрации МС в диапазоне 1–10 мг/кг и доза лазерного облучения 60 Дж/см2 не вызывают гибели клеток, вероятно из-за перехода МС в фотодинамически неактивную лейкоформу. Для всех образцов с хлорином е6 и с МС в диапазоне концентраций 0–20 мг/кг и в дозе 60 Дж/см2 наблюдается гибель клеток после ФДТ. Совместная фототоксичность МС и хлорина е6 выше, чем одного хлорина е6. Анализ времени жизни флуоресценции метаболического кофактора NADH после инкубации клеток с МС и хлорином е6 и после ФДТ с ними выявил наличие стресса, проявляемого как вытягивание облака флуоресценции NADH вдоль метаболической оси. После ФДТ с невысокими концентрациями МС происходит смещение облака флуоресценции NADH на фазорной диаграмме вправо, в сторону коротких времен жизни (ближе к анаэробному гликолизу по метаболической траектории NADH). ФДТ с МС и хлорином е6 приводит к смещению облака флуоресценции NADH на фазорной диаграмме влево, в сторону длинных времен жизни (ближе к окислительному фосфорилированию по метаболической траектории NADH), клетки при этом погибают в результате некроза.
Заключение. Совместное накопление МС в комбинации с хлорином е6 нарушает восстановление МС в бесцветную лейкоформу, при этом снижается потребление кислорода клетками, в результате чего становится возможным одновременно задействовать фотодинамические реакции I и II типа.
Введение
Опухолевое микроокружение состоит из опухолевых, иммунных и стромальных клеток, а также кровеносных сосудов и внеклеточного матрикса и представляет собой физиологическую среду, отличную от нормальных тканей, с низким содержанием кислорода, более низким pH, сосудистой аномалией, иммуносупрессивными свойствами и более высоким интерстициальным давлением [1]. Эффективность противоопухолевой терапии, в частности фотодинамической терапии (ФДТ), обратно пропорциональна степени гипоксии. Можно выделить два стратегических направления по преодолению гипоксии для дальнейшего проведения ФДТ: увеличение содержания кислорода в опухолевой ткани для кислород-зависимой ФДТ и использование кислород-независимой ФДТ с фотосенсибилизаторами, работающими по механизму I типа фотодинамических реакций [2]. Для увеличения концентрации кислорода в опухолевых тканях рассматривают такие подходы, как его экзогенная доставка, in situ генерация, уменьшение его потребления опухолевыми клетками и нормализация кровообращения в опухоли [3].
Клеточное дыхание является основным процессом потребления кислорода живыми клетками. Для получения энергии здоровые дифференцированные клетки в основном полагаются на окислительное фосфорилирование (OXPHOS) в митохондриях, в то время как опухолевые клетки задействуют аэробный гликолиз вместо OXPHOS даже в среде, обогащенной кислородом, что называется эффектом Варбурга [4]. Одновременное отключение путей энергоснабжения OXPHOS и гликолиза является наиболее прямой стратегией лечения рака [5, 6]. Ингибирование OXPHOS может уменьшить потребление кислорода клетками и этим увеличить его парциальное давление, снижая гипоксию и дополнительно усиливая эффект ФДТ [7, 8]. С другой стороны, ингибирование OXPHOS способствует усилению гликолиза, который обеспечивает опухоли быстрый синтез аденозинтрифосфата и рост. Кроме того, побочным продуктом гликолиза является лактат, который влияет на микроокружение опухоли и сигнальные пути [9, 10]. Ожидается выявление более сложных механизмов действия клинически доступных препаратов для ремоделирования микросреды гипоксии опухоли, что также может способствовать лечению гипоксии опухолей.
Другим подходом к преодолению ограничений в терапии, связанных с гипоксией, является использование фотосенсибилизаторов, работающих по I механизму фотодинамической реакции, например метиленового синего (МС). Это фенотиазиновый краситель, который используется в качестве антисептика и антидота. Однако влияние МС на клеточный метаболизм нетривиально. МС является окислительно-восстановительным агентом; в условиях острой митохондриальной дисфункции окислительно-восстановительные циклические свойства МС позволяют реактивировать OXPHOS и цикл Кребса через альтернативный путь окисления NADH [11, 12]. МС принимает электроны от восстановительных эквивалентов в митохондриях и передает их другим компонентам дыхательной цепи или молекулярному кислороду, обходя активность комплексов I, II, III электронно-транспортной цепи [13]. Ранее нами было показано, что МС может положительно влиять на оксигенацию на мышиной модели перевиваемой опухоли [14]. Однако при работе с МС имеются сложности: он склонен к образованию димеров при высокой концентрации и к переходу в бесцветную лейкоформу при гипоксии.
В настоящей работе проведено исследование фотодинамической активности МС и МС в комбинации с хлорином е6 на культуре клеток и оценен их эффект на клеточный метаболизм при совместном накоплении и последующем облучении. Идея одновременного применения двух фотосенсибилизаторов — I (МС) и II (хлорина е6) типов — интересна благодаря их разностороннему влиянию на клеточный метаболизм [15].
Хлорин е6 — фотосенсибилизатор II типа, генерирующий быстро утилизирующийся синглетный кислород 1О2. Как показывают недавние исследования, он оказывает ингибирующий эффект на цикл трикарбоновых кислот и, как следствие, на OXPHOS [16]. Предположительно хлорин е6 ингибирует цикл трикарбоновых кислот, в результате чего снижается количество восстановленных коферментов НАДН и ФАДH2, в виде которых запасается энергия окисления, выделяющаяся на разных стадиях цикла. При этом уменьшается скорость перехода МС в бесцветную фотонеактивную лейкоформу, что обусловлено восстановлением МС при взаимодействии с коферментом НАДН. Это усиливает эффект ФДТ I типа от МС, дополняя эффект от ФДТ II типа с хлорином е6. Чтобы подтвердить данную гипотезу, в настоящей работе выполнено исследование ФДТ с двумя фотосенсибилизаторами (МС и хлорином е6) на клеточных культурах.
Материалы и методы
Материалы. В работе использовали 0,35% раствор радахлорина (ООО «РАДА-ФАРМА», Россия) и 1% водный раствор метиленового синего (ОАО «Самарамедпром», Россия).
Культура клеток. Клетки эпителиоидной карциномы шейки матки HeLa культивировали в среде DMEM (Gibco, Thermo Fisher Scientifc, США) с добавлением 10% FBS (Gibco, США) и 1% раствора антибиотика/антимикотика (пенициллин/стрептомицин) (Corning, США) при 37°C и 5% CO2. Клетки пересевали с помощью 0,05% раствора трипсина (Gibco, США).
Исследование внутриклеточной продукции МС АФК. Клетки HeLa за сутки до эксперимента высевали на чашки для конфокальной микроскопии; в день эксперимента инкубировали с МС в концентрации 10 мг/кг в течение 1 ч. Затем добавляли флуоресцентный индикатор и исследовали влияние лазерного облучения с длиной волны 660 нм в дозе 30 Дж/см2 на образование продуктов фотохимических реакций in vivo по флуоресцентным изображениям клеток с помощью лазерного сканирующего конфокального инвертированного микроскопа LSM-710-NLO (Carl Zeiss, Германия).
Использовали индикатор АФК (перекись водорода H2O2, супероксид-анион O2−, гидроксильный радикал OH, гидропероксиды ROOH и пероксинитриты ONOO−) — 6-карбокси-2′,7′-дихлородигидрофлуоресцеин диацетат (6-Карбокси-H2DCFDA; ООО «Люмипроб РУС», Россия) в концентрации 1 мкм в среде, инкубируя его с клетками в течение 30 мин. 6-Карбокси-H2DCFDA возбуждали лазером с длиной волны 488 нм и детектировали флуоресценцию в диапазоне 510–580 нм.
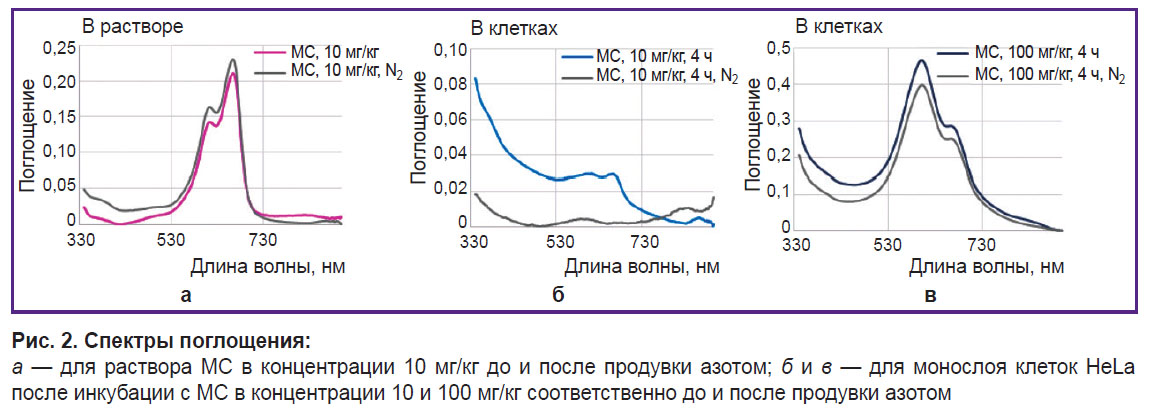
Исследование перехода МС в бесцветную восстановленную форму в условиях гипоксии при накоплении в клетках. Клетки HeLa за сутки до эксперимента высевали на чашку типа открытого культивирования для конфокальной микроскопии POCmini-2 Cell Cultivation System (PeCon GmbH, Германия). Клетки растили в полной питательной среде, затем добавляли МС в дозах 10 и 100 мг/кг на 4 ч. Перед измерениями спектров поглощения и микроскопированием клетки пятикратно отмывали от среды с МС. Чашку для конфокальной микроскопии из типа открытого культивирования с исследуемым монослоем клеток пересобирали в тип чашки закрытого культивирования с возможностью перфузии. Итоговый вариант чашки представлял собой два покровных стекла, разделенных 2 мм прокладкой, на одном из стекол находился монослой клеток. Чашку продували азотом в течение 10 мин, предварительно установив это время достаточным для полной дезоксигенации среды на образцах с эритроцитами, что подтверждалось спектроскопически по спектрам поглощения гемоглобина эритроцитов.
Спектры поглощения монослоя HeLa до и после инкубации с МС, до и после продувки азотом регистрировали при помощи спектрофотометра Hitachi U3400 (Hitachi, Япония) в диапазоне 350–900 нм. При помощи времяразрешенной флуоресцентной микроскопии (FLIM — fluorescence lifetime imaging microscopy) исследовали изменение клеточного дыхания по автофлуоресценции NADH и смотрели изменение времени жизни флуоресценции МС.
Исследование времени жизни флуоресценции NADH и МС. Для анализа типа клеточного дыхания по времени жизни флуоресценции NADH и уровня агрегации МС применяли FLIM. Автофлуоресценцию клеток регистрировали при двухфотонном возбуждении на длине волны 740 нм фемтосекундным лазером Chameleon Ultra II (Coherent, США) с использованием модуля FLIM (Becker & Hickl GmbH, Германия), подключенного к микроскопу LSM-710-NLO (Carl Zeiss, Германия). Модуль FLIM состоял из коррелированной по времени системы счета одиночных фотонов SPC-150, гибридного фотодетектора GaAsP HPM100-07 и программного обеспечения SPCM. Использовали объектив Plan-Apochromate 63x/1.4 Oil (Carl Zeiss, Германия). Для выделения сигналов флуоресценции от NADH применяли полосовой фильтр FB450-40 (Thorlabs, США). Флуоресцентные изображения с временным разрешением обрабатывали при помощи программного обеспечения SPCImage 8.0 (Becker & Hickl GmbH, Германия). Для интерпретации данных флуоресценции с временным разрешением применяли метод векторных диаграмм, где время жизни флуоресценции указывается в частотном представлении [17]. Для построения векторных диаграмм использовали библиотеки KernelDensity и Makie языка программирования Julia.
Внутриклеточное накопление МС и хлорина е6. Раствор МС или МС и хлорин е6 добавляли в культуральную среду до концентрации 1, 5, 10 и 20 мг/кг МС и 5 мг/кг хлорина е6, затем инкубировали при 37°C, 5% CO2 в течение часа. Интенсивность флуоресценции фотосенсибилизаторов в культуре анализировали при помощи лазерной сканирующей конфокальной микроскопии. МС и хлорин е6 возбуждали на длине волны 633 нм, флуоресценцию регистрировали в спектральном диапазоне 645–750 нм.
Исследование фотодинамического воздействия МС и хлорина е6 на клетки. Раствор МС или МС и хлорин е6 добавляли в культуральную среду до концентрации 1, 5, 10 и 20 мг/кг МС и 5 мг/кг хлорина е6, затем инкубировали при 37°C, 5% CO2 в течение часа. Фотодинамическое воздействие проводили путем возбуждения лазером с длиной волны 660 нм; плотность мощности составляла 100 мВт/см2. Облучение проводили в течение 10 мин, суммарная световая доза составила 60 Дж/см2. Интенсивность флуоресценции фотосенсибилизаторов в клетках оценивали до облучения, сразу после облучения и на следующий день после облучения при помощи лазерной сканирующей конфокальной микроскопии. На следующий день после облучения также проводили окрашивание акридиновым оранжевым и пропидием йодидом (АО/ПИ) с целью визуализировать живые/мертвые клетки.
Результаты
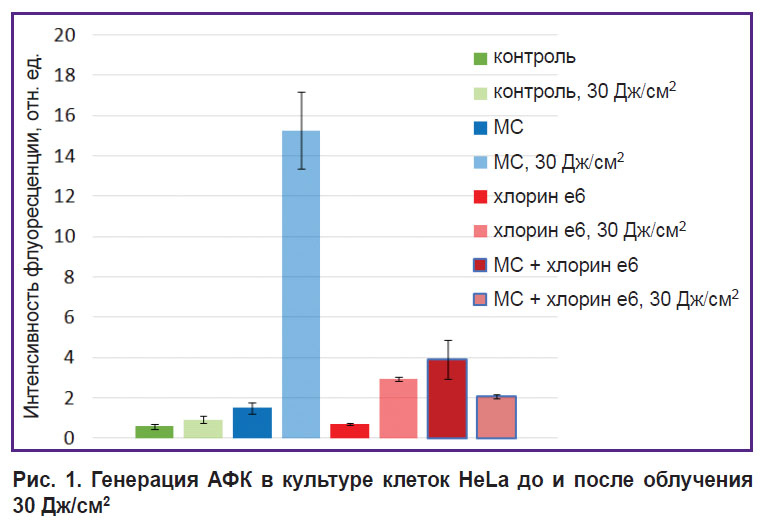
Фотохимические свойства МС в клетках. Исследования с использованием индикатора АФК — 6-Карбокси-H2DCFDA — выявили, что в результате добавления к клеткам МС происходит эффективная генерация АФК. Кроме того, ФДТ с МС приводит к усилению интенсивности флуоресценции МС внутри клеток (рис. 1).
|
Рис. 1. Генерация АФК в культуре клеток HeLa до и после облучения 30 Дж/см2 |
Скорость образования АФК при темновом накоплении МС, особенно в присутствии хлорина е6, существенна. Возможно, это связано с участием МС в цепи переноса электронов, комплексы I и II которой генерируют митохондриальные АФК [18]. Свойство МС в клетках генерировать АФК подтверждают данные работы [19] о склонности МС к фотодинамическим реакциям I типа, включающим перенос электрона и образование полувосстановленных и полуокисленных радикалов МС, что приводит к дальнейшему окислению биомолекул.
Образование агрегатов МС. При больших концентрациях МС происходит образование агрегатов, ведущее к изменению текучести мембран, в том числе мембран митохондрий, и к нарушению потенциала митохондрий. По литературным данным, при концентрации МС в воде ниже 3,4·10−5 М (эквивалентно 11,03 мг/кг) агрегация незначительна, в то время как при концентрации свыше 2,09·10−4 М (эквивалентно 66,85 мг/кг) происходит димерообразование [20]. Для исследования влияния агрегации мы использовали концентрации МС 10 и 100 мг/кг, предполагая, что в первом случае концентрация димерообразования ниже, а во втором случае она выше.
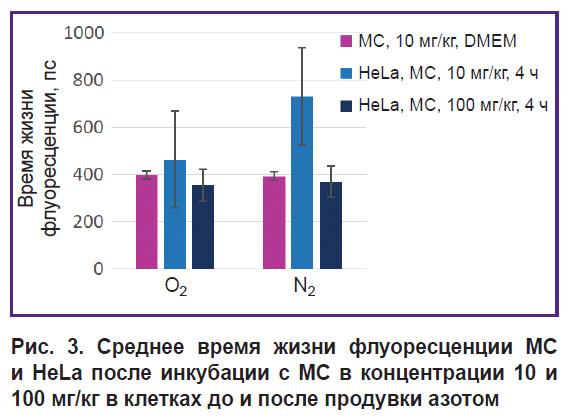
Спектры поглощения раствора МС при концентрации 10 мг/кг и монослоя HeLa после инкубации с МС в концентрациях 10 и 100 мг/кг до и после продувки азотом представлены на рис. 2, а, б, в соответственно, а время жизни флуоресценции — на рис. 3.
|
Рис. 3. Среднее время жизни флуоресценции МС и HeLa после инкубации с МС в концентрации 10 и 100 мг/кг в клетках до и после продувки азотом |
При невысоких концентрациях МС и дезоксигенации в клетках МС переходит в бесцветную лейкоформу. При высоких концентрациях МС-эффекта обесцвечивания не наблюдается. Возможно, это обусловлено тем, что, находясь в виде димеров, МС не участвует в окислительно-восстановительных реакциях клетки и поэтому не переходит в лейкоформу. Кроме того, высокая концентрация МС как окислительно-восстановительного циклера может приводить к истощению протонов, что также влияет на этот процесс.
Время жизни флуоресценции МС в растворе и внутри клеток различается только для концентрации 10 мг/кг в условиях нормального газообращения и при гипоксии. Согласно литературным данным [21], время жизни флуоресценции для мономеров МС составляет ~370 пс, а для димеров МС оно короче 20 пс. Несмотря на то, что при продувке азотом пик поглощения мономера МС в клетках после инкубации с МС в концентрации 10 мг/кг практически исчез, флуоресценция МС сохранилась, а ее время жизни выросло от 400 до 700 пс.
Результаты инкубации клеток с МС и хлорином е6. С целью исследования одновременного накопления МС и хлорина е6 клетки инкубировали в полной среде с МС в концентрации 1, 5, 10 и 20 мг/мл без и с хлорином е6 в концентрации 5 мг/мл при 37°C, 5% CO2 в течение часа.
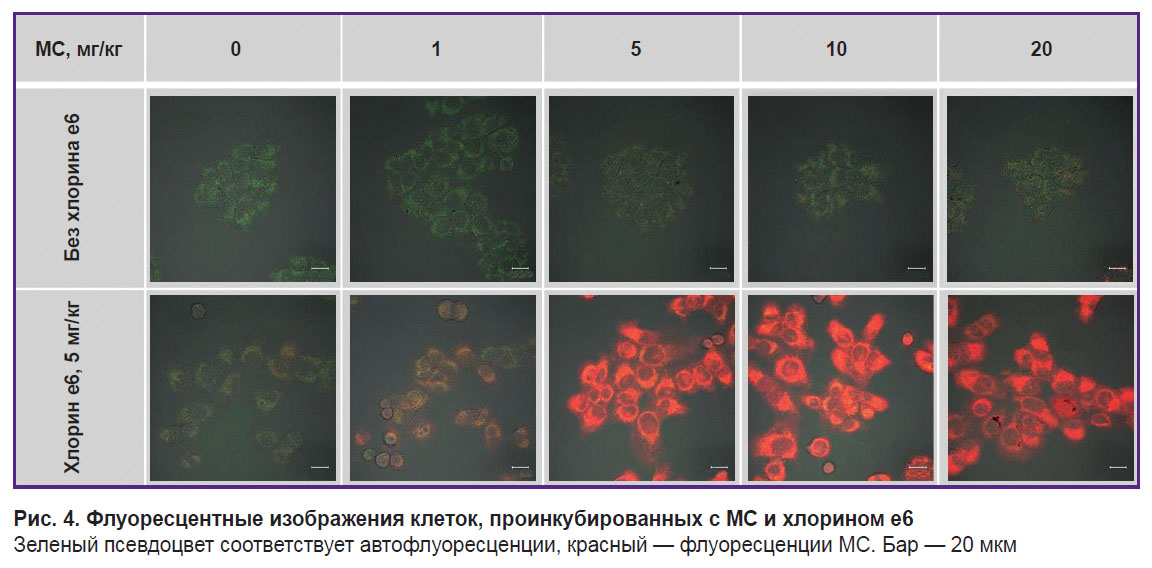
Инкубация клеток с одним МС в концентрации до 10 мг/кг не приводит к существенному увеличению его флуоресценции в клетках (рис. 4). Вероятно, при таких условиях МС в клетках переходит в фотодинамически неактивную лейкоформу. При концентрации МС 20 мг/кг в культуре выделяются отдельные клетки с интенсивной равномерной флуоресценцией МС. Такая неоднородность в накоплении МС по клеточной популяции может быть интерпретирована как критическое нарушение мембранной пластичности и мембранного потенциала клетки в целом в результате ее большей активности по накоплению МС, ведущей к образованию агрегатов.
|
Рис. 4. Флуоресцентные изображения клеток, проинкубированных с МС и хлорином е6
Зеленый псевдоцвет соответствует автофлуоресценции, красный — флуоресценции МС. Бар — 20 мкм |
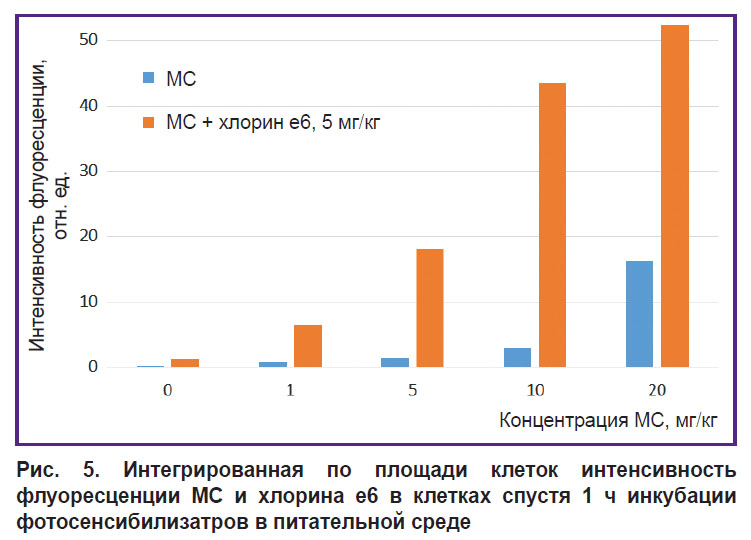
Инкубация клеток с МС одновременно с хлорином е6 приводит к большей флуоресценции МС внутри клеток по сравнению с инкубацией клеток только с МС (см. рис. 4; рис. 5). Предположительно хлорин е6 ингибирует цикл трикарбоновых кислот, что приводит к нарушению восстановления МС в лейкоформу. Кроме того, уменьшение перехода МС в лейкоформу может быть обусловлено низкоинтенсивным облучением во время сканирования, которое приводит к образованию АФК и обратному окислению лейкоформы в МС.
Фотодинамическое воздействие МС. Инкубацию клеток HeLa c МС (1, 5, 10 и 20 мг/мл) и хлорином е6 (5 мг/мл) проводили при 37°C, 5% CO2 в течение часа. Параметры ФДТ были следующими: 660 нм, 100 мВт/см2, 10 мин, 60 Дж/см2.
|
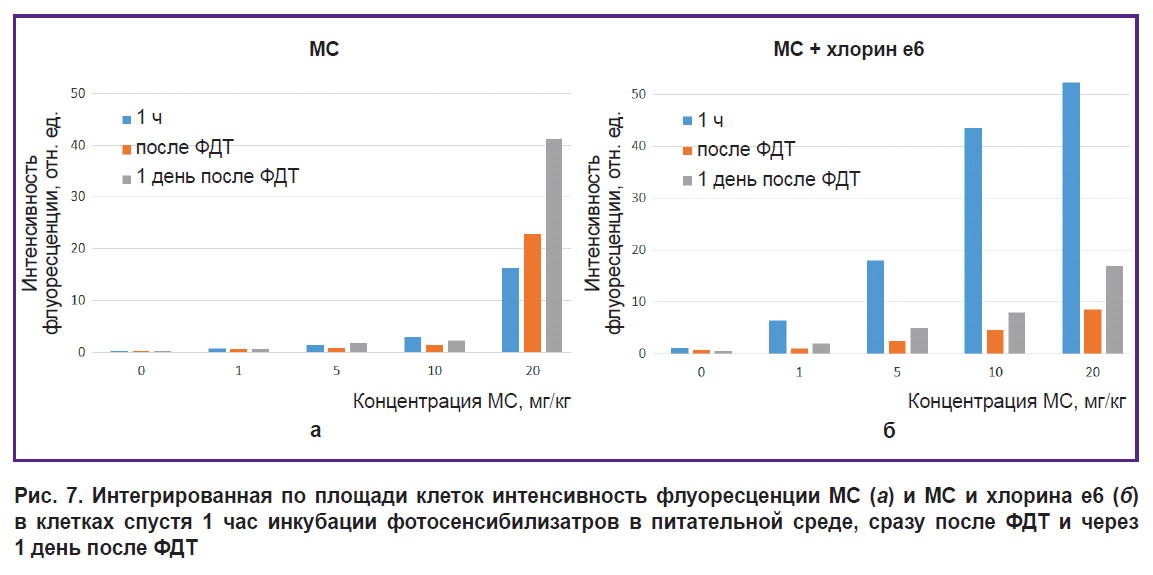
Рис. 5. Интегрированная по площади клеток интенсивность флуоресценции МС и хлорина е6 в клетках спустя 1 ч инкубации фотосенсибилизатров в питательной среде |
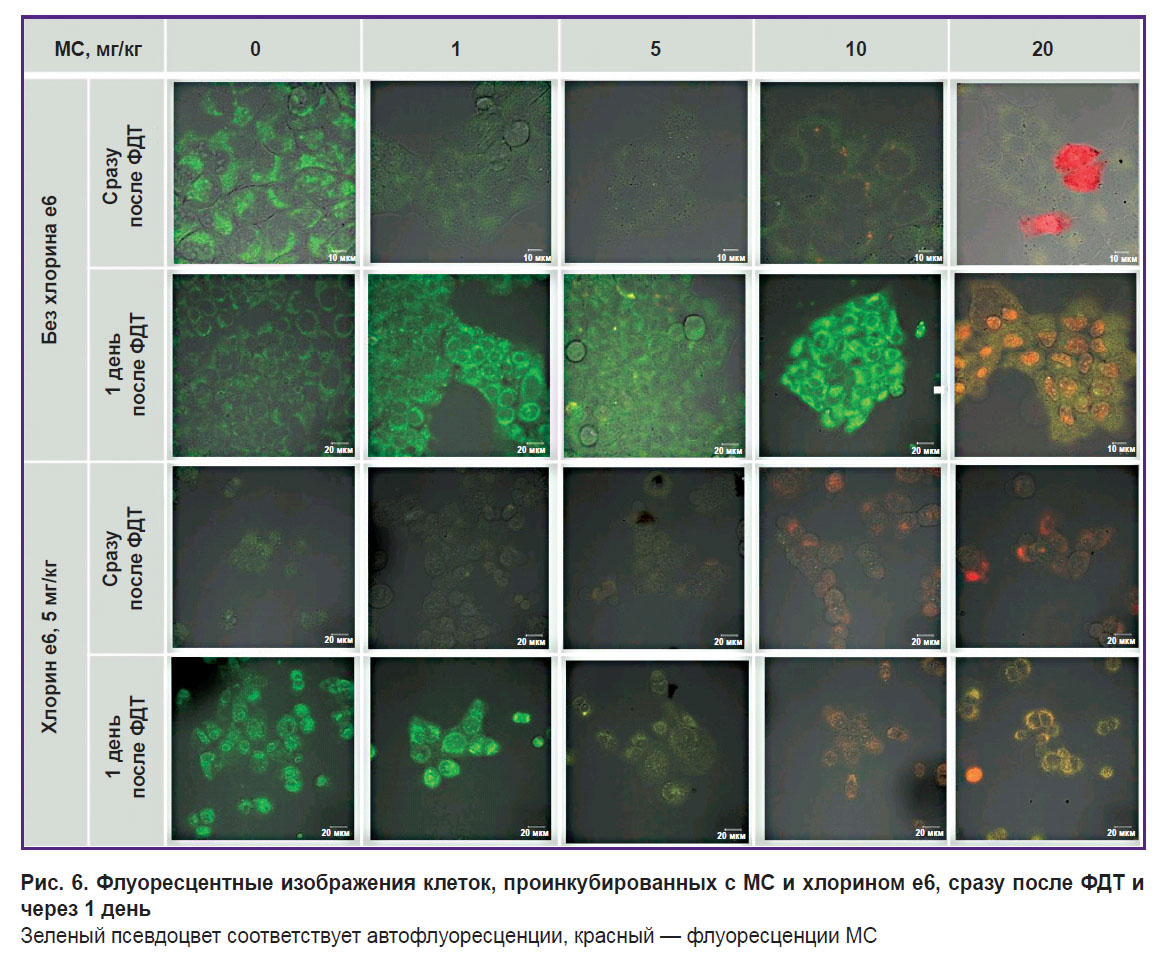
Все облученные клетки с МС и хлорином е6 потеряли флуоресценцию в красной области спектра (рис. 6 и 7). Снижение флуоресценции МС можно объяснить как фотообесцвечиванием, так и тем, что в результате ФДТ снижается содержание кислорода, отчего МС переходит в лейкоформу и не способен обратно оксилиться до МС из-за низкого содержания кислорода.
|
Рис. 6. Флуоресцентные изображения клеток, проинкубированных с МС и хлорином е6, сразу после ФДТ и через 1 день Зеленый псевдоцвет соответствует автофлуоресценции, красный — флуоресценции МС |
Интенсивность автофлуоресценции клеток, регистрируемая при возбуждении лазером с длиной волны 514 нм (флавины), свидетельствует о мощном окислительном стрессе через день после облучения. Особенно ярко выражено это явление при концентрации МС 1–10 мг/кг и для комбинации хлорина е6 с МС 0–1 мг/кг. При концентрации МС 20 мг/кг и для комбинации хлорина е6 с МС 5–20 мг/кг окислительный стресс еще сильнее и, вероятно, приводит к быстрому некрозу, поскольку не успевает выработаться ответная реакция.
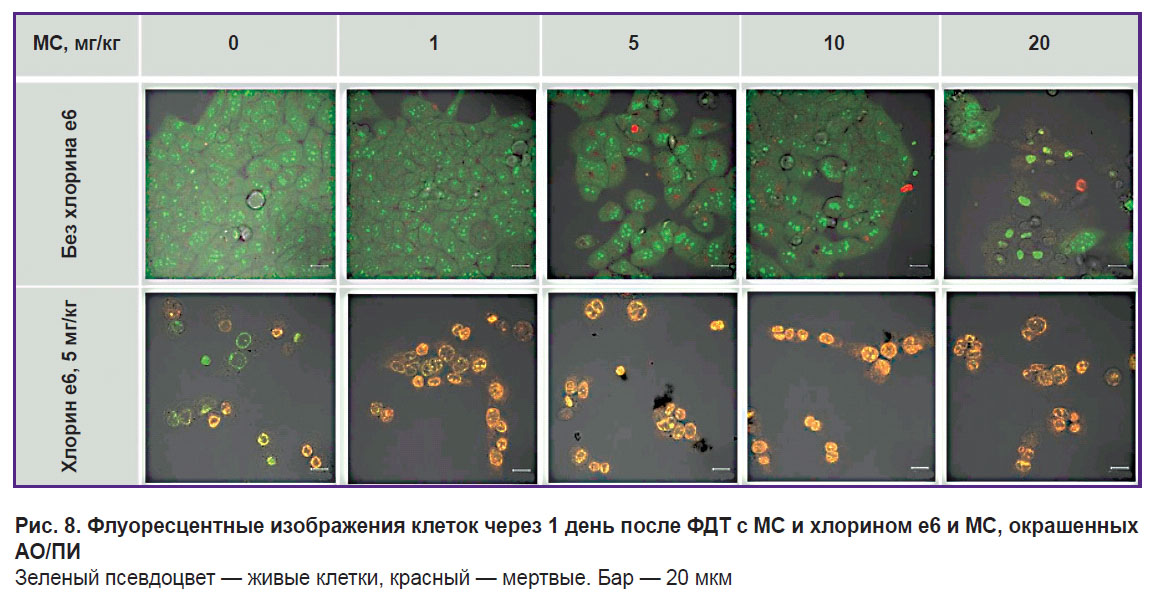
Концентрации МС 1–10 мг/кг и доза лазерного облучения 60 Дж/см2 не приводят к гибели клеток, вероятно, из-за перехода МС в фотодинамически неактивную лейкоформу. В результате ФДТ с МС в концентрации 20 мг/кг через сутки в клеточных ядрах наблюдается флуоресценция МС, а окрашивание АО/ПИ выявляет окрашивание ядер ПИ, что свидетельствует о гибели клеток. Для всех образцов с хлорином е6 и с МС 0–20 мг/кг доза 60 Дж/см2 приводит к гибели клеток после ФДТ (рис. 8). Интенсивность окрашивания ПИ ядер клеток в результате ФДТ с МС и хлорином е6 иллюстрирует, что совместная фототоксичность МС и хлорина е6 выше, чем одного хлорина е6.
|
Рис. 8. Флуоресцентные изображения клеток через 1 день после ФДТ с МС и хлорином е6 и МС, окрашенных АО/ПИ Зеленый псевдоцвет — живые клетки, красный — мертвые. Бар — 20 мкм |
FLIM-фазорные диаграммы для клеток после инкубации с фотосенсибилизаторами и после ФДТ. Проведен анализ времени жизни флуоресценции метаболического кофактора NADH после инкубации клеток с МС и хлорином е6 и после ФДТ с ними. Наша интерпретация облака точек времен жизни флуоресценции NADH на фазорной диаграмме опирается на существование «метаболической траектории», условной линии между точками 0,4 и 2,5 нс, где более короткие времена жизни соответствуют анаэробному гликолизу, более длинные — окислительному фосфорилированию [22, 23].
Изначально облако распределения времен жизни флуоресценции NADH для клеток HeLa при нормальных условиях инкубирования находилось в центре фазорной диаграммы на условной линии между 0,5 и 3,4 нс (рис. 9).
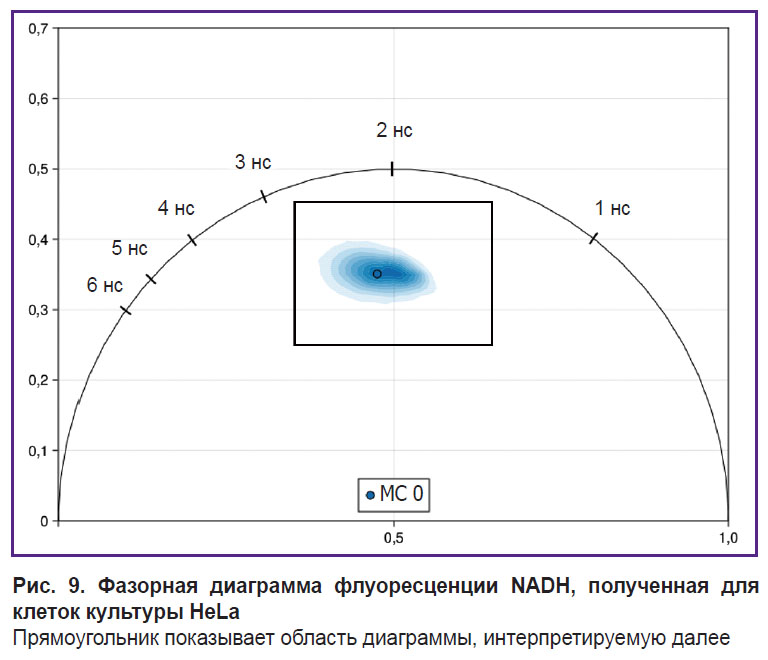
|
Рис. 9. Фазорная диаграмма флуоресценции NADH, полученная для клеток культуры HeLa
Прямоугольник показывает область диаграммы, интерпретируемую далее |
Для лучшей репрезентативности изменений далее будет приведен центральный участок фазорных диаграмм, заключающий основной сигнал — 0,35–0,65 G (ось Х) и 0,25–0,45 S (ось Y) (см. рис. 9).
Клеточный стресс от инкубации с высокими концентрациями МС (10–20 мг/кг) и МС (1–20 г/кг) одновременно с хлорином е6 приводит к нарушению мембранного потенциала в первом случае и ингибированию цикла трикарбновых кислот во втором, однако на фазорной диаграмме это отображается как незначительное вытягивание облака флуоресценции NADH вдоль метаболической оси (рис. 10).

|
Рис. 10. Фазорные диаграммы флуоресценции NADH, полученные для клеток культуры HeLa, проинкубированных с МС и МС с хлорином е6 в течение часа, сразу и через 1 день после фотодинамического воздействия |
Фотодинамическая терапия истощает уровень кислорода, что ведет к нарушению нормального клеточного метаболизма. Так, после ФДТ с невысокими концентрациями МС ожидался незначительный уровень гипоксии и окислительного стресса. В этом случае происходит смещение облака флуоресценции NADH на фазорной диаграмме вправо, в сторону коротких времен жизни (ближе к анаэробному гликолизу по метаболической траектории NADH).
Однако острая гипоксия после ФДТ с МС и хлорином е6 приводит к смещению облака флуоресценции NADH на фазорной диаграмме влево, в сторону длинных времен жизни (ближе к окислительному фосфорилированию по метаболической траектории NADH), клетки при этом погибают в результате некроза. Через сутки после ФДТ с гибелью клеток, подтвержденной окрашиванием АО/ПИ, происходит округление облака флуоресценции NADH на фазорной диаграмме с небольшим смещением его в сторону анаэробного гликолиза.
Обсуждение
Использование фотосенсибилизаторов для подавления OXPHOS с целью уменьшить потребление опухолевыми клетками кислорода на время ФДТ является многообещающим терапевтическим подходом. Амфифильный хлорин e6 преимущественно связывается с холинсодержащими головными группами фосфолипидных областей [24–26]. Есть данные систематического исследования [27] метаболического профиля клеток HeLa в течение темнового периода инкубации с фотосенсибилизаторами хлоринового ряда при помощи спектроскопии ядерного магнитного резонанса. Так, установлено, что хлорин е4 оказывает ингибирующее токсическое действие на цикл трикарбоновых кислот и метаболизм фосфатидилхолина. При этом метаболические изменения в клетках интерпретируются как стимуляция защитных механизмов против нефизиологического порфиринового ксенобиотика.
Исследования цитотоксических эффектов МС в клетках показали связь с повреждением митохондрий. На суспензиях митохондрий продемонстрировано, что МС активно с ними связывается и проникает в матрикс, стимулируемый протонным потенциалом митохондрий. Однако большее накопление MС происходит в митохондриях с повышенным протонным потенциалом, далее это приводит к восстановлению MС до фотохимически неактивной лейкоформы и к образованию димеров MС [28].
Окислительный стресс и АФК играют центральную роль во многих физиологических и патофизиологических процессах. Метаболомные методы, такие как целевая жидкостная хроматография–тандемная масс-спектрометрия (ЖХ-МС/МС), используются для количественной оценки специфических метаболитов, включая глутатион, который непосредственно участвует в окислительно-восстановительном гомеостазе. Нецелевая метаболомика дает всесторонний обзор метаболических изменений, вызванных окислительным стрессом, и может предоставить потенциальные биомаркеры рака [29]. Корреляционная визуализация позволяет визуализировать изменения в метаболизме (предоставляя абсолютные количества для >100 метаболитов, включая цикл трикарбоновых кислот, пентозофосфатный путь, метаболизм пуринов, метаболизм глутатиона, метаболизм цистеина и метионина, гликолиз и глюконеогенез) при одновременной микроскопии живых клеток [30]. На примере при кратковременном воздействии перекиси водорода in vitro показана морфологическая и метаболическая адаптация раковых клеток. Еще одним методом метаболического профилирования является использование метаболических ингибиторов или определение активности ферментов путем добавления высоких концентраций субстратов. Существует метод детального анализа метаболического профилирования в гетерогенных популяциях клеток с помощью проточной цитометрии SCENITH [31]. С другой стороны, есть FLIM — быстрый, неразрушающий метод, позволяющий изучать экзогенные и эндогенные флуорофоры, что обеспечивает высокое пространственное и временное разрешение для визуализации типов клеток, клеточных культур и биопсий in vitro и in vivo [32]. Мы исследовали уровень флуоресценции эндогенного метаболита NADH в связанной и свободной формах. Поскольку абсолютное количество связанного с белком NADH относительно стабильно, соотношение свободного (короткое время жизни) к связанному с белком (длительное время жизни) NADH совпадает с окислительно-восстановительным состоянием NADH, как и среднее время жизни NADH. Сдвиг клеточного метаболизма в сторону гликолиза и/или снижение митохондриального дыхания сопровождаются увеличением интенсивности автофлуоресценции NADH и сокращением времени его жизни, что отражается в повышении метаболического индекса NADH (отношение a1/a2). Обратные изменения указывают на восстановление митохондриальной активности. Несмотря на то, что за время облучения образцов с хлорином е6 происходят дезоксигенация, сильный окислительный стресс, а затем и гибель клеток, масштабных изменений во времени жизни флуоресценции NADH нам зафиксировать не удалось. Возможно, клетке необходимо время, чтобы перестроить пропорции метаболитов под происходящие изменения, а его у нее не было. Так, например, есть данные, что при длительном окислительном стрессе могут накапливаться продукты окисления липидов, флуоресцирующие в спектральном диапазоне NADH, со временем жизни флуоресценции 7,8 нс [33]. Кроме того, клетки в условиях гипоксии меняют активность ферментов, связанных с NADH, что должно сказаться на изменении длительной компоненты времени жизни флуоресценции NADH. При гипоксии уровень активности лактатдегидрогеназы повышается более чем десятикратно по сравнению с условиями нормоксии [34]. Время жизни флуоресценции NADH при связывании с лактатдегидрогеназой составляет 1,6 нс [35]. Вытягивание облака флуоресценции на фазорной диаграмме в сторону связанного с лактатдегидрогеназой NADH (1,6 нс), с одной стороны, и к продуктам окисления липидов (7,8 нс) — с другой, должно было бы развернуть его поперек метаболической траектории, но в наших экспериментах такого не наблюдается.
Тем не менее накопление клетками МС одновременно с хлорином е6 приводит к внутриклеточным изменениям, отражающимся в способности МС восстанавливаться в лейкоформу, а последующее облучение обусловливает более быструю клеточную гибель, чем если использовать один фотосенсибилизатор.
Заключение
Исследовано влияние фотосенсибилизаторов МС и МС в комбинации с хлорином е6 на клеточный метаболизм при совместном накоплении и последующем облучении. Идея их одновременного применения заключалась в ингибировании цикла трикарбоновых кислот хлорином е6 и, как следствие, ингибировании OXPHOS. При этом снижается потребление кислорода клетками, а также нарушается восстановление МС в бесцветную лейкоформу, что позволяет одновременно активировать фотодинамические реакции I и II типа. Нами показано, что при совместном накоплении уменьшается скорость перехода МС в бесцветную фотонеактивную лейкоформу и усиливается эффект ФДТ I типа от МС, дополняя эффект от ФДТ II типа с хлорином е6.
Финансирование. Работа выполнена при финансовой поддержке гранта Российского научного фонда №22-72-10117 («Разработка методов контроля оксигенации опухолей и повышения эффективности фотодинамической терапии при помощи метиленового синего»).
Конфликт интересов отсутствует.
Литература
- Du J., Shi T., Long S., Chen P., Sun W., Fan J., Peng X. Enhanced photodynamic therapy for overcoming tumor hypoxia: from microenvironment regulation to photosensitizer innovation. Coordination Chemistry Reviews 2021; 427: 213604, https://doi.org/10.1016/j.ccr.2020.213604.
- Wan Y., Fu L.H., Li C., Lin J., Huang P. Conquering the hypoxia limitation for photodynamic therapy. Adv Mater 2021; 33(48): e2103978, https://doi.org/10.1002/adma.202103978.
- Li X., Chen L., Huang M., Zeng S., Zheng J., Peng S., Wang Y., Cheng H., Li S. Innovative strategies for photodynamic therapy against hypoxic tumor. Asian J Pharm Sci 2023; 18(1): 100775, https://doi.org/10.1016/j.ajps.2023.100775.
- Vander Heiden M.G., Cantley L.C., Thompson C.B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science 2009; 324(5930): 1029–1033, https://doi.org/10.1126/science.1160809.
- Su Y., Lu K., Huang Y., Zhang J., Sun X., Peng J., Zhou Y., Zhao L. Targeting Warburg effect to rescue the suffocated photodynamic therapy: a cancer-specific solution. Biomaterials 2023; 294: 122017, https://doi.org/10.1016/j.biomaterials.2023.122017.
- Gao F., Dong J.H., Xue C., Lu X.X., Cai Y., Tang Z.Y., Ou C.J. Tumor-targeting multiple metabolic regulations for bursting antitumor efficacy of chemodynamic therapy. Small 2024; 20(26): e2310248, https://doi.org/10.1002/smll.202310248.
- Yuan P., Deng F.A., Liu Y.B., Zheng R.R., Rao X.N., Qiu X.Z., Zhang D.W., Yu X.Y., Cheng H., Li S.Y. Mitochondria targeted O2 economizer to alleviate tumor hypoxia for enhanced photodynamic therapy. Adv Healthc Mater 2021; 10(12): e2100198, https://doi.org/10.1002/adhm.202100198.
- Chen Q., Chen J., Liang C., Feng L., Dong Z., Song X., Song G., Liu Z. Drug-induced co-assembly of albumin/catalase as smart nano-theranostics for deep intra-tumoral penetration, hypoxia relieve, and synergistic combination therapy. J Control Release 2017; 263: 79–89, https://doi.org/10.1016/j.jconrel.2016.11.006.
- Colegio O.R., Chu N.Q., Szabo A.L., Chu T., Rhebergen A.M., Jairam V., Cyrus N., Brokowski C.E., Eisenbarth S.C., Phillips G.M., Cline G.W., Phillips A.J., Medzhitov R. Functional polarization of tumour-associated macrophages by tumour-derived lactic acid. Nature 2014; 513(7519): 559–563, https://doi.org/10.1038/nature13490.
- Huber V., Camisaschi C., Berzi A., Ferro S., Lugini L., Triulzi T., Tuccitto A., Tagliabue E., Castelli C., Rivoltini L. Cancer acidity: an ultimate frontier of tumor immune escape and a novel target of immunomodulation. Semin Cancer Biol 2017; 43: 74–89, https://doi.org/10.1016/j.semcancer.2017.03.001.
- Jiang H., Jedoui M., Ye J. The Warburg effect drives dedifferentiation through epigenetic reprogramming. Cancer Biol Med 2024; 20(12): 891–897, https://doi.org/10.20892/j.issn.2095-3941.2023.0467.
- Komlódi T., Tretter L. Methylene blue stimulates substrate-level phosphorylation catalysed by succinyl-CoA ligase in the citric acid cycle. Neuropharmacology 2017; 123: 287–298, https://doi.org/10.1016/j.neuropharm.2017.05.009.
- Xue H., Thaivalappil A., Cao K. The potentials of methylene blue as an anti-aging drug. Cells 2021; 10(12): 3379, https://doi.org/10.3390/cells10123379.
- Pominova D., Ryabova A., Skobeltsin A., Markova I., Linkov K., Romanishkin I. The use of methylene blue to control the tumor oxygenation level. Photodiagnosis Photodyn Ther 2024; 46: 104047, https://doi.org/10.1016/j.pdpdt.2024.104047.
- Bouillaud F., Ransy C., Moreau M., Benhaim J., Lombès A., Haouzi P. Methylene blue induced O2 consumption is not dependent on mitochondrial oxidative phosphorylation: implications for salvage pathways during acute mitochondrial poisoning. Respir Physiol Neurobiol 2022; 304: 103939, https://doi.org/10.1016/j.resp.2022.103939.
- Balcerczyk A., Damblon C., Elena-Herrmann B., Panthu B., Rautureau G.J.P. Metabolomic approaches to study chemical exposure-related metabolism alterations in mammalian cell cultures. Int J Mol Sci 2020; 21(18): 6843, https://doi.org/10.3390/ijms21186843.
- Ranjit S., Malacrida L., Jameson D.M., Gratton E. Fit-free analysis of fluorescence lifetime imaging data using the phasor approach. Nat Protoc 2018; 13(9): 1979–2004, https://doi.org/10.1038/s41596-018-0026-5.
- Alhayaza R., Haque E., Karbasiafshar C., Sellke F.W., Abid M.R. The relationship between reactive oxygen species and endothelial cell metabolism. Front Chem 2020; 8: 592688, https://doi.org/10.3389/fchem.2020.592688.
- Junqueira H.C., Severino D., Dias L.G., Gugliotti M.S., Baptista M.S. Modulation of methylene blue photochemical properties based on adsorption at aqueous micelle interfaces. PCCP 2002; 11: 2320–2328, https://doi.org/10.1039/b109753a.
- Fernández-Pérez A., Marbán G. Visible light spectroscopic analysis of methylene blue in water; what comes after dimer? ACS Omega 2020; 5(46): 29801–29815, https://doi.org/10.1021/acsomega.0c03830.
- Dean J.C., Oblinsky D.G., Rather S.R., Scholes G.D. Methylene blue exciton states steer nonradiative relaxation: ultrafast spectroscopy of methylene blue dimer. J Phys Chem B 2016; 120(3): 440–454, https://doi.org/10.1021/acs.jpcb.5b11847.
- Kalinina S., Freymueller C., Naskar N., von Einem B., Reess K., Sroka R., Rueck A. Bioenergetic alterations of metabolic redox coenzymes as NADH, FAD and FMN by means of fluorescence lifetime imaging techniques. Int J Mol Sci 2021; 22(11): 5952, https://doi.org/10.3390/ijms22115952.
- Ranjit S., Malacrida L., Stakic M., Gratton E. Determination of the metabolic index using the fluorescence lifetime of free and bound nicotinamide adenine dinucleotide using the phasor approach. J Biophotonics 2019; 12(11): e201900156, https://doi.org/10.1002/jbio.201900156.
- Vermathen M., Vermathen P., Simonis U., Bigler P. Time-dependent interactions of the two porphyrinic compounds chlorin e6 and mono-L-aspartyl-chlorin e6 with phospholipid vesicles probed by NMR spectroscopy. Langmuir 2008; 24(21): 12521–12533, https://doi.org/10.1021/la802040v.
- Vermathen M., Marzorati M., Vermathen P., Bigler P. pH-dependent distribution of chlorin e6 derivatives across phospholipid bilayers probed by NMR spectroscopy. Langmuir 2010; 26(13): 11085–11094, https://doi.org/10.1021/la100679y.
- Marzorati M., Bigler P., Vermathen M. Interactions between selected photosensitizers and model membranes: an NMR classification. Biochim Biophys Acta 2011; 1808(6): 1661–1672, https://doi.org/10.1016/j.bbamem.2011.02.011.
- Vermathen M., Kämpfer T., Nuoffer J.M., Vermathen P. intracellular fate of the photosensitizer chlorin e4 with different carriers and induced metabolic changes studied by 1H NMR spectroscopy. Pharmaceutics 2023; 15(9): 2324, https://doi.org/10.3390/pharmaceutics15092324.
- Gabrielli D., Belisle E., Severino D., Kowaltowski A.J., Baptista M.S. Binding, aggregation and photochemical properties of methylene blue in mitochondrial suspensions. Photochem Photobiol 2004; 79(3): 227–232, https://doi.org/10.1562/be-03-27.1.
- Iqbal M.J., Kabeer A., Abbas Z., Siddiqui H.A., Calina D., Sharifi-Rad J., Cho W.C. Interplay of oxidative stress, cellular communication and signaling pathways in cancer. Cell Commun Signal 2024; 22(1): 7, https://doi.org/10.1186/s12964-023-01398-5.
- Rusz M., Del Favero G., El Abiead Y., Gerner C., Keppler B.K., Jakupec M.A., Koellensperger G. Morpho-metabotyping the oxidative stress response. Sci Rep 2021; 11(1): 15471, https://doi.org/10.1038/s41598-021-94585-8.
- Argüello R.J., Combes A.J., Char R., Gigan J.P., Baaziz A.I., Bousiquot E., Camosseto V., Samad B., Tsui J., Yan P., Boissonneau S., Figarella-Branger D., Gatti E., Tabouret E., Krummel M.F., Pierre P. SCENITH: a flow cytometry-based method to functionally profile energy metabolism with single-cell resolution. Cell Metab 2020; 32(6): 1063–1075.e7, https://doi.org/10.1016/j.cmet.2020.11.007.
- Miskolci V., Tweed K.E., Lasarev M.R., Britt E.C., Walsh A.J., Zimmerman L.J., McDougal C.E., Cronan M.R., Fan J., Sauer J.D., Skala M.C., Huttenlocher A. In vivo fluorescence lifetime imaging of macrophage intracellular metabolism during wound responses in zebrafish. Elife 2022; 11: e66080, https://doi.org/10.7554/eLife.66080.
- Datta R., Alfonso-García A., Cinco R., Gratton E. Fluorescence lifetime imaging of endogenous biomarker of oxidative stress. Sci Rep 2015; 5: 9848, https://doi.org/10.1038/srep09848.
- Shi D.Y., Xie F.Z., Zhai C., Stern J.S., Liu Y., Liu S.L. The role of cellular oxidative stress in regulating glycolysis energy metabolism in hepatoma cells. Mol Cancer 2009; 8: 32, https://doi.org/10.1186/1476-4598-8-32.
- Leben R., Köhler M., Radbruch H., Hauser A.E., Niesner R.A. Systematic enzyme mapping of cellular metabolism by phasor-analyzed label-free NAD(P)H fluorescence lifetime imaging. Int J Mol Sci 2019; 20(22): 5565, https://doi.org/10.3390/ijms20225565.