Редокс-чувствительные флуоресцентные наночастицы для биовизуализации злокачественных новообразований
Использование флуоресцентных редокс-чувствительных наночастиц в современной биомедицине обеспечивает высокую чувствительность и точность в биовизуализации. Наночастицы интересны тем, что способны долго циркулировать в крови, где уровень глутатиона относительно низкий, и разрушаться в клетках опухоли, высвобождая загруженные красители или лекарства.
Цель исследования — разработка новых наночастиц на основе тритиоциануровой кислоты для биовизуализации злокачественных новообразований и изучение их возможностей.
Материалы и методы. Наночастицы были получены путем поликонденсации тритиоциануровой кислоты с помощью йода. Для их характеризации использовали сканирующую и просвечивающую электронную микроскопию, загрузку флуоресцентных красителей оценивали спектрофотометрически. Влияние наночастиц на жизнеспособность клеточных линий 4Т1 и A549, а также взаимодействие их с клетками изучали с помощью конфокальной лазерной сканирующей микроскопии. Распределение наночастиц в тканях и органах модельных мышей BALB/c с привитой опухолью проводили методом флуоресцентной визуализации.
Результаты. Размер синтезированных частиц, по данным сканирующей микроскопии, составил 100±20 нм. Изотерма адсорбции показала, что возможно достижение адсорбции 0,27 мг флуоресцентного красителя RhB на 1 мг наночастиц. Продемонстрировано усиленное высвобождение запакованного флуоресцентного красителя в присутствии глутатиона и ацетилцистеина. Частицы не оказали значимого влияния на жизнеспособность клеток 4Т1 и А549. После интратуморального введения они обеспечили более интенсивный флуоресцентный сигнал в зоне опухоли по сравнению с простым раствором флуоресцентного красителя.
Заключение. Разработанная система наночастиц на основе тритиоциануровой кислоты продемонстрировала высокую эффективность для применения в биовизуализации злокачественных новообразований и потенциально — в целевой доставке терапевтических агентов.
Введение
Флуоресцентные наночастицы занимают важное место в современной биомедицине благодаря своей способности обеспечивать высокую чувствительность и точность в биовизуализации [1]. Они активно применяются для изучения клеточных структур [2], отслеживания биомолекул [3], доставки лекарств [4, 5] и диагностики опухолей [6]. Особое значение использование наночастиц приобретает при биовизуализации опухолевых тканей. Они могут определять границы опухолей во время хирургических вмешательств, что позволяет хирургу более точно удалять опухолевую ткань, минимизируя повреждения здоровых участков [7–9]. Для более эффективной реализации этой задачи важно, чтобы наночастицы обладали селективностью к опухолевым тканям и удерживались в них продолжительное время [10].
На сегодняшний день в биовизуализации применяются различные типы наночастиц, включая квантовые точки [11], золотые наночастицы [12], магнитные наночастицы на основе оксида железа [13], углеродные точки [14] и наночастицы редкоземельных элементов [15]. Помимо них особый интерес представляют органические наночастицы, которые могут быть функционализированы флуоресцентными красителями ближнего инфракрасного диапазона [16]. Среди органических наночастиц значительно меньше исследованы редокс-чувствительные системы, которые обладают уникальными преимуществами.
Редокс-чувствительные наночастицы интересны тем, что способны долго циркулировать в крови, где уровень глутатиона относительно низкий, и разрушаться в клетках опухоли, высвобождая загруженные красители или лекарства [17]. Такое свойство позволяет использовать эти частицы для целевой доставки терапевтических агентов и для усиленной визуализации опухолевых клеток. Тем не менее, несмотря на перспективность применения, количество исследований, направленных на изучение редокс-чувствительных наночастиц для биовизуализации, остается ограниченным.
Для разработки таких наночастиц с улучшенными свойствами большое значение имеет исследование новых материалов, обладающих уникальной химической структурой и функциональностью. В настоящей работе в качестве основы для создания наночастиц выбрана тритиоциануровая кислота (ТТЦК). Ее структура включает дисульфидные группы, что обеспечивает редокс-чувствительность, а также позволяет создавать стабильные органические наночастицы. На сегодняшний день ТТЦК еще не использовалась при создании наночастиц для биовизуализации.
Цель исследования — синтез, характеризация и изучение действия наночастиц на основе ТТЦК.
Оценены способность наночастиц удерживать и высвобождать флуоресцентные агенты, а также возможности их накопления в опухолевых тканях.
Данное исследование призвано способствовать расширению знаний о применении новых материалов в биомедицине, что открывает перспективы создания более эффективных систем для диагностики и терапии опухолей.
Материалы и методы
Синтез наночастиц. Для синтеза наночастиц использовали следующие реактивы производства Sigma-Aldrich, США без дополнительной очистки: гидрат ТТЦК натриевой соли (98%), полиэтиленгликоль диглицидиловый эфир (ПЭГДЭ, %), йод (I2, 99%) и йодид натрия (NaI).
Сначала приготовляли 0,155 М раствор I2 в 0,3875 М водном растворе NaI, обеспечивая молярное соотношение I2:NaI, равное 1:2,5. Затем 345 мкл 0,155 М раствора ПЭГДЭ смешивали с 60 мкл свежеприготовленного 2 М раствора ТТЦК и к полученному раствору добавляли 2107 мкл деионизированной воды. Раствор перемешивали в течение 10 мин. Заранее приготовленный 0,155 М раствор I2 в растворе NaI добавляли к раствору ТТЦК порциями (всего 5 порций) с интервалом 10 с при интенсивном перемешивании (700 об./мин). После дополнительного перемешивания в течение 10 мин новая смесь приобретала бледно-белый цвет. На этом процесс синтеза завершался, а полученные наночастицы центрифугировали при 14 000 об./мин в течение 5 мин и промывали дважды водой.
Характеризация наночастиц. Гидродинамический радиус синтезированных наночастиц был определен с использованием анализатора Zetasizer Nano ZS90 (Malvern, США), оснащенного He-Ne-лазером мощностью 4,0 мВт и c длиной волны 633 нм. Для проведения измерений 100 мкл синтезированного раствора наночастиц разводили в 1 мл деионизированной воды, после чего измерения проводили в кюветах объемом 40 мкл.
Синтезированные наночастицы TTЦК были исследованы методом сканирующей электронной микроскопии (СЭМ), выполненной на сканирующем электронном микроскопе TESCAN MIRA 3 (Tescan, Чехия) с ускоряющим напряжением 0,5–30,0 кэВ. За день до измерений 2 мкл суспензии наночастиц TTЦК в воде наносили на кремниевую подложку и оставляли до полного высыхания.
С помощью просвечивающей электронной микроскопии (ПЭМ) получены изображения наночастиц с использованием микроскопа Tecnai G2 F20 X-TWIN (FEI, Нидерланды), оснащенного CCD-камерой Gatan Orius (Gatan Inc., США). Измерения проводили в режиме светлого поля при ускоряющем напряжении 200 кВ.
Загрузка флуоресцентного красителя. В качестве модельного флуоресцентного красителя использовали родамин Б (RhB). Для адсорбции красителя 0,75 мг наночастиц ТТЦК смешивали с 100 мкл водного раствора красителя с различной концентрацией (0,25; 0,50; 0,75; 1,0) и разводили водой до объема 1 мл. Затем полученные растворы перемешивали в течение 30 мин и центрифугировали в течение 5 мин при 14 000 об./мин. Остаточный супернатант, содержащий неабсорбированный краситель RhB, измеряли спектрофотометрически при длине волны 552 нм. Для расчета количества (в процентах) адсорбированного красителя RhB использовали абсорбцию супернатанта чистых наночастиц ТТЦК в качестве фона.
Для оценки десорбции и высвобождения загруженного флуоресцентного красителя в разных растворах 0,5 мг наночастиц ТТЦК с адсорбированным RhB разводили отдельно в 1 мл воды, диметилсульфоксида (ДМСО), 95% этилового спирта, 250 мМ ацетилцистеина или 250 мМ глутатиона и перемешивали в течение 60 мин. Затем наночастицы центрифугировали в течение 5 мин при 14 000 об./мин. Количество красителя RhB, высвобожденного из наночастиц в супернатант, определяли спектрофотометрически по его поглощению при длине волны 552 нм. Для расчета количества (в процентах) высвобожденного RhB использовали абсорбцию супернатанта наночастиц ТТЦК, инкубированных в соответствующем растворителе, в качестве фона.
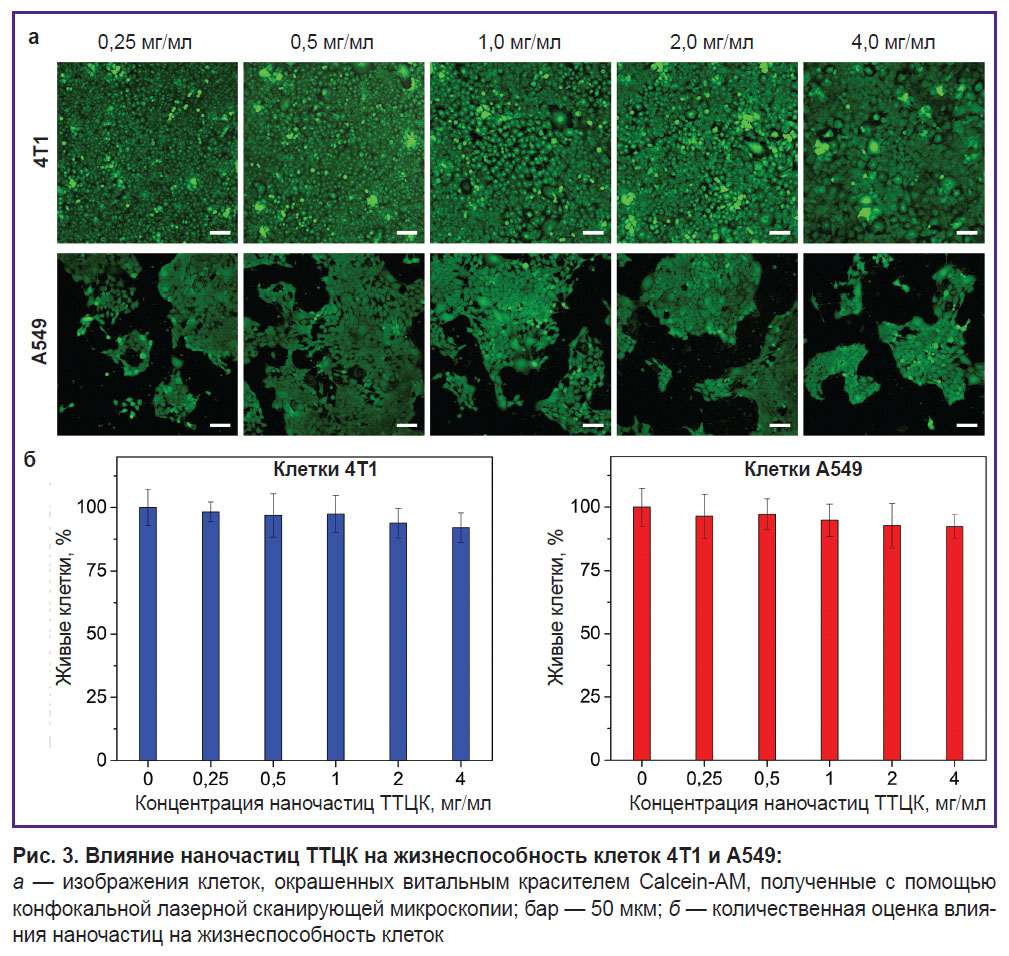
Оценка влияния наночастиц на жизнеспособность клеток. Для оценки влияния наночастиц ТТЦК на жизнеспособность клеточных культур 4T1 и A549 клетки высевали в 96-луночные планшеты в количестве 5,0∙105 клеток на лунку. Через два дня к клеткам добавляли наночастицы ТТЦК в конечных концентрациях 0,25; 0,5; 1; 2 и 4 мг/мл (в 200 мкл среды). Затем клетки инкубировали на протяжении 48 ч. По истечении этого времени живые клетки окрашивали витальным красителем Calcein-AM. Образцы дважды промывали буферным раствором PBS, после чего добавляли 10 мМ раствор Calcein-AM в 200 мкл PBS. Через 15 мин окрашенные клетки визуализировали с помощью конфокального лазерного сканирующего микроскопа Zeiss LSM 710 (Carl Zeiss, Германия). Изображения получали с использованием объектива с увеличением 10.
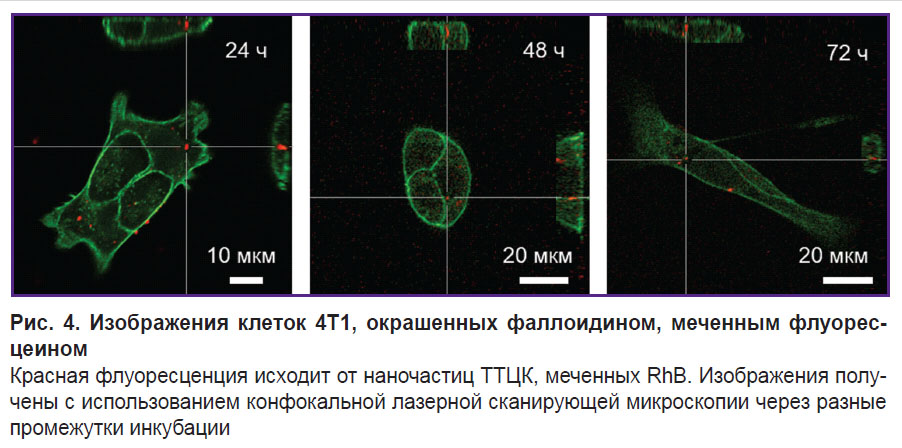
Оценка ассоциации наночастиц с клетками. Для визуализации взаимодействия наночастиц TTЦК с клетками 4T1 и A549 эти клетки высевали на чашки Петри для конфокальной микроскопии (d=35 мм; Eppendorf, Германия) в количестве 5,0∙105 клеток на чашку. На следующий день к клеткам добавляли наночастицы ТТЦК с загруженным флуоресцентным красителем RhB в конечных концентрациях 0,25; 0,5; 1; 2 и 4 мг/мл в 2 мл клеточной среды, после чего клетки оставляли на ночь. На следующий день клетки дважды промывали раствором PBS, затем добавляли 2 мл раствора формалина и помещали в холодильник на 30 мин. После этого образцы снова промывали PBS и инкубировали 15 мин в растворе 0,1% Triton X-100 в PBS. Для окрашивания клеток использовали 10 мМ раствор флуоресцеина, который добавляли вместе с 1,5 мл PBS к образцам. Через 15 мин клетки визуализировали с помощью конфокального лазерного сканирующего микроскопа Zeiss LSM 710 (Carl Zeiss, Германия). Изображения были получены с использованием объективов с увеличением 10 и 40.
Оценка визуализации злокачественных новообразований с помощью наночастиц. Для создания модельной патологии были использованы клетки мышечной карциномы молочной железы 4T1 (CRL-2539). Клетки были трипсинизированы, затем дважды промыты охлажденным PBS и ресуспендированы в PBS до концентрации 1∙106 кл./мл. После этого клетки были введены подкожно (50 мкл с концентрацией 1∙106 кл./мл) в область ноги мышей BALB/c. Через семь дней после формирования опухоли животных с опухолью достаточного размера (примерно 0,05±0,01 см3) использовали для дальнейших экспериментов.
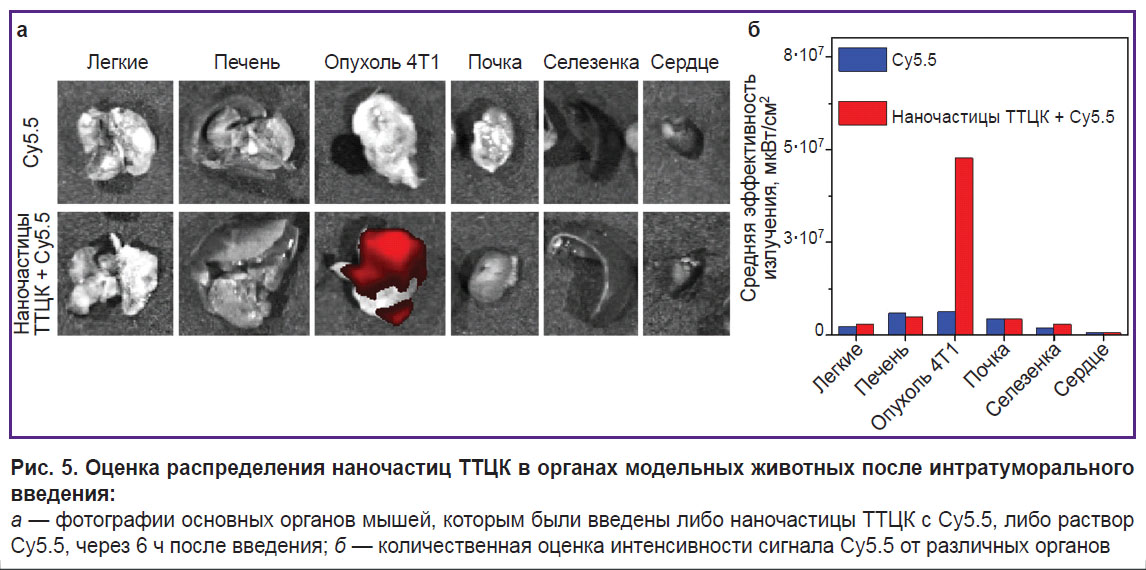
Биораспределение наночастиц ТТЦК оценивали методом флуоресцентной визуализации с использованием системы IVIS Lumina II (PerkinElmer Inc., США). Система была настроена на режим эпифлуоресценции с длинами волн возбуждения и эмиссии 640 и 690 нм соответственно. Затем модельным животным непосредственно в опухоль был введен либо свободный краситель Су5.5, либо наночастицы ТТЦК с загруженным красителем Су5.5 (50 мкл). Обе инъекции содержали одинаковую концентрацию Cy5.5 (50 мкг/мл или 2,5 мкг на инъекцию). Через 6 ч после введения проводили эвтаназию мышей, что позволило детектировать и зарегистрировать флуоресцентные сигналы из основных органов (сердца, печени, селезенки, легких, почек) и опухоли.
Результаты
Оценка размеров и морфологии полученных наночастиц. Полученные наночастицы ТТЦК были охарактеризованы с помощью метода динамического светорассеяния, СЭМ и ПЭМ (рис. 1).
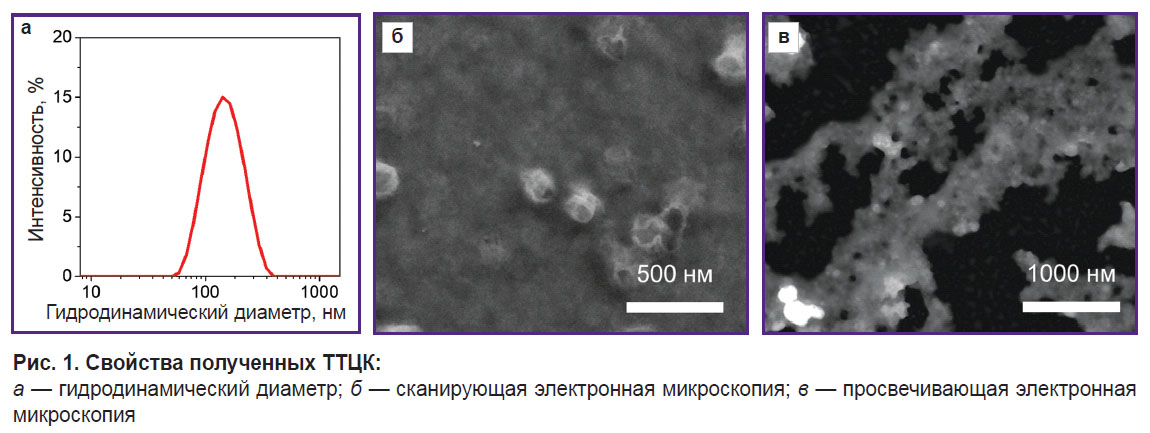
|
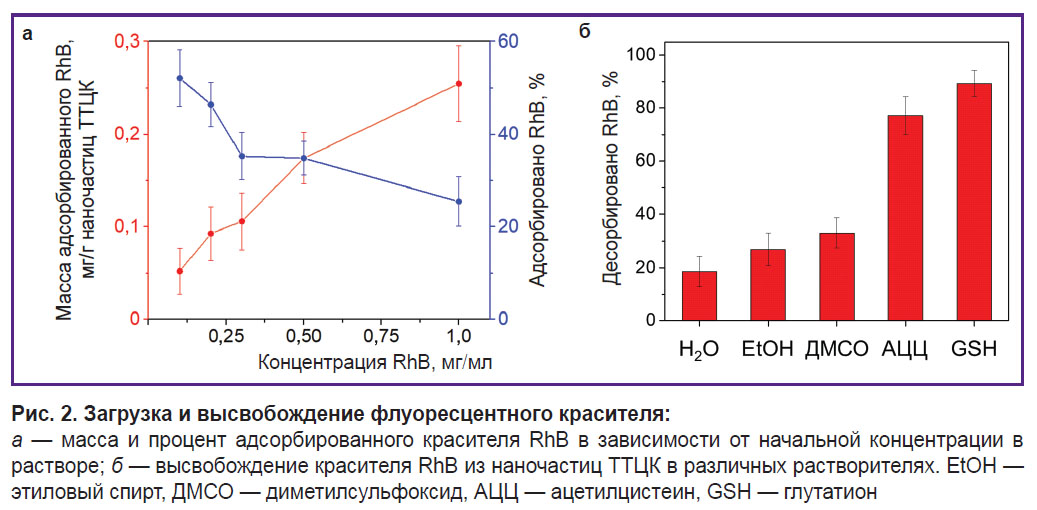
Рис. 1. Свойства полученных ТТЦК:
a — гидродинамический диаметр; б — сканирующая электронная микроскопия; в — просвечивающая электронная микроскопия |
Гидродинамический диаметр синтезированных наночастиц составил 120±20 нм. Размер их, согласно СЭМ, составил 100±20 нм.
Оценка загрузки флуоресцентного красителя. Изотерма адсорбции показала, что есть возможность достичь адсорбции 0,27 мг флуоресцентного красителя RhB на 1 мг наночастиц. При концентрации RhB 1 мг/мл приблизительно 25% RhB из раствора было адсорбировано. Однако в случае превышения такой концентрации частицы начинали агрегировать, поэтому при повышенных значениях адсорбция не была оценена (рис. 2, а). Во всех последующих экспериментах использовали наночастицы, у которых 0,2 мг красителя RhB было адсорбировано на 1 мг наночастиц ТТЦК.
Оценивали также десорбцию красителя RhB из наночастиц ТТЦК, инкубированных в различных растворителях, в том числе и в растворах ацетилцистеина и глутатиона — 77,1 и 89,2% соответственно (рис. 2, б). Такие значения обусловлены деградацией наночастиц в результате разрыва дисульфидных связей в присутствии ацетилцистеина и глутатиона. Стоит отметить, что присутствие глутатиона или ацетилцистеина вызывает ускоренное высвобождение красителя в отличие от воды, спирта или ДМСО, при которых десорбция происходит постепенно в течение 60 мин.
Влияние наночастиц на жизнеспособность опухолевых клеток. Оценка влияния наночастиц на жизнеспособность опухолевых клеток была проведена на двух клеточных линиях: клетках рака молочной железы мышей 4T1 и клетках карциномы легкого человека A549. Эти линии опухолевых клеток были выбраны из-за различного содержания внутриклеточного глутатиона: так, клетки A549 содержат больше глутатиона по сравнению с клетками 4T1 [18, 19]. Согласно полученным результатам, наночастицы ТТЦК в концентрации 4 мг/мл и меньше не оказывают существенного влияния на жизнеспособность обеих клеточных линий. Так, для клеток А549 при наивысшей концентрации наночастиц ТТЦК (4 мг/мл) жизнеспособность клеток не снизилась более 90% по сравнению с контролем (рис. 3).
Оценка ассоциации наночастиц с опухолевыми клетками. Изучение ассоциации наночастиц с опухолевыми клетками и дальнейшей их интернализации проводили на клеточной линии 4Т1. Для исследования этого процесса в динамике клетки были визуализированы через различные промежутки времени (24, 48 и 72 ч). Установлено, что в течение этого времени сигнал RhB частично ослабевает, однако отдельные частицы все еще различимы (рис. 4).
Оценка биораспределения наночастиц ТТЦК. Для изучения биораспределения наночастиц в них был загружен краситель Cy5.5, который выбирали в качестве флуоресцентного красителя дальнего красного диапазона для визуализации наночастиц в тканях. Эксперимент был проведен на модели мышей BALB/c с опухолью 4T1. Опухоль создавали путем подкожного введения клеток 4T1. Распределение наночастиц ТТЦК, загруженных Cy5.5, оценивали с помощью флуоресцентной визуализации. При сравнении результатов эксперимента с красителем, загруженным в ТТЦК, и «свободным» Cy5.5 установлено, что большая часть наночастиц сохранялась в тканях опухоли через 6 ч после внутритуморального введения (рис. 5). Более того, через 6 ч наночастицы продемонстрировали значительно более высокую степень удержания Cy5.5 в тканях опухоли по сравнению со «свободным» красителем.
Обсуждение
В данном исследовании представлена новая система редокс-чувствительных наночастиц на основе ТТЦК и изучен их потенциал для биовизуализации. Полученные результаты свидетельствуют, что эти наночастицы обладают уникальными свойствами, которые могут быть полезны для биомедицинских приложений. Синтез наночастиц ТТЦК достаточно прост и воспроизводим, что само по себе является преимуществом в контексте увеличения масштаба производительности для дальнейших исследований. Размер наночастиц составил 120±20 нм, что составляет оптимальный диапазон для использования эффекта увеличенной проницаемости и удержания в опухолевых тканях. Морфология частиц, подтвержденная СЭМ и ПЭМ, говорит об их стабильности, что имеет большое значение для дальнейших биологических экспериментов. Важно отметить, что дисульфидные группы, входящие в состав ТТЦК, обеспечивают редокс-чувствительность, но при этом не вызывают значительной агрегации частиц, которая часто является проблемой для подобных систем.
Эксперименты продемонстрировали, что наночастицы ТТЦК способны эффективно удерживать родамин Б, при этом адсорбция является оптимальной при концентрации красителя 1 мг/мл. В редокс-активных средах, таких как глутатион или ацетилцистеин, высвобождение родамина Б происходит в значительно большей степени, чем в нейтральных растворителях. Это подтверждает селективность разрушения наночастиц в опухолевых тканях с повышенным уровнем глутатиона. Такие данные подчеркивают потенциал редокс-чувствительных систем для целевой доставки. Цитотоксичность наночастиц ТТЦК на клетках 4T1 и A549 незначительна даже при концентрации 4 мг/мл, что свидетельствует о высокой биосовместимости системы. Это особенно важно в контексте потенциального клинического применения, где минимизация токсичности является ключевым требованием.
Конфокальная визуализация показала, что наночастицы ТТЦК эффективно ассоциируются с клетками и остаются стабильными в течение 72 ч, хотя интенсивность сигнала красителя со временем уменьшается. Это может быть связано с постепенным метаболизмом наночастиц внутри клеток и высвобождением красителя.
Биораспределение в модели опухоли 4T1 продемонстрировало, что наночастицы сохраняются в опухолевых тканях через 6 ч после интратуморального введения, в то время как свободный краситель быстро выводится. Это ключевой результат, который подтверждает, что наночастицы ТТЦК обеспечивают стабильное накопление в опухоли, что может быть полезно для диагностики и терапии. В сравнении с другими редокс-чувствительными наночастицами, такими как полисульфидные полимеры, система на основе ТТЦК менее токсична, а сам ее синтез более прост и масштабируем. И, наконец, представленные наночастицы обладают высокой загружающей способностью.
Следует отметить, что результаты являются многообещающими, исследование имеет некоторые ограничения. Например, биораспределение было изучено только после внутритуморального введения. В дальнейшем планируется изучить фармакокинетику после внутривенного введения, чтобы оценить потенциал использования наночастиц ТТЦК для системной доставки. Другим направлением исследований представляется модификация поверхности наночастиц для повышения селективности к опухолевым тканям.
Заключение
Разработанная и охарактеризованная новая система наночастиц на основе тритиоциануровой кислоты продемонстрировала высокую эффективность для применения в биовизуализации и потенциально — в целевой доставке терапевтических агентов. Уникальная структура ТТЦК, включающая дисульфидные группы, обеспечивает редокс-чувствительность, что делает эти наночастицы особенно перспективными для выполнения избирательного разрушения в опухолевых тканях. Полученные наночастицы обладают оптимальным размером (120±20 нм) для накопления в опухолях благодаря эффекту увеличенной проницаемости и удержания. Они продемонстрировали высокую стабильность, способность удерживать и высвобождать флуоресцентные молекулы в присутствии глутатиона, а также минимальную токсичность по отношению к клеткам. Биораспределение показало, что наночастицы сохраняются в опухолевых тканях после интратуморального введения, в то время как свободный краситель быстро выводится.
Представленная работа демонстрирует потенциал использования таких материалов, как ТТЦК, для создания биосовместимых и функциональных наночастиц. Это открывает новые перспективы для разработки систем, которые могут применяться как для диагностики, так и для терапии опухолей.
Финансирование исследования. Работа выполнена при финансовой поддержке гранта Российского научного фонда №23-23-00317.
Конфликт интересов отсутствует.
Литература
- Wolfbeis O.S. An overview of nanoparticles commonly used in fluorescent bioimaging. Chem Soc Rev 2015; 44(14): 4743–4768, https://doi.org/10.1039/c4cs00392f.
- Li W., Kaminski Schierle G.S., Lei B., Liu Y., Kaminski C.F. Fluorescent nanoparticles for super-resolution imaging. Chem Rev 2022; 122(15): 12495–12543, https://doi.org/10.1021/acs.chemrev.2c00050.
- Lian W., Litherland S.A., Badrane H., Tan W., Wu D., Baker H.V., Gulig P.A., Lim D.V., Jin S. Ultrasensitive detection of biomolecules with fluorescent dye-doped nanoparticles. Anal Biochem 2004; 334(1): 135–144, https://doi.org/10.1016/j.ab.2004.08.005.
- Roy S., Bag N., Bardhan S., Hasan I., Guo B. Recent progress in NIR-II fluorescence imaging-guided drug delivery for cancer theranostics. Adv Drug Deliv Rev 2023; 197: 114821, https://doi.org/10.1016/j.addr.2023.114821.
- Al-Thani A.N., Jan A.G., Abbas M., Geetha M., Sadasivuni K.K. Nanoparticles in cancer theragnostic and drug delivery: a comprehensive review. Life Sci 2024; 352: 122899, https://doi.org/10.1016/j.lfs.2024.122899.
- Li Y., Chen Q., Pan X., Lu W., Zhang J. New insight into the application of fluorescence platforms in tumor diagnosis: from chemical basis to clinical application. Med Res Rev 2023; 43(3): 570–613, https://doi.org/10.1002/med.21932.
- Wang K., Du Y., Zhang Z., He K., Cheng Z., Yin L., Dong D., Li C., Li W., Hu Z., Zhang C., Hui H., Chi C., Tian J. Fluorescence image-guided tumour surgery. Nature Reviews Bioengineering 2023; 1(3): 161–179, https://doi.org/10.1038/s44222-022-00017-1.
- Shi Q., Xu J., Xu H., Wang Q., Huang S., Wang X., Wang P., Hu F. Polystyrene-based matrix to enhance the fluorescence of aggregation-induced emission luminogen for fluorescence-guided surgery. Small 2024; 20(22): e2309589, https://doi.org/10.1002/smll.202309589.
- Sutton P.A., van Dam M.A., Cahill R.A., Mieog S., Polom K., Vahrmeijer A.L., van der Vorst J. Fluorescence-guided surgery: comprehensive review. BJS Open 2023; 7(3): zrad049, https://doi.org/10.1093/bjsopen/zrad049.
- Bortot B., Mangogna A., Di Lorenzo G., Stabile G., Ricci G., Biffi S. Image-guided cancer surgery: a narrative review on imaging modalities and emerging nanotechnology strategies. J Nanobiotechnology 2023; 21(1): 155, https://doi.org/10.1186/s12951-023-01926-y.
- Ali M.K., Javaid S., Afzal H., Zafar I., Fayyaz K., Ain Q.U., Rather M.A., Hossain M.J., Rashid S., Khan K.A., Sharma R. Exploring the multifunctional roles of quantum dots for unlocking the future of biology and medicine. Environ Res 2023; 232: 116290, https://doi.org/10.1016/j.envres.2023.116290.
- Hang Y., Wang A., Wu N. Plasmonic silver and gold nanoparticles: shape- and structure-modulated plasmonic functionality for point-of-caring sensing, bio-imaging and medical therapy. Chem Soc Rev 2024; 53(6): 2932–2971, https://doi.org/10.1039/d3cs00793f.
- Farinha P., Coelho J.M.P., Reis C.P., Gaspar M.M. A comprehensive updated review on magnetic nanoparticles in diagnostics. Nanomaterials (Basel) 2021; 11(12): 3432, https://doi.org/10.3390/nano11123432.
- Ansari M.A., Shoaib S., Chauhan W., Gahtani R.M., Hani U., Alomary M.N., Alasiri G., Ahmed N., Jahan R., Yusuf N., Islam N. Nanozymes and carbon-dots based nanoplatforms for cancer imaging, diagnosis and therapeutics: current trends and challenges. Environ Res 2024; 241: 117522, https://doi.org/10.1016/j.envres.2023.117522.
- Hossain M.K., Khan M.I., El-Denglawey A. A review on biomedical applications, prospects, and challenges of rare earth oxides. Applied Materials Today 2021; 24: 101104, https://doi.org/10.1016/j.apmt.2021.101104.
- Ng K.K., Zheng G. Molecular interactions in organic nanoparticles for phototheranostic applications. Chem Rev 2015; 115(19): 11012–11042, https://doi.org/10.1021/acs.chemrev.5b00140.
- Chen M., Liu D., Liu F., Wu Y., Peng X., Song F. Recent advances of redox-responsive nanoplatforms for tumor theranostics. J Control Release 2021; 332: 269–284, https://doi.org/10.1016/j.jconrel.2021.02.030.
- Zhu C., Hu W., Wu H., Hu X. No evident dose-response relationship between cellular ROS level and its cytotoxicity — a paradoxical issue in ROS-based cancer therapy. Sci Rep 2014; 4: 5029, https://doi.org/10.1038/srep05029.
- Tobwala S., Fan W., Hines C.J., Folk W.R., Ercal N. Antioxidant potential of Sutherlandia frutescens and its protective effects against oxidative stress in various cell cultures. BMC Complement Altern Med 2014; 14: 271, https://doi.org/10.1186/1472-6882-14-271.