Изучение клеток мозга при нейродегенеративных заболеваниях: микроспектроскопия комбинационного рассеяния и сканирующая ион-проводящая микроскопия
Цель исследования — выявление отличий в структуре сети отростков нейронов, составе и функциональном состоянии клеток путем изучения тел и отростков нейронов мозга крысы и астроцитов, полученных из плюрипотентных стволовых клеток здоровых доноров и пациентов с наследственной болезнью Паркинсона, с помощью комплекса современных высокоточных методов — микроспектроскопии комбинационного рассеяния, гигантского комбинационного рассеяния и сканирующей ион-проводящей микроскопии.
Материалы и методы. С помощью методов спектроскопии комбинационного рассеяния и сканирующей ион-проводящей микроскопии исследовали морфологию и состояние молекул в нейронах мозга крысы и астроцитах, индуцированных из плюрипотентных стволовых клеток здоровых доноров и пациентов с наследственной болезнью Паркинсона.
Результаты. Установлено, что характерные полосы спектров комбинационного рассеяния и гигантского комбинационного рассеяния нейронов и астроцитов позволяют исследовать распределение и конформацию ряда биологических молекул (белки, липиды, цитохромы) в норме и при патологии. Показано, что при болезни Паркинсона наблюдается снижение содержания белков и увеличение доли восстановленных цитохромов в дыхательной цепи митохондрий астроцитов. При сравнении морфологии тел и отростков астроцитов обнаружено, что высота и площадь сечения отростков астроцитов из клеток пациентов с наследственной болезнью Паркинсона значимо больше, чем у здоровых.
Заключение. Разработанный подход к регистрации распределения и конформации молекул в нейронах и астроцитах, а также к изучению морфологии отростков астроцитов позволяет диагностировать функциональное состояние клеток и исследовать механизм патогенеза болезни Паркинсона.
Введение
Спектроскопия комбинационного рассеяния (КР) — рамановская спектроскопия — является чувствительным и высокоселективным методом для исследования конформационных изменений и редокс-состояния молекул in vitro и in vivo. Спектроскопия КР позволяет исследовать живые клетки в нативных условиях без повреждений и предварительной подготовки и получать уникальную информацию не только о молекулярном составе, но и о функциональном состоянии клеток, основываясь на данных о колебательной структуре биологических молекул [1–3]. Одна из разновидностей спектроскопии КР — спектроскопия гигантского комбинационного рассеяния (ГКР) — чувствительный и универсальный инструмент химической и биохимической диагностики [4–8]. Этот метод использует эффект поверхностного плазмонного резонанса и уникальных мод молекулярных колебаний для усиления сигнала и позволяет идентифицировать структуру вплоть до уровня одиночных молекул. В последнее десятилетие было продемонстрировано, что метод ГКР также можно использовать для исследования отдельных клеток, бактерий и вирусов в их естественной среде [9–11]. Высокая чувствительность этого метода позволяет исследовать малейшие изменения в биохимическом составе клеток и предоставляет беспрецедентную возможность контролировать динамику функционального состояния отдельных клеток [12–14]. Однако при использовании метода ГКР отмечаются значительные сложности, в частности связанные со стабильностью и воспроизводимостью наноструктурированных субстратов и регистрируемых сигналов ГКР, с взаимодействием поверхности субстрата с мембраной живых клеток, с латеральной подвижностью клеток на субстрате и контактом клетки с плазмонными наноструктурами [4, 5, 15]. В связи с этим большое значение имеют работы, в которых методы КР и ГКР применяются для исследования нативных клеток животных и человека, находящихся в нормальном состоянии и при различных патологиях.
Одной из серьезных нейродегенеративных патологий, сопровождающихся повреждением клеток мозга, в частности изменением морфологии и функционирования нейронов и астроцитов, является болезнь Паркинсона (БП). Основным звеном молекулярного патогенеза БП считаются синтез и формирование нейротоксических агрегатов белка α-синуклеина, агрегация которого стимулируется не только за счет точечных мутаций и мультипликации гена, кодирующего α-синуклеин, SNCA, но и за счет усиления окислительного стресса и дисфункции митохондрий [16]. Это приводит к накоплению модифицированных «неправильных» белков, что влияет на морфологию синапсов, отростков нейронов и астроцитов.
Известно, что астроциты играют важную роль в формировании синапсов, поддержании баланса нейромедиаторов, калия и рН, а также формируют контакты с капиллярами мозга [17]. Астроциты регулируют поступление О2 из кровеносных сосудов в ткань мозга [18] и обеспечивают метаболическую поддержку нейронов, снабжая их лактатом, субстратами для синтеза нейромедиаторов [17]. Они участвуют и в патогенезе различных нейродегенеративных заболеваний, в том числе и БП [19], при этом наблюдаются изменения их морфологии и функциональной активности [19]. Этот процесс называется реактивным астроглиозисом и характеризуется увеличением продукции глиального фибриллярного кислого белка GFAP [20]. Такие изменения направлены на снижение повреждений ЦНС, однако в случае хронического реактивного астроглиозиса приводят к увеличению продукции активных форм кислорода (АФК) и высвобождению провоспалительных медиаторов, что обусловливает повреждение нейронов [20]. Увеличение продукции АФК астроцитами и окислительный стресс при БП связывают как с нарушениями функционирования митохондрий, так и с нарушениями системы защиты от окислительного стресса [21]. Кроме того, астроциты играют важную роль в утилизации альфа-синуклеина, который поступает к ним из нейронов [19, 20]. В мозге нарушения в нейронах инициируются изменениями функционирования астроцитов, которые обеспечивают метаболизм нейронов.
Для исследования клеточных механизмов возникновения нейродегенеративных заболеваний мозга, связанных с БП, необходимы разработка и внедрение новых эффективных методов исследования как морфологии нейронов и астроцитов, так и редокс-состояния компонентов дыхательной электрон-транспортной цепи (ЭТЦ) митохондрий, которая определяет синтез аденозинтрифосфата (АТФ). Как было отмечено, БП сопровождается изменением морфологии отростков нервных клеток и области синапса. Одним из современных методов для максимально неинзвазивного исследования морфологии живых клеток в культуре является метод сканирующей ион-проводящей микроскопии (СИПМ) [22–25]. Он относится к группе методов зондовой микроскопии, в качестве зонда в данном случае выступает микропипетка, а сигналом, обеспечивающим обратную связь, служит сопротивление. Приближение микропипетки к поверхности клетки вызывает увеличение сопротивления (снижение проводимости), при этом в отличие от такого распространенного метода, как атомно-силовая микроскопия, зонд не касается непосредственно поверхности клетки, избегая таким образом повреждения ее поверхности. Этот метод позволяет точно и неинвазивно оценивать геометрию клетки, в том числе ее тонких отростков, что важно в случае изучения структуры нейронов и астроцитов при БП.
В настоящее время огромный интерес приобретают исследования, проводимые с использованием индуцированных плюрипотентных стволовых клеток (ИПСК). Это стволовые клетки, которые при помощи различных молекулярных манипуляций были получены из соматических дифференцированных клеток (например, фибробластов). Такие ИПСК можно направить по другому пути развития, получив, к примеру, нейроны, астроциты и т.д. В нейробиологии ИПСК активно используются для дифференцировки в определенный тип нервных клеток и исследования развития нейропатологий на клеточном уровне.
Существует несколько способов трансформации соматических клеток в ИПСК: например, использование фибробластов кожи с их переводом в ИПСК при помощи стандартного протокола — CytoTune-iPS 2.0 Sendai Reprogramming Kit (Thermo Fisher Scientific, США) [26]. Затем в лаборатории полученные ИПСК при использовании комбинации различных факторов роста и метаболитов дифференцируются в нейроны или астроциты [26]. С помощью ИПСК, индуцированных из соматических клеток больных людей — носителей гена наследственного заболевания, можно исследовать развитие такого заболевания на клеточном уровне.
Цель исследования — выявление отличий в структуре сети отростков нейронов, составе и функциональном состоянии клеток путем изучения тел и отростков нейронов мозга крысы и астроцитов, полученных из плюрипотентных стволовых клеток здоровых доноров и пациентов с наследственной болезнью Паркинсона, с помощью комплекса современных высокоточных методов — микроспектроскопии комбинационного рассеяния, гигантского комбинационного рассеяния и сканирующей ион-проводящей микроскопии.
Материалы и методы
Культура нейронов мозга крысы. Для приготовления первичной культуры гранулярных клеток мозжечка использовали 2–4-дневных крыс линии Wistar–Kyoto. Декапитацию осуществляли в соответствии с этическими требованиями по работе с животными. Все манипуляции с животными проводили в соответствии с нормативами, указанными в руководстве «Guide for the Care and Use of Laboratory Animals» (National Research Council, 2011); с национальным стандартом РФ ГОСТ 33044–2014 «Принципы надлежащей лабораторной практики»; с этическими принципами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006). Протокол исследования одобрен Этическим комитетом биологического факультета Московского государственного университета им. М.В. Ломоносова (протокол №82-O от 08.06.2017).
Все процедуры с клетками проводили в стерильных условиях. Ткань мозжечка промывали в холодном бескальциевом и безмагниевом растворе Хэнкса (Gibco, США) с 0,04% NaHCO3, очищали от сосудов, пленок, тканей ствола мозга и других компонентов, измельчали, после чего клеточную суспензию помещали на 15 мин в 0,05% трипсин с 0,02% ЭДТА (Gibco, США) с температурой 37°С. После инкубации клетки на 2–3 мин помещали в 2–3 мл бычьей сыворотки для остановки реакции, а затем двукратно отмывали трипсин стандартным раствором Хэнкса с феноловым красным и культуральной средой МЕМ (minimal essential medium) — оба производства Gibco (США). Затем клетки диспергировали в свежей среде МЕМ до получения однородной суспензии, которую центрифугировали 2 мин при 3000 об./мин. Осажденные клетки ресуспендировали в среде NBM (neurobasal medium) (Gibco, США), содержащей 2% Supplement B-27; 0,5 мM GlutaMax; 100 U/мл пенициллина/стрептомицина — все производства Gibco, (США), а также 20 мM KCl (Sigma, CША). Подсчет нейронов выполняли в камере Горяева, количество их обычно составляло 1,0–3,5·106 клеток/мл. 100–150 мкл клеточной суспензии переносили в чашки Петри, преинкубированные с полиорнитином (Sigma, США) для улучшения адгезии клеток на их поверхности. Культивирование осуществляли в среде NBM в течение 5–7 дней в СО2-инкубаторе при 37°С, 5% СО2 и относительной влажности 98%.
Культуры дифференцированных астроцитов. Дифференцированные астроциты получали из ИПСК, выделенных от здоровых доноров и пациентов с наследственной формой БП (мутация G2019S в гене LRRK2). Дальнейшую дифференцировку ИПСК до стадии нейрональных предшественников осуществляли по методу, описанному ранее [27]. Для получения глиальных клеток из нейрональных предшественников использовали протокол, подробно описанный в работе [28]. Полученные таким методом культуры глиальных клеток были охарактеризованы по уровням экспрессии ряда генов нейроглиальной дифференцировки [28].
Микроспектроскопия комбинационного рассеяния. Распределение и конформацию белков и липидов цитоплазмы и относительное содержание восстановленных цитохромов ЭТЦ митохондрий клеток исследовали при помощи конфокального КР-спектрометра NTEGRA Spectra (НТ-МДТ, Россия), совмещенного с инвертированным микроскопом Olympus (Olympus, Япония), с лазерным возбуждением и длиной волны 532 нм, мощностью лазера на выходе из объектива 1 мВт и объективом 20× NA0.40. Длительность регистрации одного спектра составляла 60 с. Условия регистрации КР-спектров были подобраны так, чтобы освещение не приводило к снижению интенсивности сигнала КР от образца в течение не менее чем 6–8 повторных освещений астроцитов лазером с длительностью 60 с.
Спектроскопия гигантского комбинационного рассеяния. Исследование липидов и белков плазматической мембраны тонких отростков проводили при помощи спектроскопии ГКР с использованием серебряных плазмонных наноструктурированных поверхностей (ГКР-наноструктур). Синтез ГКР-наноструктур выполняли, как описано в работах [4, 5, 15]. Наноструктурированные поверхности получали при помощи ультразвукового напыления аммиачного раствора оксида серебра (в течение 60 мин) на предварительно очищенные покровные стекла, нагретые до 270°С. После приготовления наноструктурированные поверхности оставляли на 7 дней в темном месте при комнатной температуре. Для получения усиленного КР-сигнала от компонентов плазматической мембраны тонких отростков нейронов выбранные отростки нейронов накрывали небольшим кусочком стекла размером 3×3 мм с ГКР-наноструктурами, при этом наноструктурированная поверхность оказывалась ориентированной по отношению к объективу 20× NA0.40 микроскопа КР-спектрометра NTEGRA Spectra (НТ-МДТ, Россия). В экспериментах использовали лазерное возбуждение с длиной волны 532 нм и с мощностью не более 1 мВт на область регистрации. Время накопления ГКР-спектров составляло 60 с.
Коррекцию базовой линии в спектрах КР и ГКР осуществляли с использованием открытого программного обеспечения Pyraman (https://github.com/abrazhe/pyraman). Построение графиков выполняли в программе OriginPro 2022. Обработка сигнала включала в себя вычитание базовой линии и сглаживание сигнала по 10 точкам.
Сканирующая ион-проводящая микроскопия. Для исследования морфологии отростков и распределения цитоплазмы в клетке использовали сканирующий ион-проводящий микроскоп, созданный на базе инвертированного оптического микроскопа Eclipse Ti-2 (Nikon, Япония), который размещается на виброизоляционном столе STable (Supertech Instruments, Венгрия) и состоит из следующих функциональных систем: сканирующей платформы Mechanical stand, систем позиционирования и пьезоуправления, системы управления с обратной связью Universal Controller (все системы произведены компанией ICAPPIC Limited, Великобритания), а также интерфейсов ввода–вывода MultiClamp 700B и Digidata 1550B (Axon Instruments, США). В работе использовали данный сканирующий ион-проводящий микроскоп в прыжковом режиме (hopping mode), размер поля сканирования составлял 40×40 мкм, диаметр внутреннего отверстия пипетки — 50 нм, setpoint (значение падения тока при сканировании топографии) — 0,5%, длительность сканирования одного изображения — 1,5–2,0 мин. Для получения изображений нейроны помещали в раствор Хэнкса, при сканировании выполняли prescan, во время сканирования в каждом квадрате сначала проводили оценку высоты 4 углов квадрата, а затем уже сканировали внутреннюю часть выбранной области. При сканировании тел астроцитов эта величина составила около 6000 нм, при сканировании отростков — от 2000 до 4000 нм.
Статистическая обработка результатов. Результаты обрабатывали в демоверсии программы Prism 10 (GraphPad, США). Данные показаны как медиана с интерквартильным размахом. Статистическую значимость различий значений оценивали при помощи теста Манна–Уитни, p<0,05.
Результаты и обсуждение
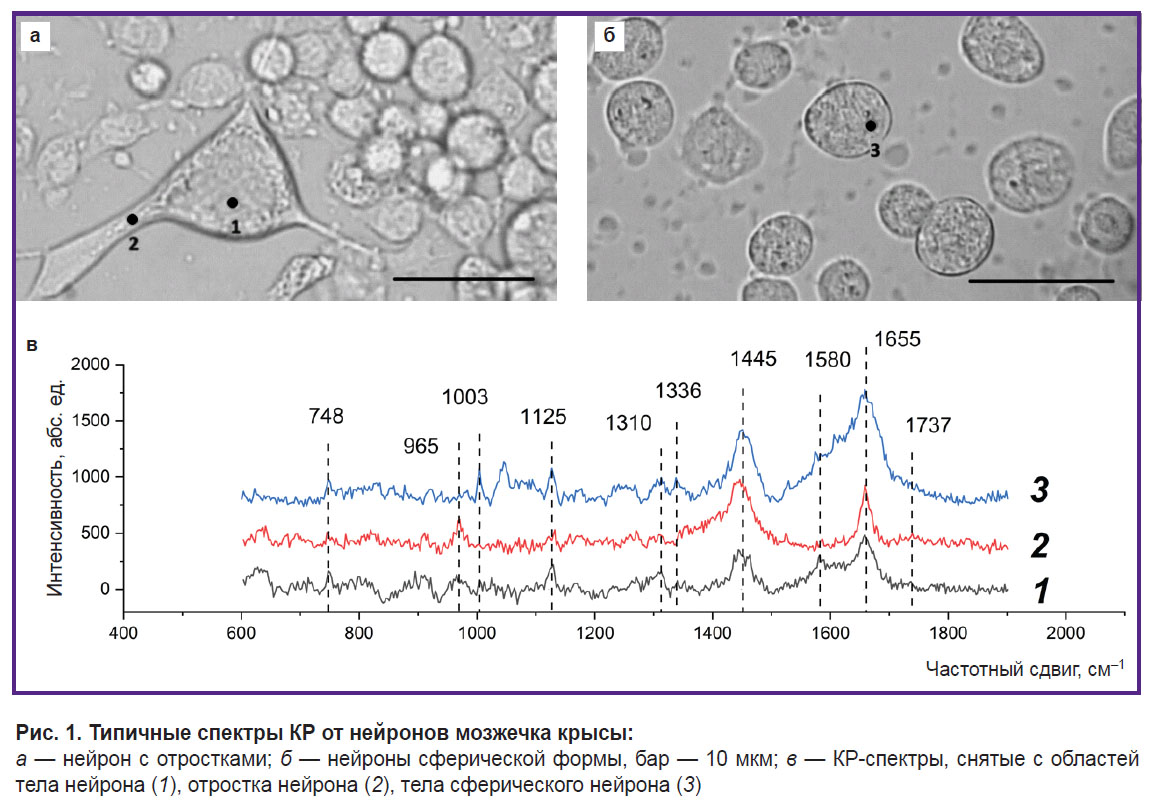
Исследование редокс-состояния цитохромов митохондрий, белок-липидного состава цитоплазмы и плазматической мембраны нейронов мозжечка. Методом спектроскопии КР были исследованы распределение и конформация белков и липидов в телах и отростках нейронов в культуре нейронов мозжечка крысы. В ходе исследования получены спектры КР от 9 нейронов, как не имеющих отростков, так и имеющих от 1 до 3 хорошо различимых отростков (рис. 1).
Представлена клетка нейрона с отростками (рис. 1, а) и спектры (рис. 1, в), зарегистрированные в области тела клетки (1) и на отростке (2). КР-спектр содержит полосы, характерные для колебаний связей белка: 1655 см–1 (Амид I), что соответствует колебаниям пептидной связи в молекулах белков с альфа-структурами; 1445 см–1 — колебаниям метиленовых групп в молекулах липидов и белков (с существенным вкладом липидов); 1003 см–1 — колебаниям ароматического кольца в остатках фенилаланина белков. Полосы КР-спектра со значениями максимумов 748 и 1125 см–1 соответствуют колебаниям связей в геме восстановленных цитохромов с- и b-типов, причем пик 748 см–1, по всей вероятности, определяется колебаниями гема восстановленных цитохромов с и с1, а полоса 1125 см–1 — колебаниями связей гемов восстановленных цитохромов bhigh и blow комплекса III ЭТЦ. Полоса КР-спектра с положением максимума пика 1336 см–1 обусловлена колебаниями гемов только восстановленных цитохромов b-типа комплекса III и, таким образом, является качественным показателем количества восстановленных цитохромов bhigh и blow комплекса III ЭТЦ. Полоса КР-спектра с пиком 1310 см–1 является результатом суммирования двух пиков с положениями максимумов 1300 и 1315 см–1, которые характерны для восстановленных цитохромов b- и с-типов соответственно. Кроме того, характерной полосой КР-спектра цитохрома («цитохромным пиком») является максимум 1580 см–1, проявляющийся как плечо у пика с положением максимума 1655 см–1.
Отметим, что достаточную интенсивность и хорошее разрешение сигнала КР можно получить только от крупных отростков нейронов. Из КР-спектров от различных областей нейрона следует, что в области отростка нейрона (дендрит или аксон) параметры КР-спектра отличаются от спектров тела нейрона: форма полосы 1655 см–1 свидетельствует о том, что в отростке клетки преобладают колебания растяжения двойных связей в жирно-кислотных остатках фосфолипидов (по положению эта полоса может совпадать с полосой Амид I, связанной с колебаниями пептидной связи в белках, однако имеет более узкую форму), а полоса 1737 см–1 отражает колебания связей C=O в составе фосфолипидов. Полоса КР-спектра 1445 см–1 соответствует колебаниям метиленовых групп молекул липидов со вкладом колебания тех же групп белка, полоса 965 см–1, по всей вероятности, соответствует колебаниям фосфатных групп в молекулах фосфолипидов и более выражена в области отростка. Снижение величины интенсивностей пиков КР-спектра, связанных с колебаниями связей гемопорфирина восстановленных цитохромов, по-видимому, обусловлено меньшим количеством митохондрий в отростке, чем в теле клетки, и, как следствие, снижением амплитуды КР от комплексов ЭТЦ и цитохромов.
Из микрофотографий исследованной культуры клеток следует, что некоторые клетки локализованы на поверхности стекла (см. рис. 1, а), в то время как другие имеют сферическую форму, не распластаны по поверхности стекла (рис. 1, б) и, по-видимому, отличаются и по своему физиологическому состоянию. На рисунке 1, б представлены микрофотографии шаровидного нейрона и КР-спектр, зарегистрированный в указанной области нейрона (рис. 1, в, 3). В области тела клетки максимумы КР-спектра 748, 1125, 1310, 1336, 1580 см–1 соответствуют колебаниям гемов восстановленных цитохромов с- и b-типов, полоса 1448 см–1 соответствует колебаниям метиленовых групп преимущественно в липидах, 1655 см–1 — колебаниям Амид I пептидных связей в белках с альфа-структурами. Установлено, что в данном случае полосы спектра КР, соответствующие восстановленным цитохромам, значительно более интенсивны, чем в случае нормальной прикрепленной клетки. Это может быть связано с заполнением ЭТЦ электронами, что свидетельствует о функциональных нарушениях в клетке, по-видимому, находящейся в предапоптотическом состоянии.
Таким образом, можно утверждать, что наличие характерных полос, соответствующих разным типам цитохромов, в КР-спектре нейрона позволяет получать информацию о состоянии дыхательной цепи митохондрий, распределении митохондрий, белков и липидов в теле нейронов и отростках. Это дает возможность анализировать физиологическое состояние клетки и развитие патологии.
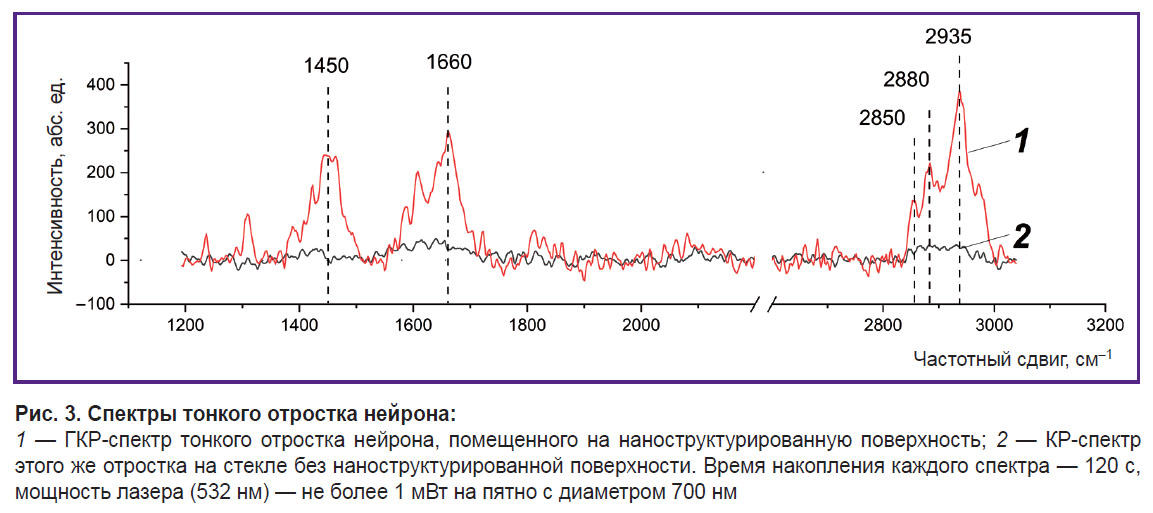
Исследование конформации белков и липидов в плазматической мембране нервных клеток при помощи спектроскопии ГКР с использованием серебряных наноструктур. Для повышения интенсивности сигнала КР, регистрируемого от клеток и молекул, был использован методический подход, основанный на спектроскопии ГКР для высокочувствительного и селективного исследования конформации липидов и белков плазматической мембраны нервных клеток крысы, в том числе плазматической мембраны их отростков (диаметр не более 1 мкм). Тонкие отростки нервных клеток прозрачны и из-за небольшого содержания белков и липидов не могут быть исследованы при помощи традиционной КР-спектроскопии. Мы показали, что в условиях размещения отростка нервной клетки на плазмонной серебряной наноструктурированной поверхности (рис. 2) и при лазерном возбуждении 532 нм существенно возрастает усиление амплитуды КР от биомакромолекул, находящихся в непосредственной близости от наноструктур поверхности — белков и липидов плазматической мембраны (рис. 3).

|
Рис. 2. Микрофотография серебряной наноструктурированной поверхности, сделанная с помощью сканирующего электронного микроскопа [цитируется по 4, 15] |
С помощью плазмонных наночастиц серебра установлено, что спектр ГКР, зарегистрированный от плазматической мембраны нейронов, содержит набор пиков, связанных с деформационными колебаниями метиленовых групп CH2 в липидах и белках (пик с положением максимума 1450 см–1), с колебаниями полосы Амид I в белках (1660 см–1), колебаниями растяжения С–Н-связей метиленовых групп в липидах и белках (пики 2850 и 2880 см–1), колебаниями растяжения С–Н-связей метильных групп в белках и липидах (2935 см–1) (рис. 3, 1). Отметим, что без применения серебряных наноструктур КР-спектр от молекул мембраны отростков практически не регистрируется (рис. 3, 2).
Таким образом, разработанный подход к применению спектроскопии ГКР для изучения нейронов может быть использован при исследовании конформационных изменений белков и липидов в мембране отростков при различных воздействиях (например, в процессах, сопровождающихся выбросом нейромедиатора, изменением возбудимости отростка, при изменении содержания мембраносвязанных ионов Са2+ или при патологических изменениях).
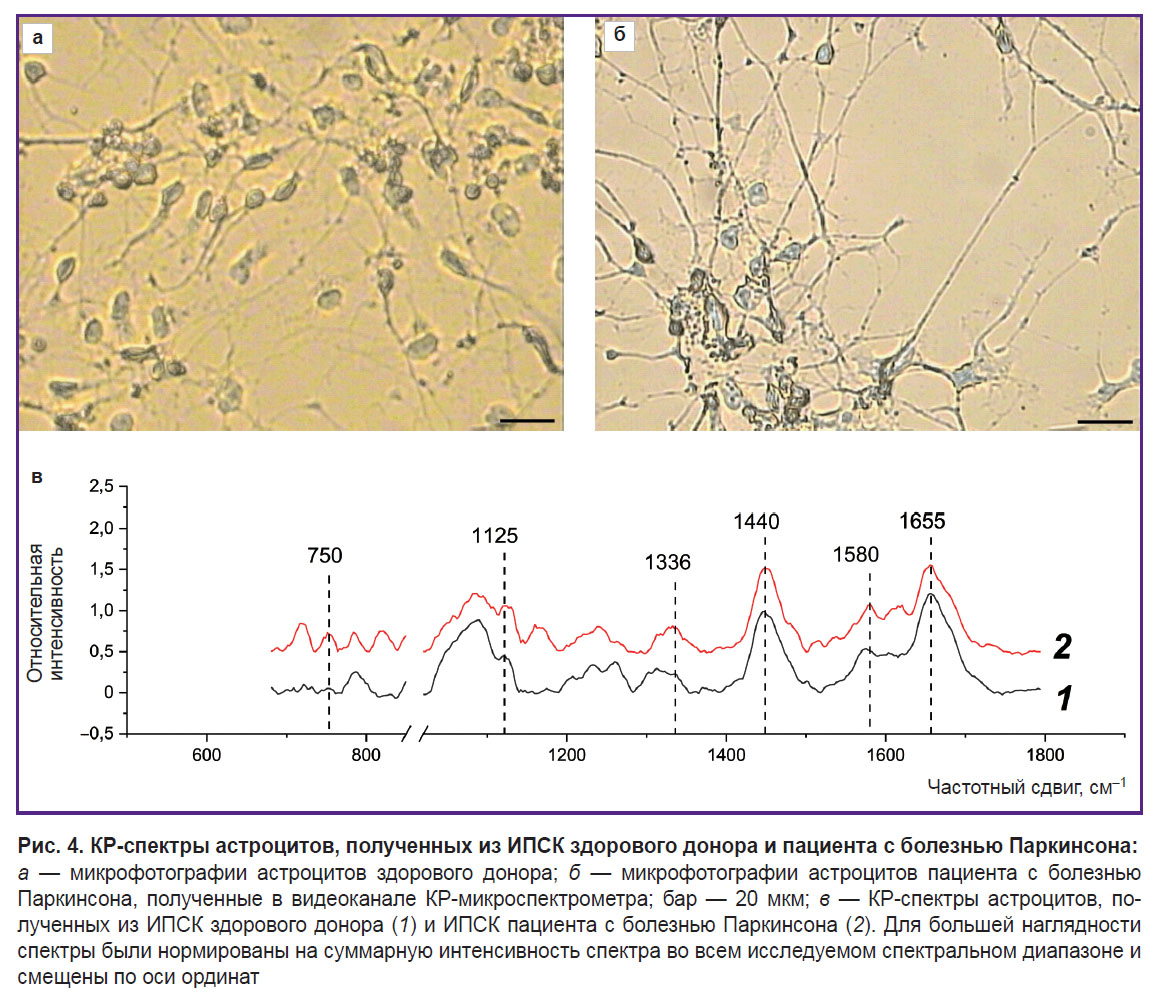
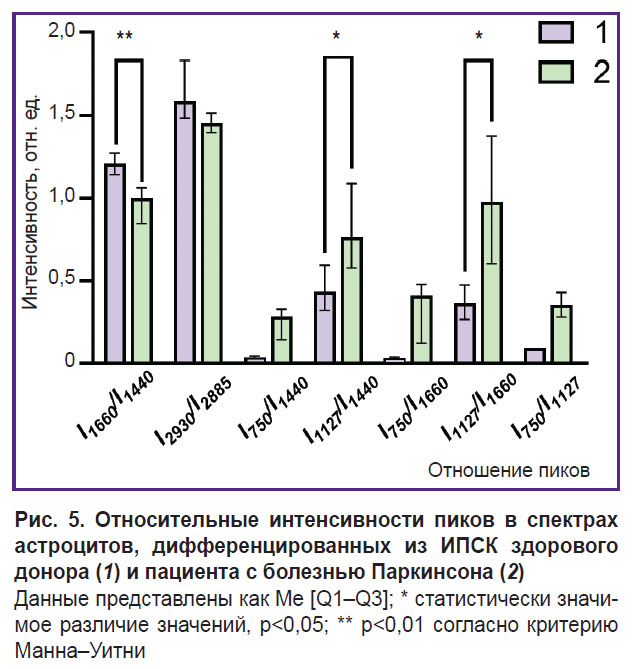
Исследование распределения и конформации белков и липидов цитоплазмы и степени заполненности электронами ЭТЦ митохондрий астроцитов, дифференцированных из ИПСК здорового донора и пациента с болезнью Паркинсона. Метод спектроскопии КР был использован для изучения состояния тел астроцитов, дифференцированных из ИПСК здорового донора и пациента с БП. Максимальный сигнал КР выявлен около ядра астроцитов, что может быть связано с большим количеством митохондрий, расположенных в этой области. Спектры регистрировали в околоядерной области для всех исследованных клеток. На рис. 4 представлены микрофотографии дифференцированных клеток и спектры КР, регистрируемые от астроцитов здорового донора и пациента с БП. В обоих случаях КР-спектры характеризуются сходным положением пиков, однако отличается относительный вклад пиков, связанных с колебаниями связей в липидах (пики с положениями максимумов 1440 и 2845 см–1; высокочастотная часть спектра не показана на рисунке) и восстановленных цитохромах с- и b-типов (пики с положениями максимумов 750, 1127 и 1582 см–1). Для количественной характеристики восстановленных цитохромов использовали соотношения интенсивностей полос 750 и 1440 см–1 (количество восстановленных цитохромов с-типа относительно липидов), 1127 и 1440 см–1 (количество восстановленных цитохромов b-типа относительно липидов), 750 и 1660 см–1 (количество восстановленных цитохромов с-типа относительно содержания белков), 1127 и 1660 см–1 (количество восстановленных цитохромов b-типа относительно содержания белков) (рис. 5).
Установлено, что в астроцитах пациентов с БП по сравнению с астроцитами здоровых доноров наблюдается увеличение относительных интенсивностей пиков спектра КР, связанных с колебаниями связей гемов в восстановленных цитохромах с- и b-типов митохондрий. Этот результат свидетельствует о том, что митохондрии астроцитов пациентов с БП содержат больше цитохромов в восстановленной форме, чем митохондрии астроцитов здоровых доноров. Это в свою очередь свидетельствует о большей степени заполненности ЭТЦ электронами в митохондриях астроцитов при патологии. Количество восстановленных цитохромов с увеличивается по сравнению с количеством восстановленных цитохромов b (отношение интенсивности полос 750 и 1127 см–1; см. рис. 5). Кроме того, интенсивность КР для всех пиков, связанных с колебаниями связей в липидах, — 1440 и 2845 см–1, по сравнению с пиками, связанными с колебаниями связей в белках 1660 и 2930 см–1, снижается в астроцитах пациентов по сравнению с астроцитами здоровых доноров. Несмотря на то, что все указанные полосы характерны и для белков, и для липидов, их интенсивность в белках и липидах отличается, в связи с чем данные соотношения (отношения интенсивности полос 1660 и 1440 см–1 и 2930 и 2885 см–1) широко используют для оценки относительного содержания белков и липидов [29]. Рис. 5 демонстрирует уменьшение данных параметров, что, по всей вероятности, связано с уменьшением содержания белков в составе цитоплазмы и мембран астроцитов у пациента с БП. Данные отличия могут свидетельствовать об изменениях в процессах синтеза белка в астроцитах пациента и накоплении липидов в телах и отростках астроцитов пациентов.
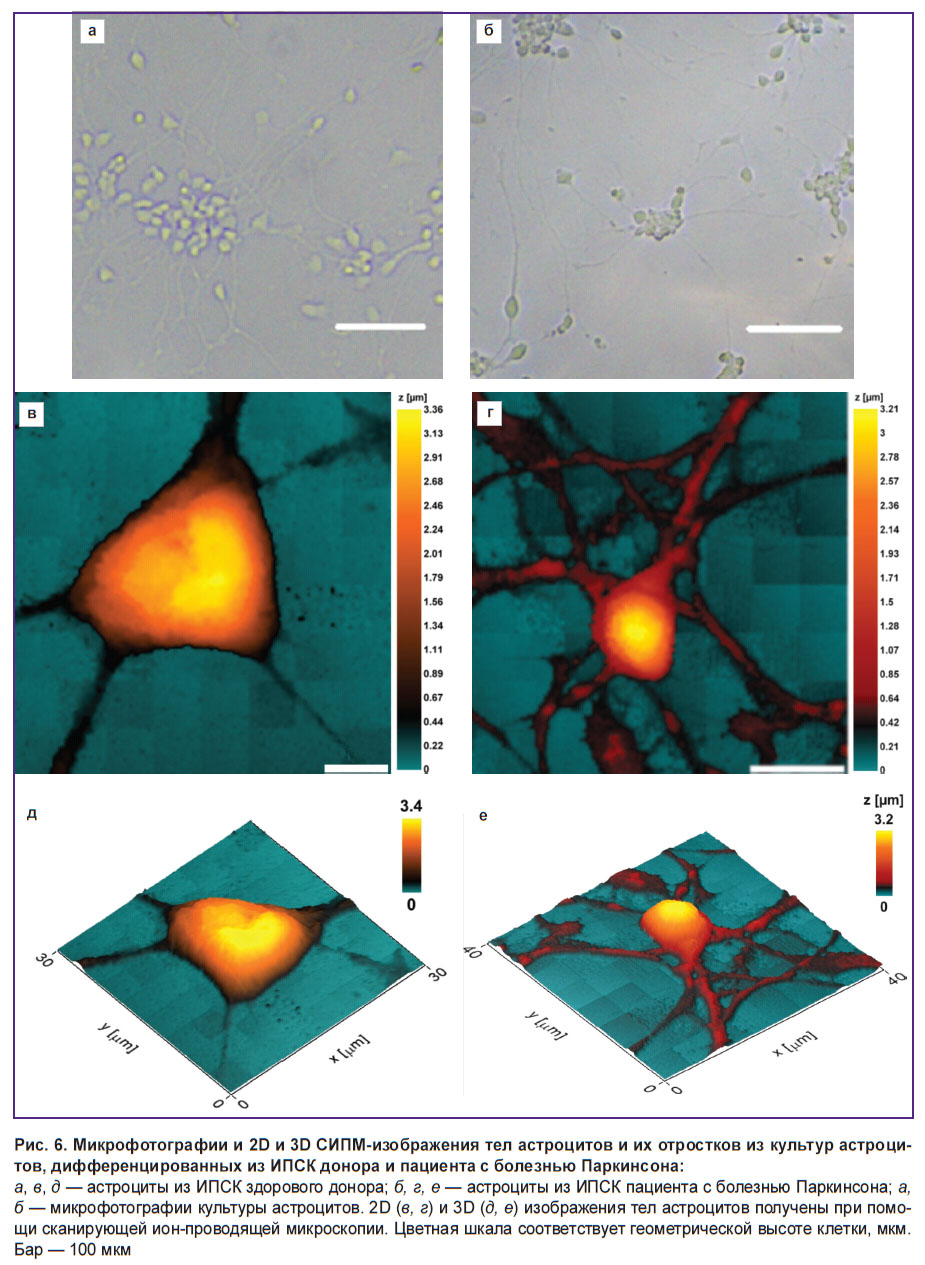
Исследование морфологии астроцитов, дифференцированных из ИПСК здорового донора и пациента с болезнью Паркинсона при помощи СИПМ. Морфологию клеток без их повреждения и деформации позволяет исследовать метод СИПМ. На рис. 6 представлены микрофотографии культур астроцитов, дифференцированных с его помощью из ИПСК донора и пациента с БП.
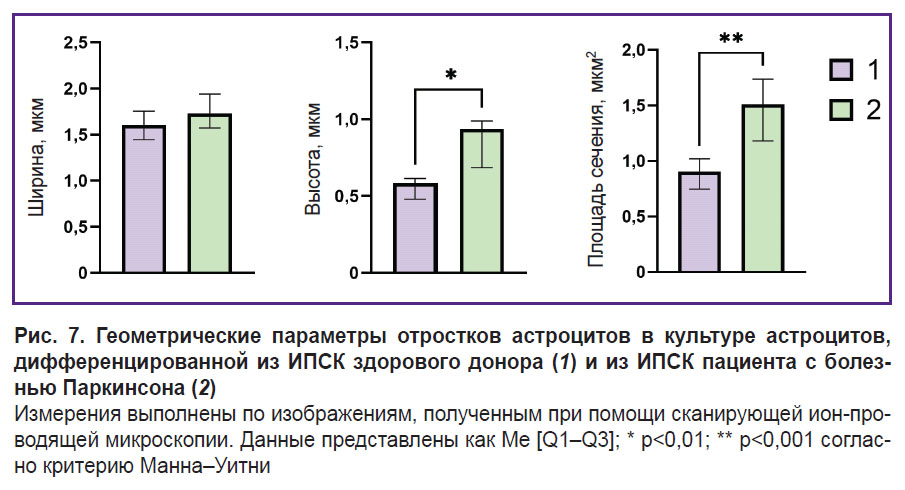
Установлено, что высота, а также общая морфология тел астроцитов, полученных из ИПСК доноров и пациентов с болезнью Паркинсона, достоверно не отличаются, в то время как высота отростков астроцитов, полученных из ИПСК пациентов с БП, больше, чем ее значение у здоровых доноров: высота отростков астроцитов здоровых доноров варьирует в диапазоне 0,58 [0,48–0,61] мкм (данные представлены как Me [Q1–Q3]), в то время как у астроцитов, выделенных из клеток пациента с БП, она составляла 0,94 [0,68–0,99] мкм. Кроме того, площадь сечения отростков астроцитов, полученных из ИПСК пациентов с БП, также была значимо выше, чем у астроцитов, выделенных из культуры здорового донора: площадь сечения отростков астроцитов, выделенных из культуры клеток здорового донора, составляла 0,90 [0,75–1,02] мкм2, в то время как у пациента с БП ее значение составляло 1,51 [1,18–1,74] мкм2 (рис. 7).
Мы предполагаем, что подобное изменение морфологии отростков астроцитов пациентов с БП может быть связано с изменениями в синтезе белков и изменением белок-липидного состава плазматической мембраны и цитоплазмы.
В последнее время ИПСК используются для исследования патогенеза БП [30, 31], что позволяет получать информацию о функционировании астроцитов человека без необходимости биопсии мозга пациентов. Однако в этом случае наблюдаются только изменения, связанные с генетическими факторами, и отсутствуют данные о влиянии на астроциты окружающих нейронов и других компонентов мозга. Известен целый ряд мутаций астроцитов, ассоциированных с развитием БП и вызывающих нарушение воспалительного ответа, функционирования митохондрий и лизосом, захвата глутамата и других функций. Показано, что у астроцитов с мутацией LRRK2 G2019S нарушена способность формирования гематоэнцефалического барьера. Такие астроциты также имеют ряд морфологических отличий, в частности нарушается формирование сети отростков, уменьшается число первичных и вторичных отростков [31]. Нарушаются также и функции митохондрий, наблюдается снижение уровня потребления кислорода и продукции АТФ по сравнению с клетками здоровых доноров. По-видимому, астроциты переключаются с окислительного фосфорилирования на аэробный гликолиз как основной путь получения энергии. В астроцитах из клеток больных БП содержится меньше митохондрий, которые локализованы преимущественно в перинуклеарном пространстве и отсутствуют в коротких отростках. Уровень окислительных повреждений в астроцитах с БП выше, чем в нормальных клетках.
Наши исследования полностью согласуются с описанной картиной нарушения морфологии и метаболизма астроцитов при БП. По данным спектроскопии КР, наблюдается увеличение количества восстановленных цитохромов с- и b-типов при патологии, что свидетельствует о большей степени заполненности ЭТЦ митохондрий электронами. Это может приводить к повышенной продукции АФК. Обнаруженные нами изменения морфологии отростков астроцитов, а именно увеличение высоты и поперечного сечения отростков у астроцитов, выделенных из культуры клеток пациентов с БП, можно интерпретировать как уменьшение относительного количества мелких отростков, что соответствует имеющимся данным о нарушении формирования сети отростков астроцитов при БП [31].
Предложенное авторами сочетание методов дает возможность получить более уникальную и точную информацию о состоянии ЭТЦ и морфологии сети отростков астроцитов, что позволяет повысить качество исследования патогенеза БП на клеточном и молекулярном уровнях.
Заключение
В ходе проведенного исследования было выявлено различное содержание белков и липидов в телах нейронов и их отростках. Хорошо разрешенные спектры КР позволяют получать информацию не только о составе различных участков клеток, но и о конформационных изменениях их компонентов, что в свою очередь позволяет судить о функциональном состоянии клеток. Для исследования тонких отростков нейронов был разработан подход с использованием метода ГКР.
Метод спектроскопии КР позволяет выявлять изменения относительного состава белков и липидов астроцитов, а также окислительно-восстановительного состояния цитохромов ЭТЦ митохондрий астроцитов, индуцированных из плюрипотентных стволовых клеток здоровых доноров и пациентов с БП. Показано, что при патологии наблюдается увеличение содержания восстановленных цитохромов. Это свидетельствует о перевосстановлении ЭТЦ, что может приводить к избыточной продукции АФК, вызывающей окислительный стресс.
Метод СИПМ позволяет получать информацию о морфологии нативных клеток в культуре без их повреждения или деформации (что характерно для таких методов, как атомно-силовая микроскопия).
Сочетание КР и СИПМ позволило впервые сравнить морфологию тел и отростков астроцитов, а также функциональное состояние астроцитов, индуцированных из плюрипотентных стволовых клеток здоровых доноров и пациентов с наследственной болезнью Паркинсона.
Полученные результаты служат основой создания систем для комплексной оценки состояния и функциональной активности нейронов и астроцитов при различных нейродегенерациях.
Финансирование. Работа выполнена при финансовой поддержке грантов Российского научного фонда: исследование редокс-состояния митохондрий и белок/липидного состава в нейронах и астроцитах при помощи спектроскопий комбинационного рассеяния и гигантского комбинационного рассеяния — при поддержке гранта №23-44-00015; исследование морфологии астроцитов — при поддержке гранта №23-44-00103.
Конфликт интересов отсутствует.
Благодарность. Авторы выражают благодарность за возможность работы в лаборатории биофизики Национального исследовательского технологического университета «МИСиС» А.С. Ерофееву.
Литература
- Jaeger D., Pilger C., Hachmeister H., Oberländer E., Wördenweber R., Wichmann J., Mussgnug J.H., Huser T., Kruse O. Label-free in vivo analysis of intracellular lipid droplets in the oleaginous microalga Monoraphidium neglectum by coherent Raman scattering microscopy. Sci Rep 2016; 6: 35340, https://doi.org/10.1038/srep35340.
- Samek O., Jonáš A., Pilát Z., Zemánek P., Nedbal L., Tříska J., Kotas P., Trtílek M. Raman microspectroscopy of individual algal cells: sensing unsaturation of storage lipids in vivo. Sensors (Basel) 2010; 10(9): 8635–8651, https://doi.org/10.3390/s100908635.
- Subramanian B., Thibault M.H., Djaoued Y., Pelletier C., Touaibia M., Tchoukanova N. Chromatographic, NMR and vibrational spectroscopic investigations of astaxanthin esters: application to “Astaxanthin-rich shrimp oil” obtained from processing of Nordic shrimps. Analyst 2015; 140(21): 7423–7433, https://doi.org/10.1039/c5an01261a.
- Brazhe N.A., Evlyukhin A.B., Goodilin E.A., Semenova A.A., Novikov S.M., Bozhevolnyi S.I., Chichkov B.N., Sarycheva A.S., Baizhumanov A.A., Nikelshparg E.I., Deev L.I., Maksimov E.G., Maksimov G.V., Sosnovtseva O. Probing cytochrome c in living mitochondria with surface-enhanced Raman spectroscopy. Sci Rep 2015; 5: 13793, https://doi.org/10.1038/srep13793.
- Nikelshparg E.I., Grivennikova V.G., Baizhumanov A.A., Semenova A.A., Sosnovtseva V., Goodilin E.A., Maksimov G.V., Brazhe N.A. Probing lipids in biological membranes using SERS. Mendeleev Communications 2019; 29(6): 635–637, https://doi.org/10.1016/j.mencom.2019.11.009.
- Pilot R., Signorini R., Durante C., Orian L., Bhamidipati M., Fabris L. A review on surface-enhanced Raman scattering. Biosensors (Basel) 2019; 9(2): 57, https://doi.org/10.3390/bios9020057.
- Premasiri W.R., Chen Y., Fore J., Brodeur A., Ziegler L.D. Chapter 10 — SERS biomedical applications: diagnostics, forensics, and metabolomics. In: Laane J. (editor). Frontiers and advances in molecular spectroscopy. Elsevier; 2018; p. 327–367, https://doi.org/10.1016/B978-0-12-811220-5.00010-1.
- Langer J., Jimenez de Aberasturi D., Aizpurua J., Alvarez-Puebla R.A., Auguié B., Baumberg J.J., Bazan G.C., Bell S.E.J., Boisen A., Brolo A.G., Choo J., Cialla-May D., Deckert V., Fabris L., Faulds K., García de Abajo F.J., Goodacre R., Graham D., Haes A.J., Haynes C.L., Huck C., Itoh T., Käll M., Kneipp J., Kotov N.A., Kuang H., Le Ru E.C., Lee H.K., Li J.F., Ling X.Y., Maier S.A., Mayerhöfer T., Moskovits M., Murakoshi K., Nam J.M., Nie S., Ozaki Y., Pastoriza-Santos I., Perez-Juste J., Popp J., Pucci A., Reich S., Ren B., Schatz G.C., Shegai T., Schlücker S., Tay L.L., Thomas K.G., Tian Z.Q., Van Duyne R.P., Vo-Dinh T., Wang Y., Willets K.A., Xu C., Xu H., Xu Y., Yamamoto Y.S., Zhao B., Liz-Marzán L.M. Present and future of surface-enhanced Raman scattering. ACS Nano 2020; 14(1): 28–117, https://doi.org/10.1021/acsnano.9b04224.
- Kuku G., Altunbek M., Culha M. Surface-enhanced Raman scattering for label-free living single cell analysis. Anal Chem 2017; 89(21): 11160–11166, https://doi.org/10.1021/acs.analchem.7b03211.
- Romo-Herrera J.M., Juarez-Moreno K., Guerrini L., Kang Y., Feliu N., Parak W.J., Alvarez-Puebla R.A. Paper-based plasmonic substrates as surface-enhanced Raman scattering spectroscopy platforms for cell culture applications. Mater Today Bio 2021; 11: 100125, https://doi.org/10.1016/j.mtbio.2021.100125.
- Shen Y., Yue J., Xu W., Xu S. Recent progress of surface-enhanced Raman spectroscopy for subcellular compartment analysis. Theranostics 2021; 11(10): 4872–4893, https://doi.org/10.7150/thno.56409.
- Ando J., Fujita K., Smith N.I., Kawata S. Dynamic SERS imaging of cellular transport pathways with endocytosed gold nanoparticles. Nano Lett 2011; 11(12): 5344–5348, https://doi.org/10.1021/nl202877r.
- Chen J., Wang J., Geng Y., Yue J., Shi W., Liang C., Xu W., Xu S. Single-cell oxidative stress events revealed by a renewable SERS nanotip. ACS Sens 2021; 6(4): 1663–1670, https://doi.org/10.1021/acssensors.1c00395.
- Zhang Y., Jimenez de Aberasturi D., Henriksen-Lacey M., Langer J., Liz-Marzán L.M. Live-cell surface-enhanced Raman spectroscopy imaging of intracellular pH: from two dimensions to three dimensions. ACS Sens 2020; 5(10): 3194–3206, https://doi.org/10.1021/acssensors.0c01487.
- Semenova A.A., Goodilin E.A., Brazhe N.A., Ivanov V.K., Baranchikov A.E., Lebedev V.A., Goldt A.E., Sosnovtseva O.V., Savilov S.V., Egorov A.V., Brazhe A.R., Parshina E.Y., Luneva O.G., Maksimov G.V., Tretyakov Y.D. Planar SERS nanostructures with stochastic silver ring morphology for biosensor chips. Journal of Materials Chemistry 2012; 22(47): 24530–24544, https://doi.org/10.1039/C2JM34686A.
- Lill C.M. Genetics of Parkinson’s disease. Mol Cell Probes 2016; 30(6): 386–396, https://doi.org/10.1016/j.mcp.2016.11.001.
- Verkhratsky A., Parpura V., Li B., Scuderi C. Astrocytes: the housekeepers and guardians of the CNS. Adv Neurobiol 2021; 26: 21–53, https://doi.org/10.1007/978-3-030-77375-5_2.
- Marina N., Christie I.N., Korsak A., Doronin M., Brazhe A., Hosford P.S., Wells J.A., Sheikhbahaei S., Humoud I., Paton J.F.R., Lythgoe M.F., Semyanov A., Kasparov S., Gourine A.V. Astrocytes monitor cerebral perfusion and control systemic circulation to maintain brain blood flow. Nat Commun 2020; 11(1): 131, https://doi.org/10.1038/s41467-019-13956-y.
- Qian K., Jiang X., Liu Z.Q., Zhang J., Fu P., Su Y., Brazhe N.A., Liu D., Zhu L.Q. Revisiting the critical roles of reactive astrocytes in neurodegeneration. Mol Psychiatry 2023; 28(7): 2697–2706, https://doi.org/10.1038/s41380-023-02061-8.
- Verkhratsky A., Rodrigues J.J., Pivoriunas A., Zorec R., Semyanov A. Astroglial atrophy in Alzheimer’s disease. Pflugers Arch 2019; 471(10): 1247–1261, https://doi.org/10.1007/s00424-019-02310-2.
- Yang Z., Wang K.K. Glial fibrillary acidic protein: from intermediate filament assembly and gliosis to neurobiomarker. Trends Neurosci 2015; 38(6): 364–374, https://doi.org/10.1016/j.tins.2015.04.003.
- Korchev Y.E., Bashford C.L., Milovanovic M., Vodyanoy I., Lab M.J. Scanning ion conductance microscopy of living cells. Biophys J 1997; 73(2): 653–658, https://doi.org/10.1016/S0006-3495(97)78100-1.
- Korchev Y.E., Milovanovic M., Bashford C.L., Bennett D.C., Sviderskaya E.V., Vodyanoy I., Lab M.J. Specialized scanning ion-conductance microscope for imaging of living cells. J Microsc 1997; 188(Pt 1): 17–23, https://doi.org/10.1046/j.1365-2818.1997.2430801.x.
- Novak P., Li C., Shevchuk A.I., Stepanyan R., Caldwell M., Hughes S., Smart T.G., Gorelik J., Ostanin V.P., Lab M.J., Moss G.W., Frolenkov G.I., Klenerman D., Korchev Y.E. Nanoscale live-cell imaging using hopping probe ion conductance microscopy. Nat Methods 2009; 6(4): 279–281. Corrected and republished from: Nat Methods 2009; 6(12): 935, https://doi.org/10.1038/nmeth.1306.
- Novak P., Shevchuk A., Ruenraroengsak P., Miragoli M., Thorley A.J., Klenerman D., Lab M.J., Tetley T.D., Gorelik J., Korchev Y.E. Imaging single nanoparticle interactions with human lung cells using fast ion conductance microscopy. Nano Lett 2014; 14(3): 1202–1207, https://doi.org/10.1021/nl404068p.
- Novosadova E., Dolotov O., Inozemtseva L., Novosadova L., Antonov S., Shimchenko D., Bezuglov V., Vetchinova A., Tarantul V., Grivennikov I., Illarioshkin S. Influence of N-arachidonoyl dopamine and N-docosahexaenoyl dopamine on the expression of neurotrophic factors in neuronal differentiated cultures of human induced pluripotent stem cells under conditions of oxidative stress. Antioxidants (Basel) 2022; 11(1): 142, https://doi.org/10.3390/antiox11010142.
- Novosadova E.V., Arsenyeva E.L., Manuilova E.S., Khaspekov L.G., Bobrov M.Y., Bezuglov V.V., Illarioshkin S.N., Grivennikov I.A. Neuroprotective properties of endocannabinoids N-arachidonoyl dopamine and N-docosahexaenoyl dopamine examined in neuronal precursors derived from human pluripotent stem cells. Biochemistry (Moscow) 2017; 82(11): 1367–1372, https://doi.org/10.1134/s0006297917110141.
- Новосадова Е.В., Арсеньева Е.Л., Антонов С.А., Казанцева Е.А., Новосадова Л.В., Курко О.Д., Иллариошкин С.Н., Тарантул В.З., Гривенников И.А. Получение и характеристика глиальных клеток из индуцированных плюрипотентных стволовых клеток человека. Нейрохимия 2020; 37(4): 358–367, https://doi.org/10.31857/S1027813320040068.
- Senkovenko A., Skryabin G., Parshina E., Piryazev A., Tchevkina E., Bagrov D. Characterization of extracellular vesicles by sulfophosphovanillin colorimetric assay and Raman spectroscopy. Front Biosci (Landmark Ed) 2024; 29(10): 366, https://doi.org/10.31083/j.fbl2910366.
- de Rus Jacquet A., Alpaugh M., Denis H.L., Tancredi J.L., Boutin M., Decaestecker J., Beauparlant C., Herrmann L., Saint-Pierre M., Parent M., Droit A., Breton S., Cicchetti F. The contribution of inflammatory astrocytes to BBB impairments in a brain-chip model of Parkinson’s disease. Nat Commun 2023; 14(1): 3651, https://doi.org/10.1038/s41467-023-39038-8.
- Ramos-Gonzalez P., Mato S., Chara J.C., Verkhratsky A., Matute C., Cavaliere F. Astrocytic atrophy as a pathological feature of Parkinson’s disease with LRRK2 mutation. NPJ Parkinsons Dis 2021; 7(1): 31, https://doi.org/10.1038/s41531-021-00175-w.