Миграция регуляторных t-клеток в периопухолевое микроокружение экспериментальной глиобластомы
Глиобластома — первичная опухоль головного мозга с самым агрессивным течением и неблагоприятным прогнозом, характеризующаяся резистентностью к стандартным методам лечения и ускользанием от противоопухолевого иммунитета. Регуляторные T-лимфоциты (Treg) играют ключевую роль в подавлении иммунитета в опухолевом микроокружении и могут выступать в качестве мишени для терапии злокачественных глиом.
Цель работы — исследовать миграцию Treg в очаг опухоли в процессе динамического роста глиобластомы на трансгенной линии мышей C57Bl/6-FoxP3-eGFP.
Материалы и методы. Исследование выполнено на мышах линии C57Bl/6-FoxP3-eGFP, позволяющей детектировать FoxP3-позитивные Treg по флуоресцентному сигналу. Ортотопические глиобластомы получали путем стереотаксического введения флуоресцентно меченных опухолевых клеток линий GL-261-BFP и GL-261-mScarlet. С помощью интравитальной конфокальной микроскопии отслеживали инфильтрацию опухолевого очага иммунными клетками, меченными с помощью внутривенного введения антител против CD45 с флуоресцентной меткой. Результаты интравитальной микроскопии подтверждали с помощью гистологического и иммуногистохимического исследования на 3, 6, 9, 14 и 16-е сутки после имплантации. Для оценки иммунологического статуса выделяли из мозга опухоль-инфильтрирующие лимфоциты (TILs) и проводили подсчет Treg на проточном цитометре (после выделения и при 9культивировании в течение 2 нед).
Результаты. Интравитальная микроскопия и исследование срезов мозга продемонстрировали инфильтрацию регуляторными Т-клетками очага глиобластомы, при этом доля этих клеток увеличивалась по мере прогрессии опухоли (увеличение абсолютного числа Treg пропорционально увеличению количества клеток глиомы). Последующее сокультивирование выделенных TILs с клетками глиомы показало обогащение популяции Treg в течение 2 нед с 2,8 до более чем 40%, что подтверждает активирующее действие глиобластомы в отношении Treg.
Заключение. Исследована динамика инфильтрации микроокружения глиомы GL-261 регуляторными Т-клетками. Показано, что клетки глиобластомы активируют Treg в периоопухолевом пространстве in vivo и способствуют их селективной экспансии при сокультивировании с TILs in vitro. Полученные данные могут быть использованы для дальнейших исследований на линии мышей C57Bl/6-FoxP3-eGFP по поиску способов инактивации Treg при глиобластоме.
Введение
Глиобластома является самой распространенной и малокурабельной опухолью головного мозга. В настоящее время пятилетняя выживаемость пациентов с глиобластомами не превышает 5–10% [1]. Это свидетельствует о неэффективности стандартного лечения (максимально возможная хирургическая резекция, лучевая терапия и химиотерапия темозоломидом и бевацизумабом), поэтому существует острая необходимость в разработке новых терапевтических подходов [2, 3].
Одним из возможных вариантов решения проблемы может стать неоадъювантная иммунотерапия [4]. Однако первые попытки клеточной иммунотерапии глиобластомы не увенчались успехом во многом вследствие ее микроокружения, которое обусловливает высокий уровень иммуносупрессии в очаге опухоли [5]. Стремительное развитие глиобластомы часто приводит к тому, что пациенты обращаются за специализированной помощью, когда опухоль уже имеет значительный размер и сформированное иммуносупрессивное микроокружение, характеризующееся снижением CD4+ Т-хелперов, цитотоксической активности и пролиферации CD8+ Т-лимфоцитов, а также увеличением содержания Treg и других неопухолевых клеток микроокружения [6, 7].
Опухолевое микроокружение представляет собой сложную систему взаимодействия множества компонентов: клетки опухоли, в том числе стволоподобные клетки глиомы, воздействуют на экстрацеллюлярный матрикс, эндотелиоциты, фибробласты, мезенхимальные стромальные клетки (МСК), а также иммунные клетки, способствуя приобретению ими проопухолевого фенотипа [8–10]. Регуляторные Т-клетки (regulatory T cells, Treg), в норме выполняющие функцию контроля воспалительных и аутоиммунных реакций в организме, вносят наибольший вклад в подавление естественного противоопухолевого иммунного ответа [11]. В связи с этим инактивация Treg является одной из самых очевидных проблем при разработке таргетной иммунотерапии глиом [12–15].
Изучение поведения Treg в процессе формирования опухолевого микроокружения глиобластомы представляет собой актуальную задачу, которую невозможно реализовать на ксенографтной модели глиобластомы человека у иммунодефицитных мышей вследствие дефекта у них клеточного звена иммунитета. Решение этой проблемы возможно с помощью трансгенной линии мышей C57Bl/6-FoxP3-eGFP, позволяющей детектировать активированные Treg в тканях. У данной линии мышей в первый экзон гена транскрипционного фактора FoxP3 клонирована последовательность зеленого флуоресцентного белка eGFP (enhanced green fluorescent protein). Активация Treg всегда сопровождается экспрессией FoxP3 [16], при этом у мышей C57Bl/6-FoxP3-eGFP в данных клетках возникает экспрессия eGFP, что позволяет визуализировать активные регуляторные CD4+ CD25+ FoxP3+ Т-клетки с помощью флуоресцентной микроскопии в соответствующем канале (Ex 475 нм, Em 508 нм). Детекция Treg у этих мышей возможна как на срезах интересующего органа, так и методом интравитальной конфокальной микроскопии в режиме реального времени.
Цель работы — исследовать миграцию регуляторных Т-лимфоцитов в очаг опухоли в процессе динамического роста глиобластомы на трансгенной линии мышей C57Bl/6-FoxP3-eGFP.
Материалы и методы
Клеточные линии. В работе для моделирования экспериментальной ортотопической глиобластомы применялись линии мышиной глиомы GL-261-mScarlet (трансдуцирована красным белком-флуорофором mScarlet) и GL-261-BFP (трансдуцирована синим флуоресцирующим белком BFP), любезно предоставленные Алексеем Степаненко (отдел нейробиологии Национального медицинского исследовательского центра психиатрии и наркологии им. В.П. Сербского, Москва).
Клетки после изъятия из криобанка культивировали в среде DMEM F12 с добавлением 20% сыворотки FBS (fetal bovine serum) и 1% антибиотика–антимикотика; конфлюентность в культуре оценивали с помощью светового микроскопа Primo Vert (Zeiss, Германия). Подсчет клеток производили в автоматическом счетчике клеток Countess 3 Automated Cell Counter (Thermo Fisher Scientific, США).
Непосредственно перед имплантацией мышам клетки глиомы снимали с культурального флакона с помощью фермента TrypLE. Полученные клетки отмывали от среды с ферментом, ресуспендировали в растворе DPBS для последующей инъекции.
Опухоль-инфильтрирующие лимфоциты (tumor-infiltrating lymphocytes, TILs) из ткани глиобластомы получали у 4 мышей на 6-й день после имплантации (сразу после интравитальной микроскопии) по протоколу, описанному ранее [16]. Для кокультивирования глиомы с TILs на плоскодонных адгезионных планшетах использовали среду IMDM с добавлением 20% сыворотки FBS и 1% пенициллина–стрептомицина.
Экспериментальная линия трансгенных мышей. Сингенную глиобластому моделировали у 16 трансгенных мышей линии C57Bl/6-FoxP3-eGFP (виварий НИИ экспериментальной онкологии и биомедицинских технологий Приволжского исследовательского медицинского университета, Н. Новгород). У данной линии мышей в первый экзон гена FoxP3 клонирована последовательность eGFP для идентификации регуляторных FoxP3+ CD4+ T-клеток.
Все протоколы исследования на животных были одобрены локальным этическим комитетом Федерального научно-клинического центра ФМБА России (протокол №7 от 6.09.2022). Исследование проведено в полном соответствии правилам работы с лабораторными животными (Рекомендация Коллегии Евразийской экономической комиссии от 14.11.2023 №33 «О Руководстве по работе с лабораторными (экспериментальными) животными при проведении доклинических (неклинических) исследований»).
Моделирование экспериментальной глиобластомы. Для получения ортотопической сингенной глиомы 4–5-недельных мышей анестезировали Золетилом (40 мг/кг, 50 мкл) и Рометаром (8 мг/мл, 50 мкл) и фиксировали через ушные проходы в стереотаксической системе (RWD Life Science, Китай). Мышей скальпировали и выполняли трепанационное отверстие в черепе в проекции стриатума правого полушария головного мозга с помощью сверла Drill Bits HM1005 0,5 мм, Round Tip (RWD Life Science, Китай). Клетки GL-261 (150 тыс. клеток в 5 мкл стерильного фосфатно-солевого буфера Дульбекко) вводили с помощью микропомпы со скоростью 1 мкл/мин. Для проведения иммуногистохимического анализа и проточной цитометрии суспензию клеток глиомы линии GL-261-BFP стереотаксически вводили в стриатум головного мозга 8 мышей (из них 3 животных были перфузированы на 9-е сутки, 3 животных — на 16-е). Для проведения интравитальной конфокальной микроскопии 5 мкл суспензии клеток глиомы линии GL-261-mScarlet инъецировали в кору правого полушария головного мозга 8 мышей: 6 животным выполнена прижизненная микроскопия на 3, 6 и 9-е сутки, у оставшихся 2 животных на 6-е сутки была выделена опухоль, из которой получили TILs для кокультивирования с клетками GL-261-mScarlet.
Магнитно-резонансная томография. Динамическое мониторирование экспериментальной глиобластомы проводили 5 из 8 мышей с глиомой GL-261-BFP на 7, 14, 21-е сутки и всем мышам с глиомой GL-261-mScarlet на 1, 9 и 16-е сутки после имплантации (перед проведением микроскопии). Исследование выполняли с помощью магнитно-резонансного томографа для малых лабораторных животных ClinScan 7T (Bruker Biospin, Германия), установленного в Центре коллективного пользования «Медицинские и биотехнологические нанотехнологии» Российского национального исследовательского медицинского университета им. Н.И. Пирогова (Москва). Сканирование проводили под ингаляционным наркозом 1,5% изофлураном в кислородной смеси при скорости потока 250 мл/мин с помощью аппарата EZ-7000 Classic System (E-Z Systems Inc., США). T2-взвешенные изображения в аксиальной, коронарной и сагиттальной проекциях получали с помощью катушки для головного мозга мелких лабораторных животных.
Интравитальная конфокальная микроскопия. Исследование проводили методом интравитальной микроскопии (ИВМ) на конфокальном микроскопе Nikon A1 MP (Nikon, Япония) с подогреваемым адаптерным столиком, оптимизированным для работы с круглыми покровными стеклами диаметром 50 мм. Мышей с поверхностным расположением глиомы GL-261-mScarlet в коре головного мозга, подтвержденной методом МРТ, анестезировали Рометаром (8 мг/мл, 50 мкл) и Золетилом (19 мг/кг); в стерильных условиях формировали интракраниальное окно, после чего укладывали животное на столик таким образом, чтобы зона интереса плотно прилегала к поверхности покровного стекла и была доступна для проведения микроскопии. Для оценки общей инфильтрации опухолевого микроокружения иммунными клетками за 15 мин до ИВМ в хвостовую вену вводили 2 мкл раствора меченых антител Brilliant Violet 421 anti-mouse CD45 antibody (BioLegend, США) в 100 мкл DPBS. Локализацию меченых клеток относительно очага опухоли определяли с помощью пошаговой съемки со смещением по оси Z. Сканирование нескольких фрагментов опухоли проводили поочередно на протяжении 120 мин (1 кадр 512×512 или 1024×1024 px каждые 40–60 с). Далее все изображения объединяли в «стек», получая таким образом 3D-модель ткани. Детектирование Treg проводили по сигналу eGFP; клеток глиомы — по сигналу mScarlet. Конфокальные микроскопические изображения обрабатывали с помощью программного обеспечения NIS Elements AR (Nikon, Япония). По завершении ИВМ интракраниальное окно укрывали кожным лоскутом, накладывали матрасный шов и далее обрабатывали раствором антисептика.
Иммунофлуоресцентный анализ на срезах мозга. Исследование срезов мозга проводили у 6 мышей с глиомой GL-261-BFP, имплантированной в стриатум, на 9-е и 16-е сутки после имплантации. Животных глубоко наркотизировали запредельной дозой пропофола и проводили им транскардиальную перфузию 4% раствором параформальдегида. После перфузии животных декапитировали и выделяли головной мозг с помощью ножниц и пинцета. Выделенный головной мозг мыши дофиксировали в течение 48 ч при 4°C в 4% растворе параформальдегида, после чего приготавливали 50 мкм срезы на вибротоме Microm HM 650V 5100mz (Campden Instruments, Англия).
Иммуноцитохимический анализ. С целью выявления Treg в микроокружении глиобластомы полученные срезы монтировали на стекло для последующей конфокальной микроскопии. Перед монтированием часть срезов дополнительно окрашивали с помощью первично меченных антител к CD105 для визуализации МСК. Окрашенные срезы монтировали на предметное стекло с помощью гипофлуоресцентной монтирующей среды Faramount Mounting Medium. Некоторые срезы перед монтированием дополнительно окрашивали DAPI (синий флуоресцентный краситель, связывающийся с ДНК) для контрастирования ядер клеток (1 мкл на 100 мкл буфера). Результаты иммуноцитохимии оценивали методом конфокальной лазерной сканирующей микроскопии (Nikon Eclipse Ti-2; Nikon, Япония). Все полученные данные были проанализированы с помощью программного обеспечения NIS Elements Viewer v. 5.21.
Выделение и проточная цитометрия Treg в опухоль-инфильтрирующих лимфоцитах. Для выделения TILs из интракраниальной опухоли животных глубоко наркотизировали и выполняли цервикальную дислокацию. Кожу и шерсть мышей обрабатывали спиртом. После декапитации маленькими хирургическими ножницами вскрывали кожу головы над теменными костями, подрезали край черепа, аккуратно разводили кости. Пинцетом извлекали головной мозг мыши и помещали его в 15 мл фалькон с DPBS + антибиотик–антимикотик. В дальнейшем в чашке Петри отбрасывали обонятельные луковицы и мозжечок и разделяли правое и левое полушарие мозга друг от друга для последующего сравнения (глиому имплантировали в правое полушарие, левое — контрольное). Каждое полушарие отдельно измельчали с добавлением DPBS до состояния суспензии. Дважды пропускали через сито (клеточный фильтр) с размером пор 100 мкм. Полученные клетки центрифугировали в течение 5 мин (400 g, 3 ускорения, 3 замедления); осадок суспендировали в буферном растворе для проточной цитометрии (Miltenyi Biotech, Германия). Оставшуюся часть выделенных из мозга TILs наращивали, как было описано ранее [17].
В полученных TILs оценивали долю CD4+ CD25+ FoxP3+ T-клеток. Исследование проводили с помощью первично меченных антител на проточном цитометре MACSQuant Analyzer 16 (Miltenyi Biotec, Германия) непосредственно после выделения TILs на 6-е сутки развития опухоли и при последующем культивировании в течение 14 дней. Полученные результаты анализировали с помощью программного обеспечения FlowJo v. 9.
Результаты
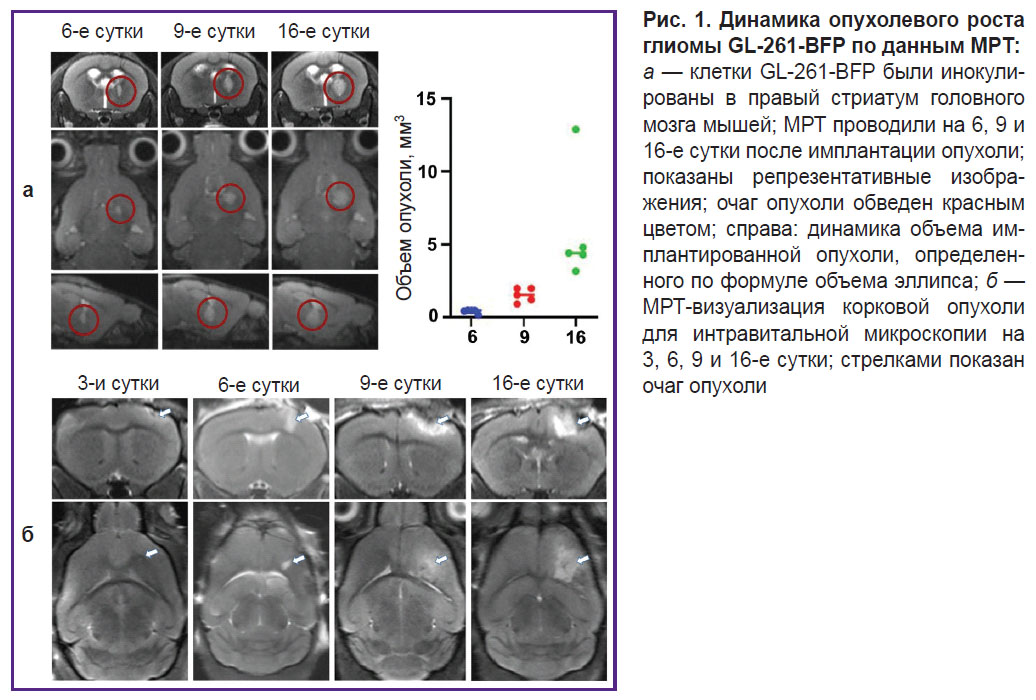
Характеристика интракраниального роста глиобластомы GL-261 методом МРТ. Для первичной характеристики роста глиомы 5 животным была выполнена динамическая МРТ на 6, 9 и 16-е сутки. Глиома обнаруживалась на 9-е сутки у всех животных и к 16-м суткам объем ее достигал 5,5 [3,8; 13,4] мм3 (рис. 1, а). С целью корковой локализации глиомы необходимо было выбрать сроки, наиболее подходящие для интравитальных исследований (с максимально поверхностным расположением опухоли). Для этого после имплантации GL-261-BFP в кору мозга ежедневно проводили МРТ-исследования. Рост опухоли начинал детектироваться на 3–4-е сутки (рис. 1, б). Вплоть до 6 сут размеры опухоли постепенно увеличивались, поверхностная локализация глиомы сохранялась. На 9-е и особенно на 16-е сутки наблюдалось существенное увеличение объема опухоли и распространение ее вглубь мозга. Исходя из особенностей роста глиомы по данным МРТ, для проведения интравитальной микроскопии и иммунофлуоресцентных исследований были выбраны следующие временны́е точки — 3, 6, 9 и 16-е сутки.
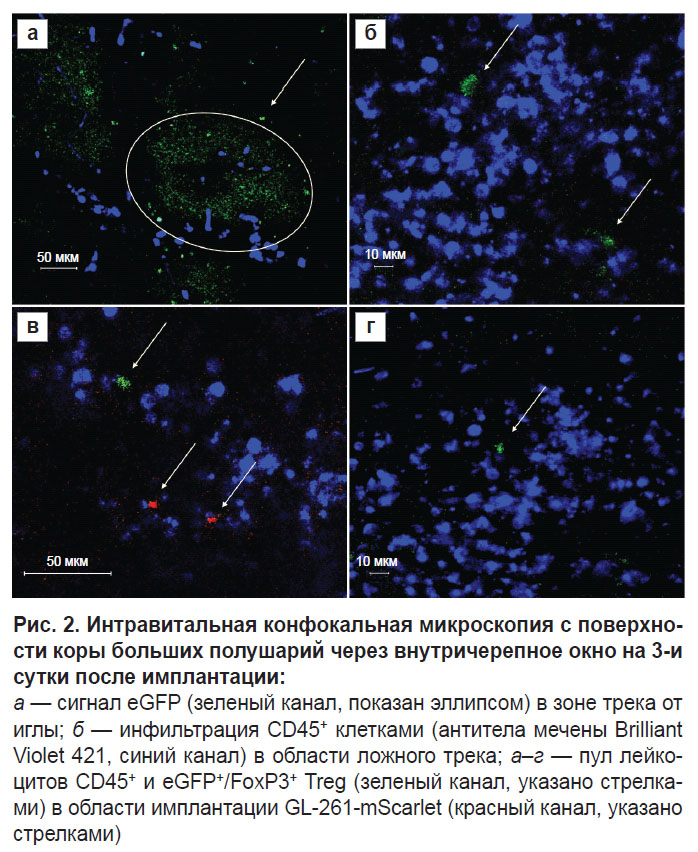
Интравитальная конфокальная микроскопия. С помощью ИВМ оценивали инфильтрацию Treg в процессе развития интракраниальной глиомы начиная с 3 сут после имплантации клеток GL-261-mScarlet в кору головного мозга. На этом сроке размеры опухоли таковы, что МРТ-картина почти не отличается от МРТ трека при ложной имплантации глиомы (см. рис. 1, б). ИВМ на этом сроке показала выраженную инфильтрацию CD45+ лейкоцитами начиная с области мягкой мозговой оболочки в зоне трека от иглы (рис. 2, а). На общем фоне CD45+ клеток наблюдались лишь единичные FoxP3+ Treg, детектируемые у мышей по сигналу eGFP+, доля которых не превышала 1% (рис. 2, б–г).
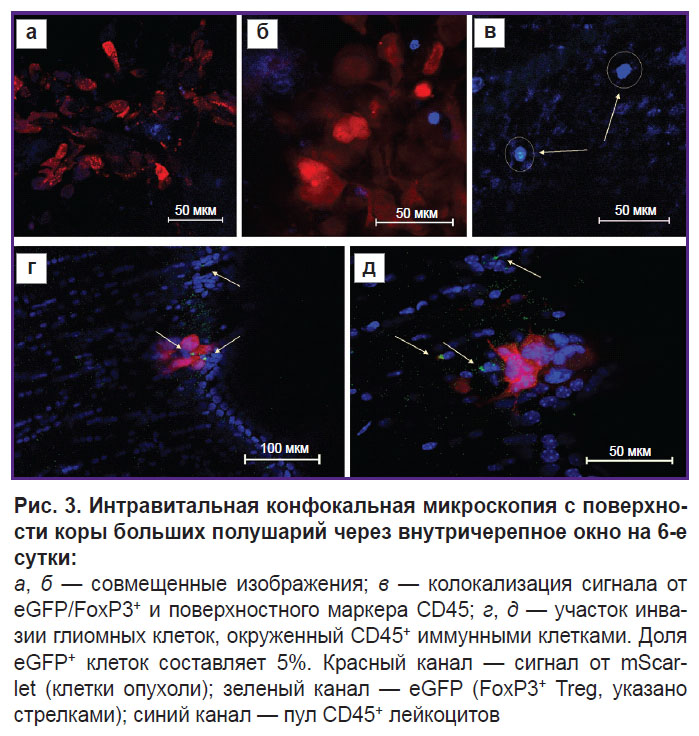
На 6-е сутки развития опухоли сигналов от eGFP+ FoxP3+ Treg в опухоли и периопухолевом пространстве по данным ИВМ стало больше, однако их доля по-прежнему не превышала 5% от общего количества инфильтрирующих периопухолевое пространство иммунных клеток (рис. 3).
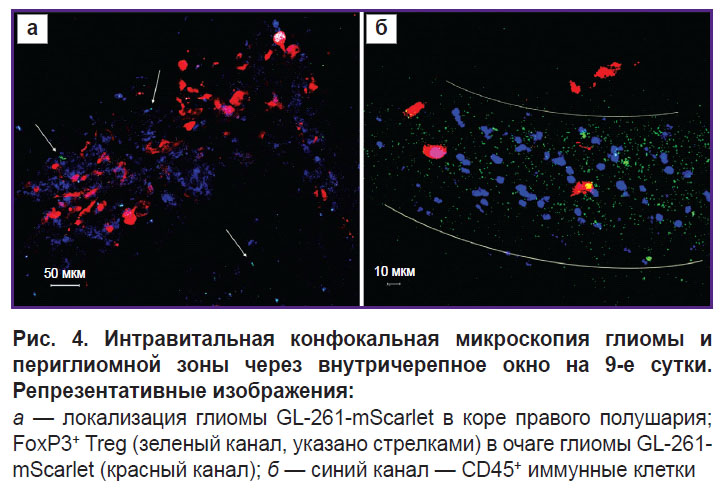
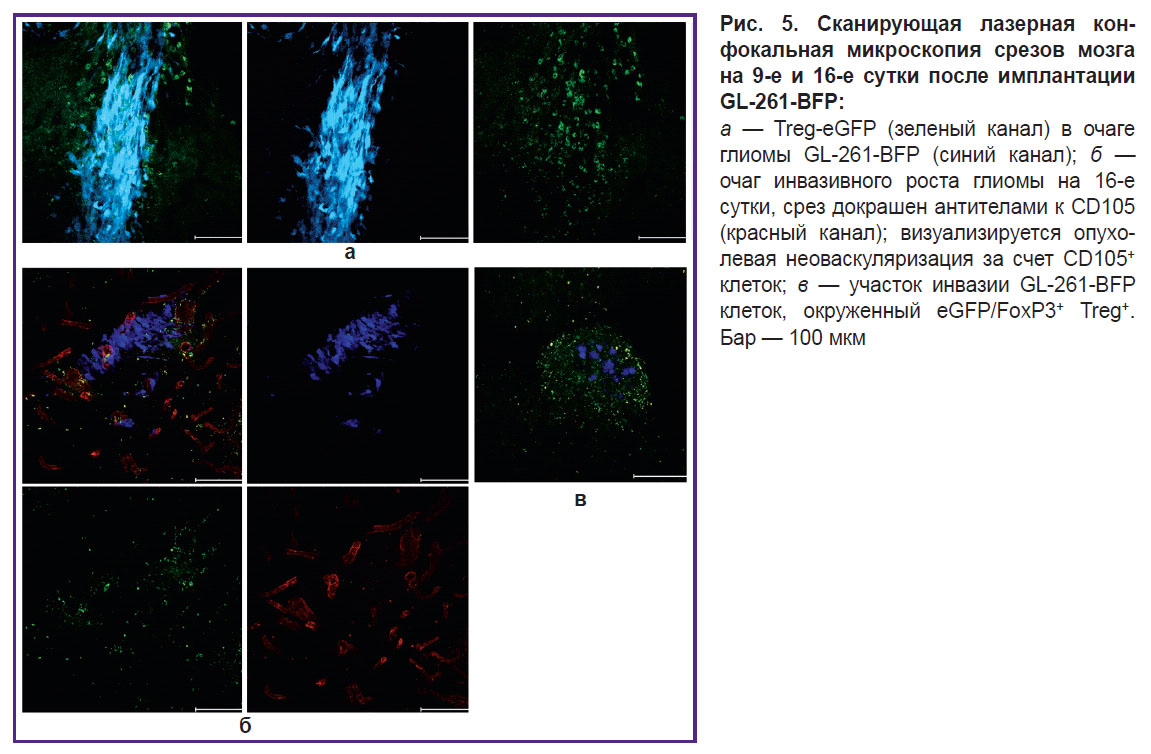
На 9-е сутки развития опухоли мы детектировали максимальное количество eGFP+, экспрессирующих FoxP3 Treg в периглиомном пространстве. Количество Treg на этом сроке в детектируемой с помощью ИВМ части опухоли достигало 10%, а в периопухолевом пространстве — около 40% (рис. 4). Вместе с тем на 9-е сутки с помощью ИВМ можно было визуализировать только полюс глиомы. Основная масса опухоли вследствие инвазивного роста за пределы внутричерепного окна и вглубь мозга была недоступна для исследования. Для того чтобы визуализировать весь очаг опухоли, проводили дополнительную серию экспериментов на 6 мышах C57Bl/6-FoxP3-eGFP с глиомой GL-261-BFP, имплантированной в стриатум. По 3 животных из этой серии были перфузированы на 9-е и 16-е сутки. Флуоресцентную визуализацию выполняли на свежеприготовленных вибротомных срезах опухолей. В красном канале в данной серии экспериментов визуализировали CD105+ опухоль-ассоциированные стромальные клетки, также играющие важную роль в иммуносупрессивном опухолевом микроокружении.
Флуоресцентная визуализация на срезах опухоли выявила, что на 9-е и 16-е сутки в толще опухоли и в периопухолевом пространстве до 50% от общего числа иммунных клеток составляют eFGP+/FoxP3+ Treg (рис. 5, а). Окрашивание антителами к CD105 выявило интенсивный опухолевый неоангиогенез (рис. 5, б). Примечательно, что eFGP+/FoxP3+ Treg окружали все обнаруженные нами участки глиомной инвазии (рис. 5, в).
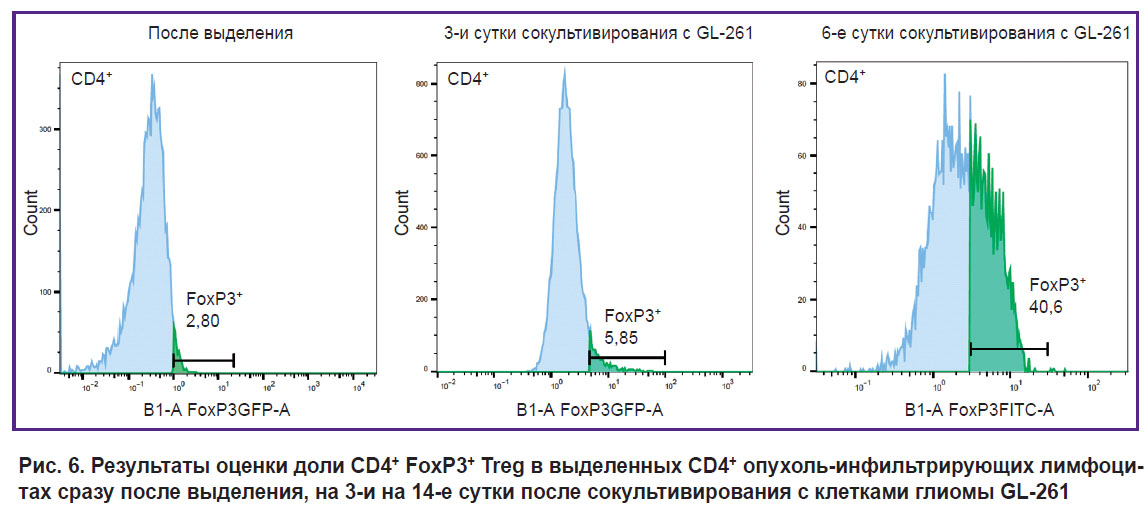
Проточная цитометрия. Поскольку сканирующая конфокальная микроскопия является лишь полуколичественным методом, для верификации содержания Treg в опухоли и периопухолевом пространстве мы выделили опухоль на 6-е сутки после имплантации, суспендировали клетки и оценили долю Treg от общего числа CD4+ T-клеток в полученных TILs с помощью проточной цитометрии. Это исследование подтвердило, что на ранних сроках развития опухоли доля Treg в опухолевом микроокружении не превышает 5% (в нашем эксперименте получилось 2,8% Treg сразу после выделения). Для доказательства выявленного нами на ИВМ и при флуоресцентной микроскопии феномена увеличения доли Treg в процессе развития глиомы мы предприняли in vitro эксперимент по культивированию полученных TILs на фидерном слое клеток глиомы GL-261. Обнаружено, что на 3-и сутки сокультивирования с глиомными клетками доля Treg составляет уже 5,8%, а на 14-е сутки — 40,6% (рис. 6). В контроле, когда суспензионные TILs отделяли от адгезионных клеток глиомы, доля Treg в процессе культивирования не менялась. Эксперимент повторили трижды с опухолями от разных мышей и данные по увеличению доли Treg более чем в 10 раз в результате сокультивирования с GL-261 воспроизвелись.
|
Рис. 6. Результаты оценки доли CD4+ FoxP3+ Treg в выделенных CD4+ опухоль-инфильтрирующих лимфоцитах сразу после выделения, на 3-и на 14-е сутки после сокультивирования с клетками глиомы GL-261 |
Таким образом, в результате исследований in vivo и in vitro была оценена динамика рекрутирования Treg внутримозговой глиомой GL-261 и показана селективная экспансия Treg в культуре TILs, которая обусловлена, вероятно, цитокинами, секретируемыми клетками глиомы. Кроме того, мы убедились, что Treg, выделенные из опухоли трансгенной мыши, можно поддерживать в культуре, имитируя опухолевое микроокружение in vitro.
Обсуждение
Многие аспекты функционирования многокомпонентного клеточного микроокружения глиобластомы в настоящий момент остаются недостаточно изученными. Механизмы рекрутинга и экспансии различных субпопуляций иммунных клеток, особенно Treg, требуют дальнейшего исследования и уточнения в контексте иммуносупрессии.
Роль Treg в иммуносупрессии при злокачественных новообразованиях общеизвестна. Транскрипционный фактор FoxP3 является ключевым в активации и функционировании Тreg. Так как белок имеет внутриклеточную локализацию, для рутинного иммунохимического выявления FoxP3+ Treg c помощью специфических антител необходима фиксация и пермеабилизация клеток, что делает невозможными прижизненные исследования. В связи с этим трансгенная линия мышей C57Bl/6-FoxP3-eGFP, у которых экспрессия FoxP3 сопровождается флуоресценцией eGFP, представляется крайне удачной платформой для прижизненного исследования механизмов активации и способов инактивации Treg в процессе развития опухоли, в том числе методом ИВМ.
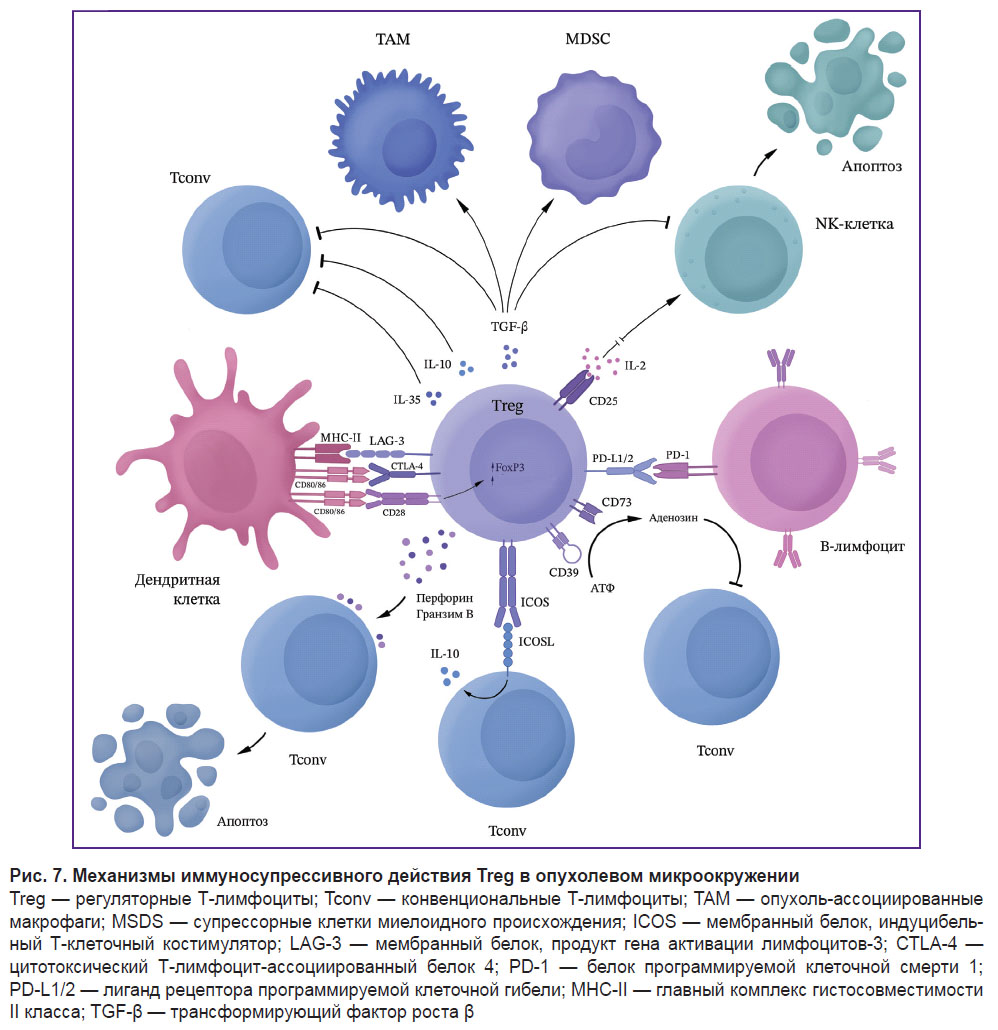
Глиомы усиливают иммуносупрессию за счет селективного, опосредованного хемокинами, рекрутирования Treg в очаг опухоли. Отмечено, что Treg у пациентов с глиобластомами имеют значительно более высокие уровни экспрессии хемокинового пути CCL2-CCR4, чем Treg у здоровых людей [18]. Treg обеспечивают ускользание глиобластомы в первую очередь за счет ингибирования CD8+ цитотоксических лимфоцитов, секретируя различные растворимые факторы, такие как IL-10 и TGF-β [19]. Активные Treg глиомы могут связываться с CD80/CD86 через CTLA-4, подавляя активность Т-лимфоцитов. С помощью анти-CTLA-4 моноклональных антител данный путь активации Treg может быть прерван. Вместе с тем недавно описан CTLA-4-независимый путь активации Treg в опухолях, при котором активация CD28 костимуляционного сигнального пути приводит к селективной пролиферации Treg, несмотря на блокаду CTLA-4 [20]. Помимо перечисленных механизмов, FoxP3 может индуцировать экспрессию HO-1, что приводит к подавлению пролиферации эффекторных Т-лимфоцитов. В глиомах Treg способен ингибировать дендритные клетки, антигенпрезентирующие клетки и другие лимфоциты, ингибируя секрецию IL-2 и IFN-γ, а также способствуя секреции TGF-β и индоламин-2,3-диоксигеназы, таким образом поддерживая иммуносупрессивную микросреду [19] (рис. 7).
В нашем исследовании мы продемонстрировали увеличение доли субпопуляции Treg в процессе развития ортотопической глиомы с помощью ИВМ и флуоресцентного анализа на срезах мозга, а также подтвердили, что глиома может не только рекрутировать Тreg из органов иммунопоэза, но и способствовать селективной экспансии Treg (показано в эксперименте in vitro при сокультивировании TILs с клетками глиомы). Вклад рекрутинга и миграции, а также селективной пролиферации в увеличение доли Treg в периопухолевом пространстве еще предстоит выяснить. Однако, учитывая наши экспериментальные данные, экспансия Treg вполне вероятно происходит под воздействием TGF-β и других цитокинов, продуцируемых клетками глиобластомы.
С помощью первично меченных анти-CD105-Alexa-Fluor-647 мы также показали активный опухолевый неоангиогенез на фоне инфильтрации стромальными клетками и Treg. В норме CD105 экспрессируется на МСК и, планируя этот эксперимент, мы ожидали таким образом визуализировать опухоль-ассоциированные МСК и исследовать их колокализацию с Тreg. Однако с помощью антител к CD105 в нашем эксперименте визуализировались микрососуды в периопухолевом пространстве (см. рис. 5). Это подтверждает имеющееся в литературе предположение о том, что данный белок в опухолевом микроокружении может быть маркером неоангиогенеза [21].
Разработанный нами методический подход с моделированием глиомы и выполнением ИВМ у трансгенных животных C57Bl/6-FoxP3-eGFP в дальнейшем может применяться для поиска подходов к преодолению иммуносупрессивного опухолевого микроокружения, в частности к подавлению активности Treg и переводу глиомы из иммунологически «холодного» в «горячее» состояние, в котором противоопухолевые иммунные механизмы при глиобластоме станут более эффективны.
Заключение
Исследована динамика инфильтрации микроокружения глиомы GL-261 регуляторными Т-клетками. Показано, что клетки глиобластомы активируют эти клетки в периоопухолевом пространстве in vivo и способствуют их селективной экспансии при сокультивировании с опухоль-инфильтрирующими лимфоцитами in vitro. Полученные данные могут быть использованы для дальнейших исследований на линии мышей C57Bl/6-FoxP3-eGFP по поиску способов преодоления иммуносупрессивного опухолевого микроокружения и инактивации Treg при глиобластоме.
Благодарности. Авторы выражают благодарность за предоставление трансгенных мышей C57BL/6-FoxP3-EGFP Дмитрию Михайловичу Чудакову, Диане Владимировне Южаковой и Юлии Вадимовне Коржимановой. Авторы благодарят доктора Илью Леонидовича Губского за помощь при выполнении МРТ-исследования головного мозга мышей.
Финансирование. Работа профинансирована из средств грантов Российского научного фонда №21-74-20110 (интравитальная микроскопия) и №22-64-00057 (эксперименты in vivo).
Конфликт интересов отсутствует.
Литература
- Marenco-Hillembrand L., Wijesekera O., Suarez-Meade P., Mampre D., Jackson C., Peterson J., Trifiletti D., Hammack J., Ortiz K., Lesser E., Spiegel M., Prevatt C., Hawayek M., Quinones-Hinojosa A., Chaichana K.L. Trends in glioblastoma: outcomes over time and type of intervention: a systematic evidence based analysis. J Neurooncol 2020; 147(2): 297–307, https://doi.org/10.1007/s11060-020-03451-6.
- Wu W., Klockow J.L., Zhang M., Lafortune F., Chang E., Jin L., Wu Y., Daldrup-Link H.E. Glioblastoma multiforme (GBM): an overview of current therapies and mechanisms of resistance. Pharmacol Res 2021; 171: 105780, https://doi.org/10.1016/j.phrs.2021.105780.
- Khan I., Mahfooz S., Elbasan E.B., Karacam B., Oztanir M.N., Hatiboglu M.A. Targeting glioblastoma: the current state of different therapeutic approaches. Curr Neuropharmacol 2021; 19(10): 1701–1715, https://doi.org/10.2174/1570159X19666210113152108.
- Medikonda R., Dunn G., Rahman M., Fecci P., Lim M. A review of glioblastoma immunotherapy. J Neurooncol 2021; 151(1): 41–53, https://doi.org/10.1007/s11060-020-03448-1.
- Bikfalvi A., da Costa C.A., Avril T., Barnier J.V., Bauchet L., Brisson L., Cartron P.F., Castel H., Chevet E., Chneiweiss H., Clavreul A., Constantin B., Coronas V., Daubon T., Dontenwill M., Ducray F., Enz-Werle N., Figarella-Branger D., Fournier I., Frenel J.S., Gabut M., Galli T., Gavard J., Huberfeld G., Hugnot J.P., Idbaih A., Junier M.P., Mathivet T., Menei P., Meyronet D., Mirjolet C., Morin F., Mosser J., Moyal E.C., Rousseau V., Salzet M., Sanson M., Seano G., Tabouret E., Tchoghandjian A., Turchi L., Vallette F.M., Vats S., Verreault M., Virolle T. Challenges in glioblastoma research: focus on the tumor microenvironment. Trends Cancer 2023; 9(1): 9–27, https://doi.org/10.1016/j.trecan.2022.09.005.
- Stepanenko A.A., Sosnovtseva A.O., Valikhov M.P., Chernysheva A.A., Abramova O.V., Pavlov K.A., Chekhonin V.P. Systemic and local immunosuppression in glioblastoma and its prognostic significance. Front Immunol 2024; 15: 1326753, https://doi.org/10.3389/fimmu.2024.1326753.
- Lu L., Sun J., Su H., Luo S., Chen J., Qiu S., Chi Y., Lin J., Xu X., Zheng D. Antitumor CD8 T cell responses in glioma patients are effectively suppressed by T follicular regulatory cells. Exp Cell Res 2021; 407(2): 112808, https://doi.org/10.1016/j.yexcr.2021.112808.
- Bugakova A.S., Chudakova D.A., Myzina M.S., Yanysheva E.P., Ozerskaya I.V., Soboleva A.V., Baklaushev V.P., Yusubalieva G.M. Non-tumor cells within the tumor microenvironment-the “eminence grise” of the glioblastoma pathogenesis and potential targets for therapy. Cells 2024; 13(10): 808, https://doi.org/10.3390/cells13100808.
- Dinevska M., Widodo S.S., Furst L., Cuzcano L., Fang Y., Mangiola S., Neeson P.J., Darcy P.K., Ramsay R.G., Hutchinson R., MacKay F., Christie M., Stylli S.S., Mantamadiotis T. Cell signaling activation and extracellular matrix remodeling underpin glioma tumor microenvironment heterogeneity and organization. Cell Oncol (Dordr) 2023; 46(3): 589–602, https://doi.org/10.1007/s13402-022-00763-9.
- Dapash M., Hou D., Castro B., Lee-Chang C., Lesniak M.S. The interplay between glioblastoma and its microenvironment. Cells 2021; 10(9): 2257, https://doi.org/10.3390/cells10092257.
- Wang X., Ge Y., Hou Y., Wang X., Yan Z., Li Y., Dong L., She L., Tang C., Wei M., Zhang H. Single-cell atlas reveals the immunosuppressive microenvironment and Treg cells landscapes in recurrent glioblastoma. Cancer Gene Ther 2024; 31(5): 790–801, https://doi.org/10.1038/s41417-024-00740-4.
- Lin H., Liu C., Hu A., Zhang D., Yang H., Mao Y. Understanding the immunosuppressive microenvironment of glioma: mechanistic insights and clinical perspectives. J Hematol Oncol 2024; 17(1): 31, https://doi.org/10.1186/s13045-024-01544-7.
- Himes B.T., Geiger P.A., Ayasoufi K., Bhargav A.G., Brown D.A., Parney I.F. Immunosuppression in glioblastoma: current understanding and therapeutic implications. Front Oncol 2021; 11: 770561, https://doi.org/10.3389/fonc.2021.770561.
- Chen B.J., Zhao J.W., Zhang D.H., Zheng A.H., Wu G.Q. immunotherapy of cancer by targeting regulatory T cells. Int Immunopharmacol 2022; 104: 108469, https://doi.org/10.1016/j.intimp.2021.108469.
- Li Y., Zhang C., Jiang A., Lin A., Liu Z., Cheng X., Wang W., Cheng Q., Zhang J., Wei T., Luo P. Potential anti-tumor effects of regulatory T cells in the tumor microenvironment: a review. J Transl Med 2024; 22(1): 293, https://doi.org/10.1186/s12967-024-05104-y.
- Wang J., Gong R., Zhao C., Lei K., Sun X., Ren H. Human FOXP3 and tumour microenvironment. Immunology 2023; 168(2): 248–255, https://doi.org/10.1111/imm.13520.
- Юсубалиева Г.М., Петричук С.В., Кривошапкин А.Л., Кедрова А.Г., Иванов Ю.В., Винокуров А.Г., Калинкин А.А., Санжаров А.Е., Ким С.В., Пономарев А.В., Купцова Д.Г., Ищенко Р.В., Троицкий А.В., Баклаушев В.П. Инфильтрирующие опухоль лимфоциты: выделение, активация, анализ цитотоксичности на культурах солидных опухолей. Клиническая практика 2020; 11(1): 49–58, https://doi.org/10.17816/clinpract33974.
- Panek W.K., Toedebusch R.G., Mclaughlin B.E., Dickinson P.J., Van Dyke J.E., Woolard K.D., Berens M.E., Lesniak M.S., Sturges B.K., Vernau K.M., Li C., Miska J., Toedebusch C.M. The CCL2-CCR4 axis promotes regulatory T cell trafficking to canine glioma tissues. J Neurooncol 2024; 169(3): 647–658, https://doi.org/10.1007/s11060-024-04766-4.
- Dikiy S., Rudensky A.Y. Principles of regulatory T cell function. Immunity 2023; 56(2): 240–255, https://doi.org/10.1016/j.immuni.2023.01.004.
- Watanabe T., Ishino T., Ueda Y., Nagasaki J., Sadahira T., Dansako H., Araki M., Togashi Y. Activated CTLA-4-independent immunosuppression of Treg cells disturbs CTLA-4 blockade-mediated antitumor immunity. Cancer Sci 2023; 114(5): 1859–1870, https://doi.org/10.1111/cas.15756.
- Bhuniya A., Sarkar A., Guha A., Choudhury P.R., Bera S., Sultana J., Chakravarti M., Dhar S., Das J., Guha I., Ganguly N., Banerjee S., Bose A., Baral R. Tumor activated platelets induce vascular mimicry in mesenchymal stem cells and aid metastasis. Cytokine 2022; 158: 155998, https://doi.org/10.1016/j.cyto.2022.155998.