Влияние пористости наночастиц кремния на их свойства сенсибилизации медицинского ультразвука низкой интенсивности
В данной работе исследована роль пористости наночастиц кремния в их способности выступать в качестве соносенсибилизаторов для сонодинамической терапии злокачественных опухолей.
Структурный анализ показал, что пористые наночастицы состоят из нанокристаллов размером ~4 нм и содержат поры диаметром ~15 нм, тогда как непористые наночастицы характеризуются плотной структурой с нанокристаллами размером 10–50 нм. Пористые наночастицы обладают выраженными фотолюминесцентными свойствами, связанными с квантово-размерными эффектами в их мелких нанокристаллах.
Цитотоксичность наночастиц изучена in vitro на клетках Hep2. Результаты показали, что как пористые, так и непористые наночастицы в исследуемом диапазоне концентраций (2–500 мкг/мл) являются нетоксичными. Ультразвук низкой интенсивности (0,88 МГц, <1 Вт) также не оказывает токсического воздействия на клетки. Однако совместное применение пористых наночастиц и ультразвука приводит к значительному снижению жизнеспособности клеток, чего не наблюдалось при использовании непористых наночастиц. Этот эффект связан с механическим разрушением клеточных мембран, а также возможной активацией дополнительных механизмов клеточной гибели, например апоптоза.
Полученные результаты подчеркивают значимость пористости как ключевого фактора, определяющего эффективность наночастиц кремния в качестве соносенсибилизаторов. Высокая эффективность, низкая токсичность и уникальные структурные свойства пористых наночастиц делают их перспективным материалом для дальнейшего изучения и разработки целенаправленных и неинвазивных методов лечения злокачественных опухолей в рамках сонодинамической терапии.
Введение
Сонодинамическая терапия (СДТ) представляет собой метод лечения злокачественных опухолей, сочетающий воздействие низкоинтенсивного ультразвука с применением соносенсибилизаторов — агентов, повышающих чувствительность опухолевых клеток к ультразвуковому излучению [1]. В последние годы особое внимание уделяется использованию наночастиц в качестве соносенсибилизаторов, что открывает новые перспективы в онкологической терапии.
Наночастицы благодаря своим уникальным физико-химическим свойствам могут усиливать терапевтический эффект ультразвука через несколько механизмов. Во-первых, они способствуют генерации активных форм кислорода при ультразвуковом облучении, что приводит к окислительному стрессу и последующей гибели опухолевых клеток. Во-вторых, наночастицы могут служить центрами нуклеации кавитации, снижая порог ее возникновения и усиливая механическое разрушение клеточных структур. В-третьих, некоторые наночастицы эффективно поглощают ультразвуковую энергию, преобразуя ее в тепло и вызывая локальную гипертермию, что приводит к деструкции опухолевых тканей [2–4].
Применение наночастиц в СДТ также позволяет достичь высокой селективности воздействия. Благодаря возможности функционализации поверхности наночастицы могут быть направлены непосредственно в опухолевые клетки, минимизируя повреждение здоровых тканей. Однако, несмотря на значительные успехи в этой области, разработка эффективных и безопасных наночастиц-соносенсибилизаторов остается актуальной задачей, требующей дальнейших исследований и клинических испытаний [4, 5].
В настоящее время особый интерес представляют наночастицы пористого кремния, которые обладают уникальными свойствами: биосовместимостью, способностью биодеградировать до нетоксичной кремниевой кислоты, а также фотолюминесценцией в видимой области спектра, обусловленной квантово-размерными эффектами [6]. Эти свойства делают наночастицы пористого кремния универсальным материалом для адресной доставки лекарств и их неинвазивного мониторинга. Важно отметить, что размер и пористость наночастиц можно варьировать, адаптируя их к конкретным медицинским задачам [7, 8]. Исследования продемонстрировали: наночастицы пористого кремния обладают низкой токсичностью как in vitro, так и при внутривенном введении in vivo и эффективно поглощаются раковыми клетками, что делает их безопасными и многообещающими для использования в биомедицине [6, 9].
Наночастицы пористого кремния рассматриваются как перспективные соносенсибилизаторы для СДТ. Одной из их ключевых особенностей является способность выступать в роли центров нуклеации кавитационных пузырьков, что значительно снижает порог возникновения кавитации при ультразвуковом воздействии [10, 11]. Кавитация, характеризующаяся образованием и последующим коллапсом микропузырьков в жидкой среде, вызывает механическое разрушение клеточных мембран и, как следствие, гибель опухолевых клеток.
На стадии докавитационного режима, т.е. до наступления полной кавитации, кремниевые наночастицы также оказывают значительное воздействие на клеточные структуры. В работе [12] показано, что совместное воздействие наночастиц и ультразвука может индуцировать апоптоз — запрограммированную клеточную гибель (это способствует устранению опухолевых клеток без развития воспалительной реакции). Таким образом, комбинированное применение ультразвука и наночастиц повышает общую эффективность лечения за счет синергетического воздействия на опухолевую ткань. Эти данные подтверждаются экспериментальными исследованиями in vitro и in vivo, демонстрирующими высокую эффективность наночастиц пористого кремния в качестве сенсибилизаторов для ультразвуковой терапии опухолей [10–14].
Целью настоящего исследования является изучение влияния пористости наночастиц кремния на их способность снижать пороги акустической кавитации и усиливать терапевтический эффект ультразвукового облучения низкой интенсивности. Для этого исследовались структурные, оптические и соносенсибилизирующие свойства наночастиц, а также их влияние на жизнеспособность клеток in vitro.
Материалы и методы
Синтез наночастиц. Водные суспензии пористых (пК-НЧ) и непористых (К-НЧ) наночастиц кремния получали путем измельчения массивов пористых и непористых кремниевых нанонитей соответственно.
Массивы нанонитей кремния получали методом металл-стимулированного химического травления (МСХТ). На первом этапе метода пластину с-Si (100) погружали в смесь 0,01 М AgNO3 и 5 М HF в объемном соотношении 1:1 на 15 с. В результате на поверхность c-Si осаждались наночастицы Ag. Затем пластину c-Si помещали в смесь 5 М HF и 30% H2O2 в объемном соотношении 10:1, где происходил процесс травления. Для того, чтобы удалить наночастицы серебра, образцы погружались в 35% HNO3 на 15 мин. Затем образцы промывали 3 раза дистиллированной водой (Merck Millipore, Германия) и сушили при комнатной температуре на воздухе.
Пористые нанонити кремния получали методом МСХТ высоколегированного c-Si с удельным сопротивлением 0,001 Ом·см. Непористые нанонити получали методом МСХТ низколегированного c-Si с удельным сопротивлением 1 Ом·см [15].
Полученные массивы кремниевых нанонитей механически отделяли от пластин c-Si и затем измельчали в дистиллированной воде (Merck Millipore, Германия) в ультразвуковой ванне (Elmasonic, Германия; 37 кГц) в течение 12 ч. После ультразвукового воздействия полученные растворы частиц седиментировались в течение 24 ч и центрифугировались в течение 5 мин при 1300 об./мин для удаления крупных неперемолотых нанонитей; полученный супернатант использовали в эксперименте. В результате измельчения пористых и непористых нанонитей получали суспензии пК-НЧ и К-НЧ сответственно.
Характеризация наночастиц. Структурные исследования полученных образцов проводили с использованием просвечивающего электронного микроскопа (LEO 912 AB OMEGA; Carl Zeiss, Германия). Для определения размера и дзета-потенциала (ZP) наночастиц кремния по данным динамического светорассеяния (ДРС) использовали прибор Malvern Zetasizer Nano ZS (Malvern Instruments Ltd, Великобритания). Состав поверхности образцов исследовали на ИК-Фурье спектрометре IR-8000 (САС, Россия) с приставкой нарушенного полного внутреннего отражения. Спектры комбинационного (рамановского) рассеяния света (КРС) измеряли на конфокальном рамановском микроскопе ConfotecTM MR350 (SOL instruments, Республика Беларусь). При регистрации КРС использовали длину волны возбуждения 633 нм и слабую мощность лазера 1 мВт для защиты образцов от перегрева. Перед измерением КРС 20 мкл суспензии наночастиц наносили на пластину из кристаллического Ge и высушивали на воздухе.
Исследование цитотоксичности наночастиц in vitro. Клетки линии Hep2 (карцинома гортани человека) культивировали во флаконах в среде DMEM, которая содержала 10% фетальной бычьей сыворотки (Gibco, США), L-глутамин (600 мг/л), HEPES (20 мМ) и гентамицин (80 мг/л). Инкубацию проводили при 5% СО2 и температуре 37°C. Для экспериментов клетки высевали в 12-луночные планшеты в концентрации 100 тыс. клеток на лунку, с добавлением 1 мл питательной среды на лунку.
Через 24 ч после посева добавляли необходимое количество наночастиц кремния. Перед добавлением частицы кремния переводили центрифугированием в культуральную среду и подвергали ультразвуковой обработке в ультразвуковой ванне с частотой 30 кГц с пипетированием для равномерного распределения частиц в растворе. Пробирку с частицами помещали в зону кавитации для обеспечения максимальной диспергируемости наночастиц.
Через 24 ч после добавления частиц клетки промывали для удаления несвязанных наночастиц. Количество клеток в каждой лунке определяли с помощью подсчета в гемоцитометре. Для оценки фазового состава клеток после воздействия наночастиц проводили окрашивание пропидий иодидом (50 мкг/мл), а затем анилизировали образцы на проточном цитофлуориметре PASIII (Partec, Германия). Это позволило определить долю жизнеспособных и мертвых клеток, а также распределение по фазам клеточного цикла.
Исследование совместного воздействия наночастиц и ультразвука на клетки in vitro. Клетки линии Hep2 подращивали в культуральных флаконах (площадь поверхности 25 см2) в течение 3 сут. Культуральная среда DMEМ содержала 10% фетальной бычьей сыворотки (Gibco, США), L-глутамин (600 мг/л), HEPES (20 мМ) и гентамицин (80 мг/л). Клетки инкубировали при температуре 37°C и 5% CO2. Во флаконе находилось 5 мл питательной среды.
Образцы водных суспензий наночастиц центрифугировали, подсушивали в сушильном шкафу для удаления остатков воды и затем растирали в течение 5 мин в агатовой ступке с добавлением культуральной среды для получения гомогенной суспензии. Культуральную среду клеток заменяли на среду, содержащую наночастицы, и инкубировали в течение 2–4 ч. Концентрация наночастиц составляла 300 мкг/мл. После инкубации клетки отмывали 3 раза раствором Хэнкса, снимали с поверхности флакона методом трипсинизации и переводили в стандартный раствор Хэнкса. Количество клеток регулировали до концентрации 2·105 кл./мл.
Подготовленные суспензии клеток обрабатывали ультразвуком с помощью аппарата ультразвуковой терапии «УЗТ-1.3.01Ф-Мед ТеКо» (ООО «Мед ТеКо», Россия). Частота ультразвукового воздействия составляла 0,88 МГц, мощность — 1 Вт, модуляция — 2/20. В эксперименте использовали полипропиленовые пробирки (Greiner Bio-One, Австрия; 50 мл, диаметр 29 мм, дно коническое, высота конуса — 18 мм), содержащие 1 мл суспензии клеток с наночастицами. Дегазированную дистиллированную воду (при температуре 37°C) применяли в качестве контактной среды между плоским ультразвуковым излучателем радиусом 2 см и кюветой, заполненной образцом. Пробирки погружали в воду на глубину 15–18 мм, причем дно пробирки находилось на высоте 66 мм от поверхности ультразвукового излучателя, расположенного на дне ванны. В контрольной группе исследовали клетки без наночастиц кремния.
Для разделения живых и мертвых клеток использовали окрашивание трипановым синим (Gibco, США) (0,4%, 1:1). Подсчет живых клеток проводили на гемоцитометре, при этом погрешность измерения оценивали методом точечного и интервального анализа с достоверностью 0,95.
Оптическая голотомография. Эксперименты по биовизуализации in vitro проводили с использованием голотомографического микроскопа HT-X1 (TomoCube, Республика Корея), любезно предоставленного для проведения экспериментов компанией «Биолайн» (Россия). Установка включала в себя блок флуоресценции с диодным источником освещения синего цвета, воздушный объектив с 40-кратным увеличением и камеру CMOS с разрешением 2,8 мегапикселя. Для поддержания жизнеспособности клеток использовали настольный инкубатор, в котором поддерживалась температура 37°С, 100% влажность, газовый состав — 5% СО2. Клетки высаживали на конфокальные чашки с тонким дном 0,17 мм вечером накануне эксперимента для полного распластывания. Наночастицы добавляли клеткам за 2 ч до начала съемки. Съемку производили в полной среде роста клеток.
Результаты
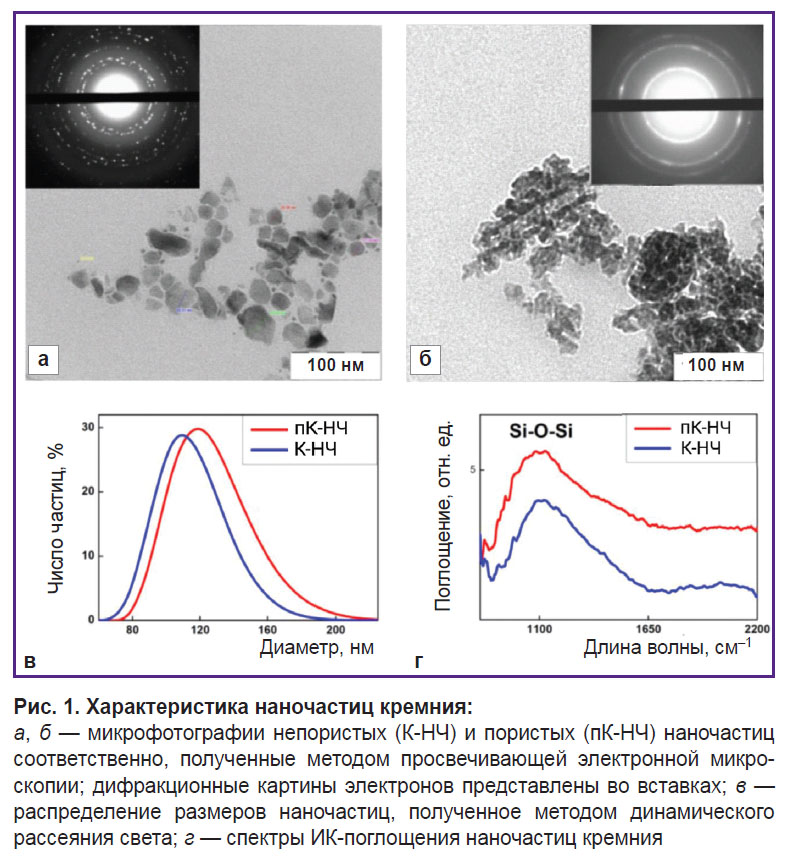
Исследование морфологии и физико-химических свойств наночастиц. Структурные свойства К-НЧ и пК-НЧ, полученных методом ультразвуковой диспергации массивов кремниевых нанонитей, были исследованы с использованием просвечивающей электронной микроскопии (ПЭМ) и динамического рассеяния света (ДРС). Микрофотографии ПЭМ (рис. 1, а, б) демонстрируют, что обе разновидности наночастиц имеют размеры 50–150 нм, и это согласуется с результатами, полученными методом ДРС (рис. 1, в). Вместе с тем К-НЧ имеют непористую структуру, а пК-НЧ состоят из мелких нанокристаллов и пор диаметром ~15 нм.
Измерения ZP показали отрицательные значения: –25 мВ для К-НЧ и –26 мВ для пК-НЧ. Такие значения свидетельствуют об устойчивости коллоидных систем и отсутствии тенденции к агрегации частиц в суспензии.
Дифракционные картины электронов, представленные во вставках на микрофотографиях ПЭМ (см. рис. 1, а, б), выявляют существенные различия между К-НЧ и пК-НЧ. К-НЧ характеризуются ярко выраженными изолированными узкими дифракционными пиками, что указывает на присутствие небольшого количества беспорядочно ориентированных относительно крупных (>10 нм) нанокристаллов кремния. В отличие от них, пК-НЧ демонстрируют уширенные концентрические кольца, соответствующие большому числу мелких (<5 нм) нанокристаллов кремния. Это подтверждает пористую структуру пК-НЧ, где наночастицы состоят из множества мелких нанокристаллов.
Спектры инфракрасного пропускания (рис. 1, г) показывают заметную широкую полосу при 1100 см–1, соответствующую связям Si-O-Si, что свидетельствует о наличии оксидного слоя на поверхности нанокристаллов кремния. Образование оксида обусловлено обработкой массивов нанонитей в HNO3 для удаления частиц серебра после процесса МСХТ, а также механическим измельчением нанонитей до наночастиц в воде. Следует отметить, что наличие оксидного слоя способствует хорошей диспергируемости наночастиц в водной среде благодаря гидрофильным свойствам их поверхности.
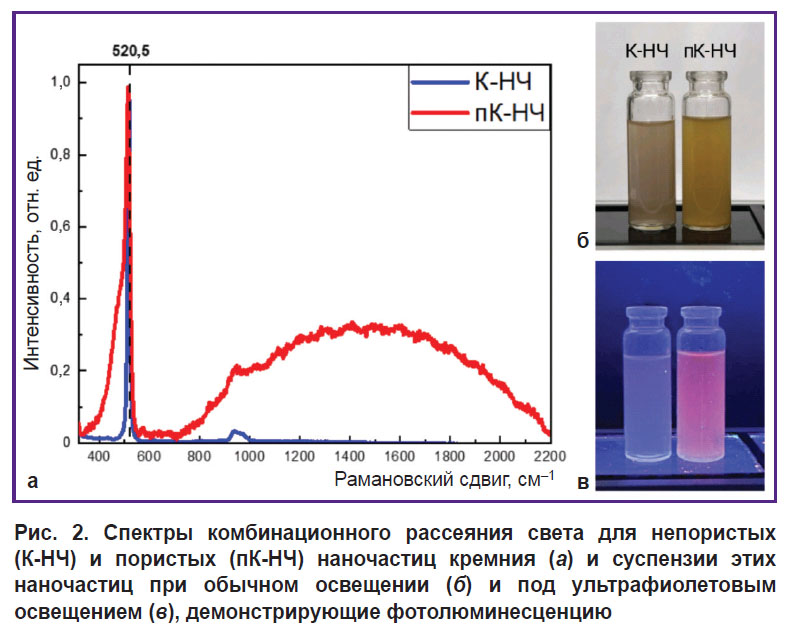
На рис. 2, а представлены спектры КРС для образцов К-НЧ и пК-НЧ. На графике наблюдается характерная для нанокристаллического кремния линия рассеяния с максимумом, сдвинутым на величину Δω относительно 520,5 см–1, что соответствует поперечным колебаниям оптических фононов (TO) в кристаллическом кремнии (c-Si). Положение максимума в КРС показано штрихованной линией. Низкочастотный сдвиг линии КРС в спектрах наночастиц связан с квантовым ограничением фононов в нанокристаллах малых размеров. Рассчитанные из положения максимума значения диаметров нанокристаллов [16] составили: для К-НЧ — 10,0 нм, для пК-НЧ — 4,3 нм. Это подтверждает уменьшение размеров нанокристаллов в пористых образцах, что приводит к более выраженным квантовым эффектам, связанным с ограничением фононов.
В спектрах пК-НЧ наблюдается широкий пик при 480 см–1, который характерен для аморфной фазы кремния. Частичная аморфизация нанокристаллов, по-видимому, является результатом процесса получения и хранения в воде образцов. Для спекра пористых образцов также наблюдается пик фотолюминесценции с максимумом в области 700 нм. Причиной возникновения фотолюминесценции является излучательная аннигиляция экси-
тонов, образующихся в кремниевых нанокристаллах малых размеров при их фотовозбуждении. Широкий спектр фотолюминесценции объясняется распределением нанокристаллов по размерам [15].
Фотографии суспензий наночастиц в дистиллированной воде (рис. 2, б, в) иллюстрируют визуальные отличия между пористыми и непористыми образцами. На изображении (б) показаны суспензии при обычном освещении. Суспензия пК-НЧ имеет более желтый оттенок по сравнению с суспензией к-НЧ, что объясняется более высокой пористостью и большой площадью поверхности наночастиц [17]. Под ультрафиолетовым освещением (см. рис. 2, в) пК-НЧ фотолюминесцируют в красной области спектра, тогда как суспензия К-НЧ светится слабее и имеет голубоватый оттенок.
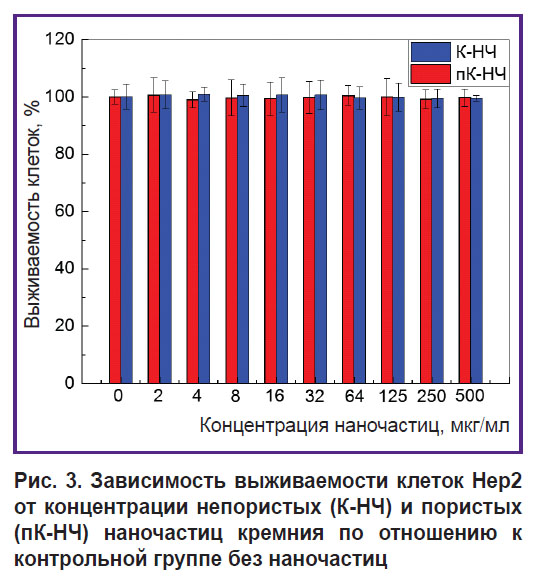
Оценка цитотоксичности наночастиц in vitro. На рис. 3 представлена зависимость выживаемости клеток от концентрации наночастиц К-НЧ и пК-НЧ в условиях in vitro.
|
Рис. 3. Зависимость выживаемости клеток Hep2 от концентрации непористых (К-НЧ) и пористых (пК-НЧ) наночастиц кремния по отношению к контрольной группе без наночастиц |
Согласно полученным данным, выживаемость клеток остается близкой к 100% для всех концентраций наночастиц в диапазоне от 2 до 500 мкг/мл. Это свидетельствует о том, что как пК-НЧ, так и К-НЧ в указанных концентрациях не оказывают выраженного цитотоксического воздействия на клетки Hep2.
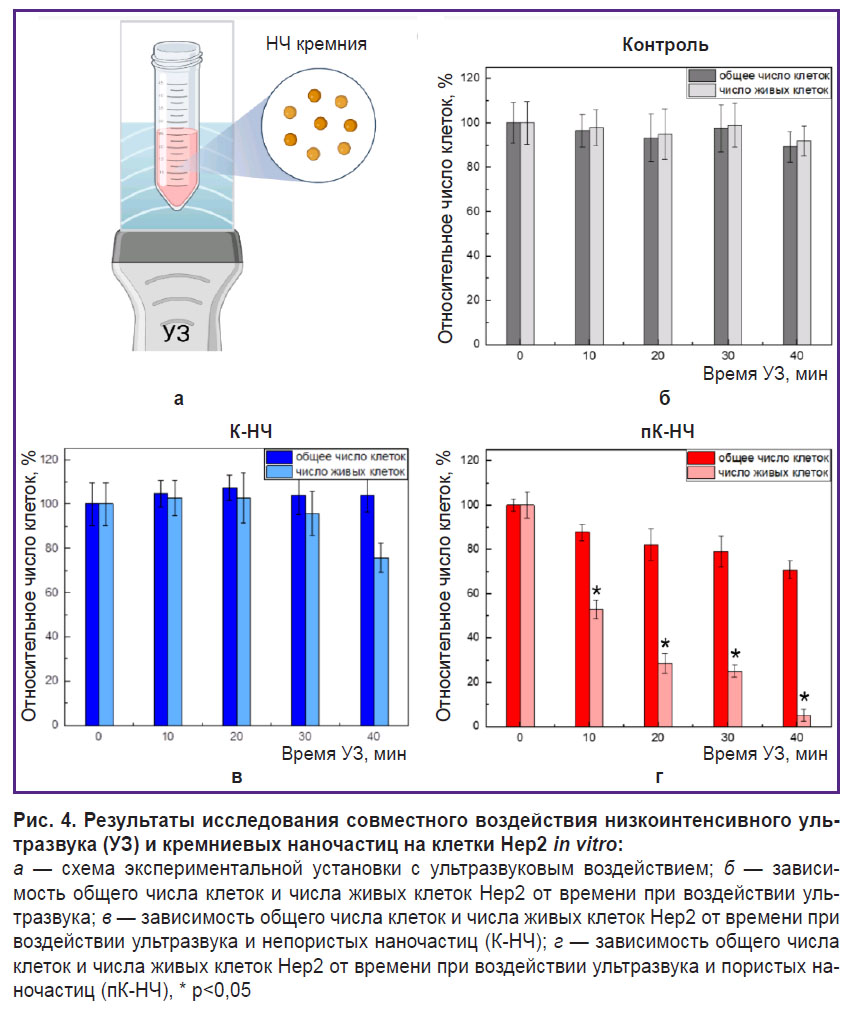
Оценка совместного воздействия низкоинтенсивного ультразвука и наночастиц на клетки in vitro. На рис. 4 представлены экспериментальные результаты исследования совместного воздействия низкоинтенсивного ультразвука и кремниевых наночастиц различной пористости на клетки Hep2 in vitro.
На рис. 4, а представлена схема экспериментальной установки, подробное описание которой приводится в разделе «Материалы и методы». Рис. 4, б иллюстрирует данные для контрольной группы клеток Hep2 при воздействии ультразвука. Общее количество клеток и число жизнеспособных клеток остаются практически неизменными при всех временны´х интервалах воздействия ультразвука (0, 10, 20, 30 и 40 мин). Это указывает на то, что в подобранных режимах эксперимента низкоинтенсивное ультразвуковое воздействие (0,88 МГц, мощность <1 Вт) не оказывает значительного влияния на клетки.
При совместном воздействии ультразвука и К-НЧ, взятых в нетоксичной концентрации 300 мкг/мл, наблюдается незначительное снижение общего числа клеток и числа живых клеток с увеличением времени ультразвукового воздействия, что указывает на невысокую цитотоксичность К-НЧ при активации ультразвука (рис. 4, в).
На рис. 4, г представлены результаты для клеток при совместном воздействии ультразвука и пК-НЧ, взятых в нетоксичной концентрации 300 мкг/мл. Видно, что с увеличением времени ультразвукового воздействия наблюдается значительное снижение количества жизнеспособных клеток, и это свидетельствует о высокой цитотоксичности пК-НЧ при активации ультразвука.
Пористые наночастицы кремния показали себя более эффективными соносенсибилизаторами в условиях ультразвукового воздействия по сравнению с непористыми благодаря ключевым особенностям их структуры. Пористая структура наночастиц способствует удержанию молекул растворенного газа в порах, что приводит к образованию центров нуклеации, существенно снижающих порог кавитации при ультразвуковом воздействии [10]. Таким образом, даже при недостаточной амплитуде ультразвука для вызова полной кавитации пК-НЧ способны локально усиливать кавитационные процессы. Кавитация сопровождается формированием пузырьков, которые при схлопывании создают локализованные области высокого давления и температуры. Эти экстремальные условия могут вызывать механическое разрушение клеточных структур, повреждение мембран или лизис клеток, что объясняет снижение общего числа клеток в данном эксперименте.
Дополнительно падение числа живых клеток при воздействии ультразвука с использованием пК-НЧ указывает на возможные более сложные механизмы гибели клеток, такие как апоптоз. В данном случае, даже при отсутствии явной макроскопической кавитации, пК-НЧ могут выступать в роли кавитационных нуклеаторов, увеличивая вероятность локальных кавитационных событий. Это в свою очередь усиливает ультразвуковую цитотоксичность за счет комбинации механического разрушения и активации биохимических путей клеточной гибели.
Исследование взаимодействия наночастиц с клетками in vitro методом оптической голотомографии. Согласно представленным выше данным, ключевым механизмом токсического воздействия активируемого пК-НЧ ультразвука считается воздействие на клеточные мембраны. Соответственно, важным элементом повреждающего эффекта пК-НЧ при воздействии ультразвука является их размещение в максимальной близости от клеточных мембран. Для того чтобы проверить, как пК-НЧ располагаются среди субклеточных мембранных структур, мы воспользовались методом голотомографической микроскопии. Облучение клеток в видимой области спектра позволяет визуализировать мембранные структуры по принципу различий в коэффициенте преломления между водной и липидной фазами. Как показано на рис. 5, наночастицы налипают на мембрану клеток в концентрации, значительно превышающей таковую в водной фазе во внеклеточной среде. Соответственно, при ультразвуковом облучении повреждающий эффект на клеточную мембрану будет усиливаться.

|
Рис. 5. Голотомографические изображения клетки, помещенной в суспензию наночастиц пористого кремния:
а — общий вид клетки; квадратом указана область, оптические срезы в которой приведены на рис. б. На оптических срезах (б), выполненных на различной высоте от подложки, видно, что через 2 ч после добавления наночастиц к клеткам большинство из них не входит в клетку, а налипает на плазматическую мембрану. Местами наночастицы скапливаются в агрегаты на поверхности клетки (голубые стрелки) в отличие от внеклеточных областей, где наночастицы распределены достаточно равномерно (розовые стрелки) |
Заключение
В данной работе проведено исследование структурных, оптических и соносенсибилизирующих свойств пористых и непористых наночастиц кремния с целью их применения в сонодинамической терапии злокачественных опухолей. Полученные данные свидетельствуют о том, что пористые наночастицы кремния обладают уникальными свойствами, которые значительно увеличивают их эффективность в качестве соносенсибилизаторов.
Результаты структурного анализа выявили существенные различия между пористыми и непористыми наночастицами кремния. Пористые наночастицы состоят из нанокристаллов размером ~4 нм и обладают пористой структурой с порами диаметром ~15 нм. В дифракционных картинах электронов для пористых наночастиц наблюдались уширенные концентрические кольца, что указывает на высокую степень аморфизации и наличие большого количества мелких нанокристаллов. В спектрах комбинационного рассеяния света для пористых наночастиц зафиксирован низкочастотный сдвиг линии рассеяния, что связано с квантовым ограничением фононов в нанокристаллах малых размеров. Дополнительно спектры продемонстрировали широкий пик в области 480 см–1, характерный для аморфной фазы кремния. Непористые наночастицы, напротив, имеют плотную структуру и состоят из нанокристаллов размером 10–50 нм. Их дифракционные картины электронов характеризуются узкими изолированными пиками, что свидетельствует о наличии большего количества крупных, хорошо упорядоченных нанокристаллов. В спектрах комбинационного рассеяния света для непористых наночастиц линия рассеяния расположена ближе к положению для кристаллического кремния (520,5 см–1), что также подтверждает их более выраженную кристалличность. Эти данные подчеркивают значительные различия в структуре двух типов наночастиц, что обусловливает их уникальные физико-химические свойства и потенциальные области применения в биомедицине.
Эксперименты in vitro подтвердили, что оба типа исследуемых наночастиц не проявляют выраженной токсичности по отношению к клеткам Hep2 при исследуемых концентрациях (2–500 мкг/мл). Кроме того, ультразвуковое воздействие низкой интенсивности (0,88 МГц, <1 Вт), применяемое в эксперименте, также не оказывает токсического влияния на клетки в отсутствие наночастиц. При совместном применении ультразвука и непористых наночастиц наблюдается лишь незначительное снижение жизнеспособности клеток, что указывает на их ограниченную способность к сенсибилизации ультразвуковых эффектов. Однако комбинация ультразвука с пористыми наночастицами приводит к значительному снижению жизнеспособности клеток. Пористые наночастицы не только усиливают механическое разрушение клеток за счет сенсибилизации локализованных кавитационных процессов при облучении ультразвука, но и, вероятно, инициируют дополнительные механизмы клеточной гибели, включая апоптоз.
Таким образом, полученные результаты подчеркивают значимость пористости как ключевого структурного параметра для повышения эффективности наночастиц кремния при сонодинамической терапии. Высокая эффективность, низкая токсичность наночастиц и отсутствие прямого токсического воздействия ультразвука делают данную комбинацию перспективным подходом для разработки целенаправленных и неинвазивных методов терапии злокачественных опухолей. Дальнейшие исследования должны быть направлены на изучение биохимических механизмов гибели клеток и оптимизацию параметров ультразвукового воздействия для клинического применения.
Финансирование. Работа выполнена при финансовой поддержке гранта Российского научного фонда №24-15-00137 («Получение кремниевых наночастиц, исследование их структурных и оптических свойств и цитотоксичности») и гранта НОШ №23-Ш06-19 («Исследование взаимодействия наночастиц с клетками методом оптической голотомографии»).
Конфликт интересов отсутствует.
Литература
- Osminkina L.A., Kudryavtsev A.A., Zinovyev S.V., Sviridov A.P., Kargina Y.V., Tamarov K.P., Nikiforov V.N., Ivanov A.V., Vasilyev A.N., Timoshenko V.Y. Silicon nanoparticles as amplifiers of the ultrasonic effect in sonodynamic therapy. Bull Exp Biol Med 2016; 161(2): 296–299, https://doi.org/10.1007/s10517-016-3399-x.
- Николаев А.Л., Гопин А.В., Конопацкая И.И., Миронов М.А., Пятаков П.А., Андронова Н.В., Трещалина Е.М., Дежкунов Н.В. Твердофазная соносенсибилизация в сонодинамической терапии онкологических заболеваний. Учебные записки физического факультета 2014; 5: 145344-1.
- Tachibana K., Feril L.B. Jr, Ikeda-Dantsuji Y. Sonodynamic therapy. Ultrasonics 2008; 48(4): 253–259, https://doi.org/10.1016/j.ultras.2008.02.003.
- Xu H., Zhang X., Han R., Yang P., Ma H., Song Y., Lu Z., Yin W., Wu X., Wang H. Nanoparticles in sonodynamic therapy: state of the art review. RSC Advances 2016; 6(56): 50697–50705, https://doi.org/10.1039/C6RA06862F.
- Huang Y., Ouyang W., Lai Z., Qiu G., Bu Z., Zhu X., Wang Q., Yu Y., Liu J. Nanotechnology-enabled sonodynamic therapy against malignant tumors. Nanoscale Adv 2024; 6(8): 1974–1991, https://doi.org/10.1039/d3na00738c.
- Park J.H., Gu L., von Maltzahn G., Ruoslahti E., Bhatia S.N., Sailor M.J. Biodegradable luminescent porous silicon nanoparticles for in vivo applications. Nat Mater 2009; 8(4): 331–336, https://doi.org/10.1038/nmat2398.
- Milliken S., Thiessen A.N., Cheong I.T., O'Connor K.M., Li Z., Hooper R.W., Robidillo C.J.T., Veinot J.G.C. "Turning the dials": controlling synthesis, structure, composition, and surface chemistry to tailor silicon nanoparticle properties. Nanoscale 2021; 13(39): 16379–16404, https://doi.org/10.1039/d1nr04701a.
- Heintz A.S., Fink M.J., Mitchell B.S. Silicon nanoparticles with chemically tailored surfaces. Applied Organometallic Chemistry 2010; 24(3): 236–240, https://doi.org/10.1002/aoc.1602.
- Maximchik P.V., Tamarov K., Sheval E.V., Tolstik E., Kirchberger-Tolstik T., Yang Z., Siakov V., Osminkina L.A. Biodegradable porous silicon nanocontainers as an effective drug carrier for regulation of the tumor cell death pathways. ACS Biomaterials Science & Engineering 2019; 5(11): 6063–6071, https://doi.org/10.1021/acsbiomaterials.9b01292.
- Gongalsky M.B., Tsurikova U.A., Kudryavtsev A.A., Pervushin N.V., Sviridov A.P., Kumeria T., Egoshina V.D., Tyurin-Kuzmin P.A., Naydov I.A., Gonchar K.A., Kopeina G.S., Andreev V.G., Zhivotovsky B., Osminkina L.A. Amphiphilic photoluminescent porous silicon nanoparticles as effective agents for ultrasound-amplified cancer therapy. ACS Appl Mater Interfaces 2025; 17(1): 374–385, https://doi.org/10.1021/acsami.4c15725.
- Sviridov A.P., Osminkina L.A., Nikolaev A.L., Kudryavtsev A.A., Vasiliev A.N., Timoshenko V.Y. Lowering of the cavitation threshold in aqueous suspensions of porous silicon nanoparticles for sonodynamic therapy applications. Applied Physics Letters 2015; 107(12), https://doi.org/10.1063/1.4931728.
- Osminkina L.A., Luckyanova E.N., Gongalsky M.B., Kudryavtsev A.A., Gaydarova A.Kh., Poltavtseva R.A., Kashkarov P.K., Timoshenko V.Y., Sukhikh G.T. Effects of nanostructurized silicon on proliferation of stem and cancer cell. Bull Exp Biol Med 2011; 151(1): 79–83, https://doi.org/10.1007/s10517-011-1264-5.
- Osminkina L.A., Nikolaev A.L., Sviridov A.P., Andronova N.V., Tamarov K.P., Gongalsky M.B., Kudryavtsev A.A., Treshalina H.M., Timoshenko V.Y. Porous silicon nanoparticles as efficient sensitizers for sonodynamic therapy of cancer. Microporous and Mesoporous Materials 2015; 210: 169–175, https://doi.org/10.1016/j.micromeso.2015.02.037.
- Osminkina L.A., Sivakov V.A., Mysov G.A., Georgobiani V.A., Natashina U.А., Talkenberg F., Solovyev V.V., Kudryavtsev A.A., Timoshenko V.Y. Nanoparticles prepared from porous silicon nanowires for bio-imaging and sonodynamic therapy. Nanoscale Res Lett 2014; 9(1): 463, https://doi.org/10.1186/1556-276X-9-463.
- Georgobiani V.A., Gonchar K.A., Osminkina L.A., Timoshenko V.Y. Structural and photoluminescent properties of nanowires formed by the metal-assisted chemical etching of monocrystalline silicon with different doping level. Semiconductors 2015; 49: 1025–1029, https://doi.org/10.1134/S1063782615080084.
- Shatskaia M.G., Nazarovskaia D.A., Gonchar K.A., Lomovskaya Y.V., Tsiniaikin I.I., Shalygina O.A., Kudryavtsev A.A., Osminkina L.A. Photoluminescent porous silicon nanowires as contrast agents for bioimaging. Kondensirovannye sredy i mezhfaznye granitsy 2024; 26(1): 161–167, https://doi.org/10.17308/kcmf.2024.26/11819.
- Canham L. Color of porous silicon. In: Canham L. (editor). Handbook of porous silicon. Springer, Cham; 2014, https://doi.org/10.1007/978-3-319-04508-5_27-1.