Построение индивидуальных карт инвазии опухолей головного мозга с помощью диффузионно-куртозисной магнитно-резонансной томографии
Цель исследования — на основе диффузионно-куртозисных изображений (ДКИ) магнитно-резонансной томографии (МРТ) разработать и реализовать алгоритм анализа изображений при опухолях головного мозга (глиобластоме и метастазе) для оценки анизотропных изменений тканей мозга в направлениях от опухоли к неизмененному по данным МРТ белому веществу, что позволит получать индивидуальные карты опухолевой инвазии.
Материалы и методы. Здоровый доброволец и два пациента (пациент с глиобластомой и пациент с единичным метастазом мелкоклеточного рака легких) исследованы с помощью ДКИ с получением 12 параметрических карт куртозиса для каждого испытуемого.
Результаты. В ходе исследования был разработан алгоритм анализа ДКИ и построения профиля тканевых параметров в направлениях от опухоли к неизмененному по данным стандартных МРТ белому веществу. В работе проведено сравнение изменений показателей ДКИ вдоль траекторий, построенных с помощью предложенного алгоритма, в перифокальной зоне глиобластомы и метастаза. Мы получили не только изменения параметров (перепады на графиках траекторий), но и визуальное отражение (на цветовых картах) известной патоморфологии процесса — в перифокальном отеке метастаза не выявлено значимых перепадов параметров ДКИ, так как имеется чистый вазогенный отек и нет инфильтративного компонента. При глиобластоме не только в зоне перифокального отека, но и за пределами зоны изменения МР-сигнала были обнаружены перепады параметров ДКИ, что, по нашему мнению, отражает нарушения диффузии вдоль волокон белого вещества и различную степень инфильтрации тканей мозга клетками глиобластомы.
Заключение. Разработанный алгоритм анализа ДКИ при опухолях головного мозга позволяет определить степень изменения микроструктуры тканей в перифокальной зоне глиобластомы мозга по сравнению с метастазом. Исследование проведено с целью получения индивидуальных карт опухолевой инвазии, которые будут применимы при планировании нейрохирургического и радиотерапевтического лечения, а также для прогнозирования направлений дальнейшего роста злокачественных глиом.
Введение
В настоящее время актуальным остается направление исследований, посвященное изучению границ опухолевой инвазии при глиомах высокой степени злокачественности [1]. Современным стандартом лечения злокачественных глиом является микрохирургическое удаление контрастируемой части опухоли по данным постконтрастных Т1-изображений. Перифокальная зона повышенного МР-сигнала в Т2-FLAIR-режиме — это область отека, инфильтрированная при глиомах опухолевыми клетками. Обычно данная зона не подлежит резекции и после удаления опухоли подвергается радиотерапевтическому лечению [2]. В последнее время появился термин «FLAIR-эктомия» — удаление опухоли по контуру изменения МР-сигнала на Т2-FLAIR-изображениях, т.е. супратотальная резекция, что возможно только с условием сохранения функционально значимых зон мозга [3]. В любом случае полностью хирургически удалить глиобластому не представляется возможным, а из перифокальной краевой зоны постоперационной полости преимущественно и идет продолженный рост опухоли [1].
В то же время исследования, включавшие не только МРТ, но и корреляции МРТ и морфологических данных, показывают, что глиомы grade 3–4 распространяются также и за пределы зоны изменения МР-сигнала в режимах Т2 и Т2-FLAIR, т.е. опухолевые клетки могут быть и в неизмененном по МРТ-данным веществе мозга [4–7].
Считается, что в отличие от глиом перифокальный отек при метастазах практически не содержит опухолевых клеток и является чисто вазогенным без инфильтративного компонента [8].
Для определения границ и дифференциации опухолей в разных исследованиях применяют различные методы и сочетания методов, а также радиомику и искусственный интеллект [8–13].
В опубликованной ранее работе [7] мы проанализировали количественные диффузионно-куртозисные и перфузионные показатели, полученные у пациентов со злокачественными глиомами до операции. Исследование проводилось в зонах накопления опухолью контрастного препарата, перифокального отека-инфильтрации и перитуморального интактного вещества мозга пораженного полушария (по данным стандартных МРТ). Кроме того, были выполнены биопсии из этих зон, а затем проведена корреляция полученных показателей с иммуногистохимическими и морфологическими данными [7]. Результаты этого исследования целесообразно применить для формирования индивидуальных карт опухолевой инвазии с целью планирования хирургического и лучевого лечения пациентов с глиомами головного мозга, а также прогнозирования направления дальнейшего роста злокачественных глиом.
Для определения работоспособности предлагаемого алгоритма исследования изображений мы сравнили данные пациентов с глиобластомой и единичным метастазом.
Цель исследования — на основе диффузионно-куртозисной МРТ разработать и реализовать алгоритм анализа изображений при опухолях головного мозга (глиобластоме и метастазе) для оценки анизотропных изменений тканей мозга в направлениях от опухоли к неизмененному по данным МРТ белому веществу, что позволит получать индивидуальные карты опухолевой инвазии.
Материалы и методы
МРТ-исследования выполняли на аппарате Signa HDxt (General Electric, США) с напряженностью магнитного поля 3,0 Тесла c 8-канальной головной катушкой в следующих режимах: аксиальная T2 FSE с толщиной среза 5 мм и зазором между срезами 1 мм; аксиальная T2-FLAIR с толщиной среза 5 мм и зазором между срезами 1 мм; T1 FSPGR с изотропным вокселом 1×1×1 мм до и после внутривенного введения гадолиний-содержащего контрастного препарата.
Диффузионно-куртозисные изображения (ДКИ) получены с использованием эхопланарной импульсной последовательности «спиновое эхо» (SE-EPI) с двумя диффузионными градиентами одинаковой амплитуды и длительности. На полученных изображениях: воксел размером 2,5×2,5×2,5 мм, 57 срезов, время повторения (repetition time, TR) — 4621 мс, время эха (echo time, TE) — 113,3 мс, угол Эрнста — 90°, поле обзора (field of view, FOV) — 240 мм. Диффузионные градиенты имели по 60 некомпланарных направлений, значения фактора диффузии: b=0, 1000 и 2500 с/мм2. Время сканирования — 22 мин. Важно отметить, что ДКИ является расширением классической диффузионно-тензорной МРТ и включает в себя дополнительную серию изображений с b=2500 с/мм2.
Пациентам МРТ-исследование проводили за 1–3 дня до операции.
В работе представлены МРТ-исследования одного здорового добровольца без патологических изменений головного мозга и хронических заболеваний (мужчина, 35 лет), одного пациента с глиобластомой (WHO grade 4) в правой лобно-островковой области (мужчина, 64 года), одного пациента с метастазом мелкоклеточного рака легкого в левой лобной доле (мужчина, 56 лет). Диагнозы пациентов были подтверждены при морфологическом исследовании после микрохирургического удаления опухолей.
Для оценки патологических изменений тканей мозга были написаны программы для персонального компьютера на Python 3.11 (https://www.python.org/) и Matlab v. R2018a (https://www.mathworks.com/). В качестве вводных данных для программы использовали диффузионно-тензорные изображения всей головы пациента с опухолью мозга, маску опухоли и белого вещества, а также совмещенную с диффузионным изображением параметрическую карту, по которой анализировали микроструктурные изменения в белом веществе. В представленной работе использовали карты диффузионных и диффузионно-куртозисных параметров, полученных при обработке ДКИ: средняя диффузия (mean diffusivity, MD), фракционная анизотропия (fractional anisotropy, FA), средний куртозис (mean kurtosis, MK), аксиальный куртозис (axial kurtosis, AK), радиальный куртозис (radial kurtosis, RK), куртозисная анизотропия (kurtosis anisotropy, KA), фракция аксональной воды (axonal water fraction, AWF), аксиальная экстрааксональная диффузия (axial extra-axonal diffusivity AxEAD), аксиальная интрааксональная диффузия (axial intra-axonal diffusivity, AxIAD), радиальная экстрааксональная диффузия (radial extra-axonal diffusivity, RadEAD), радиальная интрааксональная диффузия (radial intra-axonal diffusivity, RadIAD), извитость экстрааксонального пространства (tortuosity of extra-axonal space, TORT).
Исследование проведено в соответствии с положениями Хельсинкской декларации (2013) и одобрено локальным этическим комитетом Национального медицинского исследовательского центра нейрохирургии им. академика Н.Н. Бурденко (Москва). От всех испытуемых (здорового добровольца и пациентов) получено письменное информированное согласие на участие в исследовании.
Результаты
Алгоритм анализа изображений
В ходе исследования был разработан алгоритм анализа изображений и построения профиля тканевых параметров в направлениях от опухоли к неизмененному по данным МРТ белому веществу, который включал в себя несколько этапов.
I. Сегментация. На этом этапе проводили вычисление и ручную корректировку маски опухоли и белого вещества. Границы опухоли и опухоли и перифокального отека в случае метастаза (или перифокального отека-инфильтрации в случае глиобластомы) определяли по четырем корегистрированным между собой сериям изображений: T2, T2-FLAIR, T1-FSPGR до и после введения контрастного препарата. Под понятием «границы опухоли» подразумевается часть опухоли, накапливающая контрастный препарат.
Вспомогательные программы автоматически создавали маски опухоли и белого вещества, которые затем корректировались двумя рентгенологами.
Важно отметить, что от качества сегментации зависели результаты работы программы, поскольку она очень чувствительна к малейшим ошибкам оконтуривания границ белого вещества и опухоли.
Авторам данной работы не удалось найти программы, которые бы безошибочно выполняли автоматическую сегментацию опухоли и белого вещества. В связи с этим в представленном алгоритме анализа изображений не удалось обойтись без ручной коррекции указанных выше масок.
Для упрощения этого процесса предложено использовать вспомогательные программы, которые автоматически создают «грубые» маски опухоли и белого вещества — правка уже готовых изображений занимала меньше времени, чем создание новых. Серии Т2, Т2-FLAIR, Т1-FSPGR до и после введения контрастного препарата сегментировали с помощью программы CaPTk версии 1.7.6 [14, 15]. Маску белого вещества определяли по изображению T1 с помощью утилиты Atropos из программного пакета ANTs (https://github.com/ANTsX). Из полученных изображений удаляли области базальных ядер и таламусов, так как программа Atropos относит эти области к белому веществу. Границы таламусов и базальных ядер были определены с помощью утилиты mri_synthseg из FreeSurfer [16]. По маскам белого вещества и опухоли для пунктов II–IV затем вычисляли карту удаленности от границы опухоли.
II. Итеративное вычисление «карты расстояний». На первой итерации «единицами» помечались все прилегающие к опухоли вокселы и оставлялись только те, которые находились внутри маски белого вещества. На следующей итерации «двойками» помечались вокселы, которые прилегали к «единицам» и находились внутри маски белого вещества. На третьей итерации «тройками» помечались вокселы, прилегающие к «двойкам», находившиеся внутри маски белого вещества и не попадавшие в помеченную область одной из предыдущих итераций или опухоль. Последующие итерации выполнялись до тех пор, пока не заканчивались вокселы белого вещества, которые можно разметить.
Обозначим вычисленные таким образом расстояния переменной di, где i — номер воксела. Не связанные с опухолью области белого вещества, которые не размечаются ни на одной из итераций, исключались из анализа.
III. Вычисление матрицы переходов вокселов к границе опухоли с учетом измеряемого коэффициента диффузии (ИКД), геометрии расположения опухоли, а также особенностей маски белого вещества.
В каждом вокселе, расположенном внутри маски белого вещества головного мозга, вычисляли:
а) ИКД вдоль выбранного направления nij из воксела i в соседний воксел j;
б) вектор весовых коэффициентов Wij, j=1…26, по которому находили направление перехода из воксела i в соседний воксел j. Весовые коэффициенты вычисляли по 26 значениям ИКД в вокселах j. Весовые коэффициенты всегда равны нулю, если расстояние до опухоли в вокселе j больше, чем в вокселе i, т.е. dj>di. В остальных направлениях их величина зависит от диффузионных свойств ткани.
Для вычисления тензора диффузии и весовых коэффициентов в данной работе использовали библиотеку dipy для Python (https://dipy.org/). Данные тензоров диффузии в каждом вокселе преобразовывали в вектор длиной 26, значения которого вычисляли по формуле:
ADCij=Di·nij,
где Di — тензор диффузии в i-м вокселе, nij — единичные векторы направлений из воксела i в соседний воксел j.
Анализировали только вокселы белого вещества, для этого вычисляли и вручную корректировали маски белого вещества и опухоли. В каждом вокселе белого вещества вычисляли весовые коэффициенты направлений построения траекторий.
Введем обозначения: у воксела с индексом i есть 26 соседних вокселов с индексом j, переменная mij содержит весовые коэффициенты выбора следующего воксела для траектории. Для вокселов вне маски белого вещества весовые коэффициенты mij равны нулю. Нулевые весовые значения также получали те вокселы, в которых величина удаленности от опухоли больше, чем в анализируемом.
Под словом «удаленность» имелось в виду не геометрическое расстояние, вычисляемое по прямой, а минимальное количество шагов (по одному вокселу за шаг) внутри маски белого вещества, необходимое для достижения края опухоли. Иными словами, это кратчайшая траектория из заданной точки до опухоли внутри «лабиринта» белого вещества головного мозга.
IV. Построение псевдослучайной траектории для нахождения профиля изменения тканевых характеристик в направлениях от границ опухоли к неизмененному по данным МРТ белому веществу:
а) в качестве стартовой точки траектории случайным образом выбирали один из наиболее удаленных от опухоли на «карте расстояний» воксел белого вещества (на расстоянии d_max шагов), из которого пошагово строили траекторию в направлении к опухоли;
б) на каждом шаге вероятность перехода из воксела i в соседний воксел j была пропорциональна весовым коэффициентам Wij, j=1…26;
в) когда траектория достигала края опухоли, выбирали следующую стартовую точку на том же удалении, но где еще не были построены траектории. Если таких вокселов нет, то выбирали следующий воксел на расстоянии d_max шагов. Операцию повторяли по мере постепенного приближения стартовых точек к опухоли;
г) операцию повторяли до тех пор, пока в каждом вокселе белого вещества проходило как минимум 100 траекторий.
В анализируемом вокселе вероятность выбора соседнего воксела с направлением nij вычисляли по формуле:
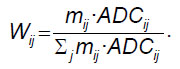
Таким образом вычислялась матрица размером nvox×26, где nvox — общее количество анализируемых на параметрической карте вокселов. В этой матрице для каждого воксела посчитаны вероятностные коэффициенты выбора следующего направления при движении от неизмененного по данным МРТ белого вещества к опухоли. Используя эти вероятностные коэффициенты, при итеративном движении по белому веществу невозможно зайти в «тупик», несмотря на геометрическую сложность структуры мозга.
Однако есть вероятность, что некоторые траектории будут «блуждать» на одном и том же удалении от опухоли и достигать ее через слишком большое количество шагов, что сделает процесс вычисления псевдослучайных траекторий очень долгим. Чтобы это исключить, в программе использовался параметр, ограничивающий то количество итераций подряд, когда траектория может строиться, не приближаясь к опухоли. В представленных в этой работе примерах такой параметр равен 12. Траектории начинали просчитывать из стартовых точек, в качестве которых вначале выбирались самые дальние вокселы (на расстоянии n шагов) и через которые не было еще построено ни одной траектории. Когда траектория доходит до края опухоли, выбирается следующая стартовая точка на том же удалении, где еще не было траекторий. Если таких вокселов нет, то берется следующий воксел на расстоянии d_max-1 шагов, через который еще не проходили траектории.
Операция повторялась по мере постепенного приближения стартовых точек к опухоли до тех пор, пока не закончатся вокселы, через которые не было построено ни одной траектории. Затем цикл повторялся от самых дальних от опухоли стартовых точек к ближним. В новом цикле для каждого расстояния di выбирались вокселы, в которых было построено минимальное количество траекторий. Важно отметить, что для стартовых точек, расположенных не на максимальном удалении, траектория «склеивалась» из двух сегментов: одного, направленного к границе опухоли, и другого, выходящего из стартовой точки в направлении, противоположном опухоли. Для построения второго сегмента вычислялась матрица вероятностных коэффициентов выбора направлений размером nvox×26. Вычисление этой матрицы проводилось аналогично вычислению матрицы, используемой для первого сегмента, но в матрице для второго сегмента, наоборот, обнулялись все соседние вокселы, у которых расстояние до опухоли меньше расстояния до нее из анализируемого воксела.
Критерием завершения работы цикла построения псевдослучайных траекторий к опухоли являлись минимум 100 построенных траекторий в каждом вокселе белого вещества. На современном компьютере с 16-ядерным процессором выполнение циклов в среде Matlab в многопоточном режиме завершалось примерно за 5 мин.
V. Построение профилей тканевых характеристик вдоль траектории:
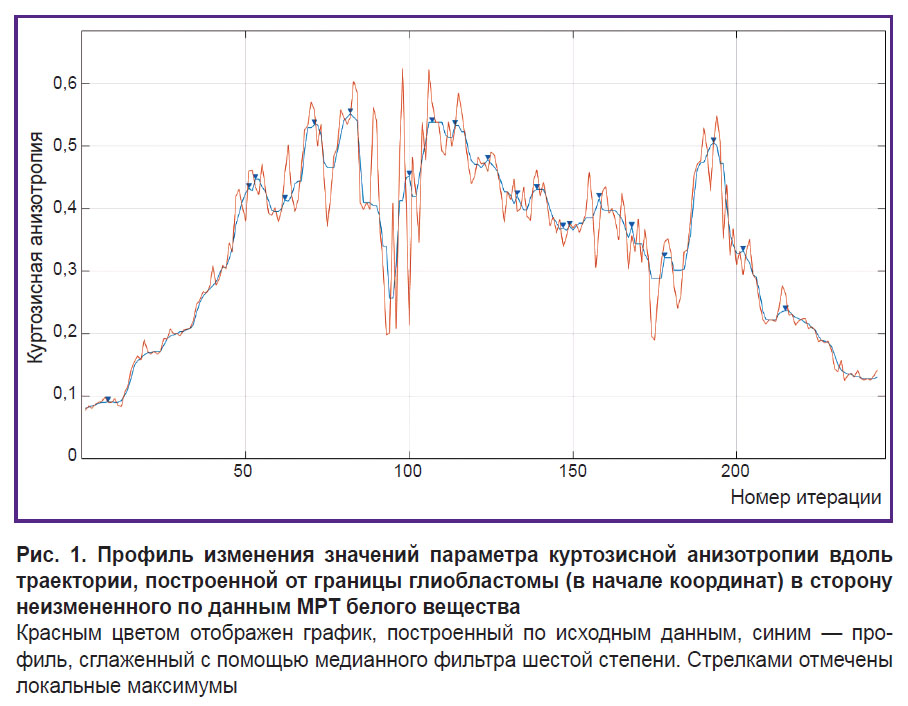
а) вдоль построенных траекторий строились профили — графики изменения численных значений в вокселах на выбранной параметрической ДКИ-карте в зависимости от степени удаления от края опухоли (рис. 1);
б) к профилям применялся медианный фильтр шестой степени для сглаживания небольших «шумовых» пиков (см. рис. 1);
в) на сглаженном профиле отмечались экстремумы и участки перепадов от минимумов к максимумам или от максимумов к минимумам.
Каждую траекторию анализировали по отдельности. Изначально предложенный в этой работе алгоритм тестировался на параметрических картах куртозиса, которые чувствительны к влиянию артефактов теплового шума. Пример профиля, полученного по карте куртозисной анизотропии, представлен на рис. 1. На нем видно большое количество локальных пиков, которые возникли, возможно, из-за теплового шума. Эти «шумовые» пики можно убрать с помощью медианного фильтра. Эмпирически был подобран оптимальный порядок этого фильтра, равный шести. Одним из преимуществ анализа изображений с помощью псевдослучайных траекторий является возможность выполнения сглаживания данных анализируемой параметрической карты, при этом полностью исключается влияние на результат МР-сигнала смежных базальных ядер и коры (серого вещества), а также ликворосодержащих структур — желудочков и субарахноидальных пространств.
VI. Построение параметрической карты «перепадов» анализируемого тканевого параметра. По проанализированным профилям для каждого воксела белого вещества вычислялась статистика следующего вида: P траекторий в данном вокселе имели участок значительного перепада, всего в данном вокселе было построено Q траекторий. По формуле 100%(P/Q) вычисляли параметрическую карту, которая «подсвечивала» области значительного изменения анализируемого параметра ДКИ в направлении от опухоли к неизмененному по данным стандартной МРТ белому веществу.
После выполнения сглаживания на каждом профиле отмечались экстремумы, а также сегменты возрастания и убывания сигнала от вокселов, по которым проходила траектория. После такой операции по всем полученным траекториям каждому из анализируемых вокселов присваивались три значения: 1) количество траекторий в данном вокселе на профиле, которые содержат участок повышения сигнала; 2) количество траекторий в данном вокселе с участком снижения сигнала на профиле; 3) общее количество траекторий, построенных через данный воксел. Поделив значения из первого или второго пункта на общее количество траекторий в вокселе, можно получить изображения, где отмечены участки существенного перепада значений используемого параметра около опухоли, которые на параметрической карте можно не заметить при визуальном анализе.
Клиническая апробация алгоритма
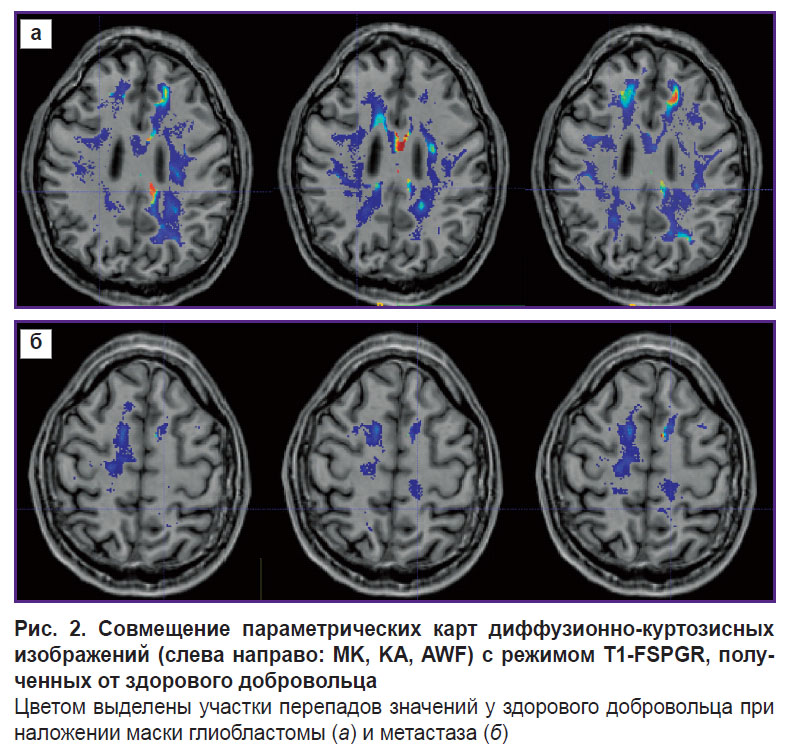
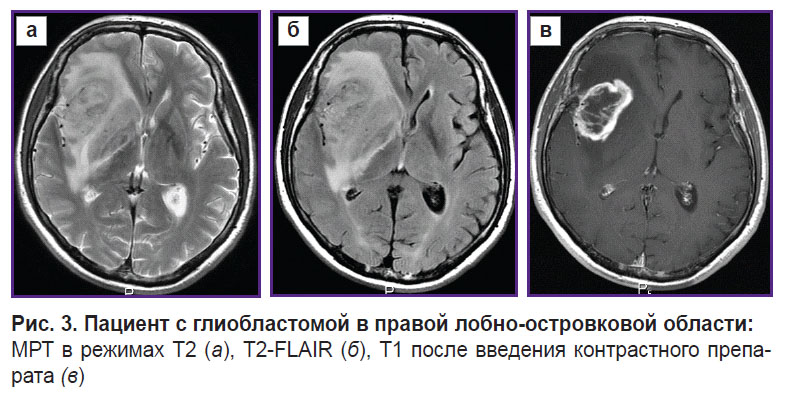
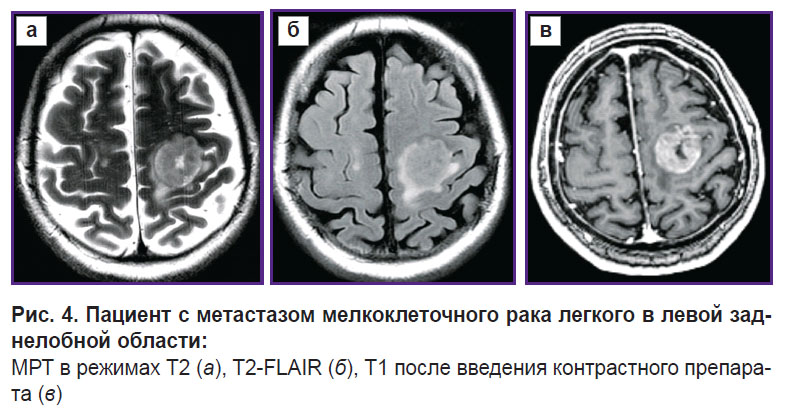
Перспективность применения алгоритма была проверена на одном здоровом добровольце (рис. 2) и двух пациентах — с глиобластомой, WHO grade 4 (рис. 3), и с единичным метастазом мелкоклеточного рака (рис. 4).
|
Рис. 3. Пациент с глиобластомой в правой лобно-островковой области: МРТ в режимах Т2 (а), Т2-FLAIR (б), Т1 после введения контрастного препарата (в) |
|
Рис. 4. Пациент с метастазом мелкоклеточного рака легкого в левой заднелобной области: МРТ в режимах Т2 (а), T2-FLAIR (б), Т1 после введения контрастного препарата (в) |
У здорового добровольца локализация опухоли была симулирована. На маску белого вещества здорового добровольца была перенесена маска опухоли пациента с помощью файлов трансформации. Эти файлы были получены после совмещения Т1-изображений каждого из пациентов и T1-изображения добровольца. Сами параметрические карты здорового добровольца не модифицировались, изменения были внесены только в файл с маской белого вещества: в эту маску были добавлены структуры опухоли — некроз, контрастируемая часть и перифокальный отек (или отек-инфильтрация для глиобластомы). Резюмируя описанный выше пункт IV, можно сделать вывод, что расположение псевдослучайных траекторий зависит от геометрии белого вещества, формы и локализации опухоли, а также значений тензоров диффузии в белом веществе испытуемого. Таким образом, эти траектории у пациента и здорового добровольца с «симулированной опухолью» должны быть схожи.
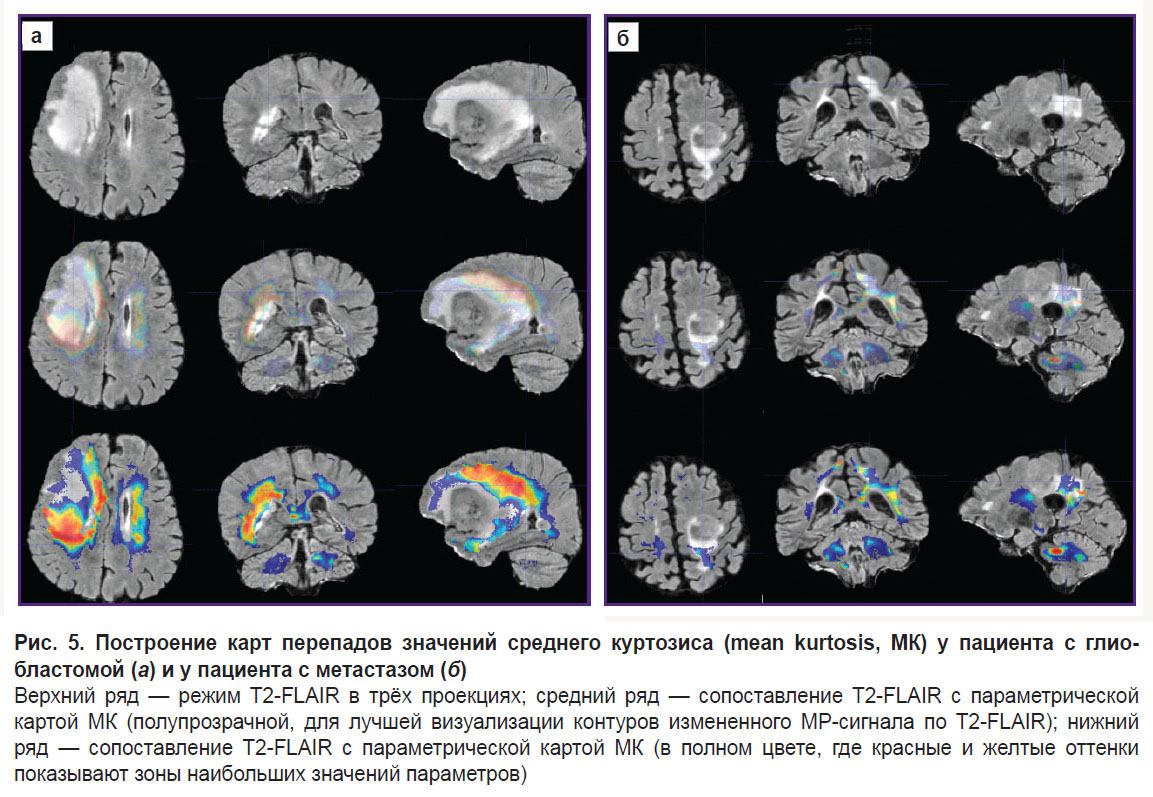
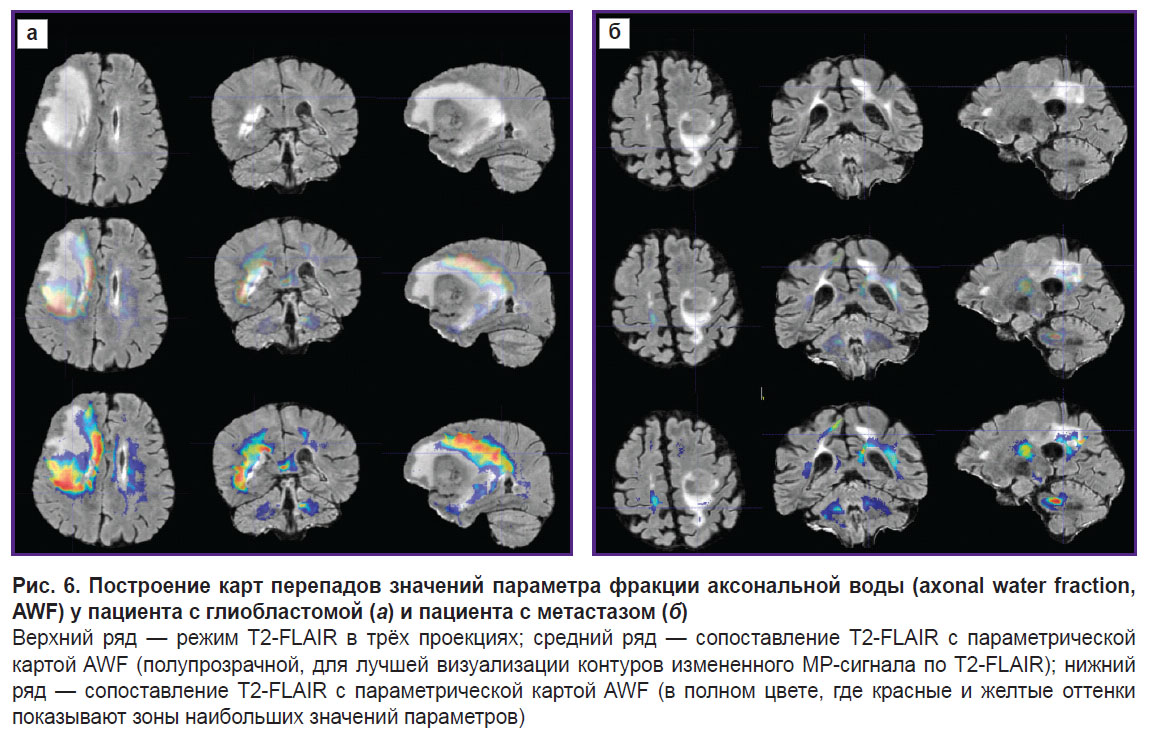
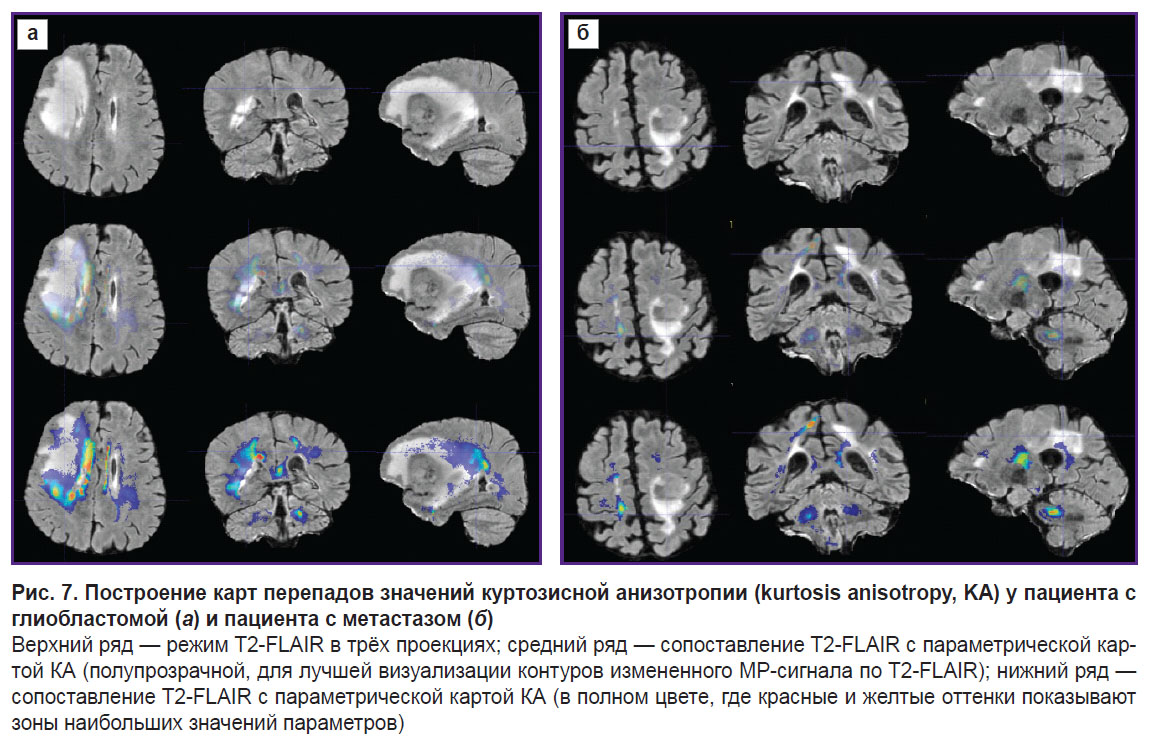
Для визуализации изменений в белом веществе последовательно были проанализированы ДКИ по всем параметрам, указанные в разделе «Материалы и методы». Наиболее значимыми оказались изменения, полученные на картах MK, RK, AWF, KA, AK. Причем, если у пациента с метастазом не было выявлено перепадов параметров за пределами части опухоли, контрастируемой на Т1 МРТ, то у пациента с глиобластомой зона изменения параметров распространялась на перифокальный отек-инфильтрацию и даже далее за его пределы. Примеры для параметров MK, AWF, КА представлены на рис. 5–7.
Обсуждение
В нашей предыдущей работе была показана высокая чувствительность и специфичность параметров диффузионно-куртозисной МРТ при дифференцировании зоны отека-инфильтрации злокачественных глиом и перифокального белого вещества мозга, не измененного на стандартных МРТ, что подтвердили данные биопсии и корреляции с маркерами Ki-67 и Bcl2 [7]. Продолжая это исследование, мы предположили, что полученные данные можно применить для построения карт, показывающих изменения параметров ДКИ не только в зонах интереса, но и на всех полученных срезах мозга и, в частности, по периферии патологического очага, что, вероятно, будет отражать степень инфильтрации тканей опухолевыми клетками.
Преимуществом предложенного в представленной работе метода анализа изображений является объективизация незначительного повышения яркости вокселов параметрических карт ДКИ при определении распространения опухолевой инвазии в перифокальной зоне глиобластомы при сравнении с метастазом.
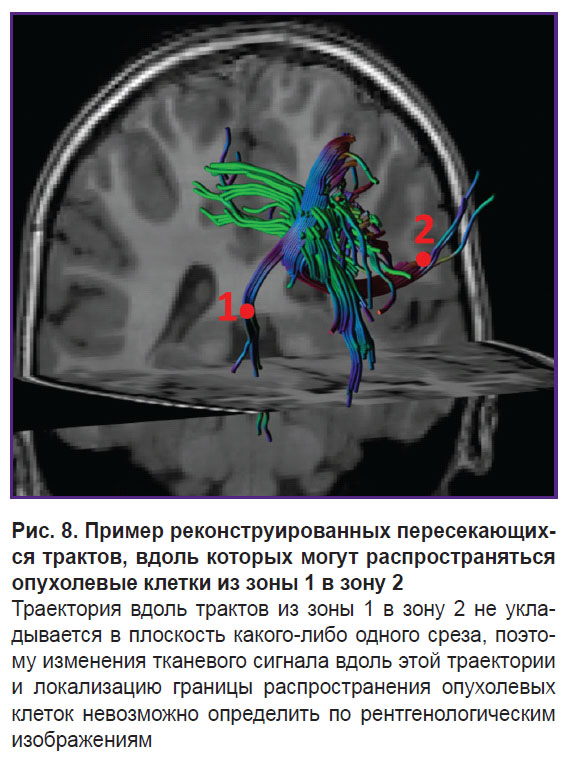
Известно, что основной путь распространения клеток глиобластомы в головном мозге — вдоль миелинизированных аксонов [1, 17–19]. Мы предположили, что яркость воксела в белом веществе мозга на параметрических картах ДКИ пропорциональна концентрации опухолевых клеток в этом вокселе. Возьмем две области интереса, находящиеся на одном срезе параметрической карты. Первая область — это зона отека-инфильтрации в белом веществе, где концентрация опухолевых клеток может быть высокой [1]. Вторая область расположена в белом веществе мозга, значительно удаленном от опухоли, где, предположительно, опухолевые клетки отсутствуют. Если допустить, что опухолевые клетки из первой зоны интереса распространялись в пределах одного среза, то по градиентной картине возможно увидеть границу опухоли, подобрав такие настройки визуализации, что контраст будет визуально отличим. Если же эти две зоны интереса расположены на разных срезах и опухолевые клетки распространялись по сложной траектории пересекающихся или соприкасающихся волокон, как на рис. 8, то в таком случае визуально определить границу роста опухоли невозможно. Мы исследовали перепады параметров ДКИ вдоль траекторий во всех направлениях.
В своей работе мы сравнили, как изменяются показатели вдоль траекторий, построенных с помощью предложенного алгоритма, в перифокальной зоне глиобластомы и метастаза. Мы получили не только изменения параметров (перепады на графиках траекторий), но и визуальное отражение (на цветовых картах) известной патоморфологии процесса — в перифокальном отеке метастаза не выявлено значимых перепадов параметров ДКИ, так как имеется чистый вазогенный отек и нет инфильтративного компонента. При глиобластоме не только в зоне перифокального отека, но и за пределами зоны изменения МР-сигнала были обнаружены перепады параметров ДКИ, что, по нашему мнению, отражает нарушения диффузии вдоль волокон белого вещества и различную степень инфильтрации тканей мозга клетками глиобластомы.
Разные авторы [20–22] ранее изучали перифокальный отек опухолей с помощью ДКИ при глиобластомах и метастазах. Эти исследования показали достоверные отличия параметров куртозиса и возможность дифференциации чистого отека и отека-инфильтрации. Такая дифференциация бывает необходимой для постановки правильного диагноза при единичных крупных метастазах, симулирующих глиобластомы (или наоборот). Эти исследования также интересны с точки зрения фундаментальной науки. Мы в своей работе визуализировали отличия перифокальной зоны глиобластомы и метастаза на цветных параметрических картах, сгенерированных при помощи алгоритма.
Если структура и патофизиология глиобластом в какой-то мере изучена, то перифокальная зона, включающая и отек, и перитуморальное неизмененное вещество мозга, изучена слабо [1, 18, 19]. В связи с актуальностью этой темы проводятся исследования с применением различных методов и их сочетаний. Так, было проведено исследование [9] перифокальной зоны глиобластом для прогнозирования дальнейшего роста опухоли с помощью мультипараметрического анализа с применением различных режимов МРТ, в том числе и диффузионно-тензорной МРТ. Эта работа показала гетерогенную структуру перитуморальной области, а также признаки опухолевой инфильтрации, которые могут отражать последующее направление распространения опухоли, что, однако, не было доказано при анализе МРТ в динамике.
Диффузионно-куртозисная МРТ дает негауссовские параметры диффузии воды, которые, вероятно, наиболее правильно отражают сложную микроструктуру тканей по сравнению с другими количественными методами нейровизуализации [22–25]. В связи с этим в своей работе мы применили именно параметры ДКИ, приняв их как самые чувствительные для тонких изменений структуры тканей мозга.
A.F. Delgado с соавт. [26], исследовавшие больных с глиомами grade 2 и 3, при помощи диффузионно-куртозисной МРТ получили достоверное различие параметров в перитуморальном белом веществе и в белом веществе противоположного полушария (без признаков опухолевого роста), что соответствует данным нашего предыдущего исследования, выполненного для глиом высокой степени злокачественности [7].
В перифокальной зоне контрастируемой части глиомы ДКИ-параметры изменяются из-за наличия вазогенного отека с опухолевой инфильтрацией, а за пределами патологически повышенного МР-сигнала по T2-FLAIR изменение параметров ДКИ, очень чувствительных к структурным изменениям, вероятно, может быть обусловлено инфильтрацией тканей опухолевыми клетками [7]. Это отражается на профилях параметров куртозиса вдоль траекторий, полученных с помощью нашего алгоритма.
Существует небольшое количество работ по сопоставлению результатов МРТ-исследований, а также гистологических и иммуногистохимических данных за пределами видимых границ глиом. Эти исследования показали, что опухолевые клетки могут быть обнаружены на значительном расстоянии от основного узла опухоли, даже в нормальном по данным стандартной МРТ веществе мозга [5, 6, 27–29].
В качестве вводных данных для представленной в этой работе программы использовались диффузионно-тензорные изображения всей головы пациента с опухолью мозга, а также совмещенные с диффузионным изображением параметрические карты ДКИ, по которым анализировались микроструктурные изменения в белом веществе. Такими параметрическими картами также могут быть и изображения тканевых времен T1- или T2-релаксации (при МР-релаксометрии), ПЭТ-изображения, перфузионные карты и т.д.
Алгоритм, предложенный в данной работе, в ближайшее время будет применен нами на большой группе пациентов с глиомами grade 2–4.
Ограничением исследования является тот факт, что невозможно верифицировать морфологические изменения по всему контуру опухоли, верификация возможна только в ограниченном количестве зон интереса. Например, ранее мы исследовали материалы биопсии только из трёх зон интереса [7].
ДКИ очень чувствительны к разного рода артефактам, что предъявляет повышенные требования к качеству оборудования, а также постобработке данных.
К недостаткам работы относится также необходимость ручной корректировки изображений.
Полученные данные требуют подтверждения в виде МРТ-исследований в динамике для анализа дальнейшего направления продолженного роста опухоли.
Заключение
Разработанный на основе диффузионно-куртозисной МРТ алгоритм анализа изображений при опухолях головного мозга позволяет оценить анизотропные изменения ткани мозга в направлениях от опухоли к неизмененному по данным МРТ белому веществу и таким образом определить степень изменения микроструктуры в перифокальной зоне глиобластомы мозга по сравнению с метастазом. Исследование проведено с целью получения индивидуальных карт опухолевой инвазии, которые будут применимы при планировании нейрохирургического и радиотерапевтического лечения, а также для прогнозирования направлений дальнейшего роста злокачественных глиом.
Финансирование. Исследование выполнено при поддержке гранта Российского научного фонда №22-75-10074, https://rscf.ru/project/22-75-10074/.
Конфликт интересов отсутствует.
Литература
- Ballestín A., Armocida D., Ribecco V., Seano G. Peritumoral brain zone in glioblastoma: biological, clinical and mechanical features. Front Immunol 2024; 15: 1347877, https://doi.org/10.3389/fimmu.2024.1347877.
- Ohmura K., Tomita H., Hara A. Peritumoral edema in gliomas: a review of mechanisms and management. Biomedicines 2023; 11(10): 2731, https://doi.org/10.3390/biomedicines11102731.
- Haddad A.F., Young J.S., Morshed R.A., Berger M.S. FLAIRectomy: resecting beyond the contrast margin for glioblastoma. Brain Sci 2022; 12(5): 544, https://doi.org/10.3390/brainsci12050544.
- Yamahara T., Numa Y., Oishi T., Kawaguchi T., Seno T., Asai A., Kawamoto K. Morphological and flow cytometric analysis of cell infiltration in glioblastoma: a comparison of autopsy brain and neuroimaging. Brain Tumor Pathol 2010; 27(2): 81–87, https://doi.org/10.1007/s10014-010-0275-7.
- Lemée J.M., Clavreul A., Aubry M., Com E., de Tayrac M., Eliat P.A., Henry C., Rousseau A., Mosser J., Menei P. Characterizing the peritumoral brain zone in glioblastoma: a multidisciplinary analysis. J Neurooncol 2015; 122(1): 53–61, https://doi.org/10.1007/s11060-014-1695-8.
- Zetterling M., Roodakker K.R., Berntsson S.G., Edqvist P.H., Latini F., Landtblom A.M., Pontén F., Alafuzoff I., Larsson E.M., Smits A. Extension of diffuse low-grade gliomas beyond radiological borders as shown by the coregistration of histopathological and magnetic resonance imaging data. J Neurosurg 2016; 125(5): 1155–1166, https://doi.org/10.3171/2015.10.JNS15583.
- Zakharova N.E., Batalov A.I., Pogosbekian E.L., Chekhonin I.V., Goryaynov S.A., Bykanov A.E., Tyurina A.N., Galstyan S.A., Nikitin P.V., Fadeeva L.M., Usachev D.Y., Pronin I.N. Perifocal zone of brain gliomas: application of diffusion kurtosis and perfusion MRI values for tumor invasion border determination. Cancers (Basel) 2023; 15(10): 2760, https://doi.org/10.3390/cancers15102760.
- Scola E., Del Vecchio G., Busto G., Bianchi A., Desideri I., Gadda D., Mancini S., Carlesi E., Moretti M., Desideri I., Muscas G., Della Puppa A., Fainardi E. Conventional and advanced magnetic resonance imaging assessment of non-enhancing peritumoral area in brain tumor. Cancers (Basel) 2023; 15(11): 2992, https://doi.org/10.3390/cancers15112992.
- Akbari H., Macyszyn L., Da X., Bilello M., Wolf R.L., Martinez-Lage M., Biros G., Alonso-Basanta M., OʼRourke D.M., Davatzikos C. Imaging surrogates of infiltration obtained via multiparametric imaging pattern analysis predict subsequent location of recurrence of glioblastoma. Neurosurgery 2016; 78(4): 572–580, https://doi.org/10.1227/NEU.0000000000001202.
- Rathore S., Akbari H., Doshi J., Shukla G., Rozycki M., Bilello M., Lustig R., Davatzikos C. Radiomic signature of infiltration in peritumoral edema predicts subsequent recurrence in glioblastoma: implications for personalized radiotherapy planning. J Med Imaging (Bellingham) 2018; 5(2): 021219, https://doi.org/10.1117/1.JMI.5.2.021219.
- Kim J.Y., Yoon M.J., Park J.E., Choi E.J., Lee J., Kim H.S. Radiomics in peritumoral non-enhancing regions: fractional anisotropy and cerebral blood volume improve prediction of local progression and overall survival in patients with glioblastoma. Neuroradiology 2019; 61(11): 1261–1272, https://doi.org/10.1007/s00234-019-02255-4.
- Long H., Zhang P., Bi Y., Yang C., Wu M., He D., Huang S., Yang K., Qi S., Wang J. MRI radiomic features of peritumoral edema may predict the recurrence sites of glioblastoma multiforme. Front Oncol 2023; 12: 1042498, https://doi.org/10.3389/fonc.2022.1042498.
- Riahi Samani Z., Parker D., Akbari H., Wolf R.L., Brem S., Bakas S., Verma R. Artificial intelligence-based locoregional markers of brain peritumoral microenvironment. Sci Rep 2023; 13(1): 963, https://doi.org/10.1038/s41598-022-26448-9.
- Davatzikos C., Rathore S., Bakas S., Pati S., Bergman M., Kalarot R., Sridharan P., Gastounioti A., Jahani N., Cohen E., Akbari H., Tunc B., Doshi J., Parker D., Hsieh M., Sotiras A., Li H., Ou Y., Doot R.K., Bilello M., Fan Y., Shinohara R.T., Yushkevich P., Verma R., Kontos D. Cancer imaging phenomics toolkit: quantitative imaging analytics for precision diagnostics and predictive modeling of clinical outcome. J Med Imaging (Bellingham) 2018; 5(1): 011018, https://doi.org/10.1117/1.JMI.5.1.011018.
- Pati S., Singh A., Rathore S., Gastounioti A., Bergman M., Ngo P., Ha S.M., Bounias D., Minock J., Murphy G., Li H., Bhattarai A., Wolf A., Sridaran P., Kalarot R., Akbari H., Sotiras A., Thakur S.P., Verma R., Shinohara R.T., Yushkevich P., Fan Y., Kontos D., Davatzikos C., Bakas S. The Cancer Imaging Phenomics Toolkit (CaPTk): technical overview. Brainlesion 2020; 11993: 380–394, https://doi.org/10.1007/978-3-030-46643-5_38.
- 16. Billot B., Greve D.N., Puonti O., Thielscher A., Van Leemput K., Fischl B., Dalca A.V., Iglesias J.E.; ADNI SynthSeg: segmentation of brain MRI scans of any contrast and resolution without retraining. Med Image Anal 2023; 86: 102789, https://doi.org/10.1016/j.media.2023.102789.
- Vollmann-Zwerenz A., Leidgens V., Feliciello G., Klein C.A., Hau P. Tumor cell invasion in glioblastoma. Int J Mol Sci 2020; 21(6): 1932, https://doi.org/10.3390/ijms21061932.
- Trevisi G., Mangiola A. Current knowledge about the peritumoral microenvironment in glioblastoma. Cancers (Basel) 2023; 15(22): 5460, https://doi.org/10.3390/cancers15225460.
- Giambra M., Di Cristofori A., Valtorta S., Manfrellotti R., Bigiogera V., Basso G., Moresco R.M., Giussani C., Bentivegna A. The peritumoral brain zone in glioblastoma: where we are and where we are going. J Neurosci Res 2023; 101(2): 199–216, https://doi.org/10.1002/jnr.25134.
- Tan Y., Wang X.C., Zhang H., Wang J., Qin J.B., Wu X.F., Zhang L., Wang L. Differentiation of high-grade-astrocytomas from solitary-brain-metastases: comparing diffusion kurtosis imaging and diffusion tensor imaging. Eur J Radiol 2015: 84(12): 2618–2624, https://doi.org/10.1016/j.ejrad.2015.10.007.
- Туркин А.М., Погосбекян Э.Л., Тоноян А.С., Шульц Е.И., Максимов И.И., Долгушин М.Б., Хачанова Н.В., Фадеева Л.М., Мельникова-Пицхелаури Т.В., Пицхелаури Д.И., Пронин И.Н., Корниенко В.Н. Диффузионная куртозисная МРТ в оценке перитуморального отека глиобластом и метастазов в головной мозг. Медицинская визуализация 2017; 4: 97–112, https://doi.org/10.24835/1607-0763-2017-4-97-112.
- Martín-Noguerol T., Mohan S., Santos-Armentia E., Cabrera-Zubizarreta A., Luna A. Advanced MRI assessment of non-enhancing peritumoral signal abnormality in brain lesions. Eur J Radiol 2021; 143: 109900, https://doi.org/10.1016/j.ejrad.2021.109900.
- Погосбекян Э.Л., Туркин А.М., Баев А.А., Шульц Е.И., Хачанова Н.В., Максимов И.И., Фадеева Л.М., Пронин И.Н., Корниенко В.Н. Диффузионная куртозисная МРТ в оценке микроструктуры вещества головного мозга. Результаты исследований здоровых добровольцев. Медицинская визуализация 2018; 4: 108–126. https://doi.org/10.24835/1607-0763-2018-4-108-126.
- Maximov I.I., Tonoyan A.S., Pronin I.N. Differentiation of glioma malignancy grade using diffusion MRI. Phys Med 2017; 40: 24–32, https://doi.org/10.1016/j.ejmp.2017.07.002.
- Pogosbekian E.L., Pronin I.N., Zakharova N.E., Batalov A.I., Turkin A.M., Konakova T.A., Maximov I.I. Feasibility of generalised diffusion kurtosis imaging approach for brain glioma grading. Neuroradiology 2021; 63(8): 1241–1251, https://doi.org/10.1007/s00234-020-02613-7.
- Delgado A.F., Fahlström M., Nilsson M., Berntsson S.G., Zetterling M., Libard S., Alafuzoff I., van Westen D., Lätt J., Smits A., Larsson E.M. Diffusion kurtosis imaging of gliomas grades II and III — a study of perilesional tumor infiltration, tumor grades and subtypes at clinical presentation. Radiol Oncol 2017; 51(2): 121–129, https://doi.org/10.1515/raon-2017-0010.
- Guo J., Yao C., Chen H., Zhuang D., Tang W., Ren G., Wang Y., Wu J., Huang F., Zhou L. The relationship between Cho/NAA and glioma metabolism: implementation for margin delineation of cerebral gliomas. Acta Neurochir (Wien) 2012; 154(8): 1361–1370, https://doi.org/10.1007/s00701-012-1418-x.
- Barajas R.F. Jr, Phillips J.J., Parvataneni R., Molinaro A., Essock-Burns E., Bourne G., Parsa A.T., Aghi M.K., McDermott M.W., Berger M.S., Cha S., Chang S.M., Nelson S.J. Regional variation in histopathologic features of tumor specimens from treatment-naive glioblastoma correlates with anatomic and physiologic MR imaging. Neuro Oncol 2012; 14(7): 942–954, https://doi.org/10.1093/neuonc/nos128.
- Eidel O., Burth S., Neumann J.O., Kieslich P.J., Sahm F., Jungk C., Kickingereder P., Bickelhaupt S., Mundiyanapurath S., Bäumer P., Wick W., Schlemmer H.P., Kiening K., Unterberg A., Bendszus M., Radbruch A. Tumor infiltration in enhancing and non-enhancing parts of glioblastoma: a correlation with histopathology. PLoS One 2017; 12(1): e0169292, https://doi.org/10.1371/journal.pone.0169292.