Цитопротекторное действие фумарата натрия в условиях in vitro модели гипоксии с применением дитионита натрия
Гипоксия является составляющей многих патологических и ряда физиологических процессов. Она также возникает в результате применения хирургических техник, связанных с ограничением кровоснабжения оперируемых органов и тканей. Это приводит к значительному снижению способности клеток осуществлять энергозависимые процессы за счет уменьшения вклада митохондрий в синтез аденозинтрифосфата (АТФ). Для защиты клеток и увеличения времени операции предложена инфузия раствора фумарата Na в течение нескольких дней до хирургической процедуры. Однако механизм наблюдаемого при этом защитного эффекта остается предметом обсуждения.
Цель исследования — изучение механизма цитопротекторного действия фумарата Na в отношении клеток почечного эпителия при моделировании острой гипоксии in vitro путем восстановления кислорода в среде дитионитом Na.
Материалы и методы. Исследования выполнены на клеточной линии эпителия почек MDCK с использованием дитионита Na в концентрации 5 мМ для создания условий гипоксии. Оценку параметров клеточного метаболизма, включая величину митохондриального мембранного потенциала, состояние митохондриальных НАДН и ФАД, содержание ионов Са2+ и Mg2+ и уровня рН в цитозоле, скорость поглощения клетками глюкозы, развитие клеточной гибели, проводили методами конфокальной и широкопольной флуоресцентной микроскопии. Определение концентрации растворенного кислорода выполняли полярографическим методом с помощью электрода Кларка.
Результаты. Показано, что применение дитионита Na позволяет моделировать состояние острой гипоксии in vitro с быстрым снижением концентрации кислорода в среде инкубирования клеток, приводящим к изменению функции митохондрий и развитию апоптоза. При этом присутствие фумарата Na снижает уровень клеточной гибели, что связано не с восстановлением АТФ-продуцирующей способности митохондрий, а с увеличением вклада альтернативных источников макроэрга.
Заключение. На клеточном уровне с использованием оптимизированной модели гипоксии показан механизм защитной роли фумарата Na, объясняющий эффективность антигипоксанта при искусственной ишемизации органов и тканей.
Введение
Гипоксия, характеризующаяся снижением парциального давления кислорода в органах и тканях, является важной составляющей как многих патологических, так и ряда физиологических процессов [1, 2]. Кроме того, возникновение гипоксии возможно при реализации органосохраняющих методик в хирургической практике, например при резекции почки, которая применяется для удаления небольших локализованных опухолей, характерных для стадий развития Т1a, Т1b и Т2 [3, 4]. В этом случае с целью лучшего контроля границ опухолевого роста за счет визуализации макроскопических различий между злокачественным образованием и здоровой тканью, снижения кровопотерь и поддержания гемостаза в ходе операции может быть использовано блокирование циркуляции крови в резецируемом органе путем холодовой или тепловой ишемии [5, 6]. Возникающие вследствие прекращения кровотока гипоксия и, соответственно, недостаточность биологического окисления и нарушение энергетического баланса приводят в итоге к гибели клеток [7]. Негативные последствия наблюдаются и в результате реоксигенации после восстановления нормальной концентрации кислорода в ткани [6]. Хотя изменения в тканях почек отмечаются уже в первые минуты процедуры [8], большинство исследователей определяют 25–30 мин как период, после которого эти изменения приобретают характер критических и необратимых [3, 5, 8–11]. Вероятно, это связано с тем, что основным клеточным механизмом, поддерживающим энергетический баланс клеток в условиях ишемии, является анаэробный гликолиз, однако его возможности в клетках почки исчерпываются уже через 15–20 мин ишемии [12]. В целом в случае проведения операции в течение более 30 мин рекомендовано применение холодовой ишемии, относительно безопасная продолжительность которой может достигать одного часа [5], или фармакологической нефропротекции, в том числе с помощью антигипоксантов [13].
В качестве антигипоксантов, которые могут быть использованы для защиты почек при тепловой ишемии, показаны антиоксиданты [14, 15], маннитол [16, 17], а также субстраты цикла Кребса и комплексов электрон-транспортной цепи (ЭТЦ) митохондрий, в частности фумарат [6]. В доклинических и клинических исследованиях отмечено, что заблаговременное внутривенное введение фумарата Na в значительной степени улучшает показатели функций почек непосредственно после завершения процедуры, а также в более долгосрочной перспективе.
Следует отметить, что механизм действия потенциальных антигипоксантов как собственно при гипоксии, так и при последующей реоксигенации, а также возможность увеличения приемлемой продолжительности ограничения кровотока в почке остаются малоизученными. К числу предлагаемых объяснений защитного эффекта можно отнести следующие процессы: синтез АТФ в анаэробных условиях за счет субстратного фосфорилирования [18, 19] и благодаря способности комплекса I ЭТЦ переносить протоны в межмембранное пространство для последующей работы F1–F0–АТФ-синтазы [18–20]; а также активацию внутриклеточных процессов, связанных со стабилизацией транскрипционного фактора HIF1α [21–28]. Широкий спектр возможных механизмов защиты и сложность процесса ишемического повреждения почечной паренхимы, понимание которых необходимо для обоснования нефропротекторной терапии [17], требуют проведения исследований с использованием релевантных моделей начиная с клеточного уровня.
Подходы к моделированию гипоксии in vitro могут быть условно разделены на две группы: 1) непрямые, ингибирующие процессы с участием кислорода или реакции, сопровождающие развитие гипоксии; 2) прямые, связанные с обеспечением минимального содержания кислорода в газовой атмосфере и/или в среде инкубирования. Применение хлорида кобальта [29, 30], блокирующего деградацию HIF1α и соответственно активирующего каскад обусловленных гипоксией процессов, является примером первой группы подходов. Могут также использоваться цианиды и азиды — ингибиторы комплекса IV ЭТЦ митохондрий, на котором происходит восстановление кислорода в процессе дыхания [31]. К общим недостаткам данных соединений относят их токсичность [32, 33] и отсутствие влияния на другие процессы, связанные с присутствием кислорода в системе, что может ставить под сомнение качество модели гипоксии. Для реализации второй группы подходов могут применяться специальные инкубаторы или камеры с регулируемой газовой средой, обеспечивающие возможность снижения содержания растворенного кислорода до 1–2% [29, 32, 34]. Несмотря на значительные очевидные преимущества, такой подход не лишен недостатков — необходимости использования специального оборудования, газовой смеси, а также сложности поддержания газового состава в случае, когда предполагается совершение дополнительных манипуляций с клетками. В качестве метода, позволяющего устранить часть указанных проблем, предложено применение высокого слоя среды, обеспечивающего лимитированную диффузией низкую скорость поступления кислорода к адгезионному клеточному слою [27, 32]. Однако очевидно, что в последнем случае достижение необходимого уровня гипоксии может быть реализовано после достаточно продолжительного времени ожидания. К известным методам удаления кислорода из среды инкубирования клеток относят использование ферментов (например, одновременно глюкозооксидазы и каталазы) [32, 35] или дитионита Na [34, 36]. Однако концентрация глюконолактона, образующегося в ходе ферментативной реакции, может значительно превышать уровень цитотоксичности [37]. Подход на основании введения в среду дитионита Na является относительно простым и приводит к резкому снижению содержания кислорода. Последнее делает дитионит Na весьма подходящим для моделирования острой гипоксии, возникающей после полного прекращения циркуляции крови [38].
Наряду с проблемой выбора подхода для создания гипоксических условий важно определить метод оценки изменений, происходящих в клетке при недостатке кислорода. Экспериментальное определение уровня образующих комплекс HIF1 белков затруднено при скрининговых исследованиях. В качестве альтернативы можно рассматривать выявление развития клеточной гибели, которая происходит по пути как апоптоза, так и некроза [39]. Однако это требует уточнений для конкретной модели, особенно ввиду современных представлений о механизмах развития путей гибели клеток [40].
В связи с этим целью настоящей работы является изучение механизма цитопротекторного действия фумарата Na в отношении клеток почечного эпителия при моделировании острой гипоксии in vitro путем восстановления кислорода в среде дитионитом Na.
Материалы и методы
Клеточная культура. Все этапы исследования были проведены с использованием клеточной линии почек MDCK (Madin–Derby canine kidney cells), которую культивировали в среде на основе DMEM («ПанЭко», Россия), содержащей 10% FBS (Biological Industries, Израиль), 1 мМ пирувата Na (Gibco, США), 2 мМ L-аланил-L-глутамина (Gibco, США), 100 мкг/мл стрептомицина и 100 Ед./мл пенициллина (Gibco, США). Клеточные культуры находились в инкубаторе при 37°C во влажной атмосфере, содержащей 5% CO2 и 95% воздуха. Плотность клеточного монослоя в ходе исследований составляла не менее 60%.
Реактивы. Для моделирования гипоксических условий путем восстановления растворенного кислорода в работе использовали дитионит Na (PanReac AppliChem, Германия). Удаление кислорода обеспечивали за счет достижения концентрации дитионита Na 5 ммоль/л путем внесения свежеприготовленного стокового раствора. В качестве источника фумарата Na использовали фармакопейный препарат Конфумин («Медполимер», Россия), представляющий собой 15% раствор фумарата Na, свободный от примесей. Для инкубирования клеток препарат Конфумин вносили в среду до достижения концентрации 5 ммоль/л.
Анализ методом конфокальной микроскопии. Измерения флуоресценции производили с помощью конфокального микроскопа LSM 900 (Carl Zeiss, Германия). Интенсивность освещения была сведена к минимуму (0,1–0,2% от максимальной мощности лазера), чтобы избежать фотовыгорания.
Оценка митохондриального мембранного потенциала ΔΨm. Для сравнительной оценки величины и анализа механизма поддержания ΔΨm использовали катионный флуоресцентный зонд тетраметилродамин (TMRM; Invitrogen, США) (максимумы возбуждения/флуоресценции ~553/578 нм). Накопление зонда в митохондриях определяется величиной отрицательного заряда на внутренней митохондриальной мембране. Перед исследованием клетки инкубировали в 25 нМ растворе зонда в течение 45 мин [41]. Величину ΔΨm оценивали на основе интенсивности флуоресценции. Для этого выполняли эксперименты в режиме послойного сканирования каждого поля зрения с последующим выделением всех клеток по отдельности и определением максимального значения сигнала для каждой клетки. В целях анализа механизма поддержания ΔΨm в рамках одного поля зрения осуществляли регистрацию изменений интенсивности флуоресценции после последовательного внесения ингибиторов комплекса V (олигомицина А, 2 мкг/мл) и комплекса I ЭТЦ (ротенона, 2 мкМ), а также митохондриального разобщителя FCCP (2 мкМ) [42]. При обработке экспериментов по анализу механизма поддержания ΔΨm проводили нормализацию интенсивности флуоресценции TMRM, при которой начальный уровень сигнала взят за 1, а конечный, соответствующий полной деполяризации митохондрий, за 0.
Оценка апоптоза и некроза. Оценку некроза в культуре клеток проводили с помощью флуоресцентных зондов Hoechst 33342 (Invitrogen, США) и йодида пропидия (Invitrogen, США). Клетки инкубировали с 5 мкМ Hoechst 33342 (максимумы возбуждения/флуоресценции ~350/481 нм) и 5 мкМ йодида пропидия (максимумы возбуждения/флуоресценции ~535/617 нм) в течение 30 мин при 37°C.
Для оценки апоптоза применяли субстрат NucView® 488 Caspase-3 (NucView, Biotium, США) (лазер возбуждения 488 нм с излучением выше 515 нм) в комбинации с Hoechst 33342 для обнаружения активации каспазы-3/7 и визуализации морфологических изменений в ядре при апоптозе. Клетки инкубировали с 5 мкМ NucView и 5 мкМ Hoechst 33342 в течение 30 мин при комнатной температуре [43].
Оценка продолжительности поддержания клетками трансмембранного градиента Ca2+ в условиях блокирования синтеза АТФ. Для сравнительной оценки способности клеток к реализации энергопотребляющих процессов за счет начального уровня АТФ использовали ратиометрический флуоресцентный зонд Mag-Fura-2, AM (Invitrogen, США), обладающий высоким сродством к Mg2+ и низким — к Ca2+. В обоих случаях образование комплекса зонда с металлами приводит к смещению пика возбуждения флуоресценции с 380 до 340 нм, c сохранением максимума интенсивности флуоресценции в области 530 нм. В качестве аналитического сигнала, характеризующего изменение состояния АТФ в клетках, использовали соотношение интенсивности флуоресценции при возбуждении длинами волн 340 и 380 нм (F340/F380). При блокировании путей синтеза АТФ рост данного параметра соответствует расходованию АТФ и высвобождению Mg2+. При полном исчерпании запасов АТФ клетки теряют способность к поддержанию разницы концентраций Ca2+ относительно цитоплазматической мембраны, что характеризуется резким увеличением сигнала [42]. Анализ проводили с помощью широкопольного флуоресцентного микроскопа на базе Olympus IX73Р1F (Olympus Corporation, Япония) и установки возбуждения и регистрации флуоресценции Cairn (Cairn Research Ltd., Великобритания) с флюоритовым иммерсионным объективом ×40, с использованием двух длин волн возбуждающего излучения ксеноновой дуговой лампы — 340 и 380 нм. Перед исследованием клетки инкубировали в 3 мкМ растворе зонда.
Изучение автофлуоресценции никотинамидадениндинуклеотида (НАДН). С целью оценки состояния комплекса I ЭТЦ в модельных условиях гипоксии, а также влияния фумарата Na исследовали уровень автофлуоресценции на широкопольном флуоресцентном микроскопе с применением флюоритового иммерсионного объектива ×40 и с использованием возбуждающего излучения (длина волны — 360 нм). Регистрацию флуоресценции осуществляли в интервале длин волн 430–480 нм.
Изучение автофлуоресценции флавинадениндинуклеотида (ФАД). При работе сукцинатдегидрогеназы происходит обратимое изменение состояния кофермента (переход от ФАД в ФАДН2 и обратно), что позволяет использовать автофлуоресценцию ФАД в качестве инструмента оценки функции комплекса II ЭТЦ. Исследования проводили с помощью микроскопа LSM 900 (Carl Zeiss, Германия) с использованием лазера с длиной волны 488 нм и регистрацией флуоресценции в интервале 490–600 нм.
Исследование кинетики поглощения клетками глюкозы. Для решения данной задачи использовали флуоресцентный аналог глюкозы –— 2-NBDG (Invitrogen, США) в концентрации 10 мкМ. Исследования проводили с помощью микроскопа LSM 900 (Carl Zeiss, Германия) (длина волны возбуждения — 488 нм, регистрация флуоресценции — свыше 490 нм) путем записи сначала автофлуоресценции клеток, а затем — сигнала, обусловленного проникновением в клетки зонда [44].
Определение уровня рН цитоплазмы. Показатель кислотности в цитоплазме оценивали с помощью ратиометрического зонда BCECF (Invitrogen, США) на широкопольном флуоресцентном микроскопе с применением флюоритового иммерсионного объектива ×40 и двух длин волн возбуждения — 430 и 495 нм. Клетки инкубировали в течение 30 мин в 5 мкМ растворе зонда с последующей отмывкой и определением уровня флуоресценции. В качестве аналитического сигнала использовали соотношение F495/F430. Для построения градуировочной зависимости F495/F430 от показателя кислотности в каждом эксперименте титровали сигнал зонда путем последовательного добавления калий-содержащих буферных растворов с рН 7,8; 7,4 и 6,7, содержащих 10 мкМ нигерицина [45].
Анализ данных и статистика. Эксперименты по микроскопическому анализу были выполнены не менее чем в трехкратной повторности; при анализе отдельных изображений использовали не менее 5 полей зрения. Статистический анализ проводили с помощью программного обеспечения OriginPro (OriginLab Corp., США). Оценку различий между сравниваемыми группами осуществляли с помощью непараметрического статистического U-критерия Манна–Уитни. Данные представляли в виде Me [Q1; Q3], а также использовали следующие обозначения: N — количество экспериментов; n — количество клеток или изображений.
Результаты
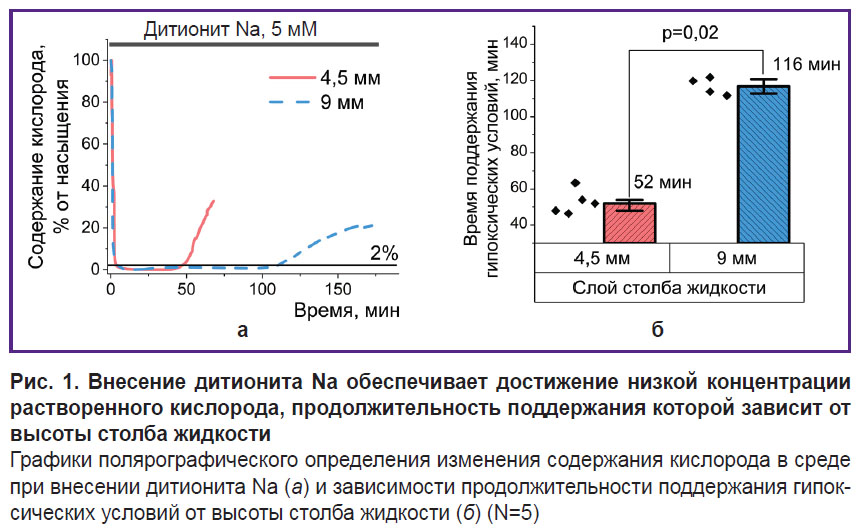
Применение дитионита Na приводит к ограниченному по времени снижению концентрации кислорода в растворе до гипоксических условий. С целью оценки условий применения основанной на дитионите Na методики моделирования острой гипоксии использовали стоковый 1 М раствор дитионита Na, при внесении которого в среду получали концентрацию 5 мМ. Такая концентрация способствует развитию признаков гипоксии, не оказывая при этом иного токсического влияния на клетки и не изменяя величину рН раствора [34, 41]. В качестве физиологически приемлемой среды в данном и последующих экспериментах использовали сбалансированный солевой раствор Хэнкса. Исследования с помощью оксиметра Oxytherm+ System (Hansatech Instruments Ltd, Великобритания) позволили установить, что при внесении восстановителя происходит резкое снижение содержания кислорода в растворе (рис. 1, а) до уровня 1–2% от насыщения. Ввиду невысокой стабильности кислородсвязывающая способность дитионита Na ограничена по времени [34]. В случае раствора с высотой 9 мм концентрация кислорода удерживается на уровне менее 1% от максимальной растворимости в течение около 100 мин с последующим быстрым увеличением до уровня, не позволяющего говорить о наличии гипоксии в системе. Снижение толщины слоя раствора в два раза приводит к сопоставимому уменьшению периода действия дитионита (рис. 1, б). При этом даже незначительное перемешивание, которое, видимо, влияет на скорость диффузии газов, резко сокращает данный промежуток времени. Все это необходимо учитывать при постановке экспериментов и, в случае их высокой продолжительности, использовать смену раствора, содержащего дитионит Na, или исключить контакт модельной системы с атмосферным воздухом. В дальнейших исследованиях при создании кратковременной гипоксии клетки инкубировали в среде с толщиной слоя 4,5 мм. Более продолжительные эксперименты проводили в ячейке, в качестве дна и крышки которой выступали покровные стекла (на нижнем покровном стекле находился монослой адгезионной культуры исследуемых клеток).
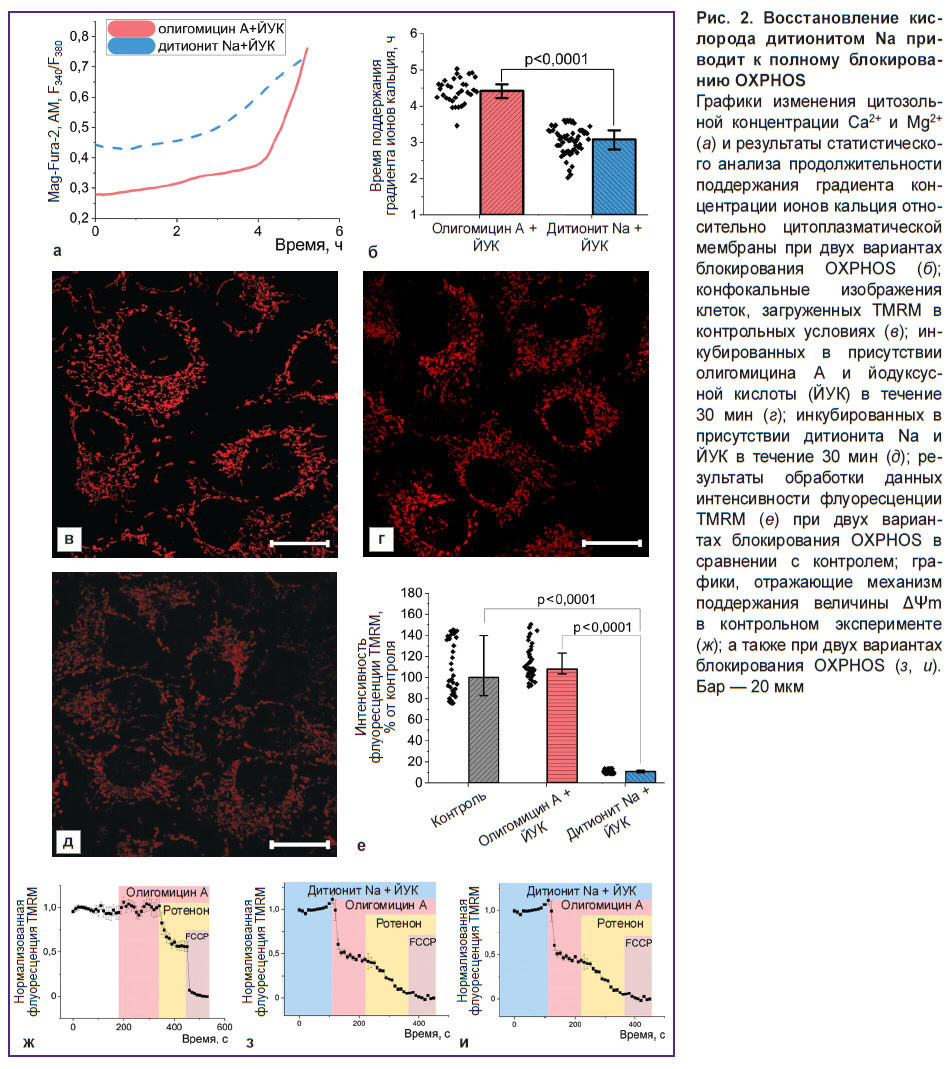
Обусловленное дитионитом Na удаление кислорода из раствора приводит к снижению жизнеспособности клеток, сопоставимому с условиями полного блокирования путей синтеза АТФ. С целью контроля изменения состояния клеток в гипоксических условиях во времени использовали оценку кинетики увеличения внутриклеточных концентраций Mg2+ и Ca2+, происходящего в результате гидролиза АТФ и вхождения Ca2+ в цитоплазму из среды соответственно, в условиях исключения синтеза АТФ. Для блокирования гликолиза и окислительного фосфорилирования (OXPHOS) в присутствии кислорода использовали йодуксусную кислоту (100 мкМ) и олигомицин А (5 мкг/мл) соответственно; в бескислородных условиях в отсутствие акцептора электронов на комплексе IV ЭТЦ внесение ингибитора F1–F0–АТФ-синтазы исключали (рис. 2, а). Период способности клеток к поддержанию разницы концентраций Ca2+ относительно цитоплазматической мембраны, характеризующий потребление имеющихся запасов АТФ, в гипоксических условиях оказался статистически значимо ниже в сравнении с экспериментом с блокированием гликолиза и OXPHOS (3,1 [2,8; 3,3] и 4,4 [4,2; 4,6] ч соответственно; p<0,0001; N=3; n=33 клетки) (рис. 2, б). Это говорит об эффективности физического удаления кислорода и даже запуске дополнительных энергопотребляющих процессов. С учетом расходования митохондриями более чем 95% потребляемого клетками кислорода [46] отличие между двумя экспериментами можно объяснить изменением состояния именно этих органелл. Как можно видеть из конфокальных изображений (рис. 2, в–д), интенсивность флуоресценции TMRM в митохондриях клеток, инкубированных в присутствии дитионита Na в течение 30 мин, приводит к значительному падению ΔΨm. Если при полном блокировании синтеза АТФ уровень ΔΨm в клетках составил 108,1 [82,8; 139,8]% от контроля, то в случае замены олигомицина А на дитионит Na он оказался резко сниженным (10,7 [9,7; 11,9]% от контроля; N=3; n=40 клеток) (рис. 2, е). При этом, как видно из рис. 2, и, в условиях гипоксии наблюдается деполяризация митохондрий после введения олигомицина А, что свидетельствует о нарушении функционирования комплекса V ЭТЦ.
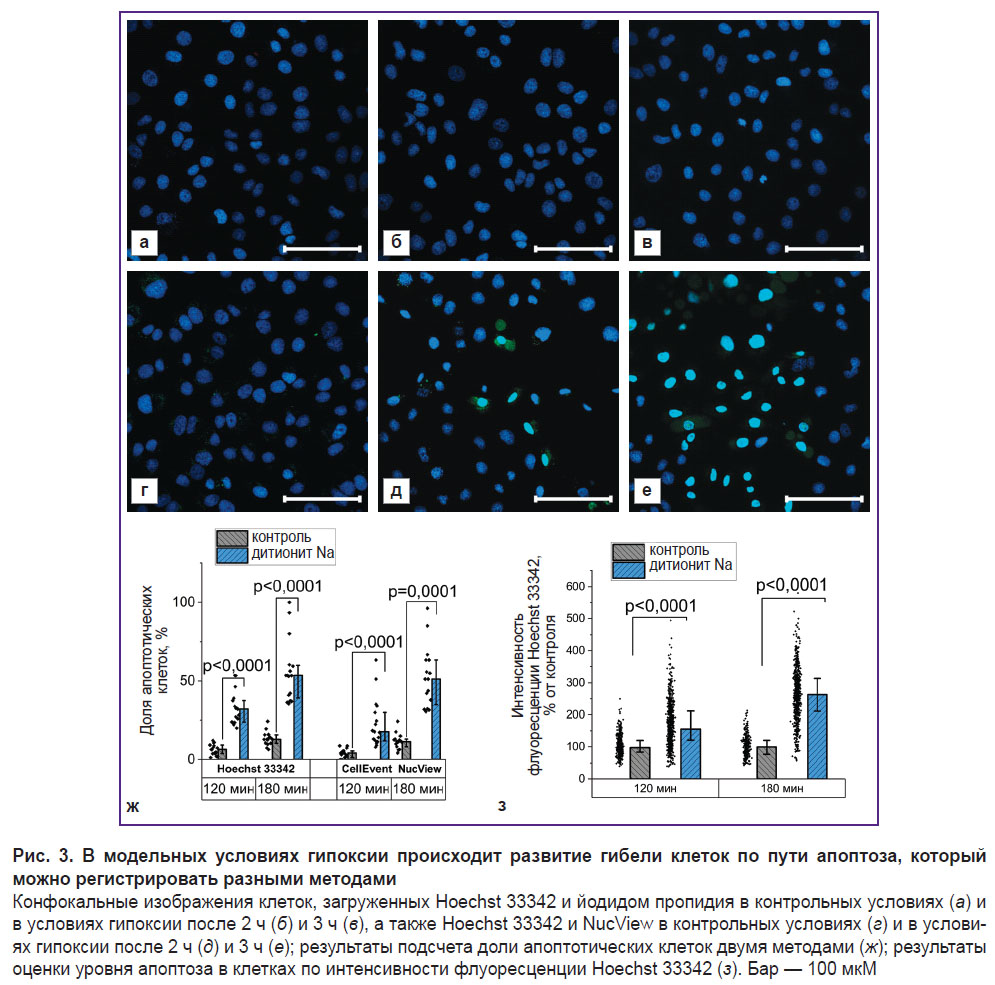
Связывание кислорода дитионитом Na запускает гибель клеток по пути апоптоза. Исчерпание запасов АТФ приводит в итоге к гибели клеток, которая может происходить по пути некроза или апоптоза. Как показывает анализ с использованием Hoechst 33342, окрашивающего ядра всех клеток, и йодида пропидия, проникающего только через поврежденные мембраны, развитие некроза нехарактерно для рассматриваемых модельных условий (доля окрашенных йодидом пропидия клеток не превышала 0,1% как в контрольной культуре, так и в культуре, которую выдерживали в присутствии дитионита Na в течение 2 и 3 ч) (рис. 3, а–в).
В целях оценки развития альтернативных путей клеточной гибели были проведены исследования с использованием селективного субстрата NucView, который приобретает способность к флуоресценции после ферментативного гидролиза и окрашивает ядра апоптотических клеток. В условиях гипоксии наблюдается значительное увеличение количества клеток с признаками апоптоза (рис. 3, г–е). Аналогичные выводы можно сделать на основании более детального изучения результатов окрашивания ядер флуоресцентным зондом Hoechst 33342. Использование этого зонда для оценки развития апоптоза обусловлено происходящими изменениями морфологии ядер, а также интенсивности флуоресценции [47]. Сравнительный анализ подсчета доли апоптотических клеток с применением двух флуоресцентных зондов показал схожие результаты при использовании селективного субстрата NucView и Hoechst 33342 (рис. 3, ж). При этом во втором случае может быть выполнен переход к более объективной оценке, основанной на определении интенсивности флуоресценции зонда (рис. 3, з): после 120 мин гипоксии данный параметр составил 155,3 [120,7; 211,8]% контроля (p<0,0001; N=3; n=484 клетки), а после 180 мин — 263,0 [211,0; 313,9]% контроля (p<0,0001; N=3; n=392 клетки).
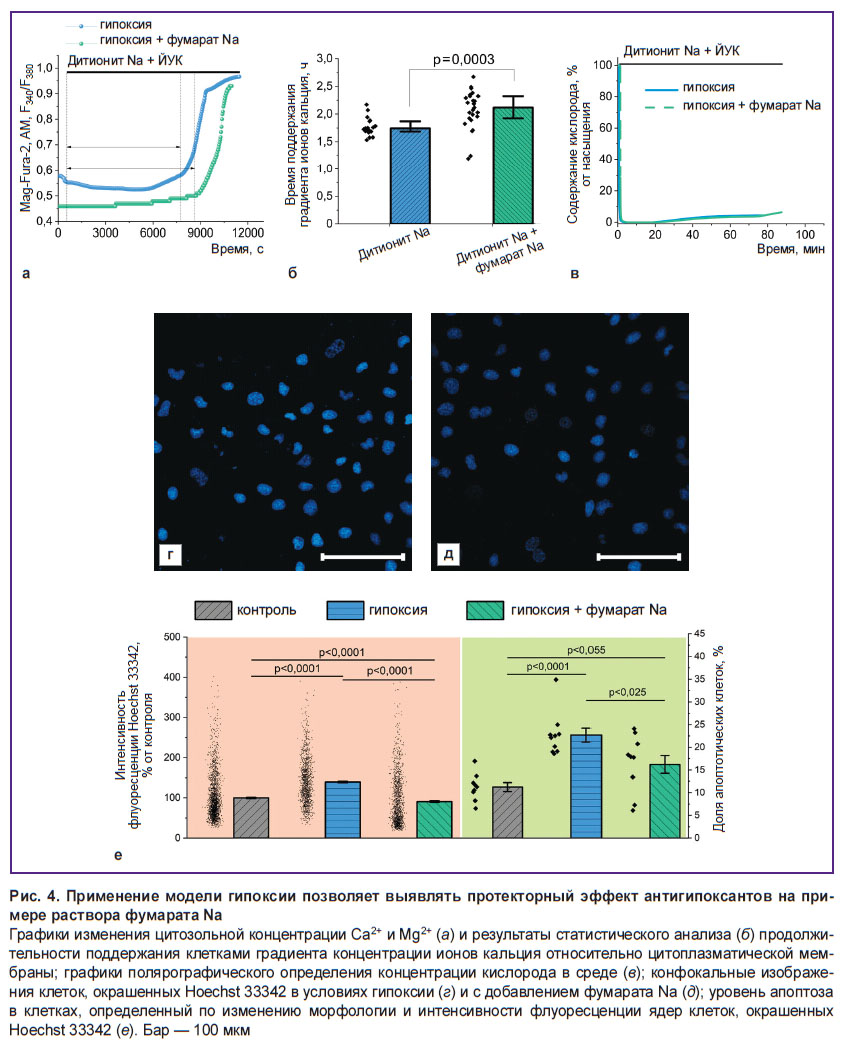
Применение фумарата Na увеличивает продолжительности жизни клеток, снижая скорость развития апоптоза в условиях гипоксии. Несмотря на применение фумарата Na в клинической практике, механизм его действия в условиях острой гипоксии представляется малоизученным. В связи с этим нами была использована модель острой гипоксии на основе дитионита Na для наблюдения происходящих изменений на клеточном уровне (рис. 4). Инкубирование клеток MDCK в условиях гипоксии в присутствии 5 мМ фумарата Na обусловливает увеличение периода способности к поддержанию разницы концентрации Ca2+ относительно цитоплазматической мембраны по сравнению с контрольным экспериментом без нефропротектора (рис. 4, а) на 26,6% (р=0,032; N=3; n=17 клеток) (рис. 4, б). Данный эффект не связан с возможной способностью фумарата Na окислять дитионит Na, снижая продолжительность обеспечения гипоксических условий (рис. 4, в). При этом наблюдаются существенно меньшие изменения морфологии ядер и увеличение интенсивности флуоресценции Hoechst 33342 (рис. 4, г, д), что свидетельствует об уменьшении скорости развития патологических процессов, приводящих к апоптозу. Статистический анализ показывает (рис. 4, е), что доля апоптотических клеток в экспериментах с 3-часовой гипоксией и с добавлением фумарата Na значительно ниже, чем без него (p<0,025; N=3; n=15 полей зрения). При этом аналогичный результат получается и при оценке развития апоптоза по связанному с конденсацией хроматина увеличению интенсивности флуоресценции Hoechst 33342. В условиях гипоксии без дополнительного воздействия интенсивность флуоресценции зонда составила 131,5 [99,8; 170,0]% контроля (p<0,0001; N=3; n=1278 клеток), в присутствии фумарата Na этот параметр оказался снижен до 68,3 [42,8; 127,7]% контроля (p=0,055; N=3; n=1326 клеток).
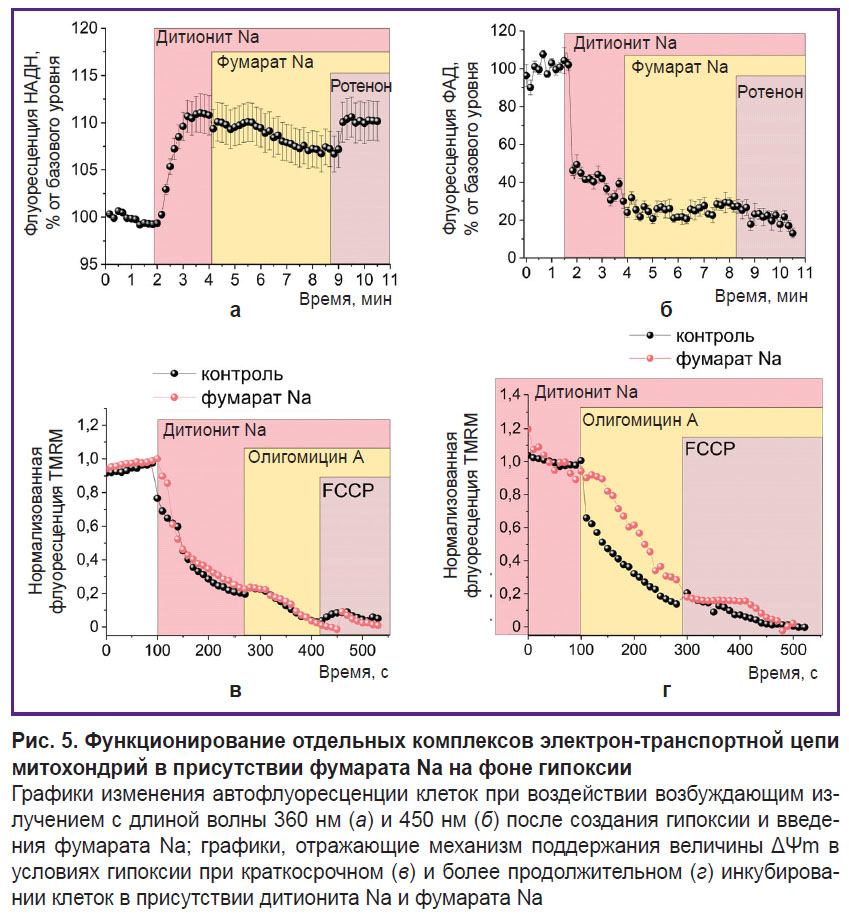
Фумарат Na обеспечивает частичное окисление митохондриальных коферментов с сохранением инверсного режима комплекса V ЭТЦ. Обусловленное фумаратом увеличение периода способности поддерживать разницу концентрации Ca2+ относительно цитоплазматической мембраны (см. рис. 4, а) косвенно свидетельствует о более высоком уровне АТФ в клетках, хотя механизм, обеспечивающий это, остается неясным. Возможность нормального функционирования ЭТЦ и протекания OXPHOS в использованных нами модельных условиях может быть проверена путем изучения состояния митохондриальных коферментов по уровню автофлуоресценции клеток при возбуждении на длине волны 360 нм (для НАДН) (рис. 5, а) и 450 нм (для ФАД) (рис. 5, б). В обоих случаях после регистрации базового уровня автофлуоресценции происходит резкое изменение сигнала при добавлении дитионита Na, что объясняется полным переходом содержащихся в митохондриях коферментов в восстановленные формы — НАДН и ФАДН2, последняя из которых не обладает способностью к флуоресценции. Последующее добавление фумарата Na до рабочей концентрации 5 мМ приводит к некоторому снижению флуоресценции НАДН (см. рис. 5, а) и росту ФАД (см. рис. 5, б). Это свидетельствует об их окислении соответственно комплексами I и II. Указанные изменения наблюдаются не сразу (примерно через 2 мин) после введения фумарата, что, вероятно, связано с процессами трансмембранного транспорта вещества. Происходящие далее обратные изменения под влиянием ротенона (2 мкМ) подтверждают связанную с фумаратом Na работу НАДН-дегидрогеназного комплекса. Однако, как показывают исследования механизма формирования ΔΨm, как при кратковременном (около 3 мин) (рис. 5, в), так и при более длительном (30 мин) (рис. 5, г) инкубировании клеток в условиях гипоксии в присутствии фумарата Na сохраняется деполяризация внутренней митохондриальной мембраны в ответ на олигомицин А, свидетельствующая о нарушении работы F1–F0–АТФ-синтазы.
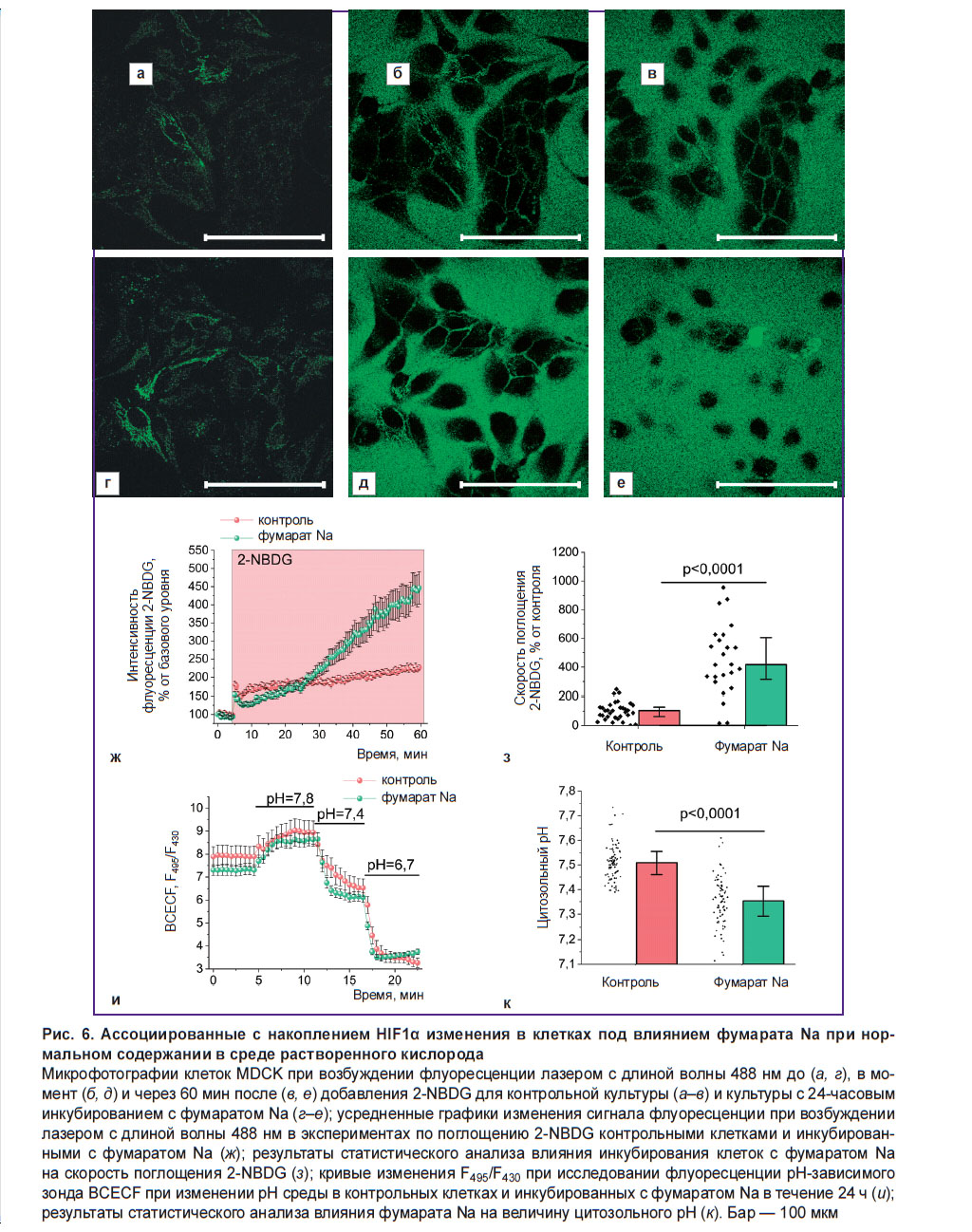
Инкубирование клеток в присутствии фумарата Na в условиях нормоксии приводит к увеличению способности клеток к поглощению глюкозы и закислению цитозоля. Поскольку применение фумарата Na в практике хирургии почки предусматривает внутривенное введение препарата в течение нескольких дней до операции [6], была проведена оценка возможности увеличения роли альтернативных OXPHOS-путей синтеза АТФ до момента наступления гипоксии. В связи с этим выполнены исследования, в рамках которых культуры клеток в течение 24 ч инкубировали в полной ростовой среде, содержащей 5 мМ фумарата Na, с последующим анализом скорости поглощения глюкозы и уровнем рН цитозоля. Как показывают эксперименты, проведенные с использованием флуоресцентного зонда 2-NBDG (рис. 6, а–з), контрольные и обработанные культуры в значительной степени различаются по скорости транспорта глюкозы через плазматическую мембрану, что может свидетельствовать о значительно более высоком уровне экспрессии гена глюкозного транспортера 1 (GLUT1). Статистический анализ демонстрирует, что суточное инкубирование с фумаратом Na приводит к более чем 4-кратному увеличению скорости поглощения 2-NBDG (p<0,0001) (см. рис. 6, ж, з).
Для оценки уровня внутриклеточного рН нами был использован ратиометрический зонд BCECF, соотношение интенсивностей флуоресценции которого в значительной степени зависит от показателя кислотности (рис. 6, и, к). Как следует из приведенных данных (см. рис. 6, к), даже в условиях нормоксии инкубирование клеток с фумаратом Na приводит к статистически значимому снижению рН — от 7,51 [7,46; 7,55] для контроля до 7,35 [7,29; 7,41] в случае экспериментальной культуры (р<0,0001; N=3; n=79 клеток).
Обсуждение
В практике резекции почки применение фумарата Na заключается в его инфузии до начала операции с целью увеличения содержания в тканях организма. При этом морфологические и клинико-биохимические исследования свидетельствуют о нефропротекторной роли фумарата Na при использовании техники тепловой ишемии органа [6]. Однако происходящие при этом изменения клеточного метаболизма и механизм защиты клеток на сегодняшний день изучены мало [18–20, 48]. Кроме того, открытым остается вопрос, связаны с ли эти изменения с действием самого вещества в период непосредственного удаления кислорода или опосредованы предварительной активацией защитных механизмов. В первом приближении ответы на указанные вопросы могут быть найдены в ходе исследований in vitro.
Для моделирования условий острой гипоксии в экспериментах на клеточной культуре MDCK использовали восстановление кислорода с помощью дитионита Na. Несмотря на преимущества, связанные с практически мгновенным снижением содержания растворенного кислорода до уровня 1–2% от насыщения (см. рис. 1, а), данный подход требует уточнения и оптимизации для конкретных экспериментальных условий. В частности, достаточно высокая реакционная способность и, соответственно, низкая стабильность ставят вопросы о времени, в течение которого соединение будет обеспечивать поддержание гипоксии. Эффект однократного внесения дитионита Na в концентрации 5 мМ зависит от высоты слоя среды над клетками (см. рис. 1, б) и ограничен периодом времени не более 120 мин, что при более продолжительном инкубировании делает необходимыми внесение новой порции восстановителя или, что более предпочтительно, исключение ее контакта с атмосферным воздухом.
Условия острой гипоксии приводят к значительным изменениям митохондриального метаболизма. В результате остановки транспорта электронов в ЭТЦ в отсутствие конечного акцептора электронов и, соответственно, блокирования работы переносящих протоны в трансмембранное пространство комплексов I, III и IV наблюдалась существенная деполяризация митохондрий, которая усиливалась при введении олигомицина А (см. рис. 2, и). Это свидетельствует о переходе комплекса V в АТФ-азный режим в целях поддержания ΔΨm, что характерно для многих патологий, связанных с митохондриальной дисфункцией [49]. При этом нарушения клеточного метаболизма в использованных модельных условиях приводят к апоптозу клеток. Оценка этого процесса возможна с применением специфических к определенному механизму клеточной гибели методов (например, флуоресцентного субстрата NucView) или на основании неспецифической оценки изменений как морфологии ядер, так и интенсивности флуоресценции связывающего с хроматином Hoechst 33342 [50, 51]. С учетом того, что развитие апоптоза может происходить как по каспазозависимому, так и по каспазонезависимому механизмам [47], последний подход перспективен для скрининговых исследований in vitro препаратов, разрабатываемых и рекомендованных к применению при искусственной ишемизации органов.
Результаты оценки апоптоза и способности клеток к обеспечению энергопотребляющих процессов свидетельствуют о наличии у фумарата выраженных защитных свойств в условиях гипоксии (см. рис. 4, е), связанных с увеличением уровня АТФ. К возможным объяснениям образования в анаэробных условиях АТФ в митохондриях можно отнести, например, субстратное фосфорилирование, происходящее в результате превращения α-кетоглутарата в сукцинат [18, 19], или реверсную работу сукцинатдегидрогеназы, восстанавливающей фумарат до сукцината, что позволяет комплексу I окислять НАДН и переносить протоны в трансмембранное пространство с последующим их возвратом через F1–F0–АТФ-синтазу и образованием АТФ [18–20]. С другой стороны, известны обоснования крайне малой вероятности последнего пути [50]. Как следует из полученных данных, добавление фумарата Na приводит к изменению соотношений НАДН/НАД и ФАДН2/ФАД, которые находят отражение в снижении и росте уровня автофлуоресценции соответственно (см. рис. 5, а, б). Это указывает на частичное восстановление работы комплекса I ЭТЦ за счет превращения фумарата в сукцинат под действием сукцинатдегидрогеназы. Однако при этом комплекс V не переходит в режим F1–F0–АТФ-синтазы — интенсивность флуоресценции TMRM снижается после добавления олигомицина А (см. рис. 5, в, г), что свидетельствует о сохранении ведущей роли АТФ-азного режима работы комплекса V в поддержании ΔΨm. Таким образом, возможное частичное восстановление функции комплекса I не связано с переносом протонов через внутреннюю митохондриальную мембрану или может быть недостаточным для формирования уровня ΔΨm, необходимого для протекания OXPHOS [48]. В связи с этим и субстратное фосфорилирование в матриксе митохондрий [18, 19], даже если оно протекает в использованных модельных условиях, будет обеспечивать образование АТФ для работы комплекса V, что не объясняет увеличение жизнеспособности клеток.
Антигипоксический эффект субстратов цикла Кребса может быть связан с активацией внутриклеточных процессов, ассоциированных с нестабильным в аэробных условиях HIF1α, который является центральным звеном в развитии обусловленного гипоксией состояния и участвует совместно с HIF1β в образовании гетеродимера HIF1 [52]. Такое предположение следует из данных об ингибировании фумаратом или сукцинатом окисляющих HIF1α пролилгидроксилаз в раковых клетках с дефицитом фумаратгидратазы и/или сукцинатдегидрогеназы, в результате чего возникает состояние псевдогипоксии даже при нормальном содержании кислорода в окружающей среде [21–23]. Это приводит к увеличению потребления клетками глюкозы за счет роста экспрессии гена GLUT1, а также вклада гликолиза в продукцию АТФ (гены гексокиназы 2 и пируваткиназы). Несмотря на меньший выход макроэрга (в результате превращения одной молекулы глюкозы образуется две молекулы АТФ), за счет относительной простоты и более высокой скорости гликолиз может обеспечить потребности клеток в энергии [53].
Накопление HIF1α в условиях увеличения содержания фумарата может быть также связано с фосфорилированием белка р65 и активацией пути NF-κB [24]. Помимо этого, ингибирование фумаратом или сукцинатом ферментов из семейства ТЕТ приводит к изменению уровня экспрессии регулируемых HIF генов [25]. Наконец, имеются данные о возможном взаимодействии накапливающегося в клетках с дефицитом фумаратгидратазы фумарата с белком KEAP1, что приводит к активации транскрипционного фактора NRF2 [26]. В целом возможность использования связанного со стабилизацией HIF1α механизма защиты при гипоксии рассмотрена в большом числе работ [27, 28], однако неизвестно, может ли с этим быть ассоциирован защитный эффект экзогенного фумарата.
В контексте защиты почек при проведении тепловой ишемии максимальный цитопротекторный эффект чаще всего достигается за счет его активации до проведения самой операции. В связи с этим были проведены исследования с 24-часовым инкубированием клеток с фумаратом Na при нормальном уровне кислорода, которые выявили значительное увеличение скорости потребления клетками глюкозы (см. рис. 6, з), а также статистически значимое снижение уровня рН в цитозоле (см. рис. 6, к). В совокупности это может свидетельствовать о характерном для анаэробных условий переключении метаболизма на анаэробный гликолиз, конечным продуктом которого выступает лактат [54]. Развитие этого процесса обусловлено активацией защитных механизмов, важнейшим элементом которых является стабилизация HIF1α [48, 49].
Заключение
Возможные риски ограничения кровоснабжения оперируемых органов и тканей могут быть снижены за счет применения антигипоксантов, в частности фумарата Na, однако только понимание механизма действия таких соединений позволит более эффективно использовать их на практике. В рамках проведенных исследований in vitro показано, что при резком снижении содержания кислорода в среде, моделирующем условия острой гипоксии, в клетках не только в значительной степени падает способность к реализации нормальных энергопотребляющих процессов, но и происходит переход комплекса V ЭТЦ митохондрий в АТФ-азный режим, что приводит к гибели клеток преимущественно по пути апоптоза. При этом фумарат Na в условиях гипоксии демонстрирует способность снижать уровень апоптоза клеток. Это связано с увеличением содержания в клетках АТФ, которое, однако, не обеспечивается восстановлением функции митохондрий. Инкубирование клеток с фумаратом Na в условиях нормоксии приводит к увеличению скорости потребления клетками глюкозы, а также к значимому снижению цитозольного рН, что может быть следствием более высокого уровня экспрессии генов глюкозных транспортеров и ключевых ферментов гликолиза, регулируемой HIF1α, и выступать объяснением показанного цитопротекторного действия.
Финансирование. Работа выполнена при финансовой поддержке гранта Правительства РФ №075-15-2024-621.
Конфликт интересов отсутствует.
Литература
- Lee J.W., Ko J., Ju C., Eltzschig H.K. Hypoxia signaling in human diseases and therapeutic targets. Exp Mol Med 2019; 51(6): 1–13, https://doi.org/10.1038/s12276-019-0235-1.
- Della Rocca Y., Fonticoli L., Rajan T.S., Trubiani O., Caputi S., Diomede F., Pizzicannella J., Marconi G.D. Hypoxia: molecular pathophysiological mechanisms in human diseases. J Physiol Biochem 2022; 78(4): 739–752, https://doi.org/10.1007/s13105-022-00912-6.
- Thompson R.H., Kaag M., Vickers A., Kundu S., Bernstein M., Lowrance W., Galvin D., Dalbagni G., Touijer K., Russo P. Contemporary use of partial nephrectomy at a tertiary care center in the United States. J Urol 2009; 181(3): 993–997, https://doi.org/10.1016/j.juro.2008.11.017.
- Mir M.C., Ercole C., Takagi T., Zhang Z., Velet L., Remer E.M., Demirjian S., Campbell S.C. Decline in renal function after partial nephrectomy: etiology and prevention. J Urol 2015; 193(6): 1889–1898, https://doi.org/10.1016/j.juro.2015.01.093.
- Funahashi Y., Yoshino Y., Sassa N., Matsukawa Y., Takai S., Gotoh M. Comparison of warm and cold ischemia on renal function after partial nephrectomy. Urology 2014; 84(6): 1408–1412, https://doi.org/10.1016/j.urology.2014.08.040.
- Попов С.В., Гусейнов Р.Г., Скрябин О.Н., Сивак К.В. Тепловая ишемия почки. М: ГЭОТАР-Медиа 2021; 272 с.
- Литвицкий П.Ф. Гипоксия. Вопросы современной педиатрии 2016; 15(1): 45–58.
- Kirkali Z. The motion: open partial nephrectomy is the standard of care for small resectable solid renal masses. Eur Urol 2007; 51(2): 561–564, https://doi.org/10.1016/j.eururo.2006.10.030.
- Damasceno-Ferreira J.A., Bechara G.R., Costa W.S., Pereira-Sampaio M.A., Sampaio F.J.B., Souza D.B. The relationship between renal warm ischemia time and glomerular loss. An experimental study in a pig model. Acta Cir Bras 2017; 32(5): 334–341, https://doi.org/10.1590/s0102-865020170050000002.
- Orvieto M.A., Zorn K.C., Mendiola F.P., Gong E.M., Lucioni A., Mikhail A.A., Gofrit O.N., Shalhav A.L. Ischemia preconditioning does not confer resilience to warm ischemia in a solitary porcine kidney model. Urology 2007; 69(5): 984–987, https://doi.org/10.1016/j.urology.2007.01.100.
- Simmons M.N., Schreiber M.J., Gill I.S. Surgical renal ischemia: a contemporary overview. J Urol 2008; 180(1): 19–30, https://doi.org/10.1016/j.juro.2008.03.022.
- Биленко М.В. Ишемические и реперфузионные повреждения органов (Молекулярные механизмы, пути предупреждения и лечения). М: Медицина; 1989; 368 с.
- Thompson R.H., Lane B.R., Lohse C.M., Leibovich B.C., Fergany A., Frank I., Gill I.S., Campbell S.C., Blute M.L. Comparison of warm ischemia versus no ischemia during partial nephrectomy on a solitary kidney. Eur Urol 2010; 58(3): 331–336, https://doi.org/10.1016/j.eururo.2010.05.048.
- Buys-Gonçalves G.F., Abreu L.A.S., Gregorio B.M., Sampaio F.J.B., Pereira-Sampaio M.A., de Souza D.B. Antioxidants as renoprotective agents for ischemia during partial nephrectomy. Biomed Res Int 2019; 2019: 8575398, https://doi.org/10.1155/2019/8575398.
- Gonçalves G.F.B., Silva M.E.M., Sampaio F.J.B., Pereira-Sampaio M.A., de Souza D.B. Quercetin as a nephroprotector after warm ischemia: histomorphometric evaluation in a rodent model. Int Braz J Urol 2021; 47(4): 796–802, https://doi.org/10.1590/S1677-5538.IBJU.2020.0358.
- Damasceno-Ferreira J.A., Abreu L.A.S., Bechara G.R., Costa W.S., Pereira-Sampaio M.A., Sampaio F.J.B., De Souza D.B. Mannitol reduces nephron loss after warm renal ischemia in a porcine model. BMC Urol 2018; 18(1): 16, https://doi.org/10.1186/s12894-018-0328-5.
- Дряженков И.Г., Комлев Д.Л., Лось М.С. Факторы ишемического повреждения почки при ее резекции. Клиническая медицина 2013; 91(6): 21–25.
- Weinberg J.M., Venkatachalam M.A., Roeser N.F., Saikumar P., Dong Z., Senter R.A., Nissim I. Anaerobic and aerobic pathways for salvage of proximal tubules from hypoxia-induced mitochondrial injury. Am J Physiol Renal Physiol 2000; 279(5): F927–F943, https://doi.org/10.1152/ajprenal.2000.279.5.F927.
- Weinberg J.M., Venkatachalam M.A., Roeser N.F., Nissim I. Mitochondrial dysfunction during hypoxia/reoxygenation and its correction by anaerobic metabolism of citric acid cycle intermediates. Proc Natl Acad Sci U S A 2000; 97(6): 2826–2831, https://doi.org/10.1073/pnas.97.6.2826.
- Spinelli J.B., Rosen P.C., Sprenger H.G., Puszynska A.M., Mann J.L., Roessler J.M., Cangelosi A.L., Henne A., Condon K.J., Zhang T., Kunchok T., Lewis C.A., Chandel N.S., Sabatini D.M. Fumarate is a terminal electron acceptor in the mammalian electron transport chain. Science 2021; 374(6572): 1227–1237, https://doi.org/10.1126/science.abi7495.
- MacKenzie E.D., Selak M.A., Tennant D.A., Payne L.J., Crosby S., Frederiksen C.M., Watson D.G., Gottlieb E. Cell-permeating alpha-ketoglutarate derivatives alleviate pseudohypoxia in succinate dehydrogenase-deficient cells. Mol Cell Biol 2007; 27(9): 3282–3289, https://doi.org/10.1128/MCB.01927-06.
- Pollard P.J., Brière J.J., Alam N.A., Barwell J., Barclay E., Wortham N.C., Hunt T., Mitchell M., Olpin S., Moat S.J., Hargreaves I.P., Heales S.J., Chung Y.L., Griffiths J.R., Dalgleish A., McGrath J.A., Gleeson M.J., Hodgson S.V., Poulsom R., Rustin P., Tomlinson I.P. Accumulation of Krebs cycle intermediates and over-expression of HIF1alpha in tumours which result from germline FH and SDH mutations. Hum Mol Genet 2005; 14(15): 2231–2239, https://doi.org/10.1093/hmg/ddi227.
- Sudarshan S., Linehan W.M., Neckers L. HIF and fumarate hydratase in renal cancer. Br J Cancer 2007; 96(3): 403–407, https://doi.org/10.1038/sj.bjc.6603547.
- Shanmugasundaram K., Nayak B., Shim E.H., Livi C.B., Block K., Sudarshan S. The oncometabolite fumarate promotes pseudohypoxia through noncanonical activation of NF-κB signaling. J Biol Chem 2014; 289(35): 24691–24699, https://doi.org/10.1074/jbc.M114.568162.
- Laukka T., Mariani C.J., Ihantola T., Cao J.Z., Hokkanen J., Kaelin W.G. Jr, Godley L.A., Koivunen P. Fumarate and succinate regulate expression of hypoxia-inducible genes via TET enzymes. J Biol Chem 2016; 291(8): 4256–4265, https://doi.org/10.1074/jbc.M115.688762.
- Ooi A., Furge K.A. Fumarate hydratase inactivation in renal tumors: HIF1α, NRF2, and “cryptic targets” of transcription factors. Chin J Cancer 2012; 31(9): 413–420, https://doi.org/10.5732/cjc.012.10102.
- Sethi K., Rao K., Shulkes A., Baldwin G., Bolton D., Patel O., Ischia J. Targeting HIF-1α to prevent renal ischemia-reperfusion injury: does it work? Int J Cell Biol 2019; 2019: 9598038, https://doi.org/10.1155/2018/9852791.
- Li Q.Y., Liu F., Tang X., Fu H., Mao J. renoprotective role of hypoxia-inducible factors and the mechanism. Kidney Dis (Basel) 2021; 8(1): 44–56, https://doi.org/10.1159/000520141.
- Muñoz-Sánchez J., Chánez-Cárdenas M.E. The use of cobalt chloride as a chemical hypoxia model. J Appl Toxicol 2019; 39(4): 556–570, https://doi.org/10.1002/jat.3749.
- Piret J.P., Mottet D., Raes M., Michiels C. CoCl2, a chemical inducer of hypoxia-inducible factor-1, and hypoxia reduce apoptotic cell death in hepatoma cell line HepG2. Ann N Y Acad Sci 2002; 973: 443–447, https://doi.org/10.1111/j.1749-6632.2002.tb04680.x.
- Tuboly E., Szabó A., Garab D., Bartha G., Janovszky Á., Erős G., Szabó A., Mohácsi Á., Szabó G., Kaszaki J., Ghyczy M., Boros M. Methane biogenesis during sodium azide-induced chemical hypoxia in rats. Am J Physiol Cell Physiol 2013; 304(2): C207–C214, https://doi.org/10.1152/ajpcell.00300.2012.
- Rinderknecht H., Ehnert S., Braun B., Histing T., Nussler A.K., Linnemann C. The art of inducing hypoxia. Oxygen 2021; 1(1): 46–61, https://doi.org/10.3390/oxygen1010006.
- Lawson W.H. Jr, Holland R.A., Forster R.E. Effect of temperature on deoxygenation rate of human red cells. J Appl Physiol 1965; 20(5): 912–918, https://doi.org/10.1152/jappl.1965.20.5.912.
- Zhao R.Z., Jiang S., Ru N.Y., Jiao B., Yu Z.B. Comparison of hypoxic effects induced by chemical and physical hypoxia on cardiomyocytes. Can J Physiol Pharmacol 2019; 97(10): 980–988, https://doi.org/10.1139/cjpp-2019-0092.
- Mueller S., Millonig G., Waite G.N. The GOX/CAT system: a novel enzymatic method to independently control hydrogen peroxide and hypoxia in cell culture. Adv Med Sci 2009; 54(2): 121–135, https://doi.org/10.2478/v10039-009-0042-3.
- Jayaraman T., Tejero J., Chen B.B., Blood A.B., Frizzell S., Shapiro C., Tiso M., Hood B.L., Wang X., Zhao X., Conrads T.P., Mallampalli R.K., Gladwin M.T. 14-3-3 binding and phosphorylation of neuroglobin during hypoxia modulate six-to-five heme pocket coordination and rate of nitrite reduction to nitric oxide. J Biol Chem 2011; 286(49): 42679–42689, https://doi.org/10.1074/jbc.M111.271973.
- Qin X., Liu B., Gao F., Hu Y., Chen Z., Xu J., Zhang X. Gluconolactone alleviates myocardial ischemia/reperfusion injury and arrhythmias via activating PKCε/extracellular signal-regulated kinase signaling. Front Physiol 2022; 13: 856699, https://doi.org/10.3389/fphys.2022.856699.
- Saxena K., Jolly M.K. Acute vs. chronic vs. cyclic hypoxia: their differential dynamics, molecular mechanisms, and effects on tumor progression. Biomolecules 2019; 9(8): 339, https://doi.org/10.3390/biom9080339.
- Shimizu S., Eguchi Y., Kamiike W., Itoh Y., Hasegawa J., Yamabe K., Otsuki Y., Matsuda H., Tsujimoto Y. Induction of apoptosis as well as necrosis by hypoxia and predominant prevention of apoptosis by Bcl-2 and Bcl-XL. Cancer Res 1996; 56(9): 2161–2166.
- Shen S., Shao Y., Li C. Different types of cell death and their shift in shaping disease. Cell Death Discov 2023; 9(1): 284, https://doi.org/10.1038/s41420-023-01581-0.
- Bracken C.P., Fedele A.O., Linke S., Balrak W., Lisy K., Whitelaw M.L., Peet D.J. Cell-specific regulation of hypoxia-inducible factor (HIF)-1alpha and HIF-2alpha stabilization and transactivation in a graded oxygen environment. J Biol Chem 2006; 281(32): 22575–22585, https://doi.org/10.1074/jbc.M600288200.
- Cheng X., Vinokurov A.Y., Zherebtsov E.A., Stelmashchuk O.A., Angelova P.R., Esteras N., Abramov A.Y. Variability of mitochondrial energy balance across brain regions. J Neurochem 2021; 157(4): 1234–1243, https://doi.org/10.1111/jnc.15239.
- Seryogina E.S., Kamynina A.V., Koroev D.O., Volpina O.M., Vinokurov A.Y., Abramov A.Y. RAGE induces physiological activation of NADPH oxidase in neurons and astrocytes and neuroprotection. FEBS J 2024; 291(9): 1944–1957, https://doi.org/10.1111/febs.17086.
- Esteras N., Blacker T.S., Zherebtsov E.A., Stelmashuk O.A., Zhang Y., Wigley W.C., Duchen M.R., Dinkova-Kostova A.T., Abramov A.Y. Nrf2 regulates glucose uptake and metabolism in neurons and astrocytes. Redox Biol 2023; 62: 102672, https://doi.org/10.1016/j.redox.2023.102672.
- Berezhnov A.V., Soutar M.P., Fedotova E.I., Frolova M.S., Plun-Favreau H., Zinchenko V.P., Abramov A.Y. Intracellular pH modulates autophagy and mitophagy. J Biol Chem 2016; 291(16): 8701–8708, https://doi.org/10.1074/jbc.M115.691774.
- Zorova L.D., Popkov V.A., Plotnikov E.Y., Silachev D.N., Pevzner I.B., Jankauskas S.S., Babenko V.A., Zorov S.D., Balakireva A.V., Juhaszova M., Sollott S.J., Zorov D.B. Mitochondrial membrane potential. Anal Biochem 2018; 552: 50–59, https://doi.org/10.1016/j.ab.2017.07.009.
- Zhivotosky B., Orrenius S. Assessment of apoptosis and necrosis by DNA fragmentation and morphological criteria. Curr Protoc Cell Biol 2001; 18: 18.3.1–18.3.23, https://doi.org/10.1002/0471143030.cb1803s12.
- Chinopoulos C. Which way does the citric acid cycle turn during hypoxia? The critical role of α-ketoglutarate dehydrogenase complex. J Neurosci Res 2013; 91(8): 1030–1043, https://doi.org/10.1002/jnr.23196.
- Vinokurov A.Y., Soldatov V.O., Seregina E.S., Dolgikh A.I., Tagunov P.A., Dunaev A.V., Skorkina M.Y., Deykin A.V., Abramov A.Y. HPRT1 deficiency induces alteration of mitochondrial energy metabolism in the brain. Mol Neurobiol 2023; 60(6): 3147–3157, https://doi.org/10.1007/s12035-023-03266-2.
- Ishikawa Y., Kitamura M. Inhibition of glomerular cell apoptosis by heparin. Kidney Int 1999; 56(3): 954–963, https://doi.org/10.1046/j.1523-1755.1999.00639.x.
- Bhadra K. A mini review on molecules inducing caspase-independent cell death: a new route to cancer therapy. Molecules 2022; 27(19): 6401, https://doi.org/10.3390/molecules27196401.
- Wheaton W.W., Chandel N.S. Hypoxia. 2. Hypoxia regulates cellular metabolism. Am J Physiol Cell Physiol 2011; 300(3): C385–C393, https://doi.org/10.1152/ajpcell.00485.2010.
- Shiratori R., Furuichi K., Yamaguchi M., Miyazaki N., Aoki H., Chibana H., Ito K., Aoki S. Glycolytic suppression dramatically changes the intracellular metabolic profile of multiple cancer cell lines in a mitochondrial metabolism-dependent manner. Sci Rep 2019; 9(1): 18699, https://doi.org/10.1038/s41598-019-55296-3.
- Lang K.S., Mueller M.M., Tanneur V., Wallisch S., Fedorenko O., Palmada M., Lang F., Bröer S., Heilig C.W., Schleicher E., Weigert C. Regulation of cytosolic pH and lactic acid release in mesangial cells overexpressing GLUT1. Kidney Int 2003; 64(4): 1338–1347, https://doi.org/10.1046/j.1523-1755.2003.00213.x.