Сфероиды из клеток эпителиального и мезенхимального фенотипов как строительные блоки в биопечати (обзор)
Основу большинства тканей и органов составляют клетки эпителиального и мезенхимального фенотипов. Эпителиальные клетки формируют защитные барьеры, играют ключевую роль в процессах абсорбции и секреции, а также участвуют в обмене веществ. Мезенхимальные клетки, обладая высокой пластичностью и способностью к миграции, обеспечивают структурную поддержку, способствуют восстановлению тканей и играют важную роль в ремоделировании матрикса. Взаимодействие между этими двумя типами клеток является критически важным для поддержания целостности и функциональности организма.
Современная тканевая инженерия направлена на создание искусственных тканей и органов, которые обладают необходимым клеточным составом, механическими свойствами и функциональным потенциалом для использования в медицине. Одним из самых популярных методов тканевой инженерии является 3D-биопечать, которая позволяет создавать сложные трехмерные структуры с заданными характеристиками. В последнее время особое внимание уделяется биопечати с применением сфероидов — трехмерных клеточных агрегатов, которые могут быть использованы в качестве строительных блоков для создания тканеинженерных конструкций. За счет многочисленных контактов клеток между собой и накопления внеклеточного матрикса в сфероидах воссоздаются условия, близкие к естественным тканям и органам.
Для оптимизации условий биопечати важно иметь точное представление о механических характеристиках сфероидов, так как они непосредственно влияют на способность клеток к миграции и слиянию, а следовательно, и на скорость формирования конструкта и его итоговую морфологию. Данный обзор обобщает существующие данные о различиях в механических свойствах эпителиальных и мезенхимальных сфероидов, рассматривает методы их совместного культивирования в различных приложениях регенеративной медицины, а также анализирует особенности их использования при разных методах биопечати для получения высококачественных тканевых конструкций.
Введение
В последние десятилетия бурно развивается тканевая инженерия, происходит объединение достижений технологий материаловедения, клеточной биологии, физики и трансплантологии для решения проблем регенеративной медицины. Технология биопечати является одним из самых перспективных подходов к формированию биоэквивалентов как для заместительной терапии, так и для получения адекватных моделей тестирования эффективности и безопасности персонализированных лекарственных препаратов.
Стратегия тканевой инженерии «сверху вниз» с формированием трехмерных конструктов и последующим добавлением к ним суспензии клеток имеет ограничения, связанные со сниженной жизнеспособностью клеток после трансплантации, с отсутствием межклеточных контактов и внеклеточного матрикса (ВКМ). Поэтому в последнее время популярен подход «снизу вверх», который предполагает биопечать с использованием не суспензии клеток, а предварительно сформированных трехмерных агрегатов клеток — сфероидов, в которых клетки сформировали комплексы межклеточных контактов, синтезировали ВКМ, дифференцировались в заданном направлении и адаптировались к гипоксии [1, 2]. В конструктах, сформированных с использованием сфероидов, жизнеспособность, пролиферация и функционально-дифференцировочный потенциал значительно выше, чем при биопечати с применением суспензии клеток.
Изучение строения и свойств сфероидов как ключевого компонента биочернил для формирования ткани является одной из фундаментальных задач тканевой инженерии и имеет важное практическое значение. Основу большинства тканей и органов составляют клетки эпителиального и мезенхимального фенотипов. Эпителиальные клетки формируют защитные барьеры, играют ключевую роль в процессах абсорбции и секреции, а также участвуют в обмене веществ. Мезенхимальные клетки, обладая высокой пластичностью и способностью к миграции, обеспечивают структурную поддержку, способствуют восстановлению тканей и играют важную роль в ремоделировании. Взаимодействие между этими двумя типами клеток является критически важным для поддержания целостности и функциональности организма. Помимо этого, все процессы развития, морфогенеза, регенерации и онкогенеза тесно связаны с переходами между эпителиальным и мезенхимальным фенотипами клеток и поиск новых моделей для их изучения является важной задачей регенеративной медицины [3]. Комбинирование сфероидов из различных типов клеток при формировании тканеинженерных конструктов позволяет воссоздавать сложные тканеспецифичные структуры.
Данный обзор обобщает имеющиеся данные о различиях между эпителиальными и мезенхимальными сфероидами, рассматривает методы их совместного культивирования в различных приложениях регенеративной медицины, а также анализирует особенности их использования при разных методах трехмерной биопечати для получения высококачественных тканевых конструкций.
Мультипотентные мезенхимальные стромальные клетки
Основным типом клеток для использования в регенеративной медицине являются мультипотентные стромальные клетки (МСК), впервые описанные Александром Яковлевичем Фриденштейном как популяция стволовых клеток костного мозга, способных дифференцироваться в остеогенном направлении [4]. Термин «мультипотентные мезенхимальные стромальные клетки» был введен благодаря работам группы Арнольда Каплана [5]. Многие исследования показывают, что популяция МСК гетерогенна по своим характеристикам и сильно варьирует от ткани-источника [6]. Тем не менее роль МСК как при естественной регенерации, так и в тканевой инженерии неоспорима. Известно, что МСК обладают выраженным «хоумингом», т.е. тропностью к местам повреждений, а также обладают противовоспалительными и иммуносупрессивными свойствами [7]. Кроме того, МСК слабо экспрессируют главные комплексы гистосовместимости, таким образом их трансплантация не приводит к иммунному ответу со стороны хозяина и отторжению, что делает их удобным источником клеток для использования в регенеративной медицине [8].
Согласно общепринятым критериям, МСК должны иметь фибробластоподобную морфологию, адгезироваться к пластику, экспрессировать поверхностные маркеры CD105, CD73, CD90 и дифференцироваться в остеогенном, хондрогенном и адипогенном направлениях [9]. Основными источниками МСК служат костный мозг, жировая ткань, амниотическая жидкость, пуповинная кровь и вартонов студень пупочного канатика [10]. В зависимости от тканевого источника МСК демонстрируют разные возможности к дифференцировке и пролиферации. Показано, что МСК костного мозга имеют наибольший потенциал к остеогенной дифференцировке [11], тогда как у МСК жировой ткани преобладает ангиогенный потенциал. МСК, полученные из пуповинной крови, обладают самым высоким пролиферативным потенциалом, что дает возможность поддерживать их в культуре в течение длительного времени [12, 13]. Наряду с классическими источниками МСК доступными и перспективными их источниками являются пульпа зуба, десна и периодонтальная связка [14, 15]. МСК из данных источников имеют более высокий потенциал к дифференцировке в остеогенном и хондрогенном направлениях по сравнению с МСК жировой ткани [16]. Таким образом, в зависимости от целей исследования должен быть выбран определенный источник популяции МСК.
Эпителиальные клетки
Эпителиальная ткань — это совокупность эпителиальных клеток, обладающих апикобазальной полярностью, тесно прилежащих друг к другу, связанных за счет плотных контактов и выстилающих поверхности и полости большинства органов. Эпителиальная ткань обладает высоким регенеративным потенциалом и выполняет защитную, секреторную, транспортную, абсорбционную и другие функции [17]. Эпителий представлен во многих системах органов человека, например таких, как кожа, роговица глаза, половая, мочевыводящая, пищеварительная, дыхательная системы [18–20]. Первичные культуры эпителиальных клеток широко применяют для исследования процессов дифференцировки и адгезии клеток, абсорбции, проницаемости и механизмов регенерации тканей [21]. Они также используются в анализе метаболических нарушений гомеостаза, например формирования фиброзной ткани при заживлении и эпителиально-мезенхимальной пластичности в случае развития злокачественных образований [22, 23]. Помимо этого, культуры эпителиальных клеток широко применяют для изучения цитотоксичности лекарственных препаратов и химических веществ.
Кроме первичных культур существует большое количество коммерчески доступных культур эпителиальных клеток человека, полученных из разных источников, таких как бронхи, легкие, трахея, плацента, мочевой пузырь, молочные железы, проксимальные канальцы почки, эндометрий сосудов, ретинальный пигментный эпителий сетчатки и др. В зависимости от целей исследования выбирается тот или иной источник эпителиальных клеток.
Восстановление барьерных эпителиальных тканей является важной и перспективной задачей в тканевой инженерии. Биоэквиваленты для облегчения регенерации тканей или ex vivo тестирований могут представлять собой клеточные пласты, созданные из эпителиальных клеток, а также тканеинженерные конструкции различного состава, созданные методами 3D-биопечати [24, 25].
Преимущества 3D-культивирования
Наиболее перспективным подходом для исследования процессов дифференцировки и межклеточных взаимодействий в условиях, приближенных к таковым в нативной ткани, может служить использование сфероида, в котором формируется градиент факторов роста, питательных веществ, кислорода [26], усиливаются взаимодействия между клетками посредством увеличения количества адгезионных контактов [27] и связей с новосинтезированным ВКМ [28]. 3D-культуры клеток в форме сфероидов приближены к нативной ткани по реализации многоклеточного микроокружения, сигнальных путей и межклеточных взаимодействий, что позволяет использовать их для моделирования процессов, происходящих в нативных тканях [29].
Преимущества 3D-культивирования показаны для многих типов клеток. Так, жизнеспособность гепатоцитов в сфероидах выше, чем в монослое, и в 3D-культуре они сохраняют высокую способность к детоксикации [30]. В сфероидах эндотелиальных клеток путем апоптоза центральных клеток формируются просветы сосудов, что позволяет изучать васкулогенез [31]. Кроме того, клеточные сфероиды широко применяют в онкологических исследованиях для анализа морфологических изменений в трансформированных клетках [32].
Преимущества 3D-культивирования неоднократно были отмечены в работах с использованием МСК. При монослойном культивировании МСК быстро «стареют», накапливается их генетическая нестабильность, что ограничивает сроки культивирования, снижаются продукция паракринных факторов, дифференцировочный потенциал и способность восстанавливать ткани реципиента после трансплантации [33]. В трехмерных условиях культуру можно поддерживать в течение длительного периода времени (до 7 мес) [34]. Одним из объяснений данного феномена является увеличение в сфероидах экспрессии маркеров плюрипотентности Oct4A и Nanog, SOX2, SSEA-4, TRA-1-60 и TRA-181. Это объясняет длительное сохранение стволовости клеток в сфероидах по сравнению с монослоем [35]. Показано, что после диссоциации сфероида раствором трипсина клетки пролиферируют активнее, чем клетки монослойной культуры. Таким образом, 3D-культивирование также увеличивает пролиферативный потенциал клеток [36].
Процесс активации пролиферации и миграции клеток сфероида при помещении его в 2D-условия на адгезивный субстрат называется реактивацией [2]. Показано, что в сфероидах усиливается секреторная активность и, как следствие, повышается противовоспалительный потенциал МСК за счет таких цитокинов и факторов роста, как VEGF (фактор роста эндотелия сосудов), основной фактор роста фибробластов, ангиогенин, прокатепсин В и интерлейкин-11 [37].
При 3D-культивировании также возрастают дифференцировочный потенциал и чувствительность клеток к индукторам, что имеет важное значение для регенеративной медицины. Например, при воздействии VEGF сфероиды из МСК быстрее дифференцируются в ангиогенном направлении, чем в монослойной культуре [38, 39]. 3D-культивирование клеток эндотелия пупочной вены человека (HUVEC) стимулирует экспрессию таких генов ангиогенеза, как CD31, VEGFR-1, VEGFR-2, а также Tie-1, Tie-2 — рецепторов к ангиопоэтину, важному фактору роста, стимулирующему ангиогенез [40]. В сфероидах из МСК жировой ткани, а также периодонтальной связки возрастает эффективность остеогенной дифференцировки, что подтверждается увеличением синтеза щелочной фосфатазы, остеокальцина и минерализации [41, 42]. Эффективная дифференцировка объясняется высоким содержанием ВКМ в сфероиде, который способствует сигналингу через α2β1-интегриновые рецепторы, что необходимо для остеогенеза [43]. В 3D-культуре возрастает и миогенный потенциал МСК по сравнению с монослоем. В сфероидах образуются зрелые структуры — миофибриллы, тогда как в 2D-культурах отмечают только начальные стадии спонтанной миогенной дифференцировки — экспрессию маркера MyoD [44]. Показано также, что сфероиды обладают более высоким регенеративным потенциалом по сравнению с монослойной культурой и дольше сохраняют потенциал к дифференцировке после трансплантации в область повреждения [43]. На примере травмы костной ткани черепа показано, что при трансплантации в область повреждения суспензии МСК костного мозга спустя 4 нед область повреждения в большей степени заполняется фиброзной тканью, тогда как трансплантация сфероидов способствует формированию полноценной костной ткани [45]. Аналогичные результаты получены для МСК, выделенных из периодонтальной связки и жировой ткани [42, 46].
Преимущества 3D-культивирования показаны также и для эпителиальных клеток. Известно, что первичные культуры эпителиальных клеток при культивировании в 2D-условиях теряют свой истинно эпителиальный фенотип, претерпевая эпителиально-мезенхимальный переход и приобретая смешанный фенотип. 3D-культуры сфероидов позволяют восстановить фенотип клеток за счет обратного мезенхимально-эпителиального перехода [47–49]. Мезенхимальные клетки также при помещении в 3D-культуру частично проходят мезенхимально-эпителиальный переход при эпителизации поверхностной зоны сфероидов [50]. Кроме того, создание 3D-культур сфероидов из эпителиальных клеток позволяет воссоздавать более естественное микроокружение за счет межклеточных контактов и контактов с ВКМ, повышая жизнеспособность эпителиальных клеток, миграционную и секреторную активность по сравнению с 2D-культурами [51, 52].
Органотипичные модели злокачественных опухолей эпителиального происхождения зачастую успешно получают и применяют для дальнейших исследований и диагностики в форме клеточных сфероидов [53, 54]. Сфероиды из опухолевых клеток позволяют открывать новые особенности инвазии новообразований различных типов рака. Установлено, что совместное культивирование опухолевых клеток эпителиального фенотипа с МСК усиливает изменение фенотипа с эпителиального на мезенхимальный. Это, тем не менее, позволяет добиться положительного эффекта для воссоздания более точной модели инвазии рака молочной железы [53]. В случае раковых клеток толстой кишки показано приобретение клетками инвазивного фенотипа в составе трехмерных культур при дополнительной стимуляции факторами роста эпителия и крипт, притом что подобного перехода фенотипа в 2D-культуре не происходило [55].
Формирование сфероидов
Сфероиды можно формировать из различных культур клеток: опухолевой и неопухолевой природы, мезенхимальных и эпителиальных фенотипов (рис. 1). Морфология сфероидов, а также эффективность их формирования зависят от типа клеток и их морфофункциональных особенностей. Неопухолевые сфероиды имеют 2 зоны: внешнюю и внутреннюю. Сфероиды из клеток имеют 3 зоны: пролиферативная внешняя кора, нейтральная молчащая зона и некротическое ядро [56]. Сфероиды из клеток эпителиального фенотипа во внутренней зоне имеют плотно упакованные клетки с хорошо развитым цитоскелетом и большим количеством контактов друг с другом, тогда как сфероиды из клеток мезенхимального фенотипа имеют плотно упакованную поверхностную зону из эпителиоподобных клеток и рыхлую внутреннюю зону с большим количеством ВКМ [57]. Как правило, к 7-му дню культивирования клетки полностью прекращают пролиферировать [39], за исключением сфероидов, сформированных из раковых клеточных линий [58, 59].
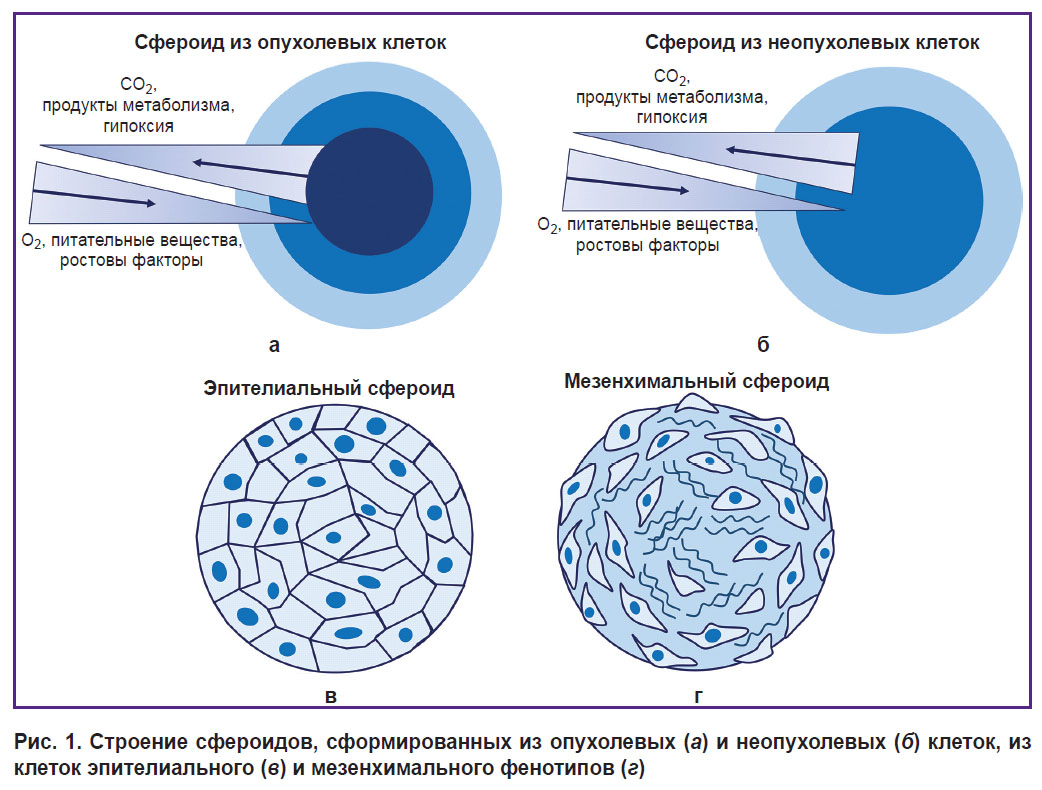
|
Рис. 1. Строение сфероидов, сформированных из опухолевых (а) и неопухолевых (б) клеток, из клеток эпителиального (в) и мезенхимального фенотипов (г) |
В процессе формирования сфероидов принято выделять этапы миграции, агрегации и адгезии, компактизации [60]. Сначала отдельные шарообразные клетки двигаются в случайных направлениях с помощью коротких выростов — филлоподий, затем клетки начинают контактировать друг с другом за счет адгезионных контактов, образуя агрегаты. Этот процесс занимает примерно два часа [61]. Затем начинается компактизация, где основную роль играют Е-кадгерин, актин и тубулин микротрубочек [60]. Для установления роли основных молекул цитоскелета применяют различные соединения, селективно блокирующие полимеризацию структур в клетках. Для разрушения актинового цитоскелета обычно используется цитохалазин D — блокатор полимеризации фибриллярного актина [62], для разрушения белков клеточной адгезии применяют антитела к Е-кадгерину, интегринам и коннексинам. Для блокирования полимеризации тубулиновых микротрубочек используют нокодазол и колхицин. В процессе формирования сфероида цитоскелет подвергается значительным изменениям. Как правило, в 3D-культурах актиновые микрофиламенты клетки находятся в кортикальном слое цитоплазмы [63]. Показано, что в поверхностных клетках сфероидов снижается жесткость по сравнению с монослойной культурой [64]. Цитохалазин D оказывает разное влияние на сфероиды из разных типов клеток. Так, например, сфероиды из МСК костного мозга могут формироваться в присутствии цитохалазина D, однако становятся более рыхлыми, их диаметр на 133% больше по сравнению с контролем [65], а обработка эпителиальных сфероидов цитохалазином D, даже в очень низких концентрациях, полностью нарушает их формирование [66]. Для хондросфер показано, что обработка цитохалазином D серьезно влияет на динамику слияния и распространения клеток и значительно снижает механические свойства сфероидов. При этом разрушение микротрубочек нокодазолом значительно влияет на реактивацию сфероидов и неожиданно приводит к увеличению жесткости. Разрушение промежуточных филаментов (виментина) также влияет на реактивацию [67].
Нарушение цитоскелета и межклеточных контактов наибольшее влияние оказывает на формирование эпителиальных сфероидов, что объясняется особенностями их строения и функционирования естественных эпителиальных тканей за счет большого количества межклеточных контактов [68, 69]. Изучение факторов, влияющих на межклеточную адгезию клеток эпителиального и мезенхимального фенотипов, позволяет прогнозировать распределение в сфероидах при самоорганизации [68, 69], а также намеренно влиять на процессы сортинга и сепарации при сфероидогенезе и формировании искусственных тканей [70, 71].
Вклад разных компонентов цитоскелета и ВКМ в механические свойства сфероидов в первую очередь зависит от типа клеток. Анализ влияния молекул цитоскелета и адгезии на формирование сфероидов из клеток эпителиального и мезенхимального фенотипов представлен в табл. 1 [65, 67–76]. Приведенные данные свидетельствуют, что, используя различные блокаторы, можно воздействовать на механические свойства сфероидов и, как следствие, — на их поведение после биопечати.
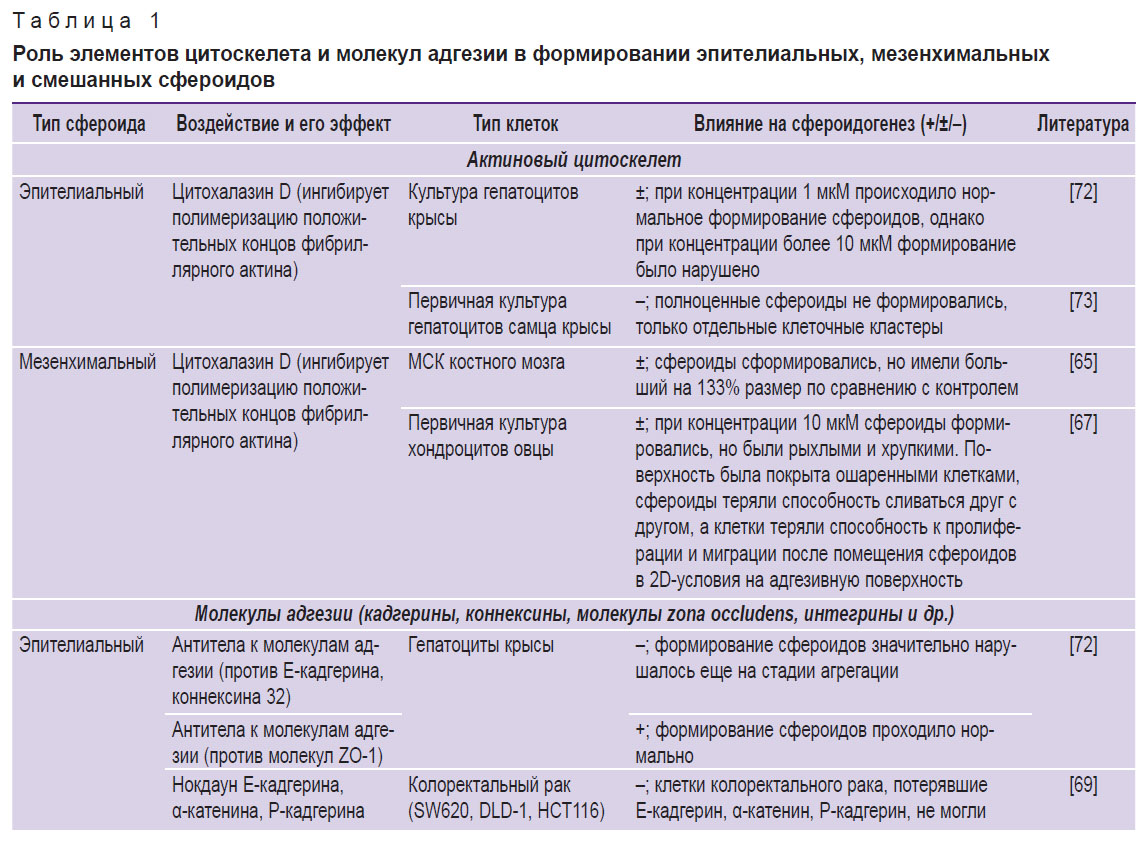
|
Таблица 1. Роль элементов цитоскелета и молекул адгезии в формировании эпителиальных, мезенхимальных и смешанных сфероидов |
Механические свойства сфероидов
В процессе роста сфероид активно синтезирует различные компоненты ВКМ, формируя тем самым механическое напряжение. Клетка может определить жесткость микроокружения, связываясь с ВКМ через различные контакты и компоненты цитоскелета [77]. Связь обеспечивается преимущественно за счет фокальных контактов, которые состоят из интегриновых рецепторов на поверхности мембраны и связывают актиновый цитоскелет с ВКМ [78]. Механические изменения могут приводить к активации ассоциированных с интегринами киназ и запускать различные сигнальные каскады, например ERK, JNK, Wnt-катенин и Hippo [79]. Сигнальный путь Hippo участвует в процессе механотрансдукции, т.е. переводит механические сигналы на уровень экспрессии генов [80]. При культивировании клеток в мягком матриксе компонент YAP/TAZ Hippo-каскада находится в цитоплазме, а при повышении жесткости комплекс транслоцируется в ядро, изменяя экспрессию генов и влияя на дифференцировку и пролиферацию клеток [81]. Таким образом, жесткость матрикса напрямую воздействует на клеточную дифференцировку. Например, показано, что при культивировании МСК на более мягком субстрате клетки дифференцируются в адипогенном направлении, тогда как более жесткий субстрат стимулирует появление остеоцитов [82]. Жесткий субстрат влияет на остеогенную дифференцировку через механочувствительные гены. Сжатие и растяжение клеток блокирует миогенную и адипогенную дифференцировку, подавляя экспрессию генов MyoD и PPAR-γ, и в то же время активирует экспрессию генов Runx2, Osterix, Msx2 и Sox9, стимулируя остеогенную дифференцировку МСК [83].
Многие белки ВКМ аккумулируют ростовые факторы. Например, фибронектин связывает VEGF [84]. Некоторые компоненты ВКМ сами по себе способны активировать рецепторы. Так, например, ламинины, фибриллины и тромбоспондины в своем составе имеют домен, подобный эпидермальному фактору роста, который способен связываться с соответствующим рецептором [85]. Таким образом, в сфероидах за счет накопления ВКМ создается благоприятное механическое окружение для направленной дифференцировки.
В настоящее время активно развиваются методы измерения механических свойств микрообъектов, доказана ключевая роль биомеханических взаимодействий при развитии организма, а также в патологических и регенеративных процессах. Показано влияние жесткости субстрата на рост и дифференцировку стволовых клеток [86], установлена более низкая жесткость раковых клеток по сравнению с нормальными [87] и изучается важная роль механических сил в эмбриональном развитии.
Для характеристики жесткости материала принято использовать модуль Юнга, который измеряется в паскалях (Па). Для определения локальных свойств ткани, а также монослойной культуры или поверхностных клеток сфероидов обычно используют наноиндентирование и метод атомно-силовой микроскопии [88]. Метод ограничен измерением свойств поверхности с глубиной проникновения (индентирования) не более 1 мкм. Для макрообразцов (от нескольких миллиметров до нескольких сантиметров толщиной) применяют механические тесты на растяжение, сжатие и изгиб материала, которые позволяют получить усредненные механические свойства по всему образцу [89, 90]. В настоящее время разработаны системы, позволяющие таким методом анализировать агрегаты клеток и клеточные пласты.
Кроме того, для определения жесткости клеточного пласта, сфероида или ткани целиком используются метод сжатия параллельными пластинами на приборе MicroSquisher [91] и кавитационная реология [92]. С помощью данных методов показано, что монослойная культура МСК, культивируемая на пластике, в среднем имеет модуль Юнга, исчисляющийся в гигапаскалях (ГПа), а в сфероидах жесткость поверхностных клеток не превышает 0,1 кПа. С помощью атомно-силовой микроскопии установлено, что модуль Юнга сфероидов из клеточной линии фибробластов мыши 3T3 лежит в диапазоне 0,3–3,5 кПа [93], а из эпителиальной линии клеток аденокарциномы толстой кишки человека (LS174T) — в диапазоне 0,3–0,6 кПа.
Метод кавитационной реологии использован для анализа механических свойств сфероидов из трансформированной клеточной линии HEK 293. Критическое давление, необходимое для разрыва связи между клетками в таких сфероидах, составляло 0,013–0,500 кПа [94]. С помощью прибора MicroSquisher показано, что модуль Юнга трехдневных сфероидов из МСК равняется 42,28±6,14 Па, а семидневных сфероидов — 62,40±5,58 Па [95]. Анализ механических свойств для мягких биологических тканей или компонентов биоэквивалента осуществляют с помощью реометра, который измеряет такие параметры гелей и жидкостей, как модуль сдвига и вязкость [96].
Для анализа механических свойств, а также поверхностного натяжения сфероидов может быть использован метод аспирации, который заключается во всасывании микропипеткой единичного сфероида, а затем вычислении необходимых параметров в соответствии с уравнением Юнга–Лапласа (описывает зависимость между внутренним давлением сфероидов и клеточной средой через изогнутую границу раздела) [97]. Таким методом было проведено сравнение механических и вязкоупругих свойств сфероидов разного размера, полученных из HUVEC, 3T3, клеток рака молочной железы мыши (4T1), фибробластов кожи человека (HDF) и совместной культуры МСК человека и HUVEC [98]. Сфероиды из фибробластов и МСК быстрее компактизовались и формировали больше ВКМ на поверхности по сравнению с эпителиальными сфероидами. С помощью данного метода также показано, что поверхностное натяжение сфероидов из HUVEC, 3T3, 4T1, HDF, МСК/HUVEC и МСК через 2 дня культивирования составило ~14, 30, 37, 41, 51 и 66 [мН/м] соответственно. Иными словами, поверхностное натяжение сфероидов, содержащих только МСК, примерно в пять раз выше, чем сфероидов из эндотелиальных клеток. Установлено также, что поверхностное натяжение сфероидов 4T1, HDF и МСК/HUVEC увеличивается с течением времени, тогда как натяжение сфероидов, полученных из других типов клеток, практически не меняется. Выявлена положительная корреляция между поверхностным натяжением сфероидов и их компактностью [99], которая зависит от количества коллагена [100]. Жесткость сфероида во многом зависит от состава и структуры ВКМ, которые могут обладать модулем упругости в диапазоне от нескольких мегапаскалей (эластин) до нескольких гигапаскалей (коллаген) [101]. При этом механические свойства также могут значительно отличаться в зависимости от ориентации, сшивок и взаимодействия различных типов волокон [102].
Так как сфероиды широко используют для моделирования процессов морфогенеза, регенерации и метастазирования тканей и при этом они служат строительными блоками при биопечати, изучение их механических свойств является важной задачей тканевой инженерии. Поверхностное натяжение и жесткость сфероидов оказывают большое влияние на их способность к слиянию, а также на реактивацию, т.е. способность клеток мигрировать из сфероида после помещения его на адгезивный субстрат или в гидрогель [103, 104]. Эти параметры в свою очередь напрямую связаны со скоростью созревания напечатанного конструкта [105–108]. Изменение механических свойств сфероидов за счет моделирования компонентов цитоскелета с использованием специфических блокаторов может повышать эффективность процессов слияния и реактивации сфероидов после биопечати [109].
Механизм слияния клеточных агрегатов принято рассматривать по аналогии с механизмом слияния капель жидкости [110]. Согласно данной модели, основными параметрами, определяющими механизм и скорость слияния, являются вязкость и поверхностное натяжение [111], что в клеточных сфероидах определяется молекулами клеточной адгезии, цитоскелетом и ВКМ.
Известны исследования, направленные на выявление связи между механическими свойствами сфероидов и скоростью их слияния [94, 112, 113], однако полученные в них результаты несколько противоречивы. Например, показано, что натяжение поверхностных клеток в сфероидах из фибробластов способствует их более быстрому слиянию по сравнению со сфероидами из эпителиальных клеток (линия клеток яичника китайского хомячка CHO) [112]. В других исследованиях утверждается, что слияние сфероидов из эпителиальных клеток (ретинальный пигментный эпителий) происходит быстрее, чем из мезенхимальных клеток, выделенных из лимба глаза [113]. По всей вероятности, высокое содержание ВКМ и плотная упаковка клеток во внешнем слое МСК сфероидов негативно влияют на их миграцию и, соответственно, на слияние сфероидов. При этом трехдневные сфероиды из МСК сливаются быстрее, что связано с низким содержанием ВКМ. Аналогичные результаты показаны для сфероидов из хондроцитов овец. На ранних сроках культивирования они сливаются быстрее, чем на поздних сроках в связи с накоплением ВКМ [114]. Более эффективное слияние сфероидов из эпителиальных клеток может быть также обусловлено тем, что коллективная миграция больше свойственна эпителиальным клеткам с хорошо развитыми межклеточными контактами [115].
В контексте тканевой инженерии часто необходимо объединять несколько типов клеток или сфероидов в составе конструкта, чтобы он наилучшим образом воспроизводил структуру ткани in vitro. Для этого используют сфероиды из разных типов клеток, при этом можно добавлять клетки последовательно для формирования организованных слоев. Например, добавление суспензии эпителиальных клеток к предварительно сформированным мезенхимальным сфероидам позволяет создать in vitro модель для изучения процессов эмбриогенеза и эпителиально-мезенхимальной пластичности [3, 116], что лежит в основе множества морфогенетических процессов, а также регенерации и метастазирования тканей [117]. Можно также использовать отдельно сфероиды из мезенхимальных и эпителиальных клеток для биопечати, их послойное разделение произойдет уже при созревании конструкта. Показано, что при слиянии мезенхимальных и эпителиальных сфероидов происходит обрастание эпителиальными клетками мезенхимальных [113]. Изучение механических характеристик сфероидов разных фенотипов требует дальнейших исследований, поскольку они непосредственно влияют на способ созревания биоэквивалента после биопечати [47], а именно на скорость слияния сфероидов, миграцию клеток и формирование отростков. Основные способы созревание биоэквивалентов после биопечати представлены на рис. 2.
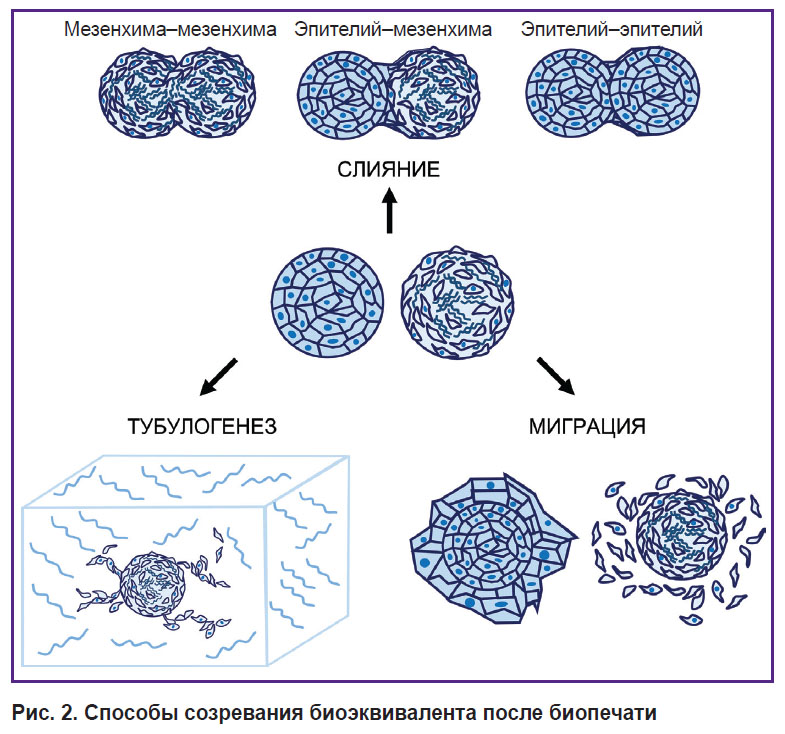
|
Рис. 2. Способы созревания биоэквивалента после биопечати |
Биопечать сфероидами
Трехмерная биопечать имеет множество преимуществ, позволяет создавать сложноорганизованные ткани, состоящие из нескольких слоев разных типов клеток в соответствующем ВКМ [118, 119]. В настоящее время разработано уже много разных методов биопечати, таких как экструзионная, аспирационная, лазерная, капельная и др. [120, 121] (рис. 3). Выбор метода зависит от желаемой морфологии и размера биоэквивалента, используемого гидрогеля, а также от фенотипа клеток и их механических характеристик. Использование сфероидов в качестве строительных блоков привлекает внимание все большего числа исследователей [122, 123], поскольку они обладают повышенной регенеративной способностью по сравнению с монослойной культурой, лучше имитируют физиологические условия, свойственные нативной ткани, и обладают высокой жизнеспособностью.
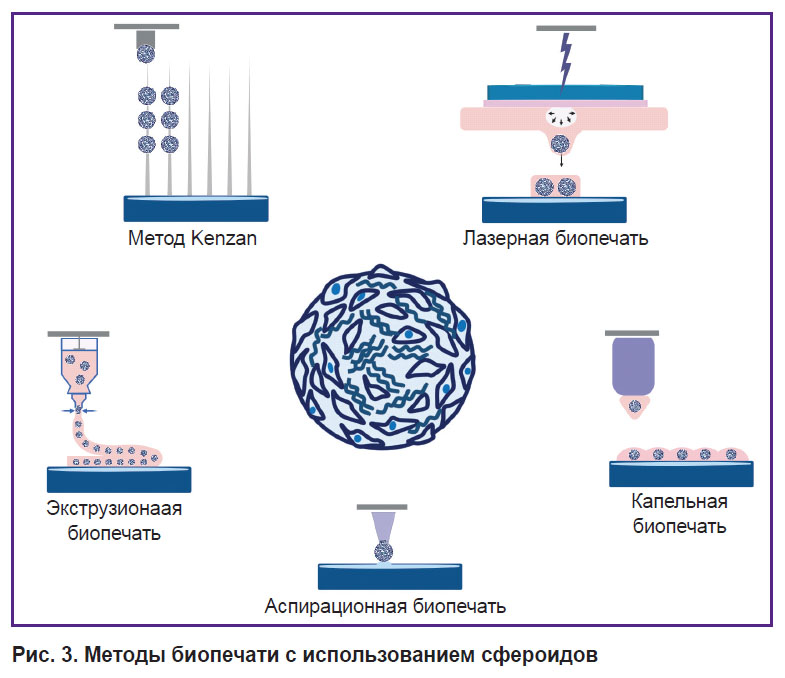
|
Рис. 3. Методы биопечати с использованием сфероидов |
Полноценное заполнение напечатанного конструкта может осуществляться как за счет миграции клеток из сфероида, так и за счет их слияния. А эти параметры напрямую зависят от механических свойств сфероидов [57], использованного гидрогеля, а также от расстояния между ними [124]. Например, для сфероидов из МСК жировой ткани показано, что при расположении их на расстоянии менее 100 мкм друг от друга они, скорее всего, будут сливаться, а на расстоянии более 400 мкм — формировать отростки по направлению друг к другу [124]. Сфероиды из HUVEC, находящиеся друг от друга на расстоянии 800 мкм, формируют более разветвленную сеть отростков (общая длина отростков составляет 11 мм) по сравнению с группой, где расстояние между сфероидами 3000 мкм (6 мм) [105]. Степень дифференцировки также может оказывать значительное влияние на скорость слияния. Например, сфероиды из МСК, дифференцированные в остеогенном направлении, сливаются медленнее по сравнению с недифференцированными [106]. Эти сфероиды на 5-е сутки культивирования сливаются значительно лучше по сравнению с 7-дневными сфероидами, что также важно учитывать при создании хрящевых эквивалентов [107]. Слияние сфероидов из кардиомиоцитов и фибробластов происходит на 4-е сутки культивирования при расстоянии между ними около 50 мкм [105].
При биопечати сфероидами отмечаются некоторые сложности, связанные в первую очередь с агрегацией сфероидов друг с другом и засорением сопла. Данная проблема может быть решена подбором специального состава гидрогеля и метода биопечати, а также за счет уменьшения размера сфероидов и модификации их механических характеристик. Сравнение методов биопечати и особенностей использованных сфероидов приведено в табл. 2 [98, 105–108, 125–137].
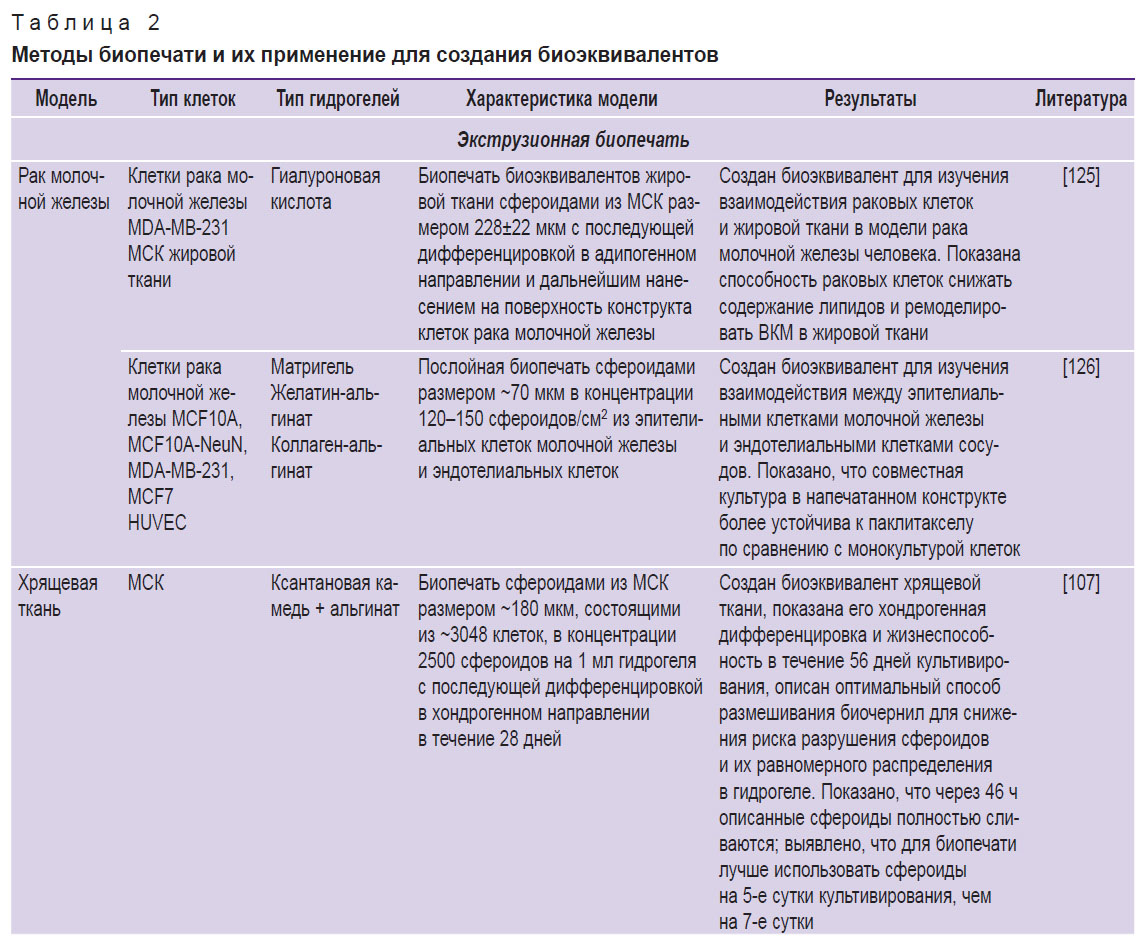
|
Таблица 2. Методы биопечати и их применение для создания биоэквивалентов |
Экструзионная биопечать
Одним из самых первых и простых методов биопечати является экструзионный, который заключается в выдавливании вязкого материала из картриджа биопринтера согласно определенной программе, задающей давление, скорость, температуру и 3D-модель биопечати. Это быстрый и легко масштабируемый способ, который позволяет получать конструкты с высокой клеточной плотностью и сохранять жизнеспособность клеток на уровне около 70–80% [138]. Однако разрешение такой печати составляет около 100–200 мкм, что значительно ниже, чем у аспирационной и лазерной биопечати [139]. По сравнению с другими технологиями данный метод является самым универсальным и может быть использован с разными типами сфероидов и гидрогелей. Однако он не применим для сфероидов большого размера, которые могут засорять сопло, к тому же механическое сдавливание приводит к гибели поверхностных клеток. Сфероиды маленького размера при использовании часто распределяются в гидрогеле неравномерно, и это приводит к тому, что они находятся далеко друг от друга, хуже сливаются и не формируют необходимую структуру конструкта.
Впервые возможность экструзионной биопечати с использованием сфероидов была показана в 2004 году в научной группе под руководством российского ученого Владимира Миронова [140]. С тех пор в этой сфере достигнуты большие успехи. Например, с использованием сфероидов из клеток щитовидной железы и эндотелиальных клеток аллантоиса получена функционирующая щитовидная железа мыши, которая после трансплантации под почечную капсулу поддерживала уровень тироксина в крови и температуру тела [130]. Особое внимание уделяется биопечати эквивалентов печени, например для тестирования гепатотоксических лекарственных препаратов. С помощью сфероидов, состоящих из эндотелиальных клеток, МСК и гепатоцитов, получен жизнеспособный конструкт печени, клетки которого не только экспрессируют печеночные белки, но также продуцируют мочевину и альбумин, т.е. сохраняют функциональность [141]. В исследовании [127] гепатоциты мыши были предварительно инкапсулированы в децеллюляризованный матрикс печени, что привело к формированию зрелого и функционального биоэквивалента, гораздо более чувствительного к гепатотоксичным препаратам по сравнению с обычными гепатосфероидами.
Много исследований посвящено биопечати сердечной ткани. Ученым уже удалось добиться сократимости сфероидов, полученных из совместной культуры кардиомиоцитов, эндотелиальных клеток и фибробластов [142]. Разработана функциональная модель очагового фиброза сердца для изучения электрофизиологических свойств ткани и тестирования лекарств [105]. Сфероиды из МСК жировой ткани в составе напечатанных конструкций используют для регенерации мягких тканей вследствие поддержки ангиогенеза [130, 143], а также для инженерии костной ткани [144, 145]. Сфероиды из МСК и HUVEC, инкапсулированные в гидрогель из коллагена и фибрина, формируют конструкты, которые эффективно дифференцируются в остеогенном направлении и формируют разветвленную сосудистую сеть по сравнению с суспензией тех же клеток в гидрогеле [146]. Получены биоэквиваленты хрящевой ткани [107, 128]. Довольно много исследований посвящено моделям различных раковых заболеваний [147]. Получен биоэквивалент для изучения взаимодействия между раковыми клетками и жировой тканью [125], а также между эпителиальными и эндотелиальными клетками [126] в модели рака молочной железы человека.
Аспирационная биопечать
Принцип аспирационной биопечати заключается в захвате одного сфероида путем аспирации и в переносе его на точную позицию в каркасе или гидрогеле. Погрешность размещения сфероида составляет не более 11–15% по отношению к его размеру [98]. Данный метод дает возможность работать со сфероидами разного размера, а также с разными механическими характеристиками, так как позволяет подобрать определенную силу аспирации, чтобы избежать деформации сфероида. В исследовании 2020 г. подробно описан механизм выбора аспирационной силы при биопечати в зависимости от механических характеристик сфероидов (вязкоупругих свойств и поверхностного натяжения). Для этого были проанализированы механические и вязкоупругие свойства сфероидов размером 200–600 мкм из клеток эндотелия вены пуповины человека (HUVEC), фибробластов мыши (3T3), клеток рака молочной железы мыши (4T1), фибробластов кожи человека (HDF) и совместной культуры МСК человека и HUVEC, а также описано соответствие этих характеристик оптимальной аспирационной силе и времени биопечати [98].
Метод аспирационной биопечати успешно применялся для создания костной [106, 108], хрящевой [108], сердечной [105] и других тканей. Показано, что для получения хрящевых эквивалентов наиболее эффективным является подход, при котором выполняют предварительную дифференцировку МСК-сфероидов в хондрогенном направлении и уже затем их используют для биопечати. Это связано с тем, что накопление ВКМ при хондродифференцировке приводит к увеличению размера сфероидов, а также к возрастанию силы поверхностного натяжения клеток, что критически важно при аспирационной биопечати, так как влияет на сохранность сфероидов [108]. При получении костного эквивалента установлено, что более эффективной является биопечать с использованием недифференцированных сфероидов из МСК с их последующим слиянием и дальнейшей остеодифференцировкой целого конструкта. Это объясняется тем, что высокое содержание ВКМ значительно увеличивает поверхностное натяжение в клетках сфероида и не дает им слиться в полноценный конструкт [108]. Однако в исследовании [98], в котором для получения эквивалента костной ткани использовали совместную культуру МСК и HUVEC, более зрелый конструкт был получен из смешанных сфероидов, предварительно дифференцированных в остеогенном направлении.
С помощью аспирационной биопечати в недавнем исследовании [105] была получена функциональная модель очагового фиброза сердца путем слияния здоровых (из кардиомиоцитов) и фиброзных (из кардиомиоцитов и фибробластов) сфероидов в определенном соотношении. Показаны влияние фиброзных рубцов на электрофизиологические свойства ткани, а также возможность использования данной модели для тестирования препаратов на основе микроРНК. Благодаря высокой точности позиционирования сфероидов при аспирационной биопечати изучено влияние расстояния между сфероидами на их функциональный потенциал. Установлено, что сфероиды из HUVEC, находящиеся ближе друг к другу (400 мкм), формируют более разветвленную сеть отростков по сравнению с группой, где расстояние между сфероидами составляет 3000 мкм.
Лазерная биопечать
Лазерная биопечать в основном применяется для печати суспензией клеток [148] и позволяет манипулировать объектами с высокой точностью (до 1 мкм), использовать широкий диапазон вязкости биочернил [149] и обеспечивать высокую жизнеспособность клеток после биопечати. Технология, основанная на индуцированном лазером переносе клеток (laser-induced forward transfer, LIFT), впервые была успешно использована для печати сфероидами в 2023 г., когда стало понятно, что сфероиды из МСК пупочного канатика человека размером около 150 мкм могут быть с высокой точностью напечатаны с использованием гидрогеля [132]. В данном исследовании был также проведен анализ влияния настроек и способов лазерного переноса сфероидов на их жизнеспособность [132].
Принцип лазерной биопечати заключается в создании капель с клетками либо сфероидами, которые под действием импульса лазера переносятся от «донора» к «реципиенту». В качестве донорской подложки обычно используется предметное стекло, покрытое тонким металлическим слоем, поглощающим энергию, а также слоем биочернил (клетки или сфероиды с гидрогелем). Энергия лазера поглощается металлическим слоем в точке его фокусировки. При этом энергопоглощающий слой нагревается и испаряется, формируется пузырек, который выталкивает из слоя струю гидрогеля с клетками или сфероидами. После этого капля попадает на акцепторную подложку, перемещаясь по струе биочернил, где формирует конструкт. Такой способ обеспечивает высокую скорость печати, точность перемещения клеток, а также их выживаемость. Однако условия переноса нужно подбирать в зависимости от типа гидрогеля и клеток [132].
Поскольку это довольно новый метод, пока мало исследований, описывающих применение лазерной биопечати со сфероидами. Есть еще одно исследование 2024 г., где лазерная биопечать успешно применена для создания тканевых эквивалентов хрящевой ткани с использованием сфероидов из клеток надкостницы, предварительно дифференцированных в хондрогенном направлении в течение 7 дней [131].
Капельная биопечать
Капельная биопечать впервые была разработана в 2000-х гг., когда научная группа под руководством Накамуры из университета Тоямы оптимизировала обычный принтер для бумаги и сделала его совместимым с клетками и вязкими гидрогелевыми чернилами [150]. Первыми конструктами, напечатанными таким способом, стали трубчатые структуры, состоящие из клеток HeLa. Капельная биопечать обладает высоким разрешением, сопоставимым с лазерной биопечатью, и является одним из самых простых, быстрых и дешевых методов [151]. Помимо этого капельная биопечать может быть использована для нанесения биочернил непосредственно в область дефекта за счет распыления капель с клетками, что важно для восстановления глубоких ран, ожогов и других поверхностных дефектов [152].
Однако капельная биопечать имеет довольно много недостатков. Одной из самых частых проблем является засорение сопла. Так как его диаметр обычно составляет 10–150 мкм, данный метод несовместим с использованием крупных объектов, например сфероидов >150 мкм, а также с вязкими гидрогелями [153]. Поэтому при капельной биопечати клетки обычно переносят в составе обычной питательной среды и печатают на поверхность гидрогеля [154]. Капельная биопечать также часто используется для получения самих сфероидов [155] и по принципу действия напоминает метод «висячей капли». При использовании капельной биопечати есть возможность получать сфероиды заданного размера, сразу инкапсулированные в определенный гидрогель [156].
Для биопечати сфероидами данный метод используется очень редко, так как сфероиды имеют диаметр, превышающий размер сопла, а сама технология печати не позволяет получить конструкт с высокой клеточной плотностью и, как следствие, с высокой механической прочностью [157].
Несмотря на описанные выше ограничения, есть несколько примеров успешной капельной биопечати. Например, с использованием гидрогеля на основе альгината были разработаны функциональные биоэквиваленты печени, состоящие из гепатоцитов, полученных из индуцированных плюрипотентных стволовых клеток (ИПСК), а также из эмбриональных стволовых клеток человека. Через 17 дней после биопечати получен функциональный конструкт, экспрессирующий такие печеночные маркеры, как альбумин и HNF4a [134]. Альгинатный гидрогель является оптимальным для капельной биопечати, так как получается путем смешения двух жидких компонентов: альгината и хлорида кальция, которые при смешивании формируют вязкий гидрогель. Это решает проблему засорения сопла.
В исследовании [135] капельная биопечать использована для получения in vitro модели альвеол легких, состоящих из эндотелиальных клеток, базальной мембраны и эпителиальных клеток. Для этого был напечатан биоэквивалент, состоящий из клеток альвеолярного эпителия II типа (A549) и эндотелиальных клеток (EA.hy926), разделенных между собой матригелем. Показано, что в отличие от ручного метода замешивания биопечать позволяет создать гомогенные клеточные слои.
Методом капельной биопечати была получена модель для оценки электростатических взаимодействий между кардиомиоцитами и фибробластами в сердечной ткани, при этом использовали два типа клеток: фибробласты сердца и кардиомиоциты человека [133].
Однако во всех описанных выше исследованиях для биопечати была использована суспензия клеток, а не сфероиды.
Метод Kenzan
Слово «кензан» (kenzan) пришло из японской культуры и дословно переводится как «гора из мечей». Это держатель из множества игл, предназначенный для фиксации растений при создании цветочных композиций. Японские исследователи предложили использовать аналогичные конструкции для фиксации сфероидов и получения микротканей [158]. Данный способ позволяет расположить сфероиды на поверхности предварительно спроектированного конструкта с точностью до 1 мкм. Конструкт представляет собой временную опору, состоящую из микроигл из нержавеющей стали, которые могут быть извлечены после слияния сфероидов и формирования должной структурной организации.
В настоящее время известен один коммерчески доступный биопринтер, принцип которого основан на методе Kenzan. Это японский биопринтер Bio-3D Printer, имеющий размер микроигл примерно 160 мкм в диаметре, которые расположены на расстоянии 500 мкм. Чтобы сфероиды в такой системе контактировали и сливались, их размер должен быть не менее 400–600 мкм. Этот метод очень редко применяется для биопечати, хотя он особенно удобен для получения трубчатых структур, например сосудов, трахеи и уретры. Для получения сосудистых структур методом Kenzan сфероиды размером около 600 мкм из эндотелиальных клеток, гладкомышечных клеток аорты и дермальных фибробластов человека нанизывали на иглы диаметром 170 мкм, находящиеся на расстоянии 400 мкм. Спустя четыре дня культивирования сфероиды сливались, формировали зрелый конструкт, иглы извлекались. Сформированные сосуды имели размер 1,5 мм в диаметре и 7 мм в длину. Они были механически прочными и сохраняли свою структурную целостность после имплантации крысам [136].
Есть несколько успешных исследований, где такая технология применялась для создания уретры и трахей, однако их результаты пока не опубликованы, а только представлены в виде докладов на конференциях. В исследовании [137] таким методом получена функциональная модель эндометриоза. При этом использованы сфероиды размером около 500 мкм из эпителиальных клеток, полученных из матки с эндометриозом (линия клеток 12Z), а также из клеточной линии эпителия рака яичника (HEYA8).
Заключение
Биопечать с использованием сфероидов в качестве клеточного компонента биочернил является перспективным направлением регенеративной медицины. В сфероидах клетки формируют комплексы межклеточных контактов, синтезируют внеклеточный матрикс, эффективнее дифференцируются в заданном направлении и адаптируются к гипоксии [27–29]. Вследствие этого биоэквиваленты, сформированные с использованием сфероидов, проявляют гораздо более высокую жизнеспособность и функционально-дифференцировочный потенциал по сравнению с конструктами, которые были напечатаны с использованием суспензии клеток [122, 140].
Созревание биоэквивалентов после печати происходит либо за счет слияния сфероидов, либо путем миграции клеток и формирования отростков. Тот или иной тип созревания зависит от того, на каком расстоянии находятся сфероиды, а также от их механических свойств. Сфероиды из МСК жировой ткани сливаются, если находятся на расстоянии менее 100 мкм друг от друга, а на расстоянии более 400 мкм формируют отростки по направлению друг к другу [124]. Сфероиды из эндотелиальных клеток при высокой плотности печати также формируют более разветвленную сеть отростков [105].
Сфероидам из мезенхимальных клеток свойственно накапливать внеклеточный матрикс, поэтому чем дольше срок их культивирования, тем хуже они будут сливаться в итоговом биоэквиваленте [107]. Остеогенная и хондрогенная дифференцировка МСК приводит к увеличению жесткости и накоплению внеклеточного матрикса, поэтому такие сфероиды не сливаются после биопечати. Многие исследователи рекомендуют дифференцировать тканеинженерный конструкт после первичной стадии созревания, т.е. после слияния сфероидов. В этом случае формируется более целостная структура со свойствами микроткани [106, 108]. Однако при аспирационной печати, напротив, лучше использовать сфероиды, предварительно дифференцированные в остеогенном и хондрогенном направлении, так как в этом случае высокое поверхностное натяжение позволяет сохранить их от механического разрушения при аспирации [108]. Аналогично это показано и для лазерной биопечати [131].
Самым популярным методом остается экструзионная биопечать. Это быстрый и легко масштабируемый способ, который позволяет сохранить жизнеспособность клеток на уровне около 70–80% [138, 139]. Однако при экструзионной биопечати достаточно сложно получить эквивалент с высокой клеточной плотностью и четким распределением сфероидов, что приводит к неравномерному созреванию эквивалентов. Помимо этого экструзионная биопечать обладает достаточно низким разрешением и не подходит для тех случаев, когда нужно поместить сфероид в точно заданную позицию при воспроизведении сложной архитектуры ткани.
Наибольшим разрешением обладают аспирационная и лазерная биопечать. Аспирационная биопечать позволяет разместить сфероид с погрешностью не более 11–15% по отношению к его размеру [98]. Высокая точность позволяет помещать сфероиды близко друг к другу и четко контролировать расстояние между ними, а также механизм созревания эквивалента (слияние, миграция или формирование отростков). Однако это очень медленный метод, и на перемещение одного сфероида уходит около 20 с [159]. Перемещение сфероидов здесь осуществляется за счет аспирационных сил, которые необходимо четко подбирать в зависимости от механических свойств объекта. Для снижения деформации лучше всего использовать более зрелые сфероиды с высоким содержанием внеклеточного матрикса. Однако в этом случае созревание эквивалента будет проходить дольше, так как сфероиды будут хуже сливаться [98, 106, 108]. Лазерная биопечать позволяет расположить сфероиды с точностью до 1 мкм, а также обеспечивает высокую жизнеспособность клеток [148, 149]. Этот метод преимущественно используется для биопечати клетками и со сфероидами применялся всего в нескольких исследованиях.
Метод Kenzan также обладает высоким разрешением (до 1 мкм) и позволяет расположить сфероиды в непосредственной близости друг от друга, что приводит к формированию плотной микроткани. Однако он накладывает ограничения на размер сфероидов и не может использоваться с объектами в диаметре меньше, чем 400 мкм. При этом для большинства сфероидов показано, что оптимальным является размер 200–300 мкм. В ином случае снижается жизнеспособность клеток в центральной зоне сфероида. Кроме того, метод Kenzan не позволят создавать биоэквиваленты сложной формы и применим в основном для печати простых плоских или трубчатых структур [136, 158].
Таким образом, при выборе способа биопечати важно обращать внимание на такие ключевые параметры, как фенотип клеток, входящих в состав сфероидов, их механические характеристики, желаемую клеточную плотность финального тканевого эквивалента и степень дифференцировки сфероидов. Для печати плотных, сложноорганизованных биоэквивалентов лучше отдать предпочтение аспирационной и лазерной биопечати, так как эти методы позволяют позиционировать сфероиды с высокой точностью и при плотном контакте. Если необходимо печатать эквиваленты крупного размера, то лучше использовать экструзионную биопечать, так как это один из самых простых и быстрых методов.
Безусловно, при использовании метода биопечати требуется учитывать множество нюансов и, к сожалению, не существует четко сформулированных правил, соблюдение которых позволило бы гарантированно получить необходимый тканевый эквивалент. Тем не менее технология биопечати с применением сфероидов представляет собой один из самых перспективных методов в области тканевой инженерии. В ближайшем будущем метод, безусловно, будет оптимизирован для создания биоэквивалентов различных типов, что откроет новые возможности как для заместительной терапии, так и для разработки адекватных моделей, позволяющих тестировать эффективность и безопасность лекарственных препаратов.
Благодарность. Исследование проведено на научной базе лаборатории, созданной в рамках Программы академического лидерства «Приоритет 2030».
Вклад авторов. Д.П. Ревокатова — написание разделов «Мультипотентные мезенхимальные стромальные клетки», «Эпителиальные клетки», «Преимущества 3D-культивирования», «Механические свойства сфероидов», «Биопечать сфероидами»; П.И. Котенева — написание раздела «Формирование сфероидов» и создание иллюстраций; Н.В. Кошелева — руководство написанием текста и создание плана статьи; А.И. Шпичка — финальное редактирование текста; П.С. Тимашев — разработка концепции статьи.
Финансирование. Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ по грантовому соглашению №075–15-2024-640 (Сеченовский университет).
Конфликта интересов нет.
Литература
- Mironov V., Visconti R.P., Kasyanov V., Forgacs G., Drake C.J., Markwald R.R. Organ printing: tissue spheroids as building blocks. Biomaterials 2009; 30(12): 2164–2174, https://doi.org/10.1016/j.biomaterials.2008.12.084.
- Kosheleva N.V., Efremov Y.M., Koteneva P.I., Ilina I.V., Zurina I.M., Bikmulina P.Y., Shpichka A.I., Timashev P.S. Building a tissue: mesenchymal and epithelial cell spheroids mechanical properties at micro- and nanoscale. Acta Biomater 2023; 165: 140–152, https://doi.org/10.1016/j.actbio.2022.09.051.
- Jeon S., Lee H.S., Lee G.Y., Park G., Kim T.M., Shin J., Lee C., Oh I.H. Shift of EMT gradient in 3D spheroid MSCs for activation of mesenchymal niche function. Sci Rep 2017; 7(1): 6859, https://doi.org/10.1038/s41598-017-07049-3.
- Фриденштейн А.Я., Петракова К.В., Куролесова А.И., Фролова Г.П. Клетки предшественники для остеогенной и кроветворной тканей. Анализ гетеротопных трансплантантов костного мозга. Цитология 1968; 5: 557–567.
- Caplan A.I. Mesenchymal stem cells. J Orthop Res 1991; 9(5): 641–650, https://doi.org/10.1002/jor.1100090504.
- Costa L.A., Eiro N., Fraile M., Gonzalez L.O., Saá J., Garcia-Portabella P., Vega B., Schneider J., Vizoso F.J. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cell Mol Life Sci 2021; 78(2): 447–467, https://doi.org/10.1007/s00018-020-03600-0.
- Gao F., Chiu S.M., Motan D.A., Zhang Z., Chen L., Ji H.L., Tse H.F., Fu Q.L., Lian Q. Mesenchymal stem cells and immunomodulation: current status and future prospects. Cell Death Dis 2016; 7(1): e2062, https://doi.org/10.1038/cddis.2015.327.
- Han Y., Li X., Zhang Y., Han Y., Chang F., Ding J. Mesenchymal stem cells for regenerative medicine. Cells 2019; 8(8): 886, https://doi.org/10.3390/cells8080886.
- Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 2006; 8(4): 315–317, https://doi.org/10.1080/14653240600855905.
- Hass R., Kasper C., Böhm S., Jacobs R. Different populations and sources of human mesenchymal stem cells (MSC): a comparison of adult and neonatal tissue-derived MSC. Cell Commun Signal 2011; 9: 12, https://doi.org/10.1186/1478-811X-9-12.
- Lee Y.C., Chan Y.H., Hsieh S.C., Lew W.Z., Feng S.W. Comparing the osteogenic potentials and bone regeneration capacities of bone marrow and dental pulp mesenchymal stem cells in a rabbit calvarial bone defect model. Int J Mol Sci 2019; 20(20): 5015, https://doi.org/10.3390/ijms20205015.
- Baksh D., Yao R., Tuan R.S. Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow. Stem Cells 2007; 25(6): 1384–1392, https://doi.org/10.1634/stemcells.2006-0709.
- Cho S.W., Sun H.J., Yang J.Y., Jung J.Y., Choi H.J., An J.H., Kim S.W., Kim S.Y., Park K.J., Shin C.S. Human adipose tissue-derived stromal cell therapy prevents bone loss in ovariectomized nude mouse. Tissue Eng Part A 2012; 18(9–10): 1067–1078, https://doi.org/10.1089/ten.TEA.2011.0355.
- Otabe K., Muneta T., Kawashima N., Suda H., Tsuji K., Sekiya I. Comparison of gingiva, dental pulp, and periodontal ligament cells from the standpoint of mesenchymal stem cell properties. Cell Med 2012; 4(1): 13–21, https://doi.org/10.3727/215517912X653319.
- Roato I., Chinigò G., Genova T., Munaron L., Mussano F. Oral cavity as a source of mesenchymal stem cells useful for regenerative medicine in dentistry. Biomedicines 2021; 9(9): 1085, https://doi.org/10.3390/biomedicines9091085.
- Fabre H., Ducret M., Degoul O., Rodriguez J., Perrier-Groult E., Aubert-Foucher E., Pasdeloup M., Auxenfans C., McGuckin C., Forraz N., Mallein-Gerin F. Characterization of different sources of human MSCs expanded in serum-free conditions with quantification of chondrogenic induction in 3D. Stem Cells Int 2019; 2019: 2186728, https://doi.org/10.1155/2019/2186728.
- Guillot C., Lecuit T. Mechanics of epithelial tissue homeostasis and morphogenesis. Science 2013; 340(6137): 1185–1189, https://doi.org/10.1126/science.1235249.
- Fuest M., Yam G.H., Mehta J.S., Duarte Campos D.F. Prospects and challenges of translational corneal bioprinting. Bioengineering (Basel) 2020; 7(3): 71, https://doi.org/10.3390/bioengineering7030071.
- Nie N., Gong L., Jiang D., Liu Y., Zhang J., Xu J., Yao X., Wu B., Li Y., Zou X. 3D bio-printed endometrial construct restores the full-thickness morphology and fertility of injured uterine endometrium. Acta Biomater 2023; 157: 187–199, https://doi.org/10.1016/j.actbio.2022.12.016.
- Torras N., Zabalo J., Abril E., Carré A., García-Díaz M., Martínez E. A bioprinted 3D gut model with crypt-villus structures to mimic the intestinal epithelial-stromal microenvironment. Biomater Adv 2023; 153: 213534, https://doi.org/10.1016/j.bioadv.2023.213534.
- Urkasemsin G., Rungarunlert S., Ferreira J.N. Bioprinting strategies for secretory epithelial organoids. Methods Mol Biol 2020; 2140: 243–249, https://doi.org/10.1007/978-1-0716-0520-2_16.
- Llorián-Salvador M., Byrne E.M., Szczepan M., Little K., Chen M., Xu H. Complement activation contributes to subretinal fibrosis through the induction of epithelial-to-mesenchymal transition (EMT) in retinal pigment epithelial cells. J Neuroinflammation 2022; 19(1): 182, https://doi.org/10.1186/s12974-022-02546-3.
- Gołąbek-Grenda A., Olejnik A. In vitro modeling of endometriosis and endometriotic microenvironment — сhallenges and recent advances. Cell Signal 2022; 97: 110375, https://doi.org/10.1016/j.cellsig.2022.110375.
- Zhu M., Iwano T., Takeda S. Fallopian tube basal stem cells reproducing the epithelial sheets in vitro-stem cell of fallopian epithelium. Biomolecules 2020; 10(9): 1270, https://doi.org/10.3390/biom10091270.
- Deniz Derman I., Yeo M., Castaneda D.C., Callender M., Horvath M., Mo Z., Xiong R., Fleming E., Chen P., Peeples M.E., Palucka K., Oh J., Ozbolat I.T. High-throughput bioprinting of the nasal epithelium using patient-derived nasal epithelial cells. Biofabrication 2023; 15(4): 044103, https://doi.org/10.1088/1758-5090/aced23.
- Costa E.C., Moreira A.F., de Melo-Diogo D., Gaspar V.M., Carvalho M.P., Correia I.J. 3D tumor spheroids: an overview on the tools and techniques used for their analysis. Biotechnol Adv 2016; 34(8): 1427–1441, https://doi.org/10.1016/j.biotechadv.2016.11.002.
- Langhans S.A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Front Pharmacol 2018; 9: 6, https://doi.org/10.3389/fphar.2018.00006.
- Pontes Soares C., Midlej V., de Oliveira M.E., Benchimol M., Costa M.L., Mermelstein C. 2D and 3D-organized cardiac cells shows differences in cellular morphology, adhesion junctions, presence of myofibrils and protein expression. PLoS One 2012; 7(5): e38147, https://doi.org/10.1371/journal.pone.0038147.
- Ryu N.E., Lee S.H., Park H. Spheroid culture system methods and applications for mesenchymal stem cells. Cells 2019; 8(12): 1620, https://doi.org/10.3390/cells8121620.
- Shen H., Cai S., Wu C., Yang W., Yu H., Liu L. Recent advances in three-dimensional multicellular spheroid culture and future development. Micromachines (Basel) 2021; 12(1): 96, https://doi.org/10.3390/mi12010096.
- Chiba M., Yokoyama C., Okada M., Hisatomi H. Mitochondrial DNA reduced by hypoxic conditions in three-dimensional (3D) spheroid cell cultures. Tumour Biol 2014; 35(12): 12689–12693, https://doi.org/10.1007/s13277-014-2593-6.
- Benien P., Swami A. 3D tumor models: history, advances and future perspectives. Future Oncol 2014; 10(7): 1311–1327, https://doi.org/10.2217/fon.13.274.
- Yannarelli G., Pacienza N., Cuniberti L., Medin J., Davies J., Keating A. Brief report: The potential role of epigenetics on multipotent cell differentiation capacity of mesenchymal stromal cells. Stem Cells 2013; 31(1): 215–220, https://doi.org/10.1002/stem.1262.
- Repin V.S., Saburina I.N., Kosheleva N.V., Gorkun A.A., Zurina I.M., Kubatiev A.A. 3D-technology of the formation and maintenance of single dormant microspheres from 2000 human somatic cells and their reactivation in vitro. Bull Exp Biol Med 2014; 158(1): 137–144, https://doi.org/10.1007/s10517-014-2709-4.
- Pochampally R. Colony forming unit assays for MSCs. Methods Mol Biol 2008; 449: 83–91, https://doi.org/10.1007/978-1-60327-169-1_6.
- Guo L., Zhou Y., Wang S., Wu Y. Epigenetic changes of mesenchymal stem cells in three-dimensional (3D) spheroids. J Cell Mol Med 2014; 18(10): 2009–2019, https://doi.org/10.1111/jcmm.12336.
- Bartosh T.J., Ylöstalo J.H., Mohammadipoor A., Bazhanov N., Coble K., Claypool K., Lee R.H., Choi H., Prockop D.J. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A 2010; 107(31): 13724–13729, https://doi.org/10.1073/pnas.1008117107.
- Gorkun A.A., Revokatova D.P., Zurina I.M., Nikishin D.A., Bikmulina P.Y., Timashev P.S., Shpichka A.I., Kosheleva N.V., Kolokoltsova T.D., Saburina I.N. The duo of osteogenic and angiogenic differentiation in ADSC-derived spheroids. Front Cell Dev Biol 2021; 9: 572727, https://doi.org/10.3389/fcell.2021.572727.
- Gorkun A.A., Shpichka A.I., Zurina I.M., Koroleva A.V., Kosheleva N.V., Nikishin D.A., Butnaru D.V., Timashev P.S., Repin V.S., Saburina I.N. Angiogenic potential of spheroids from umbilical cord and adipose-derived multipotent mesenchymal stromal cells within fibrin gel. Biomed Mater 2018; 13(4): 044108, https://doi.org/10.1088/1748-605X/aac22d.
- Stahl A., Wenger A., Weber H., Stark G.B., Augustin H.G., Finkenzeller G. Bi-directional cell contact-dependent regulation of gene expression between endothelial cells and osteoblasts in a three-dimensional spheroidal coculture model. Biochem Biophys Res Commun 2004; 322(2): 684–692, https://doi.org/10.1016/j.bbrc.2004.07.175.
- Gurumurthy B., Bierdeman P.C., Janorkar A.V. Spheroid model for functional osteogenic evaluation of human adipose derived stem cells. J Biomed Mater Res A 2017; 105(4): 1230–1236, https://doi.org/10.1002/jbm.a.35974.
- Moritani Y., Usui M., Sano K., Nakazawa K., Hanatani T., Nakatomi M., Iwata T., Sato T., Ariyoshi W., Nishihara T., Nakashima K. Spheroid culture enhances osteogenic potential of periodontal ligament mesenchymal stem cells. J Periodontal Res 2018; 53(5): 870–882, https://doi.org/10.1111/jre.12577.
- Murphy K.C., Hoch A.I., Harvestine J.N., Zhou D., Leach J.K. Mesenchymal stem cell spheroids retain osteogenic phenotype through α2β1 signaling. Stem Cells Transl Med 2016; 5(9): 1229–1237, https://doi.org/10.5966/sctm.2015-0412.
- Сабурина И.Н., Кошелева Н.В., Зурина И.М., Горкун А.А., Пулин А.А., Еремин И.И., Зорин В.Л., Копнин П.Б. Динамика изменения миогенного потенциала стромальных клеток альвеолярной слизистой оболочки рта в 2D и 3D культуре. Патологическая физиология и экспериментальная терапия 2018; 62(4): 111–119.
- Yamaguchi Y., Ohno J., Sato A., Kido H., Fukushima T. Mesenchymal stem cell spheroids exhibit enhanced in-vitro and in-vivo osteoregenerative potential. BMC Biotechnol 2014; 14: 105, https://doi.org/10.1186/s12896-014-0105-9.
- Müller A.M., Mehrkens A., Schäfer D.J., Jaquiery C., Güven S., Lehmicke M., Martinetti R., Farhadi I., Jakob M., Scherberich A., Martin I. Towards an intraoperative engineering of osteogenic and vasculogenic grafts from the stromal vascular fraction of human adipose tissue. Eur Cell Mater 2010; 19: 127–135, https://doi.org/10.22203/ecm.v019a13.
- Zurina I.M., Shpichka A.I., Saburina I.N., Kosheleva N.V., Gorkun A.A., Grebenik E.A., Kuznetsova D.S., Zhang D., Rochev Y.A., Butnaru D.V., Zharikova T.M., Istranova E.V., Zhang Y., Istranov L.P., Timashev P.S. 2D/3D buccal epithelial cell self-assembling as a tool for cell phenotype maintenance and fabrication of multilayered epithelial linings in vitro. Biomed Mater 2018; 13(5): 054104, https://doi.org/10.1088/1748-605X/aace1c.
- Grisanti S., Guidry C. Transdifferentiation of retinal pigment epithelial cells from epithelial to mesenchymal phenotype. Invest Ophthalmol Vis Sci 1995; 36(2): 391–405.
- Репин В.С., Сабурина И.Н. Клеточная биология развития. Под ред. Деева Р.В. М; 2010.
- Haghwerdi F., Khozaei Ravari M., Taghiyar L., Shamekhi M.A., Jahangir S., Haririan I., Baghaban Eslaminejad M. Application of bone and cartilage extracellular matrices in articular cartilage regeneration. Biomed Mater 2021; 16(4): 10.1088/1748-605X/ac094b, https://doi.org/10.1088/1748-605X/ac094b.
- Al-Juboori A.A.A., Ghosh A., Jamaluddin M.F.B., Kumar M., Sahoo S.S., Syed S.M., Nahar P., Tanwar P.S. Proteomic analysis of stromal and epithelial cell communications in human endometrial cancer using a unique 3D co-culture model. Proteomics 2019; 19(21–22): e1800448, https://doi.org/10.1002/pmic.201800448.
- Hong X., Xu Y., Pang S.W. Enhanced motility and interaction of nasopharyngeal carcinoma with epithelial cells in confined microwells. Lab Chip 2023; 23(3): 511–524, https://doi.org/10.1039/d2lc00616b.
- Hong H.K., Yun N.H., Jeong Y.L., Park J., Doh J., Lee W.Y., Cho Y.B. Establishment of patient-derived organotypic tumor spheroid models for tumor microenvironment modeling. Cancer Med 2021; 10(16): 5589–5598, https://doi.org/10.1002/cam4.4114.
- Haykal M.M., Nahmias C., Varon C., Martin O.C.B. Organotypic modeling of the tumor landscape. Front Cell Dev Biol 2020; 8: 606039, https://doi.org/10.3389/fcell.2020.606039.
- Ludwig K., Tse E.S., Wang J.Y. Colon cancer cells adopt an invasive phenotype without mesenchymal transition in 3-D but not 2-D culture upon combined stimulation with EGF and crypt growth factors. BMC Cancer 2013; 13: 221, https://doi.org/10.1186/1471-2407-13-221.
- Lazzari G., Couvreur P., Mura S. Multicellular tumor spheroids: a relevant 3D model for the in vitro preclinical investigation of polymer nanomedicines. Polymer Chemistry 2017; 8(34): 4947–4969, https://doi.org/10.1039/c7py00559h.
- Kosheleva N.V., Efremov Y.M., Shavkuta B.S., Zurina I.M., Zhang D., Zhang Y., Minaev N.V., Gorkun A.A., Wei S., Shpichka A.I., Saburina I.N., Timashev P.S. Cell spheroid fusion: beyond liquid drops model. Sci Rep 2020; 10(1): 12614, https://doi.org/10.1038/s41598-020-69540-8.
- Hildebrandt C., Büth H., Thielecke H. A scaffold-free in vitro model for osteogenesis of human mesenchymal stem cells. Tissue Cell 2011; 43(2): 91–100, https://doi.org/10.1016/j.tice.2010.12.004.
- Caprio N.D., Burdick J.A. Engineered biomaterials to guide spheroid formation, function, and fabrication into 3D tissue constructs. Acta Biomater 2023; 165: 4–18, https://doi.org/10.1016/j.actbio.2022.09.052.
- Lee B.H., Kim M.H., Lee J.H., Seliktar D., Cho N.J., Tan L.P. Modulation of Huh7.5 spheroid formation and functionality using modified PEG-based hydrogels of different stiffness. PLoS One 2015; 10(2):e0118123, https://doi.org/10.1371/journal.pone.0118123.
- Lee Y.B., Kim E.M., Byun H., Chang H.K., Jeong K., Aman Z.M., Choi Y.S., Park J., Shin H. Engineering spheroids potentiating cell-cell and cell-ECM interactions by self-assembly of stem cell microlayer. Biomaterials 2018; 165: 105–120, https://doi.org/10.1016/j.biomaterials.2018.02.049.
- Schliwa M. Action of cytochalasin D on cytoskeletal networks. J Cell Biol 1982; 92(1): 79–91, https://doi.org/10.1083/jcb.92.1.79.
- Zhou Y., Chen H., Li H., Wu Y. 3D culture increases pluripotent gene expression in mesenchymal stem cells through relaxation of cytoskeleton tension. J Cell Mol Med 2017; 21(6): 1073–1084, https://doi.org/10.1111/jcmm.12946.
- Vyas V., Solomon M., D’Souza G.G.M., Huey B.D. Nanomechanical analysis of extracellular matrix and cells in multicellular spheroids. Cell Mol Bioeng 2019; 12(3): 203–214, https://doi.org/10.1007/s12195-019-00577-0.
- Kim S.A., Lee E.K., Kuh H.J. Co-culture of 3D tumor spheroids with fibroblasts as a model for epithelial-mesenchymal transition in vitro. Exp Cell Res 2015; 335(2): 187–196, https://doi.org/10.1016/j.yexcr.2015.05.016.
- Smyrek I., Mathew B., Fischer S.C., Lissek S.M., Becker S., Stelzer E.H.K. E-cadherin, actin, microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biol Open 2019; 8(1): bio037051, https://doi.org/10.1242/bio.037051.
- Gryadunova A.A., Koudan E.V., Rodionov S.A., Pereira F.D.A.S., Meteleva N.Y., Kasyanov V.A., Parfenov V.A., Kovalev A.V., Khesuani Y.D., Mironov V.A., Bulanova E.A. Cytoskeleton systems contribute differently to the functional intrinsic properties of chondrospheres. Acta Biomater 2020; 118: 141–152, https://doi.org/10.1016/j.actbio.2020.10.007.
- Cai G., Li X., Lin S.S., Chen S.J., Rodgers N.C., Koning K.M., Bi D., Liu A.P. Matrix confinement modulates 3D spheroid sorting and burst-like collective migration. Preprint. bioRxiv 2024; 2023.07.23.549940, https://doi.org/10.1101/2023.07.23.549940.
- Stadler M., Scherzer M., Walter S., Holzner S., Pudelko K., Riedl A., Unger C., Kramer N., Weil B., Neesen J., Hengstschläger M., Dolznig H. Exclusion from spheroid formation identifies loss of essential cell-cell adhesion molecules in colon cancer cells. Sci Rep 2018; 8(1): 1151, https://doi.org/10.1038/s41598-018-19384-0.
- Saemundsson S.A., Ganguly S., Curry S.D., Goodwin A.P., Cha J.N. Controlling cell organization in 3D coculture spheroids using DNA interactions. ACS Biomater Sci Eng 2023; 9(6): 3185–3192, https://doi.org/10.1021/acsbiomaterials.3c00546.
- Bijonowski B. Spatiotemporal regulation of cell–cell adhesions. IntechOpen; 2022, https://doi.org/10.5772/intechopen.97009.
- Nakamura M., Shinji T., Ujike K., Hirasaki S., Koide N., Tsuji T. Cytoskeletal inhibitors, anti-adhesion molecule antibodies, and lectins inhibit hepatocyte spheroid formation. Acta Med Okayama 2002; 56(1): 43–50, https://doi.org/10.18926/AMO/31727.
- Tzanakakis E.S., Hansen L.K., Hu W.S. The role of actin filaments and microtubules in hepatocyte spheroid self-assembly. Cell Motil Cytoskeleton 2001; 48(3): 175–189, https://doi.org/10.1002/1097-0169(200103)48:3<175::AID-CM1007>3.0.CO;2-2.
- Toda S., Blauch L.R., Tang S.K.Y., Morsut L., Lim W.A. Programming self-organizing multicellular structures with synthetic cell-cell signaling. Science 2018; 361(6398): 156–162, https://doi.org/10.1126/science.aat0271.
- Hoffecker I.T., Iwata H. Manipulation of cell sorting within mesenchymal stromal cell-islet cell multicellular spheroids. Tissue Eng Part A 2014; 20(11–12): 1643–1653, https://doi.org/10.1089/ten.TEA.2013.0305.
- Perez J.E., Jan A., Villard C., Wilhelm C. Surface tension and neuronal sorting in magnetically engineered brain-like tissue. Adv Sci (Weinh) 2023; 10(27): e2302411, https://doi.org/10.1002/advs.202302411.
- Gomez G.A., McLachlan R.W., Yap A.S. Productive tension: force-sensing and homeostasis of cell-cell junctions. Trends Cell Biol 2011; 21(9): 499–505, https://doi.org/10.1016/j.tcb.2011.05.006.
- Cui X., Hartanto Y., Zhang H. Advances in multicellular spheroids formation. J R Soc Interface 2017; 14(127): 20160877, https://doi.org/10.1098/rsif.2016.0877.
- Geiger B., Spatz J.P., Bershadsky A.D. Environmental sensing through focal adhesions. Nat Rev Mol Cell Biol 2009; 10(1): 21–33, https://doi.org/10.1038/nrm2593.
- Zheng Y., Pan D. The hippo signaling pathway in development and disease. Dev Cell 2019; 50(3): 264–282, https://doi.org/10.1016/j.devcel.2019.06.003.
- Aragona M., Panciera T., Manfrin A., Giulitti S., Michielin F., Elvassore N., Dupont S., Piccolo S. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell 2013; 154(5): 1047–1059, https://doi.org/10.1016/j.cell.2013.07.042.
- Smith L.R., Cho S., Discher D.E. Stem cell differentiation is regulated by extracellular matrix mechanics. Physiology (Bethesda) 2018; 33(1): 16–25, https://doi.org/10.1152/physiol.00026.2017.
- Rutkovskiy A., Stensløkken K.O., Vaage I.J. Osteoblast differentiation at a glance. Med Sci Monit Basic Res 2016; 22: 95–106, https://doi.org/10.12659/msmbr.901142.
- Wijelath E.S., Rahman S., Namekata M., Murray J., Nishimura T., Mostafavi-Pour Z., Patel Y., Suda Y., Humphries M.J., Sobel M. Heparin-II domain of fibronectin is a vascular endothelial growth factor-binding domain: enhancement of VEGF biological activity by a singular growth factor/matrix protein synergism. Circ Res 2006; 99(8): 853–860, https://doi.org/10.1161/01.RES.0000246849.17887.66.
- Schenk S., Hintermann E., Bilban M., Koshikawa N., Hojilla C., Khokha R., Quaranta V. Binding to EGF receptor of a laminin-5 EGF-like fragment liberated during MMP-dependent mammary gland involution. J Cell Biol 2003; 161(1): 197–209, https://doi.org/10.1083/jcb.200208145.
- Johns M.M., Garrett C.G., Hwang J., Ossoff R.H., Courey M.S. Quality-of-life outcomes following laryngeal endoscopic surgery for non-neoplastic vocal fold lesions. Ann Otol Rhinol Laryngol 2004; 113(8): 597–601, https://doi.org/10.1177/000348940411300801.
- Cross S.E., Jin Y.S., Rao J., Gimzewski J.K. Nanomechanical analysis of cells from cancer patients. Nat Nanotechnol 2007; 2(12): 780–783, https://doi.org/10.1038/nnano.2007.388.
- Efremov Y.M., Kotova S.L., Timashev P.S. Viscoelasticity in simple indentation-cycle experiments: a computational study. Sci Rep 2020; 10(1): 13302, https://doi.org/10.1038/s41598-020-70361-y.
- Krivega E.S., Kotova S.L., Timashev P.S., Efremov Y.M. Mechanical characterization of soft biomaterials: which time and spatial scale to choose? Soft Matter 2024; 20(26): 5095–5104, https://doi.org/10.1039/d4sm00530a.
- Vazquez O.R., Avila I.O., Díaz J.C.S., Hernandez E. An overview of mechanical tests for polymeric biomaterial scaffolds used in tissue engineering. Journal of Research Updates in Polymer Science 2016; 4(4): 168–178, https://doi.org/10.6000/1929-5995.2015.04.04.1.
- Efremov Y.M., Dokrunova A.A., Efremenko A.V., Kirpichnikov M.P., Shaitan K.V., Sokolova O.S. Distinct impact of targeted actin cytoskeleton reorganization on mechanical properties of normal and malignant cells. Biochim Biophys Acta 2015; 1853(11 Pt B): 3117–3125, https://doi.org/10.1016/j.bbamcr.2015.05.008.
- Fuentes-Caparrós A.M., Dietrich B., Thomson L., Chauveau C., Adams D.J. Using cavitation rheology to understand dipeptide-based low molecular weight gels. Soft Matter 2019; 15(31): 6340–6347, https://doi.org/10.1039/c9sm01023h.
- Jorgenson A.J., Choi K.M., Sicard D., Smith K.M., Hiemer S.E., Varelas X., Tschumperlin D.J. TAZ activation drives fibroblast spheroid growth, expression of profibrotic paracrine signals, and context-dependent ECM gene expression. Am J Physiol Cell Physiol 2017; 312(3): C277–C285, https://doi.org/10.1152/ajpcell.00205.2016.
- Blumlein A., Williams N., McManus J.J. The mechanical properties of individual cell spheroids. Sci Rep 2017; 7(1): 7346, https://doi.org/10.1038/s41598-017-07813-5.
- Baraniak P.R., Cooke M.T., Saeed R., Kinney M.A., Fridley K.M., McDevitt T.C. Stiffening of human mesenchymal stem cell spheroid microenvironments induced by incorporation of gelatin microparticles. J Mech Behav Biomed Mater 2012; 11: 63–71, https://doi.org/10.1016/j.jmbbm.2012.02.018.
- Schroyen B., Vlassopoulos D., Van Puyvelde P., Vermant J. Bulk rheometry at high frequencies: a review of experimental approaches. Rheol Acta 2020; 59, 1–22, https://doi.org/10.1007/s00397-019-01172-w.
- Guevorkian K., Colbert M.J., Durth M., Dufour S., Brochard-Wyart F. Aspiration of biological viscoelastic drops. Phys Rev Lett 2010; 104(21): 218101, https://doi.org/10.1103/PhysRevLett.104.218101.
- Ayan B., Heo D.N., Zhang Z., Dey M., Povilianskas A., Drapaca C., Ozbolat I.T. Aspiration-assisted bioprinting for precise positioning of biologics. Sci Adv 2020; 6(10): eaaw5111, https://doi.org/10.1126/sciadv.aaw5111.
- Foty R.A., Steinberg M.S. The differential adhesion hypothesis: a direct evaluation. Dev Biol 2005; 278(1): 255–263, https://doi.org/10.1016/j.ydbio.2004.11.012.
- Kim M.H., Takeuchi K., Kino-Oka M. Role of cell-secreted extracellular matrix formation in aggregate formation and stability of human induced pluripotent stem cells in suspension culture. J Biosci Bioeng 2019; 127(3): 372–380, https://doi.org/10.1016/j.jbiosc.2018.08.010.
- Guimarães C.F., Gasperini L., Marques A.P., Reis R.L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials 2020; 5(5): 351–370, https://doi.org/10.1038/s41578-019-0169-1.
- Padhi A., Nain A.S. ECM in differentiation: a review of matrix structure, composition and mechanical properties. Ann Biomed Eng 2020; 48(3): 1071–1089, https://doi.org/10.1007/s10439-019-02337-7.
- Fletcher D.A., Mullins R.D. Cell mechanics and the cytoskeleton. Nature 2010; 463(7280): 485–492, https://doi.org/10.1038/nature08908.
- Pegoraro A.F., Janmey P., Weitz D.A. Mechanical properties of the cytoskeleton and cells. Cold Spring Harb Perspect Biol 2017; 9(11): a022038, https://doi.org/10.1101/cshperspect.a022038.
- Daly A.C., Davidson M.D., Burdick J.A. 3D bioprinting of high cell-density heterogeneous tissue models through spheroid fusion within self-healing hydrogels. Nat Commun 2021; 12(1): 753, https://doi.org/10.1038/s41467-021-21029-2.
- Kim M.H., Banerjee D., Celik N., Ozbolat I.T. Aspiration-assisted freeform bioprinting of mesenchymal stem cell spheroids within alginate microgels. Biofabrication 2022; 14(2): 10.1088/1758-5090/ac4dd8, https://doi.org/10.1088/1758-5090/ac4dd8.
- Decarli M.C., Seijas-Gamardo A., Morgan F.L.C., Wieringa P., Baker M.B., Silva J.V.L., Moraes Â.M., Moroni L., Mota C. Bioprinting of stem cell spheroids followed by post-printing chondrogenic differentiation for cartilage tissue engineering. Adv Healthc Mater 2023; 12(19): e2203021, https://doi.org/10.1002/adhm.202203021.
- Ayan B., Celik N., Zhang Z., Zhou K., Kim M.H., Banerjee D., Wu Y., Costanzo F., Ozbolat I.T. Aspiration-assisted freeform bioprinting of prefabricated tissue spheroids in a yield-stress gel. Commun Phys 2020; 3: 183, https://doi.org/10.1038/s42005-020-00449-4.
- Efremov Y.M., Zurina I.M., Presniakova V.S., Kosheleva N.V., Butnaru D.V., Svistunov A.A., Rochev Y.A., Timashev P.S. Mechanical properties of cell sheets and spheroids: the link between single cells and complex tissues. Biophys Rev 2021; 13(4): 541–561, https://doi.org/10.1007/s12551-021-00821-w.
- Dechristé G., Fehrenbach J., Griseti E., Lobjois V., Poignard C. Viscoelastic modeling of the fusion of multicellular tumor spheroids in growth phase. J Theor Biol 2018; 454: 102–109, https://doi.org/10.1016/j.jtbi.2018.05.005.
- Foty R.A., Pfleger C.M., Forgacs G., Steinberg M.S. Surface tensions of embryonic tissues predict their mutual envelopment behavior. Development 1996; 122(5): 1611–1620, https://doi.org/10.1242/dev.122.5.1611.
- Jakab K., Damon B., Marga F., Doaga O., Mironov V., Kosztin I., Markwald R., Forgacs G. Relating cell and tissue mechanics: implications and applications. Dev Dyn 2008; 237(9): 2438–2449, https://doi.org/10.1002/dvdy.21684.
- Kosheleva N.V., Ilina I.V., Kozhina K.V., Zurina I.M., Roskova A.E., Gorkun A.A., Ovchinnikov A.V., Agranat M.B., Morozov S.G., Saburina I.N. Cellular model based on laser microsurgery of cell spheroids to study the repair process. Russian Journal of Developmental Biology 2017; 48(1): 56–64, https://doi.org/10.1134/s1062360417010076.
- Omelyanenko N.P., Karalkin P.A., Bulanova E.A., Koudan E.V., Parfenov V.A., Rodionov S.A., Knyazeva A.D., Kasyanov V.A., Babichenko I.I., Chkadua T.Z., Khesuani Y.D., Gryadunova A.A., Mironov V.A. Extracellular matrix determines biomechanical properties of chondrospheres during their maturation in vitro. CARTILAGE 2018; 11(4): 521–531, https://doi.org/10.1177/1947603518798890.
- Mayor R., Etienne-Manneville S. The front and rear of collective cell migration. Nat Rev Mol Cell Biol 2016; 17(2): 97–109, https://doi.org/10.1038/nrm.2015.14.
- Belair D.G., Wolf C.J., Wood C., Ren H., Grindstaff R., Padgett W., Swank A., MacMillan D., Fisher A., Winnik W., Abbott B.D. Engineering human cell spheroids to model embryonic tissue fusion in vitro. PLoS One 2017; 12(9): e0184155, https://doi.org/10.1371/journal.pone.0184155.
- Forte E., Chimenti I., Rosa P., Angelini F., Pagano F., Calogero A., Giacomello A., Messina E. EMT/MET at the crossroad of stemness, regeneration and oncogenesis: the Ying-Yang equilibrium recapitulated in cell spheroids. Cancers (Basel) 2017; 9(8): 98, https://doi.org/10.3390/cancers9080098.
- Matai I., Kaur G., Seyedsalehi A., McClinton A., Laurencin C.T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials 2020; 226: 119536, https://doi.org/10.1016/j.biomaterials.2019.119536.
- Mandrycky C., Wang Z., Kim K., Kim D.H. 3D bioprinting for engineering complex tissues. Biotechnol Adv 2016; 34(4): 422–434, https://doi.org/10.1016/j.biotechadv.2015.12.011.
- Unagolla J.M., Jayasuriya A.C. Hydrogel-based 3D bioprinting: a comprehensive review on cell-laden hydrogels, bioink formulations, and future perspectives. Appl Mater Today 2020; 18: 100479, https://doi.org/10.1016/j.apmt.2019.100479.
- Yusupov V., Churbanov S., Churbanova E., Bardakova K., Antoshin A., Evlashin S., Timashev P., Minaev N. Laser-induced forward transfer hydrogel printing: a defined route for highly controlled process. Int J Bioprint 2020; 6(3): 271, https://doi.org/10.18063/ijb.v6i3.271.
- Benmeridja L., De Moor L., De Maere E., Vanlauwe F., Ryx M., Tytgat L., Vercruysse C., Dubruel P., Van Vlierberghe S., Blondeel P., Declercq H. High-throughput fabrication of vascularized adipose microtissues for 3D bioprinting. J Tissue Eng Regen Med 2020; 14(6): 840–854, https://doi.org/10.1002/term.3051.
- De Moor L., Smet J., Plovyt M., Bekaert B., Vercruysse C., Asadian M., De Geyter N., Van Vlierberghe S., Dubruel P., Declercq H. Engineering microvasculature by 3D bioprinting of prevascularized spheroids in photo-crosslinkable gelatin. Biofabrication 2021; 13(4): 10.1088/1758-5090/ac24de, https://doi.org/10.1088/1758-5090/ac24de.
- Kim S.J., Byun H., Lee S., Kim E., Lee G.M., Huh S.J., Joo J., Shin H. Spatially arranged encapsulation of stem cell spheroids within hydrogels for the regulation of spheroid fusion and cell migration. Acta Biomater 2022; 142: 60–72, https://doi.org/10.1016/j.actbio.2022.01.047.
- Horder H., Guaza Lasheras M., Grummel N., Nadernezhad A., Herbig J., Ergün S., Teßmar J., Groll J., Fabry B., Bauer-Kreisel P., Blunk T. Bioprinting and differentiation of adipose-derived stromal cell spheroids for a 3D breast cancer-adipose tissue model. Cells 2021; 10(4): 803, https://doi.org/10.3390/cells10040803.
- Swaminathan S., Hamid Q., Sun W., Clyne A.M. Bioprinting of 3D breast epithelial spheroids for human cancer models. Biofabrication 2019; 11(2): 025003, https://doi.org/10.1088/1758-5090/aafc49.
- Kim M.K., Jeong W., Jeon S., Kang H.W. 3D bioprinting of dECM-incorporated hepatocyte spheroid for simultaneous promotion of cell-cell and -ECM interactions. Front Bioeng Biotechnol 2023; 11: 1305023, https://doi.org/10.3389/fbioe.2023.1305023.
- Liu R., Jia L., Chen J., Long Y., Zeng J., Liu S., Pan B., Liu X., Jiang H. Chondrocyte spheroid-laden microporous hydrogel-based 3D bioprinting for cartilage regeneration. International Journal of Bioprinting 2023, https://doi.org/10.36922/ijb.0161.
- Jiang Z., Jin B., Liang Z., Wang Y., Ren S., Huang Y., Li C., Sun H., Li Y., Liu L., Li N., Wang J., Cui Z., Huang P., Yang H., Mao Y., Ye H. Liver bioprinting within a novel support medium with functionalized spheroids, hepatic vein structures, and enhanced post-transplantation vascularization. Biomaterials 2024; 311: 122681, https://doi.org/10.1016/j.biomaterials.2024.122681.
- Bulanova E.A., Koudan E.V., Degosserie J., Heymans C., Pereira F.D., Parfenov V.A., Sun Y., Wang Q., Akhmedova S.A., Sviridova I.K., Sergeeva N.S., Frank G.A., Khesuani Y.D., Pierreux C.E., Mironov V.A. Bioprinting of a functional vascularized mouse thyroid gland construct. Biofabrication 2017; 9(3): 034105, https://doi.org/10.1088/1758-5090/aa7fdd.
- Hall G.N., Fan Y., Viellerobe B., Iazzolino A., Dimopoulos A., Poiron C., Clapies A., Luyten F.P., Guillemot F., Papantoniou I. Laser-assisted bioprinting of targeted cartilaginous spheroids for high density bottom-up tissue engineering. Biofabrication 2024; 16(4): 10.1088/1758-5090/ad6e1a, https://doi.org/10.1088/1758-5090/ad6e1a.
- Minaeva E.D., Antoshin A.A., Kosheleva N.V., Koteneva P.I., Gonchukov S.A., Tsypina S.I., Yusupov V.I., Timashev P.S., Minaev N.V. Laser bioprinting with cell spheroids: accurate and gentle. Micromachines (Basel) 2023; 14(6): 1152, https://doi.org/10.3390/mi14061152.
- Khoury R.E., Nagiah N., Mudloff J.A., Thakur V., Chattopadhyay M., Joddar B. 3D bioprinted spheroidal droplets for engineering the heterocellular coupling between cardiomyocytes and cardiac fibroblasts. Cyborg Bionic Syst 2021; 2021: 9864212, https://doi.org/10.34133/2021/9864212.
- Faulkner-Jones A., Fyfe C., Cornelissen D.J., Gardner J., King J., Courtney A., Shu W. Bioprinting of human pluripotent stem cells and their directed differentiation into hepatocyte-like cells for the generation of mini-livers in 3D. Biofabrication 2015; 7(4): 044102, https://doi.org/10.1088/1758-5090/7/4/044102.
- Horváth L., Umehara Y., Jud C., Blank F., Petri-Fink A., Rothen-Rutishauser B. Engineering an in vitro air-blood barrier by 3D bioprinting. Sci Rep 2015; 5: 7974, https://doi.org/10.1038/srep07974.
- Itoh M., Nakayama K., Noguchi R., Kamohara K., Furukawa K., Uchihashi K., Toda S., Oyama J., Node K., Morita S. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One 2015; 10(9): e0136681, https://doi.org/10.1371/journal.pone.0136681.
- Wendel J.R.H., Wang X., Smith L.J., Hawkins S.M. Three-dimensional biofabrication models of endometriosis and the endometriotic microenvironment. Biomedicines 2020; 8(11): 525, https://doi.org/10.3390/biomedicines8110525.
- Murphy S.V., Atala A. 3D bioprinting of tissues and organs. Nat Biotechnol 2014; 32(8): 773–785, https://doi.org/10.1038/nbt.2958.
- Ozbolat I., Hospodiuk M., Pan N., Moncal K.K., Akkouch A. A bioprinted pancreatic tissue model with multiscale vascularization. Frontiers in Bioengineering and Biotechnology 2016; 4, https://doi.org/10.3389/conf.fbioe.2016.01.01105.
- Jakab K., Neagu A., Mironov V., Markwald R.R., Forgacs G. Engineering biological structures of prescribed shape using self-assembling multicellular systems. Proc Natl Acad Sci U S A 2004; 101(9): 2864–2869, https://doi.org/10.1073/pnas.0400164101.
- Goulart E., de Caires-Junior L.C., Telles-Silva K.A., Araujo B.H.S., Rocco S.A., Sforca M., de Sousa I.L., Kobayashi G.S., Musso C.M., Assoni A.F., Oliveira D., Caldini E., Raia S., Lelkes P.I., Zatz M. 3D bioprinting of liver spheroids derived from human induced pluripotent stem cells sustain liver function and viability in vitro. Biofabrication 2019; 12(1): 015010, https://doi.org/10.1088/1758-5090/ab4a30.
- Polonchuk L., Surija L., Lee M.H., Sharma P., Liu Chung Ming C., Richter F., Ben-Sefer E., Rad M.A., Mahmodi Sheikh Sarmast H., Shamery W.A., Tran H.A., Vettori L., Haeusermann F., Filipe E.C., Rnjak-Kovacina J., Cox T., Tipper J., Kabakova I., Gentile C. Towards engineering heart tissues from bioprinted cardiac spheroids. Biofabrication 2021; 13(4): 10.1088/1758-5090/ac14ca, https://doi.org/10.1088/1758-5090/ac14ca.
- Pati F., Ha D.H., Jang J., Han H.H., Rhie J.W., Cho D.W. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials 2015; 62: 164–175, https://doi.org/10.1016/j.biomaterials.2015.05.043.
- Tytgat L., Van Damme L., Van Hoorick J., Declercq H., Thienpont H., Ottevaere H., Blondeel P., Dubruel P., Van Vlierberghe S. Additive manufacturing of photo-crosslinked gelatin scaffolds for adipose tissue engineering. Acta Biomater 2019; 94: 340–350, https://doi.org/10.1016/j.actbio.2019.05.062.
- Ahmad T., Shin H.J., Lee J., Shin Y.M., Perikamana S.K.M., Park S.Y., Jung H.S., Shin H. Fabrication of in vitro 3D mineralized tissue by fusion of composite spheroids incorporating biomineral-coated nanofibers and human adipose-derived stem cells. Acta Biomater 2018; 74: 464–477, https://doi.org/10.1016/j.actbio.2018.05.035.
- Heo D.N., Hospodiuk M., Ozbolat I.T. Synergistic interplay between human MSCs and HUVECs in 3D spheroids laden in collagen/fibrin hydrogels for bone tissue engineering. Acta Biomater 2019; 95: 348–356, https://doi.org/10.1016/j.actbio.2019.02.046.
- Zhuang P., Chiang Y.H., Fernanda M.S., He M. Using spheroids as building blocks towards 3D bioprinting of tumor microenvironment. Int J Bioprint 2021; 7(4): 444, https://doi.org/10.18063/ijb.v7i4.444.
- Ovsianikov A., Gruene M., Pflaum M., Koch L., Maiorana F., Wilhelmi M., Haverich A., Chichkov B. Laser printing of cells into 3D scaffolds. Biofabrication 2010; 2(1): 014104, https://doi.org/10.1088/1758-5082/2/1/014104.
- Antoshin A.A., Churbanov S.N., Minaev N.V., Zhang D., Zhang Y., Shpichka A.I., Timashev P.S. LIFT-bioprinting, is it worth it? Bioprinting 2019; 15: e00052, https://doi.org/10.1016/j.bprint.2019.e00052.
- Nishiyama Y., Nakamura M., Henmi C., Yamaguchi K., Mochizuki S., Nakagawa H., Takiura K. Development of a three-dimensional bioprinter: construction of cell supporting structures using hydrogel and state-of-the-art inkjet technology. J Biomech Eng 2009; 131(3): 035001, https://doi.org/10.1115/1.3002759.
- Mironov V., Trusk T., Kasyanov V., Little S., Swaja R., Markwald R. Biofabrication: a 21st century manufacturing paradigm. Biofabrication 2009; 1(2): 022001, https://doi.org/10.1088/1758-5082/1/2/022001.
- Skardal A., Mack D., Kapetanovic E., Atala A., Jackson J.D., Yoo J., Soker S. Bioprinted amniotic fluid-derived stem cells accelerate healing of large skin wounds. Stem Cells Transl Med 2012; 1(11): 792–802, https://doi.org/10.5966/sctm.2012-0088.
- Ozbolat I.T., Hospodiuk M. Current advances and future perspectives in extrusion-based bioprinting. Biomaterials 2016; 76: 321–343, https://doi.org/10.1016/j.biomaterials.2015.10.076.
- Gurkan U.A., El Assal R., Yildiz S.E., Sung Y., Trachtenberg A.J., Kuo W.P., Demirci U. Engineering anisotropic biomimetic fibrocartilage microenvironment by bioprinting mesenchymal stem cells in nanoliter gel droplets. Mol Pharm 2014; 11(7): 2151–2159, https://doi.org/10.1021/mp400573g.
- Liu C., Chen Y., Chen H., Zhang P. Droplet-based bioprinting for fabrication of tumor spheroids. International Journal of Bioprinting 2024; 10(1): 1214, https://doi.org/10.36922/ijb.1214.
- Kotlarz M., Ferreira A.M., Gentile P., Russell S.J., Dalgarno K. Droplet-based bioprinting enables the fabrication of cell–hydrogel–microfibre composite tissue precursors. Bio-Design and Manufacturing 2022; 5(3): 512–528, https://doi.org/10.1007/s42242-022-00192-5.
- Gudapati H., Dey M., Ozbolat I. A comprehensive review on droplet-based bioprinting: past, present and future. Biomaterials 2016; 102: 20–42, https://doi.org/10.1016/j.biomaterials.2016.06.012.
- Moldovan N.I., Hibino N., Nakayama K. Principles of the Kenzan method for robotic cell spheroid-based three-dimensional bioprinting. Tissue Eng Part B Rev 2017; 23(3): 237–244, https://doi.org/10.1089/ten.TEB.2016.0322.
- Heo D.N., Ayan B., Dey M., Banerjee D., Wee H., Lewis G.S., Ozbolat I.T. Aspiration-assisted bioprinting of co-cultured osteogenic spheroids for bone tissue engineering. Biofabrication 2020; 13(1): 10.1088/1758-5090/abc1bf, https://doi.org/10.1088/1758-5090/abc1bf.










