Функциональная анатомия сердца овцы как модель для испытания сердечно-сосудистых устройств
Цель исследования — оценить пригодность животной модели для доклинических испытаний имплантируемых кардиоваскулярных устройств путем изучения числовых анатомо-функциональных характеристик сердца овцы, установить отличия их от характеристик сердца человека.
Материалы и методы. Работа выполнена на 17 здоровых помесных овцах на основе романовской породы. В 1-й группе (n=7) масса тела составила 20–29 кг, во 2-й группе (n=10) — 30–43 кг. Всем животным выполняли эхоКГ-исследование на аппарате Philips CX50 (revision 3.1.2; Philips, Нидерланды) секторно-фазированным датчиком S5-1 из правой парастернальной проекции (по длинной и короткой осям) с определением частоты сердечных сокращений, толщины стенки правого желудочка в диастолу, конечно-диастолического размера правого и левого желудочков (КДР ПЖ и КДР ЛЖ), конечно-систолического размера левого желудочка (КСР ЛЖ), толщины межжелудочковой перегородки в систолу и диастолу, толщины задней стенки левого желудочка в систолу и диастолу.
Функциональные параметры левого желудочка: конечно-систолический и конечно-диастолический объем левого желудочка (КСО ЛЖ и КДО ЛЖ), фракцию выброса и фракцию укорочения — рассчитывали с использованием модифицированного метода Симпсона, «встроенного» в программное обеспечение эхоКГ-аппарата. Измеряли диаметр фиброзного кольца митрального клапана и параметры корня аорты: диаметры аортального клапана, синусов Вальсальвы и синотубулярного соединения, а также высоту корня аорты от фиброзного кольца до линии синотубулярного соединения.
После аутопсии выполняли прямые измерения диаметров восходящей аорты и ствола легочной артерии, межкомиссуральных расстояний и высоты створок аортального клапана.
Результаты. Установлено, что по ряду анатомо-функциональных показателей — фракции выброса, толщине миокарда, КДР ЛЖ и КСР ЛЖ, диаметрам аорты и ствола легочной артерии — сердце овцы очень близко к человеческому. В то же время КДО ЛЖ и КСО ЛЖ овцы значительно меньше, чем у человека, даже в соотношении с площадью поверхности тела, а диаметр митрального клапана в среднем больше.
Несмотря на сопоставимость диаметров аортального клапана, синусов Вальсальвы и синотубулярного соединения, строение корня аорты овцы и человека разное: у овцы меньше высота и межкомиссуральные расстояния створок. Кроме того, были обнаружены особенности в расположении створок по отношению к оси клапана: межкомиссуральное расстояние правой коронарной створки почти в 2 раза превышает аналогичный показатель левой коронарной створки.
Для большинства анатомо-функциональных показателей не обнаружено корреляционных связей с массой тела животных. Лишь во 2-й группе была выявлена значимая положительная корреляция между массой тела и высотой створок аортального клапана.
Заключение. Анатомо-функциональные характеристики сердца овцы близки к таковым человека, но не идентичны. Овца может служить валидной экспериментальной моделью для доклинических испытаний имплантируемых кардиоваскулярных устройств, однако для успешного эксперимента необходимы тщательный скрининг животных с эхоКГ-оценкой параметров таргетной зоны и выбор соответствующего ей типоразмера устройства.
Введение
Проблема разработки новых имплантируемых устройств для хирургического лечения приобретенных пороков сердца остается актуальной в связи с ростом продолжительности жизни и, соответственно, увеличением популяции населения в возрасте старше 60–70 лет и более. У пожилых пациентов для коррекции дегенеративных пороков все шире используются транскатетерные устройства. Технические инновации и устойчивый прогресс в развитии кардиохирургии также стимулируют новые разработки малоинвазивных устройств для применения в педиатрической группе больных [1, 2].
При разработке имплантируемых медицинских изделий в эндоваскулярной и сердечно-сосудистой хирургии обязателен этап доклинических испытаний на крупных животных, с ортотопической имплантацией тестируемого устройства. Для этих целей обычно используют телят [3], свиней [4] и овец [5]. Эксперименты с использованием овец — не редкость при изучении технических аспектов имплантации новых кардиоваскулярных устройств, а также оценке их функции и отдаленных структурных трансформаций [6, 7]. Конечно, оптимальными можно было бы считать модели с использованием приматов [8], однако это обусловливает повышенные требования к финансовой и этической сторонам эксперимента.
При выборе животной модели и планировании эксперимента необходимо убедиться в том, что целевая зона сердечно-сосудистой системы животного соответствует имплантируемому устройству по анатомическим и функциональным показателям. Значительное несоответствие размеров и характеристик приведет к неудачам при попытках имплантации, получению недостоверных результатов или их отсутствию. Так, например, известной проблемой при ортотопической транскатетерной имплантации свиньям некоторых моделей самораскрывающихся аортальных клапанов является обструкция коронарного кровотока [9]. Возможны и такие осложнения, как миграция митрального транскатетерного протеза и/или парапротезная регургитация вследствие неконгруэнтности изделий, разработанных для человека [10, 11].
При планировании испытаний медицинских изделий знание морфометрических особенностей области вмешательства необходимо с целью снижения риска летальности лабораторных животных и получения валидных результатов эксперимента. Нерезультативное инвазивное вмешательство и тем более напрасная гибель животного недопустимы с биоэтической точки зрения.
К сожалению, на сегодняшний день мы не встретили в доступных литературных источниках единого протокола изучения анатомо-функциональных параметров сердца овец. Как правило, в публикациях представлены общее описание корня аорты овец и данные о зависимости размеров сердца и его отдельных структур от породы, пола, массы тела и возраста, а также индивидуальные топографические особенности сердца некоторых животных [12, 13].
Целью нашего исследования явилось определение числовых значений анатомо-функциональных характеристик сердца овцы, выявление отличий их от параметров сердца человека и оценка пригодности конкретной животной модели для доклинических испытаний имплантируемых кардиоваскулярных устройств.
Материалы и методы
Работа выполнена на 17 здоровых помесных овцах на основе романовской породы, широко распространенных в Новосибирской области. Этих животных традиционно используют в Национальном медицинском исследовательском центре им. академика Е.Н. Мешалкина Минздрава России для доклинических испытаний имплантируемых медицинских изделий. Овцы, включенные в данное исследование, были разделены на 2 группы: 1-я группа (n=7) — животные с массой тела 20–29 кг; 2-я группа (n=10) — животные с массой тела 30–43 кг. Все овцы прошли предварительный ветеринарный осмотр и были признаны клинически здоровыми.
Работа одобрена биоэтической комиссией Национального медицинского исследовательского центра им. академика Е.Н. Мешалкина Минздрава России (протокол №3 от 25.08.2023). Условия содержания и работа с животными соответствовали требованиям Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006).
Доклинические испытания проводили в рамках проекта по разработке транскатетерного митрального биопротеза. Аортальный клапан оставался интактным, что позволило выполнить его прямую морфометрию у всех животных, умерших после эвтаназии в остром опыте или в раннем (не более 10 дней) послеоперационном периоде.
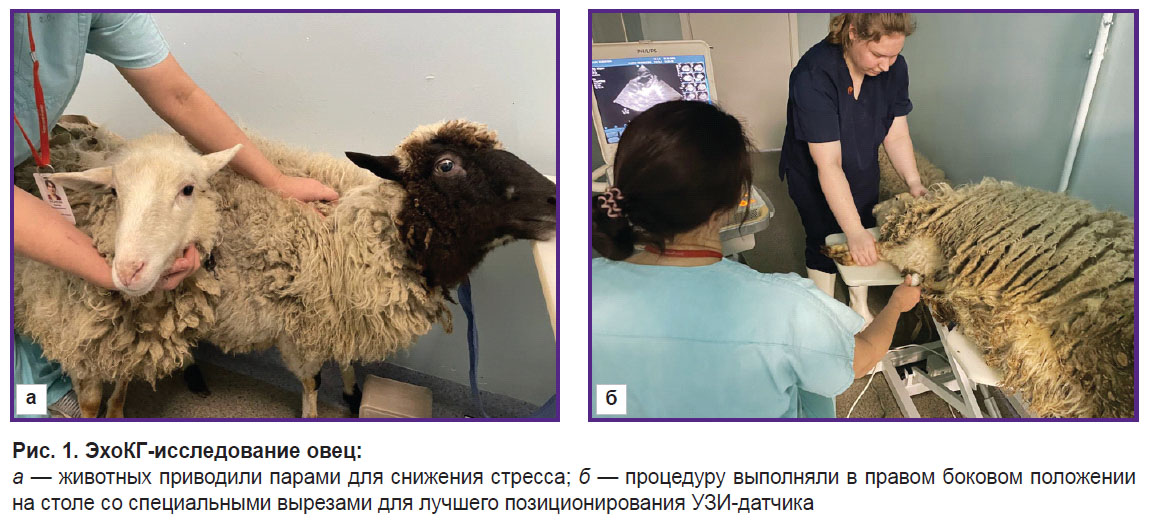
ЭхоКГ-исследование выполняли без седации, поэтому для уменьшения стресса животных приводили парами и давали время для адаптации перед началом исследования (рис. 1).
В день эхоКГ-исследования животных взвешивали на весах ВСП4-150 ЖСО (ГК «Невские весы», Россия), класс точности — III по ГОСТ OIML R76-1-2011.
Боковую часть грудной клетки с правой стороны в области сердечного толчка (4–5-й межреберный промежуток, нижняя треть) освобождали от шерсти с помощью машинки для стрижки животных Max45 (Moser, Германия). Овцу укладывали на стол в правое боковое положение, с отведенными вперед грудными конечностями, удерживая руками. Само исследование занимало не более 10 мин.
ЭхоКГ выполняли на ультразвуковом аппарате Philips CX-50 (revision 3.1.2; Philips, Нидерланды) секторно-фазированным датчиком S5-1 по методикам, ранее описанным для животных [14–16]. В качестве контактной среды на кожу животных в области эхо-окна наносили Акугель средней вязкости. Изображения получали из правой парастернальной проекции (по длинной и короткой осям). Вид по длинной оси позволял получать четырехкамерное и пятикамерное изображения.
Фиксировали следующие параметры: частоту сердечных сокращений, толщину стенки правого желудочка в диастолу, конечно-диастолический размер правого (КДР ПЖ) и левого желудочка (КДР ЛЖ), толщину межжелудочковой перегородки (МЖП) в диастолу, толщину задней стенки левого желудочка в диастолу и систолу, конечно-систолический размер левого желудочка (КСР ЛЖ).
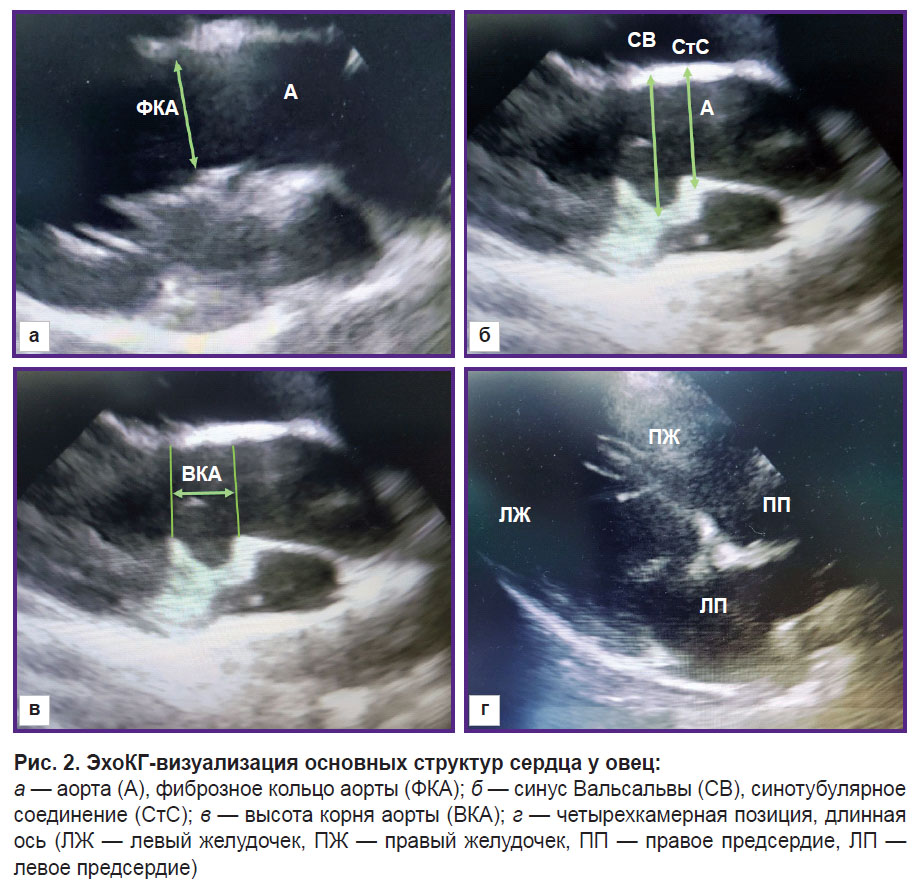
Функциональные параметры левого желудочка: конечно-диастолический (КДО ЛЖ) и конечно-систолический объем (КСО ЛЖ), фракцию выброса, фракцию укорочения — рассчитывали с использованием модифицированного метода Симпсона, «встроенного» в программное обеспечение эхоКГ-аппарата. Диаметр фиброзного кольца аорты фиксировали во время систолы, в момент его максимального размера; курсор устанавливали от внутреннего края к внутреннему краю в точке прикрепления створок. Синус Вальсальвы и синотубулярное соединение измеряли во время диастолы от внешнего контура до внешнего контура, высоту корня аорты — от фиброзного кольца до линии синотубулярного соединения (рис. 2).
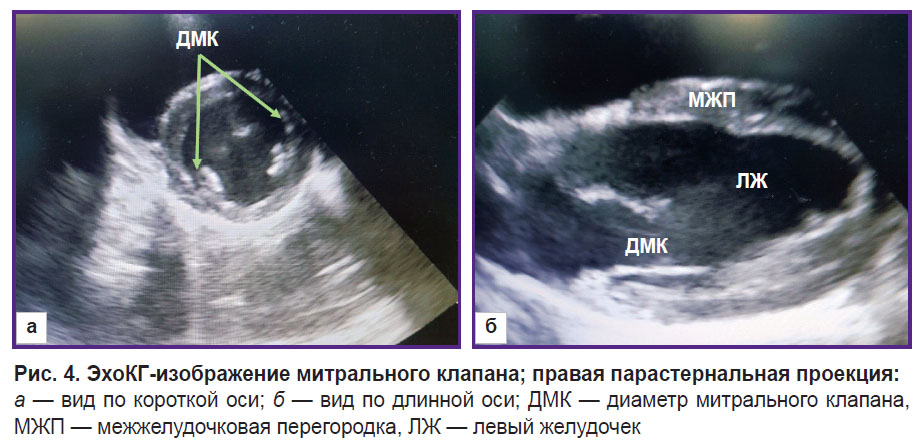
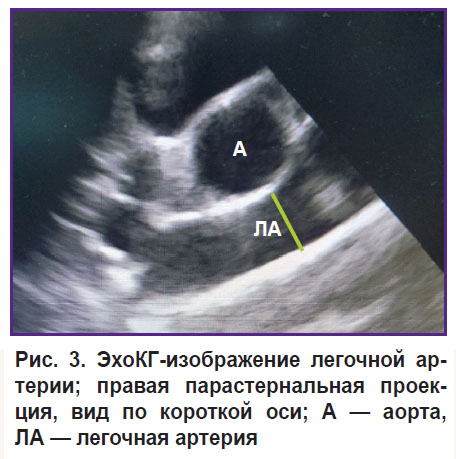
Поворот датчика вокруг своей оси позволял получить изображение сердца животного по короткой оси. Из этой позиции оценивали диаметр легочной артерии на уровне клапана (рис. 3). Диаметр митрального клапана оценивали по длинной и короткой осям (рис. 4).
|
Рис. 3. ЭхоКГ-изображение легочной артерии; правая парастернальная проекция, вид по короткой оси; А — аорта, ЛА — легочная артерия |
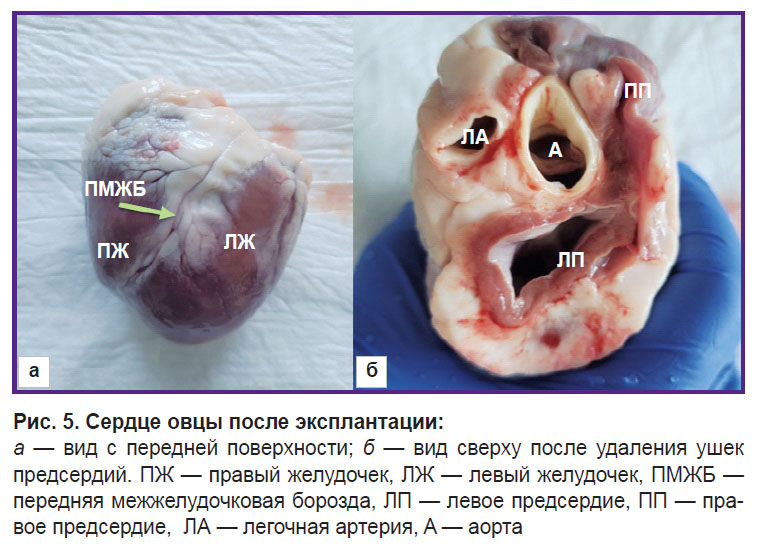
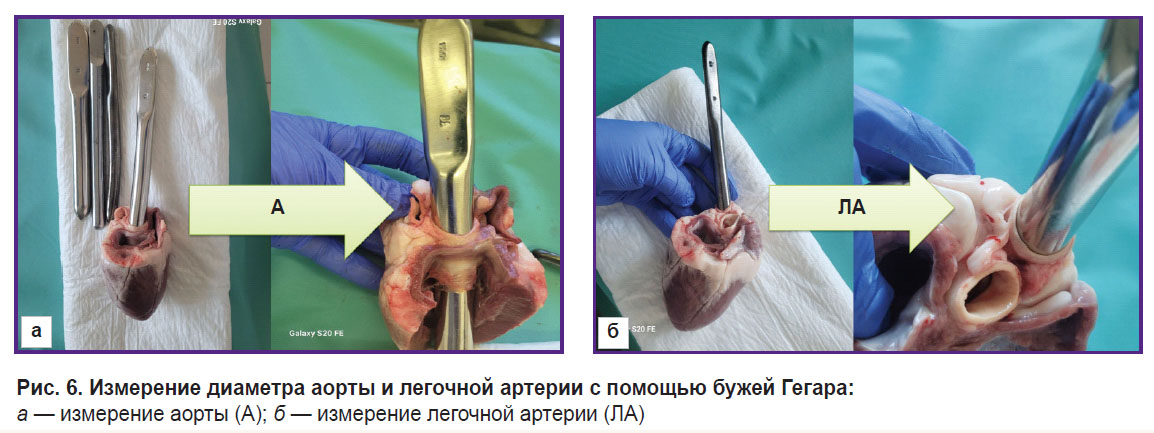
Для выполнения прямых измерений размеров сердечных структур сердца извлекали при аутопсии по стандартной методике (рис. 5). С помощью бужей Гегара (рис. 6) оценивали диаметр восходящей аорты и легочной артерии. Затем рассекали корень аорты по комиссуре между створками.
|
Рис. 6. Измерение диаметра аорты и легочной артерии с помощью бужей Гегара:
а — измерение аорты (A); б — измерение легочной артерии (ЛА) |
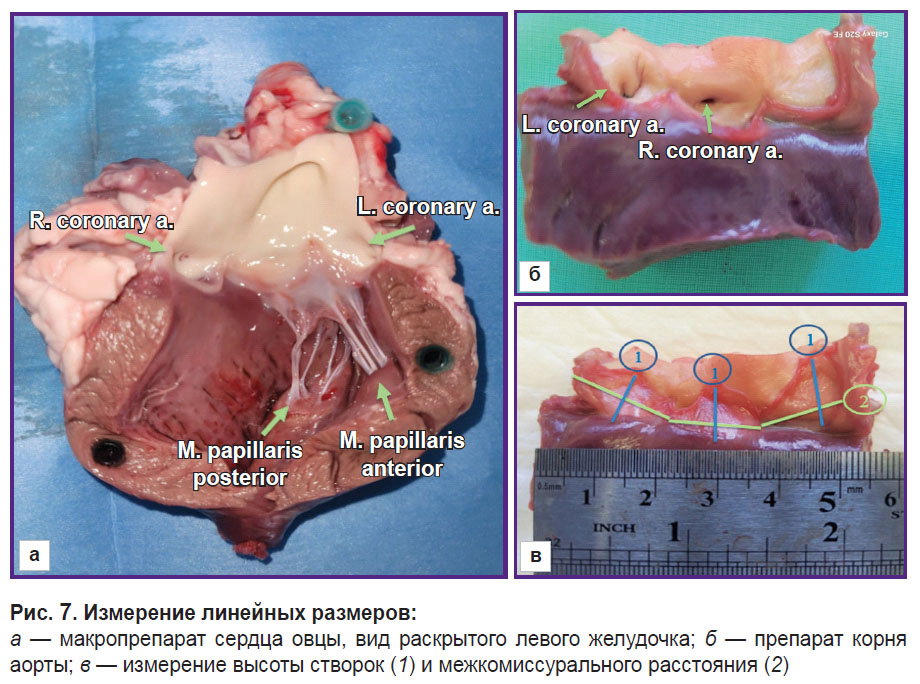
Измерение линейных размеров проводили с помощью циркуля с точностью до 1,0 мм и методики точного моделирования нити по конфигурации структуры сердца с последующим измерением ее длины линейкой (рис. 7). Определяли межкомиссуральное расстояние между вершинами комиссур с измерением длины по выпуклой стенке синуса, а высоту створки — от середины длины свободного края створки до середины длины прикрепления створки к фиброзному кольцу.
|
Рис. 7. Измерение линейных размеров:
а — макропрепарат сердца овцы, вид раскрытого левого желудочка; б — препарат корня аорты; в — измерение высоты створок (1) и межкомиссурального расстояния (2) |
Наличие каких-либо повреждений или аномалий структур являлось критерием исключения из исследования.
Отношение массы к площади поверхности тела у овец рассчитывали по общепринятой в ветеринарии формуле [17]:
BSA=К·(m/2,3)·10–4,
где BSA — площадь поверхности тела, м2; m — масса тела, г; К — коэффициент для различных видов животных (в настоящем исследовании равен 10,1).
Статистическая обработка данных осуществлена с использованием пакета Statistica 8.0 (StatSoft Inc., США). О нормальности распределения судили по критерию Шапиро–Уилка. Поскольку распределение отличалось от нормального, были использованы методы непараметрической статистики. Данные представлены как медиана (Ме) и межквартильный интервал [Q1; Q3]. Для оценки статистической значимости различий использовали U-критерий Манна–Уитни; для оценки корреляции — метод Спирмена. Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
К сожалению, при выполнении исследования без седации невозможно полностью исключить стресс у животного, о чем свидетельствовало увеличение средней частоты сердечных сокращений до 97–98 в минуту при норме 60–80 в минуту.
Во всех случаях исследования из правого парастернального доступа в 4–5-м межреберном промежутке были получены качественные изображения, позволившие выполнить точные измерения, результаты которых представлены в табл. 1.
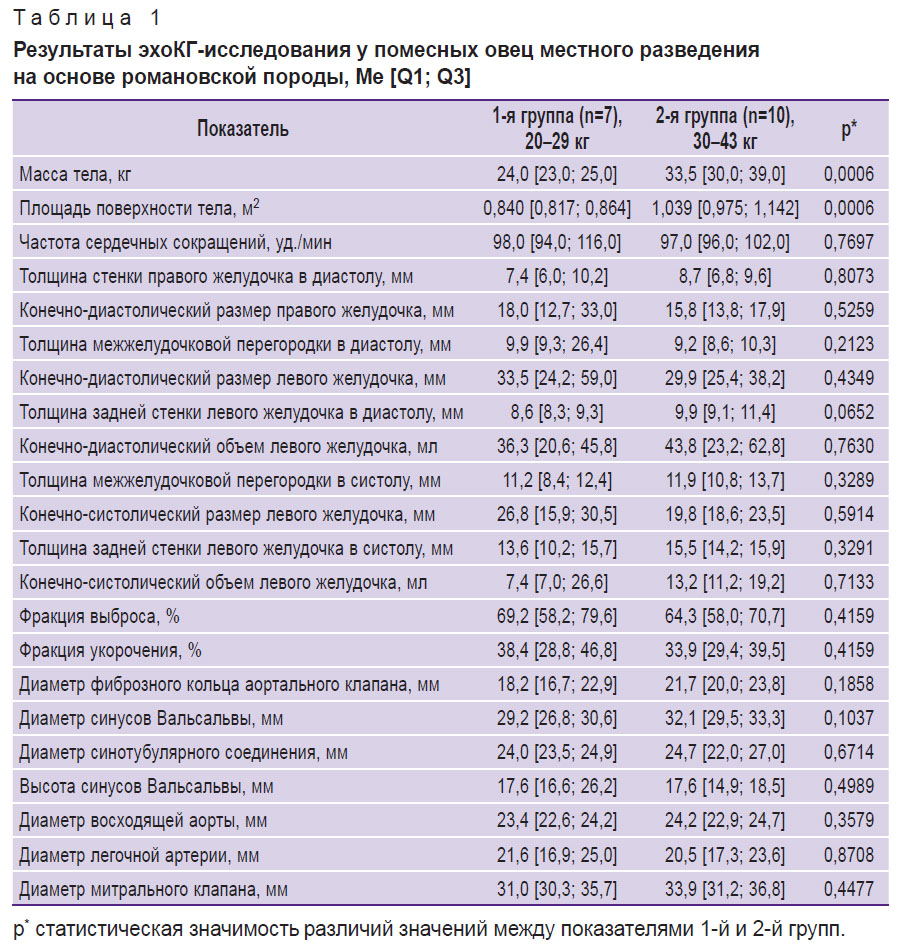
|
Таблица 1. Результаты эхоКГ-исследования у помесных овец местного разведения на основе романовской породы, Me [Q1; Q3] |
Данные, полученные при прямом измерении диаметров аорты и легочной артерии (см. рис. 6), совпадали с данными, полученными при эхоКГ-исследовании (табл. 2). Таким образом, при планировании экспериментальной операции размеры имплантируемого устройства с высокой точностью могут быть выбраны на основании результатов эхоКГ-исследования.
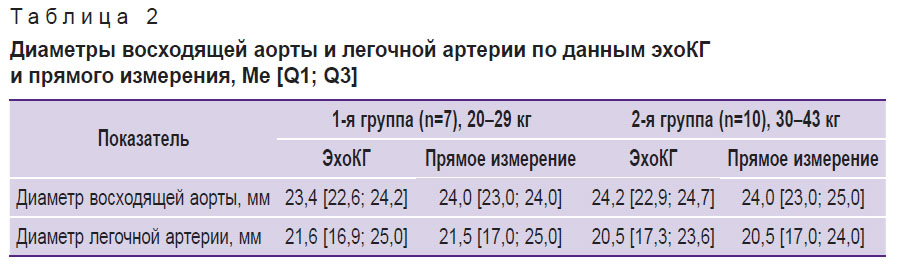
|
Таблица 2. Диаметры восходящей аорты и легочной артерии по данным эхоКГ и прямого измерения, Me [Q1; Q3] |
Полученные в настоящей работе результаты продемонстрировали крайне высокую индивидуальную вариабельность анатомических и функциональных параметров сердца овец. При этом ни один из показателей, приведенных в табл. 1, не обнаружил корреляционной связи с массой тела животных (для всех показателей корреляция была оценена как слабая при значениях ρ<0,4). У животных 2-й группы отмечалась лишь статистически незначимая тенденция к увеличению некоторых измеряемых структур (толщины стенки желудочков, межжелудочковой перегородки, размера желудочков, аорты от фиброзного кольца до восходящей ее части, а также митрального клапана).
Необходимо отметить, что по ряду анатомо-функциональных показателей сердце овцы очень близко к человеческому. Так, фракция выброса у овец составляет 58–79%, что близко к референсным значениям человека (53–77%) [18, 19]. Толщина задней стенки ЛЖ составляет у человека 8–11 мм, у овцы 8,6–9,9 мм; толщина МЖП в диастолу составляет 9–12 и 9,2–9,9 мм соответственно [20].
Несмотря на то, что КСР ЛЖ и КДР ЛЖ у овец в среднем меньше, чем у человека (КСР человека равен 21,6–39,8 мм, КДР — 37,8–58,4 мм [18]), среди животных как 1-й, так и 2-й групп можно без труда найти тех, чьи показатели укладываются в референсные значения для здоровых людей. У овец показатели КСР ЛЖ и КДР ЛЖ очень вариабельны, особенно у животных 1-й группы, и находятся в диапазоне 15,9–30,5 и 24,4–59,0 мм соответственно.
В то же время объемные показатели левого желудочка овцы значительно ниже, чем у человека, даже в отношении к площади поверхности тела (табл. 3).
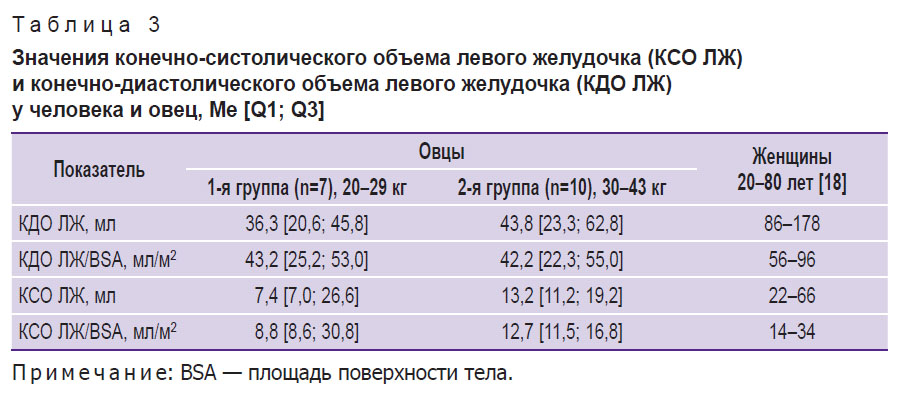
|
Таблица 3. Значения конечно-систолического объема левого желудочка (КСО ЛЖ) и конечно-диастолического объема левого желудочка (КДО ЛЖ) у человека и овец, Me [Q1; Q3] |
Диаметр митрального клапана у овец несколько больше, чем у человека (31–34 мм): у мужчин средние размеры его составляют 29 мм, а у женщин — 26 мм [21]. Диаметры восходящей аорты и легочной артерии (см. табл. 1 и 2) у овец близки к таковым у человека (19–35 и 16–29 мм соответственно) [22].
Большой интерес для invivo испытаний протезов аортального клапана представляет геометрия корня аорты овец, соответствие его размеров размерам человека. Известно, что диаметр фиброзного кольца аортального клапана у человека находится в диапазоне 16–23 мм [19]. У овец в нашем исследовании эти значения составили от 16,7 мм в 1-й группе до 23,8 мм во 2-й группе (см. табл. 1). Диаметры синусов Вальсальвы и синотубулярного соединения у овец вполне сопоставимы с аналогичными показателями человека, но их вариабельность несколько меньше. Так, диаметр синусов Вальсальвы у овец составляет 26,8–33,3 мм, тогда как у человека — 22–35 мм; диаметр синотубулярного соединения — 23,5–27,0 и 18–30 мм соответственно [19].
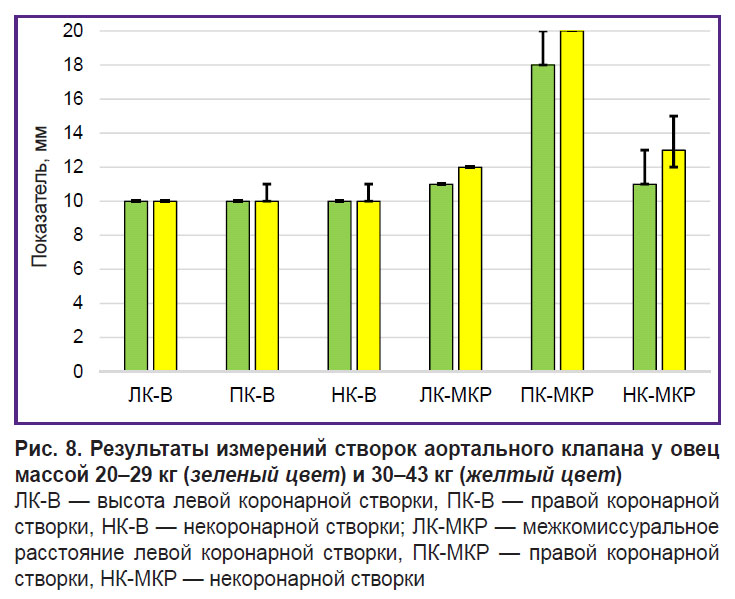
Результаты прямых измерений показали, что высота створок аортального клапана составила около 10–12 мм вне зависимости от массы животных (рис. 8). У человека она приблизительно в два раза больше и составляет 19–24 мм [23]. Еще большие различия обнаружены в расположении комиссур створок по отношению к оси клапана. Расстояние между комиссурами створок аортального клапана человека довольно равномерное и составляет 24–33 мм [23], а межкомиссуральные расстояния, измеренные нами у овец, составили для левой коронарной створки 11–13 мм, для некоронарной створки они составили 11–15 мм.
У овец 2-й группы межкомиссуральные расстояния были на 1–2 мм больше (см. рис. 8), чем у овец 1-й группы, хотя эти различия и не были статистически значимы (р>0,1). Межкомиссуральное расстояние правой коронарной створки составило 18–20 мм в обеих группах. У животных 1-й группы выявлена положительная корреляция по Спирмену между массой тела и этим межкомиссуральным расстоянием (ρ=0,82 при р<0,05). У животных 2-й группы положительная корреляция по Спирмену выявлена между массой тела и межкомиссуральным расстоянием левой коронарной створки (ρ=0,82 при р<0,05), между массой тела и высотой левой коронарной створки (ρ=0,72 при р<0,05), массой тела и высотой правой коронарной створки (ρ=0,85 при р<0,05), массой тела и высотой некоронарной створки (ρ=0,83 при р<0,05).
Проведенные исследования привели нас к заключению, что анатомо-функциональные характеристики сердца овцы близки к таковым человека, но не идентичны. У человека эти характеристики напрямую связаны с массой тела, возрастом, ростом, площадью поверхности тела и т.д. [24, 25]. Однако такие зависимости отсутствуют для сердца овцы, поэтому выбор животного для конкретного эксперимента не должен быть ориентирован на его массу. Так, аортальный клапан с диаметром 23 мм или митральный клапан с диаметром 35 мм почти одинаково часто можно встретить как в группе со средней массой 24 кг, так и у животных, масса которых на 10 кг больше. При этом следует отметить, что мы не обнаружили значимых корреляций между диаметрами этих клапанов и показателями линейных и объемных размеров сердца. В то же время выявлены корреляционные связи между массой животного и строением корня аорты, что необходимо учитывать при выборе объекта эксперимента.
Необходимо также принимать во внимание меньшие объемные размеры полостей сердца овцы по сравнению с сердцем человека. Это особенно актуально при испытаниях транскатетерных протезов митрального клапана, которые предназначены в основном для пациентов с ишемической митральной недостаточностью и, соответственно, «большим» левым желудочком.
Оптимальным подходом к планированию экспериментов мы считаем предварительное моделирование in silico, т.е. последовательное выполнение эхоКГ-скрининга нескольких экспериментальных животных, 3D-моделирование таргетной зоны с последующей виртуальной имплантацией испытуемого устройства, выбор животного с оптимальными анатомо-функциональными характеристиками и типоразмера имплантируемого устройства и только после этого — непосредственное выполнение хирургического эксперимента.
Результаты работы позволили выделить несколько практических аспектов, которые важно учитывать при изучении характеристик целевой зоны.
Во-первых, выполнение эхокардиографии у овец без седации осложняется чувствительностью этих животных к стрессу с развитием тахипноэ и тахикардии. Однако выполнение седации требует подготовки животных (как минимум, лишения корма на 12 ч), а также провоцирует снижение систолической и диастолической функции во время наркоза. Кроме того, общая анестезия у овец снижает сократительную способность сердца [26]. Мы считаем, что более целесообразны немедикаментозные меры снижения стресса — максимально бережное обращение, исследование парами, ручная фиксация, угощение минеральной солью-лизунцом во время исследования.
Во-вторых, следует принимать во внимание сложности получения качественных апикальных изображений, обусловленные килевидной формой грудной клетки, узкими межреберными промежутками и наличием газа в рубце овец [3]. Мы тоже столкнулись с этой проблемой, однако получению необходимых данных это не помешало, поскольку все эхоКГ-исследования выполнялись из правого бокового положения, в парастернальной позиции, по длинной и короткой осям.
При подготовке к эксперименту по имплантации аортального клапана следует также учитывать два фактора, выявленные нами в процессе исследования. Первый из них — прямая корреляция между массой тела животного и высотой створок, а также между массой и межкомиссуральным расстоянием. Второй — большие различия межкомиссуральных расстояний. Аортальный клапан человека более осесимметричен и демонстрирует значимые корреляции между ключевыми параметрами створок [27]. Эти факторы нужно брать в расчет, поскольку некоторые модели имплантируемых клапанов могут вызывать коронарную обструкцию при недооценке анатомических параметров таргетной зоны.
Таким образом, полученные результаты исследования показывают необходимость обязательного эхокардиографического исследования таргетной зоны перед выполнением хирургического эксперимента.
Заключение
Представленные численные анатомо-функциональные характеристики сердца здоровых помесных овец местного разведения на основе романовской породы продемонстрировали их имеющиеся различия с характеристиками сердца человека, что не мешает признать этих овец валидной моделью для доклинических испытаний имплантируемых кардиоваскулярных устройств.
Полученные сведения будут полезны кардиологам, хирургам и инженерам, занимающимся разработкой девайсов для хирургии митрального клапана, аортального клапана и клапана легочной артерии, а также их доклиническими испытаниями на животных.
Финансирование. Исследование проведено в рамках гранта Российского научного фонда 23-15-00434.
Конфликт интересов отсутствует.
Литература
- Blaser M.C., Kraler S., Lüscher T.F., Aikawa E. Multi-omics approaches to define calcific aortic valve disease pathogenesis. Circ Res 2021; 128(9): 1371–1397, https://doi.org/10.1161/CIRCRESAHA.120.317979.
- Bouma B.J., Mulder B.J. Changing landscape of congenital heart disease. Circ Res 2017; 120(6): 908–922, https://doi.org/10.1161/CIRCRESAHA.116.309302.
- Karimov J.H., Moazami N., Kobayashi M., Sale S., Such K., Byram N., Sunagawa G., Horvath D., Gao S., Kuban B., Golding L.A., Fukamachi K. First report of 90-day support of 2 calves with a continuous-flow total artificial heart. J Thorac Cardiovasc Surg 2015; 150(3): 687–693.e1, https://doi.org/10.1016/j.jtcvs.2015.06.023.
- Rusakova Y.L., Grankin D.S., Podolskaya K.S., Zhuravleva I.Y. Pigs as models to test cardiovascular devices. Biomedicines 2024; 12(6): 1245, https://doi.org/10.3390/biomedicines12061245.
- Барбараш Л.С., Клышников К.Ю., Хаес Б.Л., Халивопуло И.К., Стасев А.Н., Крутицкий С.С., Борисенко Д.В., Ситникова М.А., Иванова А.В., Кудрявцева Ю.А., Кокорин С.Г., Евтушенко А.В., Овчаренко Е.А. Первый опыт репротезирования митрального клапана с использованием системы бесшовной имплантации по методу «протез-в-протез»: двухэтапная имплантация на крупном животном. Бюллетень экспериментальной биологии и медицины 2019; 168(12): 783–787.
- Kim D.H., Morris B., Guerrero J.L., Sullivan S.M., Hung J., Levine R.A. Ovine model of ischemic mitral regurgitation. Methods Mol Biol 2018; 1816: 295–308, https://doi.org/10.1007/978-1-4939-8597-5_23.
- Van Hoof L., Claus P., Jones E.A.V., Meuris B., Famaey N., Verbrugghe P., Rega F. Back to the root: a large animal model of the Ross procedure. Ann Cardiothorac Surg 2021; 10(4): 444–453, https://doi.org/10.21037/acs-2020-rp-21.
- Sampath S., Klimas M., Feng D., Baumgartner R., Manigbas E., Liang A.L., Evelhoch J.L., Chin C.L. Characterization of regional left ventricular function in nonhuman primates using magnetic resonance imaging biomarkers: a test-retest repeatability and inter-subject variability study. PLoS One 2015; 10(5): e0127947, https://doi.org/10.1371/journal.pone.0127947.
- Cai J., Huang H., Zhou Y., Mei Y., Shao J., Wang Y. A new type of aortic valved stent with good stability and no influence on coronary artery. J Cardiothorac Surg 2013; 8: 210, https://doi.org/10.1186/1749-8090-8-210.
- Joudinaud T.M., Flecher E.M., Curry J.W., Kegel C.L., Weber P.A., Duran C.M. Sutureless stented aortic valve implantation under direct vision: lessons from a negative experience in sheep. J Card Surg 2007; 22(1): 13–17, https://doi.org/10.1111/j.1540-8191.2007.00337.x.
- Bai Y., Zong G.J., Wang Y.Y., Jiang H.B., Li W.P., Wu H., Zhao X.X., Qin Y.W. Percutaneous aortic valve replacement using a W-model valved stent: a preliminary feasibility study in sheep. Chin Med J (Engl) 2009; 122(6): 655–658.
- Acorda J.A., Pajas A.M.G. M-mode echocardiographic values in male and female Philippine sheep (Ovis aries) (Artiodactyla: Bovidae) by age and status of lactation and pregnancy. Philipp J Vet Med 2015; 52(1): 11–20.
- Hong T., Maish M.S., Cohen J., Fitzpatrick P., Bert A.A., Harper J.S. 3rd, Fang D., Hoffman-Kim D., Hopkins R.A. Reproducible echocardiography in juvenile sheep and its application in the evaluation of a pulmonary valve homograft implant. Contemp Top Lab Anim Sci 2000; 39(5): 20–25.
- Vloumidi E.I., Fthenakis G.C. Ultrasonographic examination of the heart in sheep. Small Ruminant Research 2017; 152: 119–127, https://doi.org/10.1016/j.smallrumres.2016.12.019.
- Poser H., Semplicini L., De Benedictis G.M., Gerardi G., Contiero B., Maschietto N., Valerio E., Milanesi O., Semplicini A., Bernardini D. Two-dimensional, M-mode and Doppler-derived echocardiographic parameters in sedated healthy growing female sheep. Lab Anim 2013; 47(3): 194–202, https://doi.org/10.1177/0023677213486895.
- Boon J.A. Two-dimensional and M-mode echocardiography for the small animal practitioner. Ames, Iowa: John Wiley & Sons Inc; 2017.
- Онкология мелких домашних животных. Под ред. Трофимцова Д.В., Вилковыского И.Ф. М: Издательский дом «Научная библиотека»; 2017.
- Lang R.M., Badano L.P., Mor-Avi V., Afilalo J., Armstrong A., Ernande L., Flachskampf F.A., Foster E., Goldstein S.A., Kuznetsova T., Lancellotti P., Muraru D., Picard M.H., Rietzschel E.R., Rudski L., Spencer K.T., Tsang W., Voigt J.U. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28(1): 1–39.e14, https://doi.org/10.1016/j.echo.2014.10.003.
- Petersen S.E., Khanji M.Y., Plein S., Lancellotti P., Bucciarelli-Ducci C. European Association of Cardiovascular Imaging expert consensus paper: a comprehensive review of cardiovascular magnetic resonance normal values of cardiac chamber size and aortic root in adults and recommendations for grading severity. Eur Heart J Cardiovasc Imaging 2019; 20(12): 1321–1331, https://doi.org/10.1093/ehjci/jez232.
- Vandroux D., Houehanou Y.C., Magne J., Saka D., Sonou A., Amidou S., Houinato D., Preux P.M., Aboyans V., Lacroix P. Normal reference values of cardiac chamber sizes and functional parameters in a beninese community population: the TAHES study. Int J Cardiovasc Imaging 2023; 39(9): 1729–1739, https://doi.org/10.1007/s10554-023-02892-0.
- Ricci F., Aung N., Gallina S., Zemrak F., Fung K., Bisaccia G., Paiva J.M., Khanji M.Y., Mantini C., Palermi S., Lee A.M., Piechnik S.K., Neubauer S., Petersen S.E. Cardiovascular magnetic resonance reference values of mitral and tricuspid annular dimensions: the UK Biobank cohort. J Cardiovasc Magn Reson 2020; 23(1): 5, https://doi.org/10.1186/s12968-020-00688-y.
- Beck L., Mohamed A.A., Strugnell W.E., Bartlett H., Rodriguez V., Hamilton-Craig C., Slaughter R.E. MRI measurements of the thoracic aorta and pulmonary artery. J Med Imaging Radiat Oncol 2018; 62(1): 64–71, https://doi.org/10.1111/1754-9485.12637.
- Matsushima S., Karliova I., Gauer S., Miyahara S., Schäfers H.J. Geometry of cusp and root determines aortic valve function. Indian J Thorac Cardiovasc Surg 2020; 36(Suppl 1): 64–70, https://doi.org/10.1007/s12055-019-00813-2.
- Svedenhag J., Larsson T.P., Lindqvist P., Olsson A., Rythén Alder E. Individual reference values for 2D echocardiographic measurements. The Stockholm — Umeå Study. Clin Physiol Funct Imaging 2015; 35(4): 275–282, https://doi.org/10.1111/cpf.12161.
- Wenzel J.P., Petersen E., Nikorowitsch J., Senftinger J., Sinning C., Theissen M., Petersen J., Reichenspurner H., Girdauskas E. Transthoracic echocardiographic reference values of the aortic root: results from the Hamburg City Health Study. Int J Cardiovasc Imaging 2021; 37(12): 3513–3524, https://doi.org/10.1007/s10554-021-02354-5.
- Jazwiec T., Malinowski M., Proudfoot A.G., Eberhart L., Langholz D., Schubert H., Wodarek J., Timek T.A. Tricuspid valvular dynamics and 3-dimensional geometry in awake and anesthetized sheep. J Thorac Cardiovasc Surg 2018; 156(4): 1503–1511, https://doi.org/10.1016/j.jtcvs.2018.04.065.
- Одинокова С.Н., Николенко В.Н., Комаров Р.Н., Винокуров И.А., Мнацаканян Г.В., Белхароева Р.Х. Корреляции морфометрических параметров структур корня аорты, имеющие практическое значение в хирургической коррекции аортального клапана. Морфологические ведомости 2020; 28(1): 30–36, https://doi.org/10.20340/mv-mn.2020.28(1):30-36.