Разработка аналогов мембран внутреннего уха для экспериментальной оториноларингологии
Цель исследования — разработка и оценка модели мембраны круглого окна (мМКО) внутреннего уха человека, подходящей для репрезентативных исследований прохождения и цитотоксичности лекарственных препаратов.
Биологическая часть исследования. Для изготовления мМКО были протестированы различные варианты подложек, включая 2 варианта коллагеновых мембран Viscoll («ИМТЕК», Россия) и многосоставную мембрану G-Derm (G-DERM, Россия). На мембраны были посажены только эпителиальные клетки линии HaCaT в первом варианте и первичные дермальные фибробласты человека в комплексе с эпителиальными клетками линии HaCaT (последовательное нанесение) во втором варианте. Полученные мМКО оценены по морфологическим критериям при помощи гистохимических методов. В результате тестов было решено остановиться на мМКО, построенных на мембранах Viscoll с включением как первичных фибробластов, так и эпителиальных клеток человека.
Инженерная часть исследования. На полученной мМКО проведена серия научных экспериментов, направленных на исследование проницаемости и отработку режимов электрофизического воздействия на данный биологический барьер с сохранением его морфологической и функциональной целостности, а также обеспечения ускоренного прохождения дексаметазона через нее. Для ускоренного прохождения дексаметазона через мМКО электрофизическая установка инициировала направленный ионофорез отрицательного заряженных молекул дексаметазона параллельно с электропорацией мембран клеток в составе образца. После воздействия проводилась оценка остаточной жизнеспособности мМКО при помощи гистохимической окраски кальцеином и пропидий йодидом. Изменение концентрации дексаметазона после прохождения мМКО оценивали с использованием высокочувствительного хроматографа.
Заключение. В ходе оптимизации протокола получения мМКО и отбора подходящих компонентов подложки и клеточного материала было решено остановиться на модели, построенной на тонкой коллагеновой мембране Viscoll в качестве подложки, а также на первичных дермальных фибробластах человека и эпителиальных клетках линии HaCaT в качестве клеточного материала. Полученные экспериментальные образцы мМКО представляют собой полунепроницаемую мембрану с живыми клетками на поверхности и являются альтернативным аналогом нативной структуры, поскольку воспроизводят ее геометрические и морфофункциональные характеристики.
Помимо этого, продемонстрирован способ применения мМКО для доклинических исследований электрофизических установок, обеспечивающих ускоренное прохождение через нее целевых веществ при помощи электропоративного и ионофоретического воздействия.
Введение
Нарушения слуха и расстройства вестибулярного аппарата, возникающие на фоне негнойной патологии внутреннего уха, представляют собой огромную проблему, так как сильно ухудшают качество жизни человека. Лечение указанных заболеваний всегда включает медикаментозную терапию, где важной и сложной задачей является адресный транспорт лекарственных препаратов к очагу патологического процесса. На решение этой задачи направлены усилия по разработке методов таргетной доставки синтетических глюкокортикоидов и препаратов сосудисто-метаболического ряда через биологические барьеры улитки [1]. Наиболее перспективным методом доставки препаратов через биологические мембраны среднего уха является использование генераторов электрического поля, которые вызывают фоноэлектрофоретический, электропоративный и ионофоретический эффекты. Такой подход снижает процент оперативных вмешательств и риск инвалидизации пациентов, так как хирургические методы, как правило, сопровождаются высокими рисками потери слуха [2–4].
При внедрении описанных методик в клиническую практику возникает серьезная проблема — трудность преодоления биологических барьеров (мембран) для создания необходимой терапевтической концентрации в очаге поражения. Известно, что медикаментозно можно воздействовать на функцию внутреннего уха, но ввести туда лекарственный препарат очень сложно [5]. Мембранные образования внутреннего уха препятствуют проникновению лекарств внутрь, что обусловлено их барьерной функцией, необходимой для защиты такого тонкого аппарата, как система слухового анализатора. Для безопасного преодоления биологических барьеров необходимы эксперименты по определению основных электрофизических параметров воздействия на мембрану круглого окна (МКО) улитки и на морфологические структуры капилляров сосудистой полоски улитки для активного транспорта лекарственного препарата. Есть два основных подхода к испытаниям разрабатываемых методик: использование модельных лабораторных животных и использование модельных систем. Различные способы моделирования и их комбинирование с целью уменьшения использования в доклинических исследованиях животных уже нашли свое применение в испытании новых лекарственных средств [6–8].
Критически важным для использования такой технологии является возможность создавать модели тканей, которые точно воспроизводят микроанатомию нативной ткани.
Мембранные образования внутреннего уха (овальное окно преддверия и круглое окно улитки) относятся к естественным пограничным отверстиям в капсуле лабиринта височной кости. Опосредованно, через мембраны этих двух окон, перилимфа внутреннего уха контактирует со средним ухом. Анатомически ниша круглого окна улитки открывается в барабанную лестницу основного завитка улитки. Размеры ниши круглого окна очень вариабельны. По данным разных авторов, стенки ниши образуют призму размерами 1,50–2,75×1,0–2,72 мм, глубиной 0,65–2,12 мм и площадью 2,0–3,32 мм2 [9–15]. МКО служит барьером между полостью среднего уха и улиткой и играет важную роль в механике среднего уха и улитки как в норме, так и при патологии [16–19]. МКО считается основным путем проникновения потенциально фототоксичных веществ из полости среднего уха во внутреннее ухо. Кроме того, МКО может участвовать в секреции и абсорбции веществ [20, 21]. Эксперименты на животных показывают, что МКО ведет себя как полупроницаемая мембрана. Было показано, что многие вещества как с низкой, так и с высокой молекулярной массой проникают через МКО при помещении их в нишу круглого окна [9]. Вещества, помещенные на МКО, способны проходить через цитоплазму в виде пиноцитозных везикул или через разные каналы между клетками в эпителии. В слое соединительной ткани клетки могут фагоцитировать вещество и перемещать его в перилимфу и/или проникать в кровеносные или лимфатические сосуды в этом слое [22]. Теоретически, после того как вещество достигнет перилимфы, оно будет направляться в спинномозговую жидкость через улитковый акведук до барабанной лестницы или попадет в эндолимфу.
Ранее уже были изучены точность и надежность моделей проницаемости МКО in vitro. Традиционно такими моделями служили изолированные участки улитки уха с круглым окном некоторых модельных животных: МКО монгольской песчанки, морской свинки, шиншиллы, овцы и др. [23–26]. Еще один интересный пример моделирования формы МКО был описан в работе японских ученых [27]. Форму МКО у человека трудно исследовать из-за ее расположения глубоко в углублении (круглая оконная ниша). Тем не менее ученым удавалось получить препарат МКО вместе с участком прилегающих костей черепа. Помимо этого для лучшего понимания структуры и свойств МКО при помощи лазерной сканирующей микроскопии получена ее трехмерная цифровая модель.
У человека и большинства животных МКО состоит из трех слоев: наружного эпителия, обращенного к среднему уху; слоя соединительной ткани; внутреннего эпителия, примыкающего к внутреннему уху [28]. Слой соединительной ткани содержит коллагеновые волокна, а также другие эластические волокна и фибробласты. Все это обеспечивает основную структурную поддержку мембраны. МКО имеет утолщения по краям и более тонкую область ближе к центру. Эта разница толщины создает небольшую выпуклость в направлении барабанной лестницы [10]. Средняя толщина МКО человека составляет примерно 70 мкм [28].
Для воссоздания живого эпителиального барьера МКО идеальным вариантом было бы культивирование на поверхности мембраны клеток эпителия среднего уха человека в сочетании с фибробластами. Роль разных популяций фибробластов в поддержании функции и структуры коллагена и эпителия была нами изучена ранее [29]. Однако для получения культуры клеток мембранных образований среднего уха исследователям требуется постоянный доступ к донорскому человеческому материалу ввиду того, что первичные культуры человеческих эпителиальных клеток имеют ограниченное количество генераций при культивировании in vitro. В случае, если задачей работы является наработка партий образцов моделей мембраны круглого окна (мМКО), возникает необходимость подобрать такой вариант эпителиального клеточного компонента, который был бы не только морфологически близким к оригиналу, но и легкодоступным, не слишком дорогим и простым в выращивании.
Цель исследования — разработка и оценка модели мембраны круглого окна внутреннего уха человека, подходящей для репрезентативных исследований прохождения и цитотоксичности лекарственных препаратов.
Материалы и методы
Формирование мМКО. На подложки из коллагена Viscoll («ИМТЕК», Россия) (образцы 1 и 2) и комбинации коллагена высокой плотности и гиалуроновой кислоты G-Derm (G-DERM, Россия) наносили клетки линии HaCaT (по 100 000 на 1 см2) и культивировали в условиях 5% CO2 в среде DMEM/F12 («ПанЭко», Россия) с 10% FBS, глутамином (Gibco, США) и нормоцином (InvivoGen, США). Замену среды осуществляли каждые 3 дня. Через 10 сут культивирования клетки на поверхности подложки достигали монослоя и мМКО считали сформированной.
Приготовление гистологических препаратов мМКО. Для иммуноокрашивания мМКО через 10 дней с момента посадки эпидермальных клеток трижды отмывали от среды раствором фосфатно-солевого буфера (PBS) («ПанЭко», Россия), далее фиксировали при помощи 4% параформальдегида (Sigma, США) в течение 30 мин при комнатной температуре. После фиксации мМКО трижды промывали PBS («ПанЭКо», Россия) по 5 мин и затем проводили через 15 и 30% растворы сахарозы (Helicon, Россия). Далее мМКО погружали в коммерческую среду для замораживания тканей Tissue-Tek O.C.T. Compound (Sakura Finetek, Япония) и замораживали в жидком азоте. Криосрезы мМКО толщиной 7 мкм изготавливали на криостате Leica CM1900 (Leica Microsystems, Германия). После высушивания в течение 1 ч на срезы наносили раствор гематоксилина Майера (BioVitrum, Россия) (инкубация в течение 10 мин), а после промывки проточной водой — эозин («БиоВитрум», Россия) (инкубация 30 с). После промывки дистиллятом срезы заключали в биомаунт (Bio Optica, Италия). Препараты визуализировали на инвертированном флуоресцентном микроскопе Olympus IX73 с камерой Olympus DP74 (Olympus, Япония). Изображения обрабатывали в программе ImageJ (https://imagej.net/).
Формирование финальной мМКО и оценка проницаемости разных вариантов модели для дексаметазона. На перевернутые мембранные вставки с порами мембраны 0,4 мкм, находящиеся в лунках 24-луночного планшета (SPL, Китай), во всех случаях были помещены коллагеновые мембраны. На поверхность этих мембран наносили клетки линии HaCaT — по 100 000 клеток на вставку в 100 мкл среды; в варианте с промежуточным слоем фибробластов сначала на поверхность мембраны наносили фибробласты человека — по 50 000 клеток на вставку в 100 мкл среды, а через 2 ч среду удаляли и наносили клетки линии HaСaТ по 100 000 клеток в 100 мкл среды. В варианте мМКО с фибробластами на дне лунок 24-луночного планшета дополнительно помещали по 50 000 фибробластов человека в 200 мкл среды. На следующие сутки в лунки со вставками наливали по 1 мл среды. Состав среды соответствовал среде, описанной выше (см. «Формирование мМКО»). Замену среды осуществляли каждые 3 дня. Через неделю с момента начала эксперимента вставки с образцами мМКО, не отделяя мембраны от дна вставки, изымали из системы культивирования в 24-луночных планшетах и перемещали на 96-луночные планшеты для исследования проницаемости мембран. Для этого нижние лунки 96-луночного планшета заполняли PBS — по 300 мкл на лунку, так, чтобы жидкость касалась мембраны, размещенной на поверхности лунок. Сверху каждой такой лунки помещали вставку с мМКО таким образом, чтобы образец соприкасался с жидкостью в лунке 96-луночного планшета. После разведения раствора дексаметазона для инъекций («Эллара», Россия) с концентрацией 4 мг/мл в PBS 1:1 полученный раствор заливали во вставки по 300 мкл на вставку с мМКО, обеспечивая пассивную диффузию через мМКО, прижимали вставки к плато крышкой от плато и оставляли на 1 ч в инкубаторе. Через 1 ч из нижних лунок раствор отбирали и определяли относительную концентрацию дексаметазона. После получения числовых значений с трех повторов эксперимента рассчитывали среднее арифметическое и стандартное отклонение среднего. Оценку значимости проводили при сравнении выборок значений остаточной относительной концентрации дексаметазона в экспериментальных группах и в двух контролях (контроль без воздействия как электрофизической установки, так и дексаметазона и контроль воздействия дексаметазона без установки).
Проведение эксперимента по ускорению прохождения дексаметазона через мМКО. Через 10 сут после посева фибробластов и кератиноцитов мМКО подвергали воздействию электрического тока в экспериментальной электрофизической установке, разработанной в Институте электрофизики и электроэнергетики РАН [30], которая обеспечивает сквозной ионофорез и электропорацию мМКО. Сила постоянного тока в первой группе экспериментов составляла 1,0–1,3 мА, во второй — 0,5 мА. Сила импульсного тока во всех экспериментах, где применялась электропорация, составляла 400 мА. Частота импульсного тока в зависимости от эксперимента варьировала от 1 Гц до 10 кГц (указано далее для каждого эксперимента, где был задействован импульсный ток). Сразу после воздействия мМКО возвращали в культуральную среду и вновь помещали в условия СО2-инкубатора.
Оценка выживаемости клеток в составе мМКО после работы установки в режиме ионофореза, электропорации или их совместного воздействия на образец. Контрольные образцы мМКО на разных типах подложек и экспериментальные образцы мМКО на базе G-Derm через 20 ч после обработки исследовали на жизнеспособность при помощи флуоресцентных красителей. Для этого в лунки с культивируемыми образцами вносили краситель кальцеин АМ (Servicebio, Китай) (зеленое окрашивание живых клеток) в концентрации 1:2000 и пропидий йодид (Invitrogen, США) (красное окрашивание ядер в погибающих клетках) в концентрации 1:3000. Окрашивание проводили в течение 1 ч, после чего среду заменяли на свежую, а мембраны визуализировали и делали фотографии на инвертированном флуоресцентном микроскопе Olympus IX73 с камерой Olympus DP74 (Olympus, Япония).
Процент живых и мертвых клеток был подсчитан при помощи программы Image J в ручном режиме (плагин Cell counter notice). После получения числовых значений с тремя повторами эксперимента рассчитывали среднее арифметическое и стандартное отклонение среднего. Оценку активности кальцеина проводили при помощи анализа интенсивности зеленого света в поле зрения.
Определение количества дексаметазона, прошедшего через мМКО. Для определения количества дексаметазона, прошедшего через экспериментальные образцы мембран, использовали высокоточный метод высокоэффективной жидкостной хроматографии. Проводили анализ проб, полученных после прохождения через разные варианты мМКО и через коллагеновые мембраны без клеток и без разбавления на жидкостном хроматографе Agilent 1100 (Agilent Technologies, США), используя аналитическую колонку Thermo GOLD C18 (150,0×4,6 мм, 5 мкм; Thermo Fisher Scientific, США) с элюентом состава 35/65 ацетонитрил/вода (HPLC grade), с расходом 1 мл/мин. Температура термостата была установлена на 25°С, длина волны УФ-детектора — на 240 нм. Пробы вводили шприцем объемом 5 мкл (Hamilton). Объем вводимой в хроматограф пробы — 1 мкл. По полученным на хроматограммах площадям сигнала дексаметазона проводили предварительную оценку проницаемости мембраны при пассивной диффузии, сравнивая эти площади с площадью сигнала дексаметазона в исходном растворе.
Статистическая обработка данных. Принадлежность всех выборок к нормальному распределению проверяли при помощи теста Шапиро–Уилка в программе Jamovi (v. 2.3.28). Результаты со значениями p>0,05 подтверждали нулевую гипотезу о нормальности распределения. Статистическую значимость различий в значениях концентраций дексаметазона в растворах, а также в значениях измеренной активности кальцеина в поле зрения и количества пропидий йодид-позитивных клеток определяли с помощью однофакторного дисперсионного анализа (ANOVA) в программе Statistica 10.0 (StatSoft, США). Результаты со значениями p<0,05 считались статистически значимо отличающимися от нулевой гипотезы. Доверительные интервалы на всех графиках были построены на основе значений стандартного отклонения от среднего арифметического в выборках.
Результаты и обсуждение
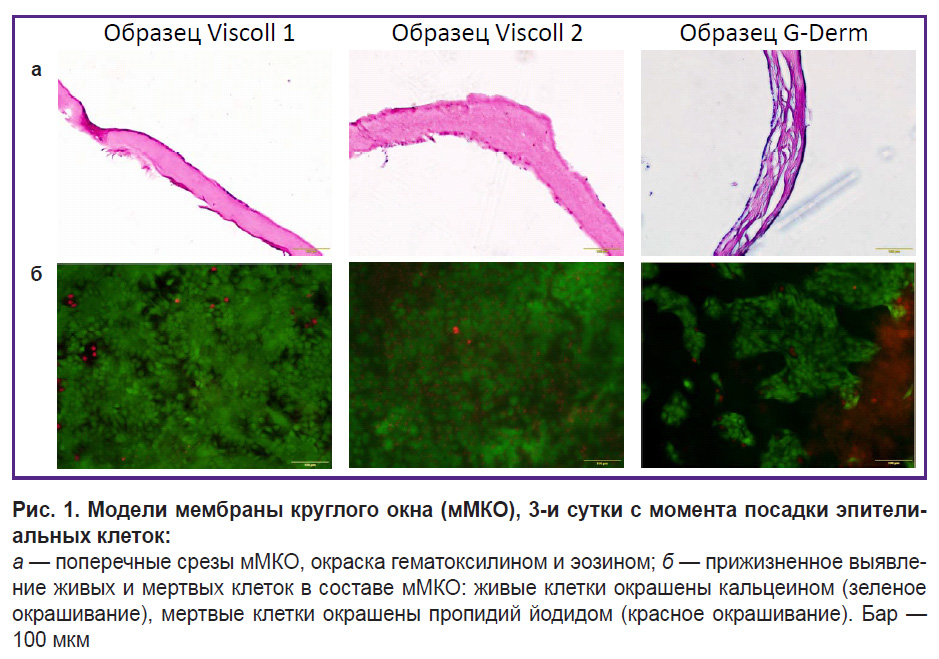
Выбор подложки для мМКО. В основе разрабатываемой модели лежит воссоздание основных компонентов МКО человека: тонкой коллагеновой мембраны и живых эпителиальных клеток, способных образовывать на ее поверхности равномерный монослой. Были выбраны и протестированы на цитотоксичность и адгезивность три биополимерные подложки отечественного производства: две коллагеновые мембраны Viscoll, созданные из коллагена высокой плотности, и биополимерная пластина, состоящая из гиалуроновой кислоты и коллагена G-Derm (рис. 1). Мы протестировали все мембраны в культурах иммортализованных клеток человека линии HaCaT. Выявлено, что данная клеточная линия хорошо адгезирует к образцам и образует на них относительно плотный слой, однако конфлюентный монослой формировался только на мембранах Viscoll (рис. 1, б).
У образцов из коллагена Viscoll структура на срезе выглядит более однородно, у образца G-Derm структура содержит большое количество слоев, полостей и неровностей (рис. 1, а). Есть вероятность, что такая рыхлая слоистая структура мембраны будет обладать повышенной проницаемостью для дексаметазона, и это может искажать данные экспериментов на следующих этапах исследования. Тест жизнеспособности эпидермальных клеток, посаженных на мембраны, который основан на окраске витальными красителями — пропидий йодидом и кальцеином, продемонстрировал высокую жизнеспособность клеточного компонента в составе мМКО во всех экспериментальных группах (см. рис. 1, б). Помимо этого выявлено, что у всех тестируемых образцов толщина на срезе не превышает 200 мкм и сопоставима с толщиной МКО человека. Таким образом, было принято решение в качестве матрицы-основы использовать коллагеновые мембраны Viscoll, поскольку морфология и плотность пучков коллагеновых волокон у данного типа носителя похожа на таковые у МКО кошки, морской свинки и овцы, которые были описаны в литературе [21, 26]. Известно, что в составе соединительной ткани круглого окна внутреннего уха человека присутствуют фибробласты, которые могут являться неучтенным фактором в оценке проницаемости круглого окна для целевого вещества — дексаметазона [10]. Поскольку, согласно литературным данным, разные популяции фибробластов по-разному влияют как на состояние коллагенового матрикса, так и на более высокие показатели выживаемости эпителиальных клеток, было решено подготовить несколько вариантов мМКО на основе тотальной фракции фибробластов с разными вариантами эпителиомезенхимного взаимодействия двух типов клеток [29, 31, 32].
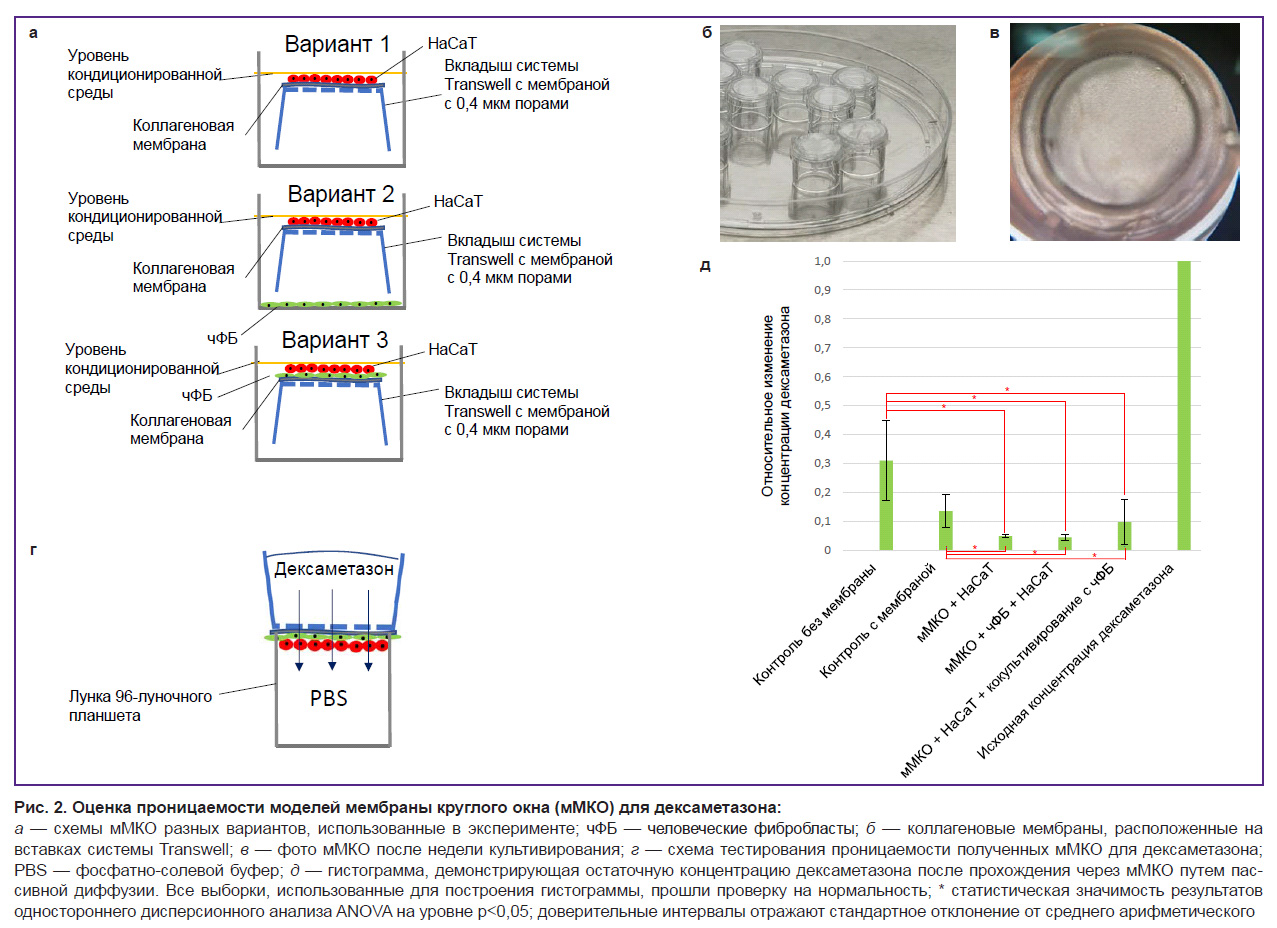
Оценка пассивной проницаемости разных мМКО для дексаметазона. Для оценки проницаемости дексаметазона было сформировано 3 варианта мМКО в системе с мембранными вставками (рис. 2, а). После того, как на мембранах сформировался клеточный слой (рис. 2, в), мМКО считали завершенными и приступали к эксперименту по диффузии раствора дексаметазона в концентрации 2 мг/мл по методу, описанному в главе «Материалы и методы» (рис. 2, г). После сбора и анализа проб было выявлено, что все варианты мМКО являются полупроницаемыми для дексаметазона, однако выполняют барьерную функцию и пропускают лишь часть вещества: дексаметазон был обнаружен во всех пробах, при этом его концентрация значительно снижалась. Результирующая концентрация дексаметазона составила 13,5% в модели с одной коллагеновой мембраной без клеточного материала; 5,0% в мМКО с использованием только эпителиальных клеток; 4,5% в мМКО с использованием человеческих фибробластов (чФБ) и эпителиальных клеток; 9,7% в мМКО с эпителиальными клетками при кокультивировании с чФБ (рис. 2, д). Таким образом, результирующая концентрация дексаметазона после прохождения через мМКО разных типов уменьшалась в 10–20 раз относительно исходной. Согласно литературным данным, подобные тесты не проводили на аналогичных моделях круглого окна среднего уха человека. В связи с этим мы сравнили результаты измерений пассивной диффузии дексаметазона в концентрации 20 мг/мл через наши мМКО и МКО, извлеченные из уха морских свинок [33]. Через 60 мин после введения дексаметазона скорость диффузии в нашей модели была как минимум в 10 раз выше и наиболее близка в варианте мМКО с чФб и HaCaT. Разница в скорости пассивной диффузии может быть обусловлена различиями во внеклеточном матриксе в составе мембраны.
Обобщая полученные данные, можно сделать вывод, что эпителиальный слой, формируемый клетками линии HaCaT, обеспечивает достоверное снижение проницаемости коллагеновой мембраны. Внесение в систему дополнительного клеточного типа очень незначительно усиливает эти свойства. Влияние фибробластов на выживаемость эпителиального слоя после электрофизического воздействия необходимо дополнительно исследовать в дальнейшем.
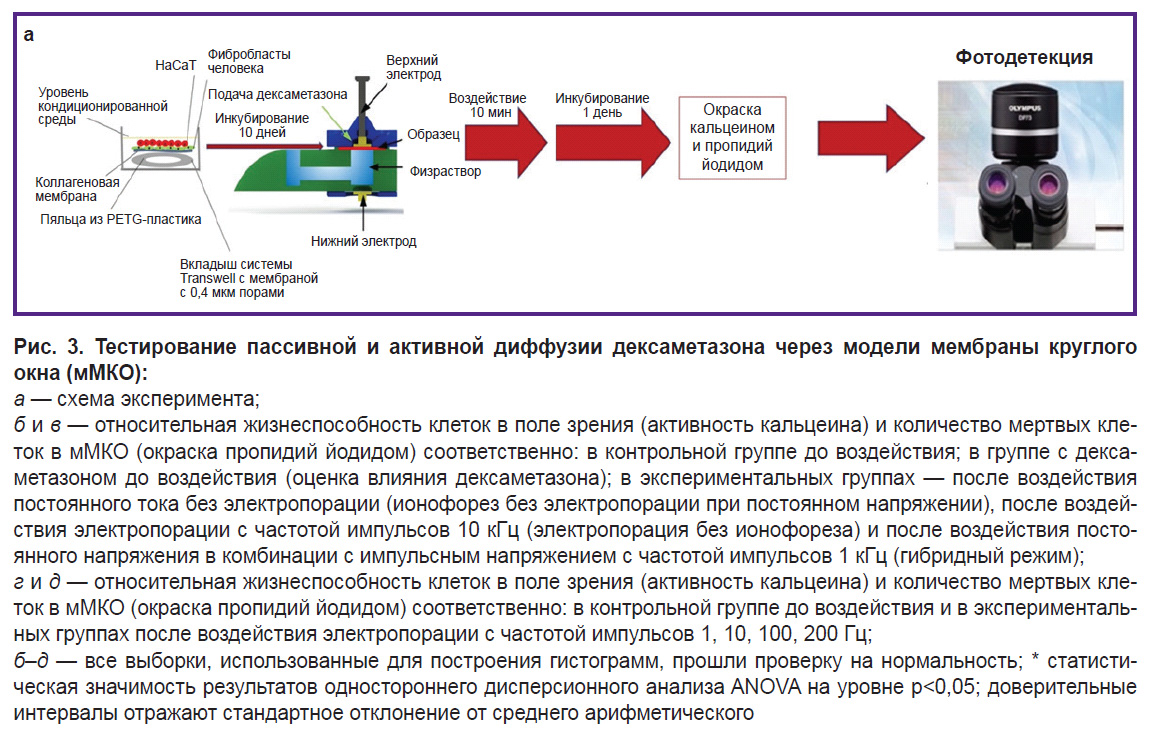
На следующем этапе работы созданные мМКО были использованы для контрольных испытаний экспериментальной электрофизической установки [30] (рис. 3, а), целью создания которой было ускорение процесса прохождения дексаметазона через мембрану, являющуюся моделью круглого окна внутреннего уха.
В ходе тестирования экспериментальной установки в разных режимах удалось определить, что режим работы установки с использованием только постоянного тока и только импульсного тока с частотой 10 кГц сильно снижает жизнеспособность клеток относительно контроля. Однако при комбинации постоянного тока и импульсного тока с частотой 1 кГц жизнеспособность клеточного материала падает не столь значительно — примерно в 2 раза в центре мембраны (в участке непосредственного контакта мембраны с электродом) и на треть на периферии (в области, где не было контакта). Кроме того, в ходе оценки цитотоксичности чистого дексаметазона без воздействия установки было определено, что значения жизнеспособности статистически близки к группе с комбинированным воздействием, где использовали более низкий ток (рис. 3, б). Стоит отметить, что количество мертвых клеток достаточно велико во всех режимах работы установки и превосходит группу контроля в 10 раз. Разница между группами «ионофорез без электропорации», «электропорация 10 кГц без ионофореза» и «1 кГц» статистически незначима. Количество мертвых клеток в группах оценки действия дексаметазона и контроля не различается (рис. 3, в).
В ходе тестирования комбинированного режима работы установки с активными электропорацией и ионофорезом и с меньшей частотой импульсного тока (в пределах от 1 до 10 Гц) жизнеспособность клеток падает незначительно, при этом достоверной разницы в количестве мертвых клеток между этими двумя группами не наблюдается (рис. 3, г, д). В то же время большая частота импульсного тока (более 100 Гц) приводит к значительному снижению жизнеспособности клеток и статистически значимому относительно контроля повышению количества мертвых клеток (до 2,5 раза относительно контроля) (см. рис. 3, г, д). Это может быть связано с нарушением осмотического давления клеток и сильным нагревом образца при более высокой частоте импульсов. Большая жизнеспособность мМКО после воздействия может быть связана с более низким током (1 и 10 Гц). В ходе длительного культивирования мМКО после воздействия установки с частотой импульсного тока 1 и 10 Гц вокруг мембран на поверхности дна 6-луночных культуральных планшетов, в которых культивировали мМКО, были обнаружены колонии кератиноцитов и фибробластов. Это косвенно подтверждает хорошую остаточную жизнеспособность клеток в мМКО и их миграционный и пролиферативный потенциал после воздействия установки на этих режимах.
Заключение
В ходе данного исследования удалось создать репрезентативную по своим физическим параметрам мМКО внутреннего уха человека, а также разработать методику оценки жизнеспособности клеточного материала в составе модели после воздействия исследуемого фактора. Это особенно актуально в свете того, что достоверная оценка жизнеспособности нативной МКО практически невозможна ввиду проблем с ее извлечением в неповрежденном состоянии. Разработанная модель может быть использована для тестирования новых методов доставки лекарственных препаратов в эндолимфу и перилимфу внутреннего уха. В частности, в данной работе было показано, что мМКО демонстрирует удовлетворительную проницаемость для целевого вещества — дексаметазона в условиях пассивной диффузии. Были также определены оптимальные в рамках сохранения жизнеспособности параметры работы ранее разработанной установки (частота импульсного тока), обеспечивающей ускоренное прохождение дексаметазона через мМКО при помощи ионофореза и электропорации. Данная модель, включающая фибробласты и кератиноциты человека на плотном полупроницаемом коллагеновом матриксе, может быть использована в дальнейшем в фундаментальных исследованиях и в качестве тест-системы для фармацевтических разработок, поскольку способствует сохранению нативных взаимодействий между эпителиальной и мезенхимной клеточными фракциями, а также стимулирует нормализацию матрикса посредством включенных в состав клеток.
Финансирование исследования. Работа поддержана Московским центром инновационных технологий в здравоохранении (договор №2012-1/22-2НИР). В части изучения эпителиомезенхимных взаимодействий в тканевых эквивалентах и роли фибробластов в морфогенезе эпителиев работа поддержана грантом Российского научного фонда (проект №21-74-30015).
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Соснов А.В., Иванов Р.В., Балакин К.В., Шоболов Д.Л., Федотов Ю.А., Калмыков Ю.М. Разработка систем доставки лекарственных средств с применением микро- и наночастиц. Качественная клиническая практика 2008; 2: 4–12.
- Kalia Y.N., Naik A., Garrison J., Guy R.H. Iontophoretic drug delivery. Adv Drug Deliv Rev 2004; 56(5): 619–658, https://doi.org/10.1016/j.addr.2003.10.026.
- Guy R.H., Kalia Y.N., Delgado-Charro M.B., Merino V., López A., Marro D. Iontophoresis: electrorepulsion and electroosmosis. J Control Release 2000; 64(1–3): 129–132, https://doi.org/10.1016/s0168-3659(99)00132-7.
- Kalaria D.R., Singhal M., Patravale V., Merino V., Kalia Y.N. Simultaneous controlled iontophoretic delivery of pramipexole and rasagiline in vitro and in vivo: transdermal polypharmacy to treat Parkinson’s disease. Eur J Pharm Biopharm 2018; 127: 204–212, https://doi.org/10.1016/j.ejpb.2018.02.031.
- Adunka O., Unkelbach M.H., Mack M., Hambek M., Gstoettner W., Kiefer J. Cochlear implantation via the round window membrane minimizes trauma to cochlear structures: a histologically controlled insertion study. Acta Otolaryngol 2004; 124(7): 807–812, https://doi.org/10.1080/00016480410018179.
- Brightman F.A., Leahy D.E., Searle G.E., Thomas S. Application of a generic physiologically based pharmacokinetic model to the estimation of xenobiotic levels in human plasma. Drug Metab Dispos 2006; 34(1): 94–101, https://doi.org/10.1124/dmd.105.004838.
- Jones H.M., Gardner I.B., Collard W.T., Stanley P.J., Oxley P., Hosea N.A., Plowchalk D., Gernhardt S., Lin J., Dickins M., Rahavendran S.R., Jones B.C., Watson K.J., Pertinez H., Kumar V., Cole S. Simulation of human intravenous and oral pharmacokinetics of 21 diverse compounds using physiologically based pharmacokinetic modelling. Clin Pharmacokinet 2011; 50(5): 331–347, https://doi.org/10.2165/11539680-000000000-00000.
- De Buck S.S., Sinha V.K., Fenu L.A., Nijsen M.J., Mackie C.E., Gilissen R.A. Prediction of human pharmacokinetics using physiologically based modeling: a retrospective analysis of 26 clinically tested drugs. Drug Metab Dispos 2007; 35(10): 1766–1780, https://doi.org/10.1124/dmd.107.015644.
- Goycoolea M.V. Clinical aspects of round window membrane permeability under normal and pathological conditions. Acta Otolaryngol 2001; 121(4): 437–447, https://doi.org/10.1080/000164801300366552.
- Carpenter A.M., Muchow D., Goycoolea M.V. Ultrastructural studies of the human round window membrane. Arch Otolaryngol Head Neck Surg 1989; 115(5): 585–590, https://doi.org/10.1001/archotol.1989.01860290043012.
- Camelliti P., Borg T.K., Kohl P. Structural and functional characterisation of cardiac fibroblasts. Cardiovasc Res 2005; 65(1): 40–51, https://doi.org/10.1016/j.cardiores.2004.08.020.
- Camelliti P., Green C.R., LeGrice I., Kohl P. Fibroblast network in rabbit sinoatrial node: structural and functional identification of homogeneous and heterogeneous cell coupling. Circ Res 2004; 94(6): 828–835, https://doi.org/10.1161/01.RES.0000122382.19400.14.
- Baudino T.A., Carver W., Giles W., Borg T.K. Cardiac fibroblasts: friend or foe? Am J Physiol Heart Circ Physiol 2006; 291(3): H1015–H1026, https://doi.org/10.1152/ajpheart.00023.2006.
- Gabbiani G. The cellular derivation and the life span of the myofibroblast. Pathol Res Pract 1996; 192(7): 708–711, https://doi.org/10.1016/S0344-0338(96)80092-6.
- Hinz B., Phan S.H., Thannickal V.J., Galli A., Bochaton-Piallat M.L., Gabbiani G. The myofibroblast: one function, multiple origins. Am J Pathol 2007; 170(6): 1807–1816, https://doi.org/10.2353/ajpath.2007.070112.
- Georges P.C., Hui J.J., Gombos Z., McCormick M.E., Wang A.Y., Uemura M., Mick R., Janmey P.A., Furth E.E., Wells R.G. Increased stiffness of the rat liver precedes matrix deposition: implications for fibrosis. Am J Physiol Gastrointest Liver Physiol 2007; 293(6): G1147–G1154, https://doi.org/10.1152/ajpgi.00032.2007.
- Humphrey J.D., Dufresne E.R., Schwartz M.A. Mechanotransduction and extracellular matrix homeostasis. Nat Rev Mol Cell Biol 2014; 15(12): 802–812, https://doi.org/10.1038/nrm3896.
- Wang Q., Chiang E.T., Lim M., Lai J., Rogers R., Janmey P.A., Shepro D., Doerschuk C.M. Changes in the biomechanical properties of neutrophils and endothelial cells during adhesion. Blood 2001; 97(3): 660–668, https://doi.org/10.1182/blood.v97.3.660.
- Leung L.Y., Tian D., Brangwynne C.P., Weitz D.A., Tschumperlin D.J. A new microrheometric approach reveals individual and cooperative roles for TGF-beta1 and IL-1beta in fibroblast-mediated stiffening of collagen gels. FASEB J 2007; 21(9): 2064–2073, https://doi.org/10.1096/fj.06-7510com.
- Richardson T.L., Ishiyama E., Keels E.W. Submicroscopic studies of the round window membrane. Acta Otolaryngol 1971; 71(1): 9–21, https://doi.org/10.3109/00016487109125327.
- Miriszlai E., Benedeczky I., Csapó S., Bodánszky H. The ultrastructure of the round window membrane of the cat. ORL J Otorhinolaryngol Relat Spec 1978; 40(2): 111–119, https://doi.org/10.1159/000275393.
- Mao-li D., Zhi-qiang C. Permeability of round window membrane and its role for drug delivery: our own findings and literature review. Journal of Otology 2009; 4(1): 34–43, https://doi.org/10.1016/S1672-2930(09)50006-2.
- Lundman L.A., Holmquist L., Bagger-Sjöbäck D. Round window membrane permeability. An in vitro model. Acta Otolaryngol 1987; 104(5–6): 472–480, https://doi.org/10.3109/00016488709128277.
- Gan R.Z., Nakmali D., Zhang X. Dynamic properties of round window membrane in guinea pig otitis media model measured with electromagnetic stimulation. Hear Res 2013; 301: 125–136, https://doi.org/10.1016/j.heares.2013.01.001.
- Keskin Yılmaz N., Albasan H., Börkü M.K., Paparella M.M., Cüreoğlu S. Three-dimensional analysis of round window membrane in the chinchilla model with acute otitis media induced with streptococcus pneumoniae 7F. Turk Arch Otorhinolaryngol 2021; 59(1): 43–48, https://doi.org/10.4274/tao.2021.5998.
- Han S., Suzuki-Kerr H., Suwantika M., Telang R.S., Gerneke D.A., Anekal P.V., Bird P., Vlajkovic S.M., Thorne P.R. Characterization of the sheep round window membrane. J Assoc Res Otolaryngol 2021; 22(1): 1–17, https://doi.org/10.1007/s10162-020-00778-9.
- Nomura Y., Tanaka T., Kobayashi H., Kimura Y., Soejima Y., Sawabe M. A 3-dimensional model of the human round window membrane. Ann Otol Rhinol Laryngol 2019; 128(6_suppl): 103S–110S, https://doi.org/10.1177/0003489419833406.
- Goycoolea M.V., Lundman L. Round window membrane. Structure function and permeability: a review. Microsc Res Tech 1997; 36(3): 201–211, https://doi.org/10.1002/(SICI)1097-0029(19970201)36:3<201::AID-JEMT8>3.0.CO;2-R.
- Роговая О.С., Зупник А.О., Измайлова Л.Ш., Воротеляк Е.А. Морфофункциональная характеристика фибробластов папиллярного и ретикулярного слоев дермы кожи человека. Вестник Московского университета. Серия 16. Биология 2021; 76(4): 250–257.
- Воеводин В.В., Воротеляк Е.А., Крюков А.И., Кунельская Н.Л., Мищенко В.В., Небогаткин С.В., Роговая О.С., Романов К.И., Рябинин А.А., Хомич В.Ю., Шершунова Е.А. Использование электрофизической установки для импульсного воздействия на биологические мембраны и оценка их жизнеспособности. Прикладная физика 2024; 2: 1.
- Boehnke K., Mirancea N., Pavesio A., Fusenig N.E., Boukamp P., Stark H.J. Effects of fibroblasts and microenvironment on epidermal regeneration and tissue function in long-term skin equivalents. Eur J Cell Biol 2007; 86(11–12): 731–746, https://doi.org/10.1016/j.ejcb.2006.12.005.
- Rogovaya O.S., Abolin D.S., Cherkashina O.L., Smyslov A.D., Vorotelyak E.A., Kalabusheva E.P. In vitro and in vivo evaluation of antifibrotic properties of verteporfin in a composition of a collagen scaffold. Biochemistry (Mosc) 2024; 89(5): 942–957, https://doi.org/10.1134/S0006297924050146.
- Sun J.J., Liu Y., Kong W.J., Jiang P., Jiang W. In vitro permeability of round window membrane to transforming dexamethasone with delivery vehicles — a dosage estimation. Chin Med J (Engl) 2007; 120(24): 2284–2289.