Эффективность машинного обучения в прогнозировании обструктивного поражения коронарных артерий в первые часы госпитализации при остром коронарном синдроме без подъема сегмента ST
Цель исследования — оценка точности прогностических моделей обструктивного поражения коронарных артерий (ОПКА) при остром коронарном синдроме без подъема сегмента ST (ОКСбпST), разработанных в первые часы госпитализации больных.
Материалы и методы. В исследование включено 610 пациентов с ОКСбпST невысокого риска с медианой возраста 62 года, которые по результатам инвазивной коронарографии были разделены на 2 группы: первая — 363 больных (59,5%) с ОПКА (сужение просвета коронарной артерии ≥50%), вторая — 247 больных (40,5%) без коронарной обструкции (<50%). Клинико-функциональный статус пациентов оценивали по 62 параметрам, доступным на ранних сроках госпитализации и включающим клинико-демографические, антропометрические, лабораторные, электрокардиографические и эхокардиографические данные.
Для разработки прогностических моделей ОПКА использовали методы машинного обучения: многофакторную логистическую регрессию, случайный лес и стохастический градиентный бустинг (СГБ). Модели содержали наборы предикторов, выделенных при первичном врачебном осмотре в стационаре (первый сценарий прогноза), через 1 ч наблюдения (второй сценарий) и спустя 3 ч (третий сценарий). Качество моделей оценивали по шести метрикам. Степень влияния отдельных предикторов на конечную точку исследования определяли методом аддитивного объяснения Шепли (SHAP). Стратификация вероятности ОПКА выполнялась с выделением категорий низкого, среднего, высокого и очень высокого риска.
Результаты. На основе методов машинного обучения были разработаны прогностические модели ОПКА, среди которых лучшие метрики качества демонстрировали модели СГБ с наборами предикторов, соответствующих трем сценариям прогноза (площадь под ROC-кривой: 0,846; 0,887 и 0,949 соответственно). Методом SHAP выделены факторы с доминирующим влиянием на ОПКА, к которым относились антропометрические индикаторы (окружность талии, бедер и их отношение) — при первом и втором сценариях прогноза и глобальная продольная систолическая деформация левого желудочка — при третьем. На основе данных моделей СГБ выделены категории низкого, среднего, высокого и очень высокого риска ОПКА, цифровые диапазоны которых зависели от сценариев прогноза.
Заключение. Прогностические модели ОПКА, разработанные на основе СГБ, позволяют с высокой точностью оценить степень поражения коронарного русла у больных ОКСбпST в первые часы госпитализации. Наибольшую точность прогноза ОПКА демонстрировали модели третьего сценария, структура которых помимо анамнестических, антропометрических и ЭКГ-данных включала клинико-биохимические показатели крови и эхокардиографические индикаторы. Таким образом, стратификация риска ОПКА с помощью данных моделей может быть полезным инструментом при выборе оптимальной стратегии реваскуляризации миокарда.
Введение
Ишемическая болезнь сердца (ИБС) занимает ведущее место в структуре сердечно-сосудистых заболеваний (ССЗ) в большинстве стран мира. В половине случаев ИБС дебютирует острым коронарным синдромом (ОКС), который является наиболее частым поводом для экстренной госпитализации больных. ОКС без подъема сегмента ST (ОКСбпST) встречается значительно чаще, чем ОКС с подъемом сегмента ST, а его развитие ассоциируется с более широким спектром патофизиологических механизмов [1]. Помимо неполной окклюзии эпикардиальных артерий к причинам ОКСбпST относят спазм или спонтанную диссекцию коронарных артерий, миокардиальные мышечные мостики, микрососудистый спазм, синдром такоцубо и др. [2].
В последние годы по результатам инвазивной коронарной ангиографии (КАГ) все чаще фиксируются случаи необструктивного поражения коронарных артерий (НПКА), которые имеют место у 25% больных с ОКСбпST [3]. В Российской Федерации при ежегодном увеличении использования КАГ примерно у 50% пациентов данная процедура не завершается реваскуляризацией миокарда, в большинстве случаев из-за отсутствия обструктивного поражения коронарных артерий (ОПКА). В связи с этим все активней обсуждаются вопросы, связанные с оценкой целесообразности применения КАГ при ОКСбпST низкого и промежуточного риска, что обусловлено необходимостью ограничения случаев ее необоснованного применения, сокращения неоправданных осложнений инвазивной процедуры и нерациональных расходов здравоохранения. Актуальность такого подхода подтверждается сопоставимыми результатами госпитального прогноза у пациентов с ОКСбпST с невысоким риском неблагоприятных исходов при использовании мультиспиральной компьютерной томографии коронарных артерий и инвазивной КАГ [4]. Перспективным инструментом неинвазивной верификации ОПКА являются прогностические алгоритмы на основе современных методов машинного обучения, позволяющие с высокой точностью оценивать степень поражения коронарных артерий [3]. Однако надежность таких алгоритмов может зависеть от сроков их разработки после госпитализации больных с ОКСбпST в стационар, поскольку на точность прогноза влияет набор предикторов, включенных в модель.
Цель исследования — оценка точности прогностических моделей ОПКА при ОКСбпST, разработанных в первые часы госпитализации больных.
Материалы и методы
Одноцентровое ретроспективное исследование выполнено на базе данных, включающей сведения о 610 пациентах с ОКСбпST в возрасте от 30 до 80 лет (медиана возраста (Мe) — 62 года, 95% доверительный интервал (ДИ) — 61–63), поступивших в отделение неотложной кардиологии Владивостокской клинической больницы №1 в 2021–2024 гг. Оценку риска рассчитывали по шкале GRACE: низкий риск имел место у 457 больных (75%), средний — у 153 больных (25%). Сбор данных выполнен в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации (2024). Протокол исследования был одобрен этическим комитетом Дальневосточного федерального университета (протокол №4 от 5 декабря 2019 г.). От всех участников получено письменное информированное согласие.
Критерии включения: больные с ОКСбпST без доказанного некроза миокарда по результатам исследования высокочувствительного сердечного тропонина I, подвергшиеся инвазивной КАГ.
Критерии невключения: острый инфаркт миокарда, чрескожное коронарное вмешательство или коронарное шунтирование в анамнезе. По результатам инвазивной КАГ было выделено 2 группы пациентов: в 1-ю вошли 363 больных (59,5%) с ОПКА (сужение просвета коронарной артерии ≥50%), во вторую — 247 пациентов (40,5%) с НПКА (<50%).
Клинико-функциональный статус больных оценивали с помощью 62 признаков, включающих клинико-демографические, антропометрические (окружность талии — ОТ, окружность бедер — ОБ и их отношение — ОТ/ОБ), лабораторные, электрокардиографические (ЭКГ) и эхокардиографические (эхоКГ) данные. Забор венозной крови у пациентов осуществляли при поступлении в стационар с последующим исследованием на анализаторах Mindray BS-800M (Mindray, Китай) и Sysmex XN-550 (Sysmex Corporation, Япония). Определяли содержание гемоглобина (Hb), эритроцитов (RBC), лейкоцитов (WBC), тромбоцитов (PLT), скорость оседания RBC (СОЭ), гематокрит (HCT), тромбокрит (PCT), средний объем RBC (MCV), среднее содержание Hb в RBC (MCH), среднюю концентрацию Hb в эритроцитарной массе (MCHC), ширину распределения RBC (RDW-CV), средний объем PLT (MPV), ширину распределения PLT (PDW), показатели липидного спектра, концентрацию глюкозы, мочевой кислоты (МК), С-реактивного белка (СРБ) и креатинина.
По результатам ЭКГ-исследования оценивали продолжительность интервалов PQ, QT, QRS, наличие депрессии сегмента ST≥0,1 мВ в двух и более смежных отведениях, его элевацию ≥0,1 мВ в отведении aVR. ЭхоКГ проводили на аппарате GE Vivid S60 (GE Healthcare, США) по общепринятой методике. Определяли толщину межжелудочковой перегородки, задней стенки левого желудочка (ЛЖ), индекс массы миокарда ЛЖ. Регистрировали конечно-диастолический и конечно-систолический объемы ЛЖ, объем левого предсердия. Рассчитывали ударный объем, фракцию выброса ЛЖ. Для определения глобальной продольной систолической деформации (ГПСД) ЛЖ использовали данные апикальной 4-камерной позиции тканевых допплеровских изображений миокарда с помощью программного обеспечения аппарата GE Vivid S60.
Конечная точка исследования была представлена ОПКА в форме бинарного признака («отсутствие» или «наличие»). Входные признаки (подгруппа потенциальных предикторов) выражались в форме непрерывных и категориальных переменных.
Статистическая обработка данных и методы машинного обучения. Распределение данных по тесту Колмогорова–Смирнова отличалось от нормального, в связи с чем использовали непараметрические методы статистики. Показатели были представлены медианой (Ме) и межквартильными интервалами [Q1; Q3], для межгрупповых сравнений непрерывных переменных применяли тест Манна–Уитни, а для категориальных — 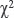 . Отношение шансов (ОШ) и 95% ДИ рассчитывали с помощью точного теста Фишера. Статистически значимыми считали различия при p<0,05. Для разработки прогностических моделей ОПКА использовали методы машинного обучения: многофакторную логистическую регрессию (МЛР), случайный лес (СЛ) и стохастический градиентный бустинг (СГБ). Модели были разработаны на обучающей выборке (9/10) пациентов и верифицированы на тестовой (1/10). Качество моделей оценивали по шести метрикам: площадь под ROC-кривой (AUC), F-мера, чувствительность (Se), специфичность (Sp), положительное (PPV) и отрицательное (NPV) прогностическое значение.
. Отношение шансов (ОШ) и 95% ДИ рассчитывали с помощью точного теста Фишера. Статистически значимыми считали различия при p<0,05. Для разработки прогностических моделей ОПКА использовали методы машинного обучения: многофакторную логистическую регрессию (МЛР), случайный лес (СЛ) и стохастический градиентный бустинг (СГБ). Модели были разработаны на обучающей выборке (9/10) пациентов и верифицированы на тестовой (1/10). Качество моделей оценивали по шести метрикам: площадь под ROC-кривой (AUC), F-мера, чувствительность (Se), специфичность (Sp), положительное (PPV) и отрицательное (NPV) прогностическое значение.
Дизайн исследования включал 4 этапа. На первом из них для выделения потенциальных предикторов, линейно связанных с ОПКА, был проведен межгрупповой статистический анализ клинико-функциональных факторов. На втором этапе разработаны прогностические модели ОПКА с наборами предикторов, полученных при первичном врачебном осмотре больных в стационаре, через 1 ч наблюдения и спустя 3 ч, что соответствует временны́м интервалам стратификации риска неблагоприятного исхода ОКСбпST по результатам исследования уровня сердечных тропонинов [1]. На третьем этапе с помощью метода аддитивного объяснения Шепли (SHAP) определяли интенсивность влияния отдельных предикторов прогностических моделей ОПКА на конечную точку исследования. На четвертом этапе выполняли стратификацию риска ОПКА по данным модели СГБ в соответствии с алгоритмом, который включал разделение датасета на 5 подвыборок методом стратифицированного k-fold с последующим обучением моделей в цикле на четырёх из этих подвыборок и тестированием на одной с фиксацией результатов прогноза. Для принятия решения о наличии ОПКА подбирали порог отсечения расчетной вероятности таким образом, чтобы значения Se и Sp были максимально близкими. К ОПКА относили случаи, при которых расчетная вероятность превышала порог отсечения, а к НПКА — не превышала. Диапазон вероятностей ниже порога отсечения был разделен на 2 уровня — низкий и средний риск ОПКА, а выше порога — на высокий и очень высокий риск. Для разделения были использованы медианные значения предсказанных вероятностей в группах сравнения, которые соотносили с границами низкого и очень высокого риска. Оценку точности стратификации риска выполняли с помощью метрики Accuracy (Ac). Анализ данных и разработку моделей выполняли на языке Python с открытым исходным кодом, v. 3.9.16.
Результаты
На первом этапе исследования по результатам межгруппового анализа была установлена статистическая значимость различий по 36 показателям клинико-функционального статуса больных ОКСбпST (табл. 1). Максимальный уровень статистической значимости был связан с гендерной принадлежностью (мужской пол), статусом курения, отягощенной наследственностью по ССЗ, показателями ОТ, ОТ/ОБ, RDW-CV, MPV, PDW, уровнями общего холестерина, холестерина липопротеинов высокой плотности и холестерина липопротеинов низкой плотности (ХС ЛПНП), креатинина, СРБ, МК, а также ГПСД ЛЖ (p<0,0001). Наибольшее значение ОШ фиксировалось при наличии хронической обструктивной болезни легких (ОШ=8,41), а менее заметная, но статически значимая вероятность ОПКА ассоциировалась с табакокурением (ОШ=2,6), отягощенным по ССЗ семейным анамнезом (ОШ=2,3), мужским полом (ОШ=2,2) и коморбидностью с сахарным диабетом (ОШ=1,67). При этом артериальная гипертензия и фибрилляция предсердий в группах сравнения регистрировались с одинаковой частотой, что свидетельствовало об отсутствии линейных взаимосвязей этих факторов с ОПКА (ОШ=0,91; p=0,8 и ОШ=0,86; p=0,7 соответственно). По данным межгруппового статистического анализа показатели возраста, роста, массы тела обследованных, концентрации глюкозы и общего белка в крови, систолическое и диастолическое артериальное давление имели сопоставимые величины, указывающие на низкую вероятность их влияния на ОПКА.
|
Таблица 1. Клинико-функциональные показатели больных острым коронарным синдромом без подъема сегмента ST, Мe [Q1; Q3] |
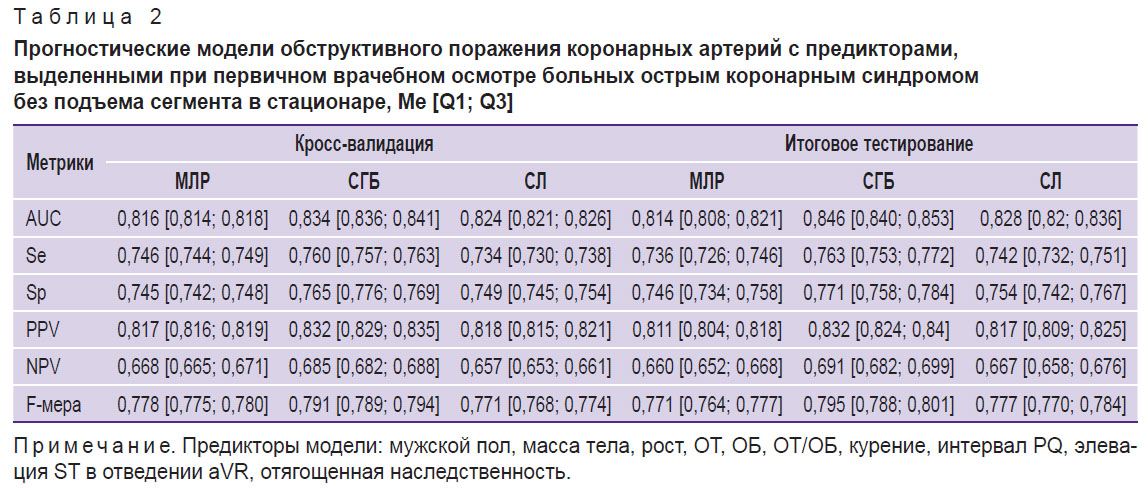
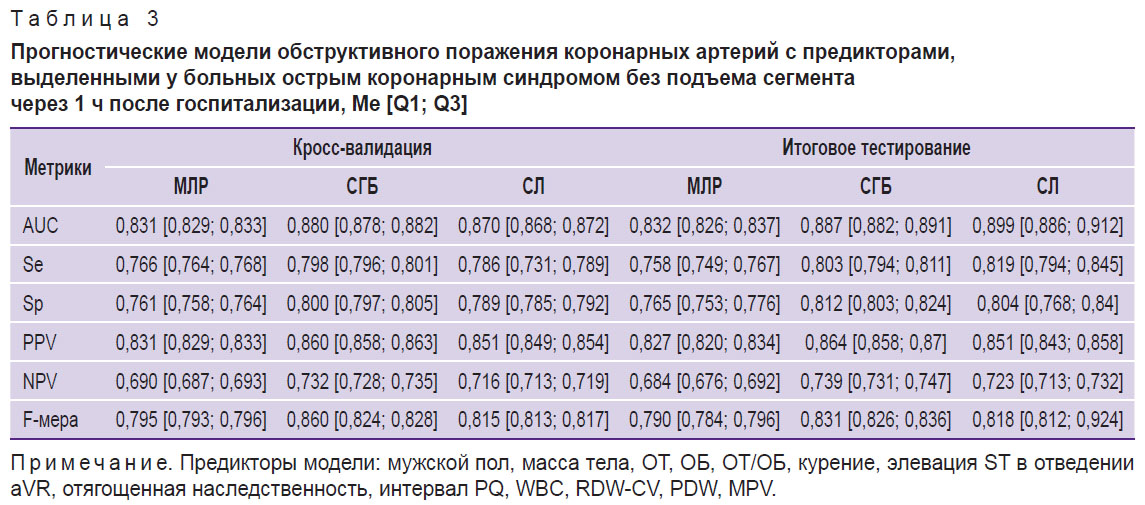
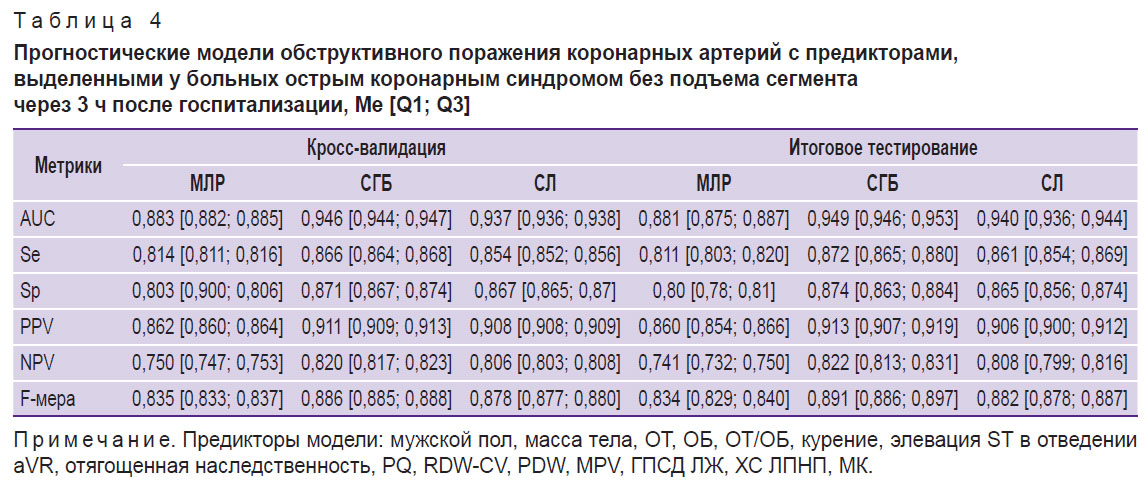
На втором этапе исследования с помощью методов МЛР, СЛ и СГБ были разработаны прогностические модели, позволяющие оценить вероятность ОПКА до выполнения инвазивной КАГ. К предикторам, выделенным из набора данных, которые были получены при первичном врачебном осмотре больных в стационаре, относились следующие показатели: мужской пол, статус курения, отягощенная наследственность, масса тела, рост, ОТ, ОБ, интервал PQ, наличие элевации ST в отведении aVR. Через 1 ч наблюдения за больными базовый состав предикторов дополнялся результатами клинического анализа крови (WBC, RDW-CV, PDW, MPV), а спустя 3 ч — биохимическими и эхоКГ-показателями (ХС ЛПНП, МК и ГПСД ЛЖ). Анализ метрик качества показал, что модели, разработанные на различных временны́х интервалах методом СГБ, обладают более высокой прогностической точностью по сравнению с моделями на основе МЛР и СЛ (табл. 2–4). Важно также отметить, что последовательное расширение спектра предикторов сопровождалось возрастанием качества прогноза, индикаторы которого достигали максимальных значений при использовании полного комплекса доступных для анализа клинико-функциональных данных (см. табл. 4).
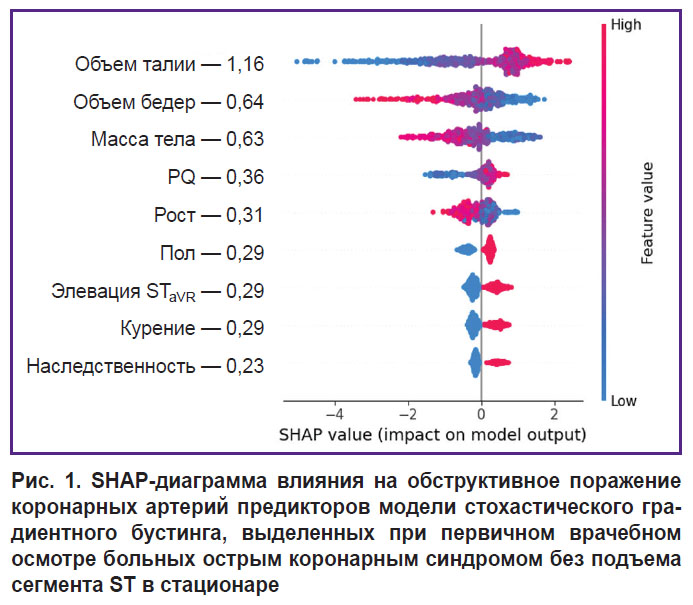
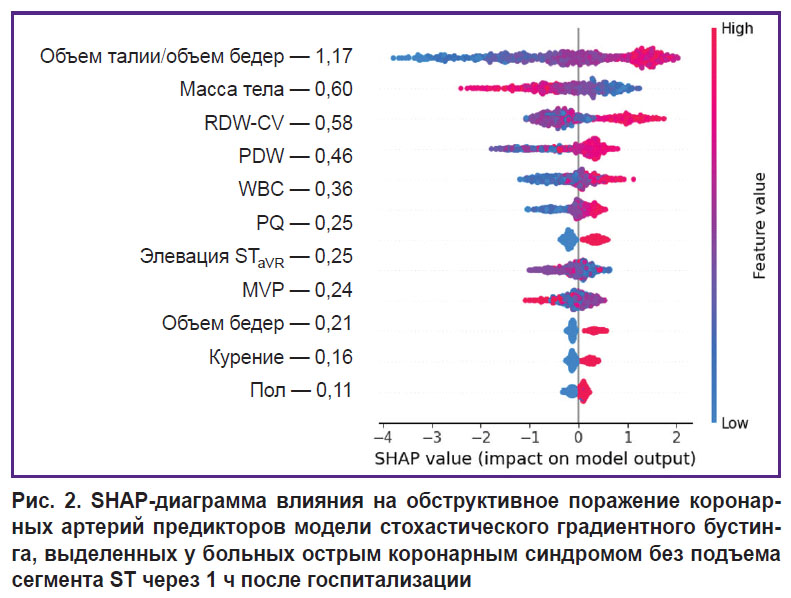
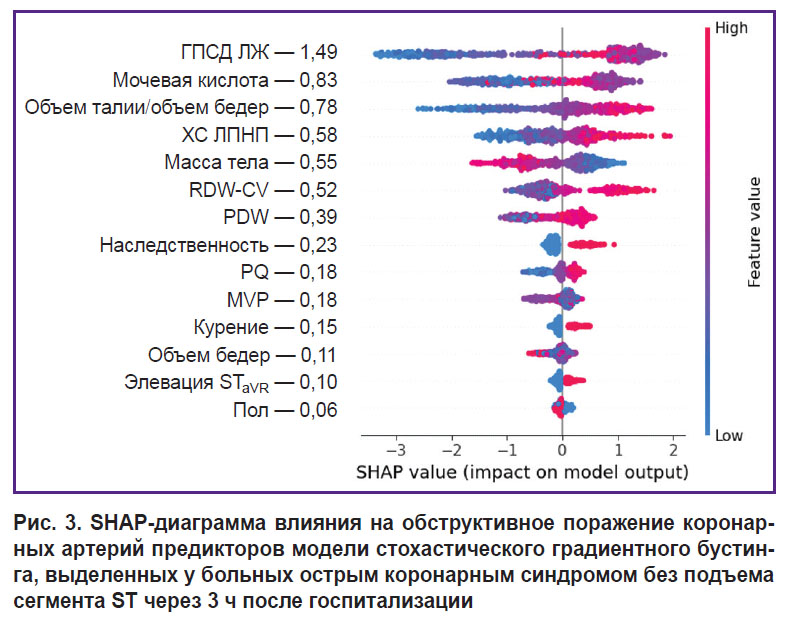
На третьем этапе исследования с помощью метода SHAP определяли степень влияния отдельных предикторов, входящих в структуру лучших моделей СГБ, на реализацию конечной точки. Результаты анализа показали, что среди предикторов прогностических моделей, разработанных по данным первичного врачебного осмотра больных в стационаре, наиболее тесную связь с ОПКА демонстрировал показатель ОТ, увеличение которого ассоциируется с возрастающим риском гемодинамически значимых стенозов коронарных артерий (рис. 1). Менее заметные взаимосвязи с конечной точкой фиксировались у показателей гендерной принадлежности (мужской пол), массы тела, роста, ОБ, табакокурения, интервала PQ и элевации ST в отведении aVR, а минимальное влияние на ОПКА оказывал фактор отягощенной наследственности по ССЗ. При ранжировании предсказательной ценности предикторов модели СГБ, включающей показатели клинического анализа крови, установлено, что интенсивность воздействия последних на ОПКА значительно уступает антропометрическому индексу ОТ/ОБ, уровень которого был максимальным (рис. 2). Влияние на конечную точку RDW-CV было сопоставимым с массой тела больных, а MPV — с признаком элевации сегмента ST в отведении aVR. В прогностической модели СГБ, предикторы которой были дополнены биохимическими и эхоКГ-показателями, наибольшую взаимосвязь с ОПКА демонстрировал индикатор ГПСД ЛЖ (рис. 3). Менее заметное влияние на конечную точку оказывали показатели МК, ОТ/ОБ, ХС ЛПНП и масса тела, а минимальное — фактор мужского пола и табакокурение.
На четвертом этапе исследования по данным моделей СГБ, включающих различные наборы предикторов, был стратифицирован риск ОПКА, соответствующий временны́м интервалам прогнозирования (табл. 5). Вероятность наличия ОПКА соотносили с выделением категорий низкого, среднего, высокого и очень высокого риска, цифровые диапазоны которых зависели от структуры моделей. Результаты исследования показали, что прогностическая модель первого сценария, разработанная на основе предикторов, которые были получены при первичном врачебном осмотре в стационаре, позволяет выделить пациентов с ОПКА из группы очень высокого риска с точностью по метрике Ac в 92,6%. По данным этой модели, у больных с низким риском ОПКА точность прогноза гемодинамически незначимого стеноза была несколько ниже (Ac — 86,6%). Модели 2-го и 3-го сценария, структура которых была дополнена гематологическими и эхоКГ-предикторами, имеют более высокую точность идентификации больных с ОПКА при очень высоком риске коронарного стеноза (Ac — 95,0–99,4%) и больных с НПКА — при его низком риске (Ac — 96,8–100%). При этом качество прогноза ОПКА среди пациентов среднего и высокого риска при всех сценариях моделирования было существенно ниже (Ac — 71,2–78,8%).

|
Таблица 5. Стратификация риска обструктивного поражения коронарных артерий (ОПКА) у больных острым коронарным синдромом без подъема сегмента ST, % |
Обсуждение
Широкое применение в клинической практике «классических» шкал оценки риска неблагоприятного исхода (GRACE, HEART, TIMI) при различных вариантах ОКС позволило повысить качество оказания медицинской помощи и сократить время принятия решений в отношении инвазивной реваскуляризации миокарда. ОКСбпST является одной из наиболее сложных форм ИБС, что обусловлено рядом факторов: гетерогенной популяцией больных, отличающихся различными клиническими вариантами заболевания; неоднозначностью подходов к стратификации риска и оценке ее эффективности; сложностью выбора оптимальных стратегий лечения, что чаще всего связано с многососудистым поражением коронарных артерий, пожилым и старческим возрастом больных [5]. В нашем исследовании по результатам динамического контроля ЭКГ и тропонина I у всех больных была диагностирована нестабильная стенокардия, клинические проявления которой относились к невысокому риску неблагоприятных исходов по шкале GRACE. По данным КАГ, почти у 60% больных анализируемой когорты были выявлены ОПКА и у 40% — НПКА. Это, с одной стороны, подтверждает известные представления о неоднородности патофизиологических механизмов, участвующих в развитии острой ишемии миокарда при нестабильной стенокардии, а с другой — свидетельствует о целесообразности использования современных прогностических технологий для оценки степени поражения коронарных артерий у этой категории больных до выполнения инвазивной процедуры.
Ранее [5, 6] было показано, что наличие предварительной информации о состоянии коронарного русла у больных ОКСбпST, полученной с помощью алгоритмов машинного обучения, может усилить прогностический ресурс шкал-рискометров и способствовать выбору оптимальных стратегий лечения. Важность такого подхода иллюстрируется на примере шкалы GRACE, недостаточную эффективность которой в ряде исследований связывали с отсутствием в ее структуре данных о гендерной принадлежности больных, индикаторах коморбидности, с избыточной зависимостью генерируемых заключений от показателя возраста и др. Модификация данной шкалы путем расширения спектра предикторов повышала точность стратификации риска госпитальной летальности при различных клинических вариантах ОКС [7]. Вместе с тем возможности для совершенствования инструментов рискометрии за счет использования неинвазивных индикаторов ОПКА в настоящее время ограничены из-за отсутствия общепринятых прогностических алгоритмов коронарной обструкции [8]. Для решения этой задачи в данном исследовании были впервые разработаны прогностические модели ОПКА у больных нестабильной стенокардией на основе предикторов, полученных в первые часы госпитализации и соответствующих временны́м интервалам, которые установлены клиническими рекомендациями для ранней стратификации риска неблагоприятных исходов при ОКСбпST с помощью высокочувствительных тропонинов [1, 2].
Результаты нашего исследования показали, что хорошим качеством прогноза ОПКА отличались уже модели первого сценария, в которых наибольшим предиктивным потенциалом обладали 3 антропометрических показателя, характеризующих метаболический статус больных: ОТ, ОБ и масса тела (см. табл. 2 и рис. 1). Абдоминальное ожирение относят к наиболее «агрессивным» факторам кардиометаболического риска, основной мишенью которых являются коронарные артерии. Это подтверждается предиктивной ценностью соотношений ОТ/ОБ≥0,9 и ОТ/рост≥0,69 в прогностической модели ОПКА, разработанной ансамблевым методом на основе 10 алгоритмов МЛР (AUC — 0,82) [9]. В настоящей работе использование этих индикаторов в качестве изолированных показателей в непрерывной форме позволило достичь более высокой точности прогноза ОПКА в модели СГБ первого сценария (АUC — 0,846).
В прогностических моделях второго сценария доминирующее влияние на ОПКА оказывал индекс ОТ/ОБ, а менее заметная взаимосвязь с конечной точкой ассоциировалась с массой тела и показателями клинического анализа крови (RDW-CV, PDW и WBC), которые все чаще используются для прогностических исследований в клинической медицине. В последние годы в ряде исследований отмечена важность RDW-CV как независимого предиктора неблагоприятных клинических исходов при различных заболеваниях, в том числе ИБС [10, 11]. Предполагается, что этот показатель может быть индикатором интенсивности окислительного стресса, субклинического воспаления и повышенной активности нейроэндокринной системы. Ранее [12] было показано, что у больных ИБС с ОПКА фиксируются более высокие уровни RDW-CV, чем при ИБС на фоне НПКА (14,59±1,04% vs 13,60±0,68%, p<0,0001). В данном исследовании предиктивная ценность RDW-CV была идентифицирована при значении более 14,3% в прогностической модели ОПКА (AUC=0,793, PPV=85,42%). В работе G. Namazi с соавт. [10] уровень RDW-CV у больных с ОПКА на фоне стабильного течения ИБС был существенно выше по сравнению со здоровыми лицами. В нашем исследовании предиктивное значение RDW-CV в отношении ОПКА было доказано на когорте больных с ОКСбпST, что уточняет представления о прогностическом ресурсе данного фактора. Показатели PDW, WBC и MPV имели менее интенсивные взаимосвязи с конечной точкой исследования, чем RDW-CV (см. рис. 2). Вместе с тем появляется все больше публикаций, в которых тромбоцитарно-лейкоцитарные взаимодействия относят к патофизиологическим детерминантам тромбообразования, воспаления и атерогенеза, играющим ключевую роль в развитии ИБС [13, 14]. Показано, что увеличение PDW более 17% ассоциируется с более выраженной коронарной обструкцией и неблагоприятными исходами ОКС [15]. В работе I. Vogiatzis c соавт. [16] у больных ОКС была установлена тесная взаимосвязь показателей MPV со шкалой SYNTAX (Sx), характеризующей тяжесть поражения коронарного русла. При интактных коронарных артериях (Sx — 0 баллов) среднее значение MPV составляло 9,57 фл, а при Sx на уровне 1–22 баллов — 10,6 фл. У больных с Sx в диапазоне 23–32 баллов и более 33 баллов среднее значение MPV возрастало до 11,18 и 12,57 фл соответственно.
Прогностические модели ОПКА третьего сценария, разработанные на обобщенных данных первичного врачебного осмотра, клинико-биохимического анализа крови и эхоКГ, имели более высокие метрики качества, чем модели первого и второго сценариев, что обеспечивалось предиктивным потенциалом новых факторов: ГПСД ЛЖ, МК и ХС ЛПНП (см. табл. 4). В ряде исследований показатель ГПСД ЛЖ был признан информативным индикатором ОПКА. Прогностические свойства этого показателя фиксировались при его уровне менее 19% [17, 18]. Гиперурикемия является доказанным фактором кардиометаболического риска, тесно ассоциированным с атеросклеротическим ремоделированием коронарых артерий. Установлено, в частности, что при концентрации МК в крови более 356 мкмоль/л вероятность ОПКА возрастала в 2,2 раза [9]. В настоящем исследовании интенсивность влияния показателя МК на прогноз ОПКА в лучшей модели СГБ была в 1,8 раза ниже, чем ГПСД ЛЖ, но существенно выше, чем других предикторов этой модели (см. рис. 3). Важно также отметить, что предиктивная ценность ХС ЛПНП уступала отношению ОТ/ОБ, но была сопоставимой с массой тела больных. Стратификация риска ОПКА у больных ОКСбпST в первые часы госпитализации показала, что ее точность зависит от сценария прогноза и возрастает по мере расширения спектра предикторов прогностических моделей (см. табл. 5). Данный подход позволяет получить предварительную информацию о состоянии коронарного русла, которая может быть полезной для определения тактики лечения больных.
Ограничения настоящего исследования связаны с его ретроспективным характером и необходимостью валидации моделей на больных ОКСбпST из других лечебных учреждений.
Заключение
Представленные в настоящей работе прогностические модели ОПКА, разработанные на основе СГБ, позволяют с высокой точностью оценить степень поражения коронарных артерий у больных ОКСбпST в первые часы госпитализации. Наибольшей точностью прогноза ОПКА обладают модели, структура которых помимо анамнестических, антропометрических и ЭКГ-данных включает показатели клинико-биохимического анализа крови и эхоКГ. Результаты прогнозирования ОПКА и стратификации его риска дополняют информацию о функциональном статусе больных ОКСбпST и могут использоваться при выборе стратегии реваскуляризации миокарда. Перспективы дальнейших исследований по данной проблеме связаны с апробацией разработанных прогностических моделей ОПКА в качестве дополнительных инструментов для оценки рисков развития неблагоприятных событий при различных клинических вариантах ОКС.
Источник финансирования. Работа выполнена при финансовой поддержке проекта FZNS-2023-0010 Госзадания Дальневосточного федерального университета.
Конфликт интересов. Все авторы заявляют об отсутствии потенциального конфликта интересов.
Литература
- Барбараш О.Л., Дупляков Д.В., Затейщиков Д.А., Панченко Е.П., Шахнович Р.М., Явелов И.С., Яковлев А.Н., Абугов С.А., Алекян Б.Г., Архипов М.В., Васильева Е.Ю., Галявич А.С., Ганюков В.И., Гиляревский С.Р., Голубев Е.П., Голухова Е.З., Грацианский Н.А., Карпов Ю.А., Космачева Е.Д., Лопатин Ю.М., Марков В.А., Никулина Н.Н., Певзнер Д.В., Погосова Н.В., Протопопов А.В., Скрыпник Д.В., Терещенко С.Н., Устюгов С.А., Хрипун А.В., Шалаев С.В., Шпектор А.В., Якушин С.С. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал 2021; 26(4): 4449, https://doi.org/10.15829/1560-4071-2021-4449.
- Byrne R.A., Rossello X., Coughlan J.J., Barbato E., Berry C., Chieffo A., Claeys M.J., Dan G.A., Dweck M.R., Galbraith M., Gilard M., Hinterbuchner L., Jankowska E.A., Jüni P., Kimura T., Kunadian V., Leosdottir M., Lorusso R., Pedretti R.F.E., Rigopoulos A.G., Rubini Gimenez M., Thiele H., Vranckx P., Wassmann S., Wenger N.K., Ibanez B.; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J 2023; 44(38): 3720–3826, https://doi.org/10.1093/eurheartj/ehad191.
- Циванюк М.М., Гельцер Б.И., Шахгельдян К.И., Емцева Е.Д., Завалин Г.С., Шекунова О.И. Электрокардиографические, эхокардиографические и липидные показатели в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST. Российский кардиологический журнал 2022; 27(6): 5036, https://doi.org/10.15829/1560-4071-2022-5036.
- Кузнецова К.В., Бикбаева Г.Р., Сухинина Е.М., Таумова Г.Х., Бенян А.С., Дупляков Д.В., Тухбатова А.А., Адонина Е.В., Кислухин Т.В., Нагорнова В.В. Мультиспиральная компьютерная или инвазивная коронарография у пациентов с острым коронарным синдромом низкого и промежуточного риска — одноцентровое исследование. Российский кардиологический журнал 2024; 29(1S): 5702, https://doi.org/10.15829/1560-4071-2024-5702.
- Несова А.К., Рябов В.В. Парадоксы острого коронарного синдрома без подъема сегмента ST в условиях реальной клинической практики. Российский кардиологический журнал 2024; 29(3): 5623, https://doi.org/10.15829/1560-4071-2024-5623.
- Kabiri A., Gharin P., Forouzannia S.A., Ahmadzadeh K., Miri R., Yousefifard M. HEART versus GRACE score in predicting the outcomes of patients with acute coronary syndrome; a systematic review and meta-analysis. Arch Acad Emerg Med 2023; 11(1): e50, https://doi.org/10.22037/aaem.v11i1.2001.
- Зыков М.В., Дьяченко Н.В., Трубникова О.А., Эрлих А.Д., Кашталап В.В., Барбараш О.Л. Коморбидность и пол пациентов в оценке риска смерти в стационаре после экстренного чрескожного коронарного вмешательства. Кардиология 2020; 60(9): 38–45, https://doi.org/10.18087/cardio.2020.9.n1166.
- Циванюк М.М., Гельцер Б.И., Шахгельдян К.И., Вишневский А.А., Шекунова О.И. Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST. Российский кардиологический журнал 2022; 27(8): 507, https://doi.org/10.15829/1560-4071-2022-5079.
- Гельцер Б.И., Циванюк М.М., Шахгельдян К.И., Емцева Е.Д., Вишневский А.А. Факторы кардиометаболического риска в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST. Российский кардиологический журнал 2021; 26(11): 4494, https://doi.org/10.15829/1560-4071-2021-4494.
- Namazi G., Heidar Beygi S., Vahidi M.H., Asa P., Bahmani F., Mafi A., Raygan F. Relationship between red cell distribution width and oxidative stress indexes in patients with coronary artery disease. Rep Biochem Mol Biol 2023; 12(2): 241–250, https://doi.org/10.61186/rbmb.12.2.241.
- Чаулин А.М., Григорьева Ю.В., Павлова Т.В., Дупляков Д.В. Диагностическая ценность клинического анализа крови при сердечно-сосудистых заболеваниях. Российский кардиологический журнал 2020; 25(12): 3923, https://doi.org/10.15829/1560-4071-2020-3923.
- Nagula P., Karumuri S., Otikunta A.N., Yerrabandi S.R.V. Correlation of red blood cell distribution width with the severity of coronary artery disease — a single center study. Indian Heart J 2017; 69(6): 757–761, https://doi.org/10.1016/j.ihj.2017.04.007.
- Zhao Z., Zhang X., Sun T., Huang X., Ma M., Yang S., Zhou Y. Prognostic value of systemic immune-inflammation index in CAD patients: systematic review and meta-analyses. Eur J Clin Invest 2024; 54(2): e14100, https://doi.org/10.1111/eci.14100.
- Choi D.H., Kang S.H., Song H. Mean platelet volume: a potential biomarker of the risk and prognosis of heart disease. Korean J Intern Med 2016; 31(6): 1009–1017, https://doi.org/10.3904/kjim.2016.078.
- Bekler A., Ozkan M.T., Tenekecioglu E., Gazi E., Yener A.U., Temiz A., Altun B., Barutcu A., Erbag G., Binnetoglu E. Increased platelet distribution width is associated with severity of coronary artery disease in patients with acute coronary syndrome. Angiology 2015; 66(7): 638–643, https://doi.org/10.1177/0003319714545779.
- Vogiatzis I., Samaras A., Grigoriadis S., Sdogkos E., Koutsampasopoulos K., Bostanitis I. The mean platelet volume in the prognosis of coronary artery disease severity and risk stratification of acute coronary syndromes. Med Arch 2019; 73(2): 76–80, https://doi.org/10.5455/medarh.2019.73.76-80.
- Liou K., Negishi K., Ho S., Russell E.A., Cranney G., Ooi S.Y. Detection of obstructive coronary artery disease using peak systolic global longitudinal strain derived by two-dimensional speckle-tracking: a systematic review and meta-analysis. J Am Soc Echocardiogr 2016; 29(8): 724–735.e4, https://doi.org/10.1016/j.echo.2016.03.002.
- Sharma S., Lassen M.C.H., Nielsen A.B., Skaarup K.G., Biering-Sørensen T. The clinical application of longitudinal layer specific strain as a diagnostic and prognostic instrument in ischemic heart diseases: a systematic review and meta-analysis. Front Cardiovasc Med 2023; 10: 980626, https://doi.org/10.3389/fcvm.2023.980626.