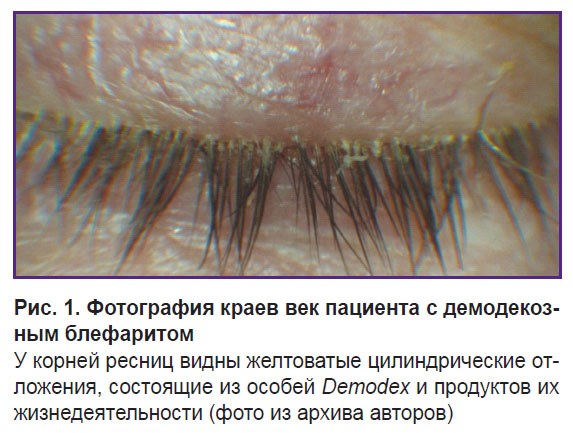
Современные технологии в диагностике и лечении демодекозного блефарита (обзор)
Блефарит, ассоциированный с инвазией клещей рода Demodex, является широко распространенным состоянием, осложнениями которого могут быть деформации краев век, синдром сухого глаза, эрозии и язвы роговицы.
Рассмотрены аспекты эпидемиологии и патогенеза, а также новые направления диагностики и лечения демодекозного блефарита. Представлена сравнительная характеристика современных диагностических модальностей, включая традиционную световую микроскопию, латеральное оттягивание и ротацию ресниц, а также технологии прижизненной визуализации, такие как конфокальная микроскопия и оптическая когерентная томография. Установлено, что усовершенствование методов визуализации при помощи машинного обучения позволит повысить доступность ранней диагностики заболевания и обеспечить своевременную инициацию этиотропного лечения. Анализируемые в обзоре препараты для консервативной терапии демодекозного блефарита представлены с позиций специфичности фармакологических эффектов и системной безопасности, при этом особое внимание привлечено к проблемам токсичности и длительности сроков использования лекарственных средств. В качестве перспективных и недостаточно изученных подходов к лечению выделены комбинированные лекарственные средства и различные методы лазерного воздействия на клеща Demodex и структуры краев век. Продемонстрирована разнородность подходов к оценке эффективности методик диагностики и лечения, что актуализирует необходимость разработки стандартизированной шкалы тяжести демодекозного блефарита, отражающей как клинические показатели, так и результаты инструментальных исследований. В заключении авторы приходят к выводу, что развитие неинвазивных методов визуализации и наиболее коротких и безопасных алгоритмов терапии позволит перейти на качественно новый уровень результативности лечения пациентов с демодекозным блефаритом.
Введение
Блефариты — это группа воспалительных заболеваний краев век, сопровождающихся зудом, покраснением, шелушением и образованием характерных отложений. Им подвержены как дети, так и взрослые [1]. По этиопатогенезу блефариты относят к мультифакториальной патологии, в развитии которой играют роль инфекционные агенты, демодекозная инвазия, атопия и себорея [2]. По локализации процесса выделяют передний, задний и смешанный блефариты [2, 3]. Развитие переднего блефарита характеризуется воспалением структур ресничного края века; его наиболее частыми причинами являются клещи рода Demodex, стафилококковая инфекция и себорея [3, 4]. При развитии заднего блефарита поражается участок века, соприкасающийся с роговицей и бульбарной конъюнктивой, преимущественно вследствие демодекозной инвазии. Клещ обнаруживается на эпилированных ресницах у 29% обследованных пациентов в возрастной группе от 0 до 25 лет, у 53% — в возрасте 26–50 лет, у 67% пациентов старше 50 лет [5–8].
Актуальность проблемы ранней диагностики и этиотропного лечения блефарита демодекозной этиологии связана с его потенциальными осложнениями, включающими деформацию краев век, синдром сухого глаза, эрозии и язвы роговицы [9]. Особый интерес представляют изучение возможностей современных диагностических технологий, в том числе методов прижизненной визуализации и машинного обучения (искусственного интеллекта) для неинвазивной оценки состояния краев век, а также анализ доказательной базы в отношении существующих схем комплексного терапевтического и аппаратного лечения пациентов с демодекозным блефаритом [10, 11].
Стратегия поиска литературы
Проведен поиск статей в базах данных PubMed, eLIBRARY.RU и Google Scholar, опубликованных за период c 1970 по 2023 г., по следующим ключевым словам: блефарит, демодекозный блефарит, лечение, терапия, фармакотерапия (blepharitis, Demodex blepharitis, treatment, therapy, pharmacotherapy). Из 305 выявленных источников 101 научная статья была признана релевантной для обзора по критериям тематической принадлежности.
Биологические основы
Demodex (от греч. demos — воск или жир, dex — насекомое) — микроскопический эктопаразит из класса арахнид порядка акариновых. Это один из наиболее распространенных паразитов, обитающих в организме человека. Jacob Henle впервые описал клеща Demodex в 1841 г., в дальнейшем Carl Gustav Theodor Simon определил его как человеческий клещ Demodex. В настоящее время известен 21 вид клещей рода Demodex [12, 13]. Среди открытых видов только два описаны на теле человека: Demodex folliculorum longus (D. folliculorum) и Demodex folliculorum brevis(D. brevis). Наиболее активное скопление особей наблюдается преимущественно в зонах повышенного выделения кожного сала, а именно в лицевой области и районе наружных слуховых проходов.
Вопрос о том, является ли этот клещ комменсалом, т.е. симбионтом, не приносящим вреда, или сапрофитным паразитом, до сих пор остается спорным. На данный момент принято считать, что физиологически допустимое количество клещей — менее 5 особей на 1 см2 при поражении кожи и не более 2 единиц при поражении ресниц [8].
Эпидемиология
Распространенность клеща Demodex в области век в мировой популяции составляет от 41 до 70% [14]. При этом распространенность демодекоза увеличивается с возрастом и достигает 67–100% среди населения старше 50 лет [5, 14]. В качестве факторов риска могут выступать нарушение секретопродуцирующей и секретовыводящей функций мейбомиевых желез, нарушение целостности дермы и эпидермиса, воздействие солнечного света, прием алкоголя, курение, стрессы, горячие напитки, острая пища и резкие перепады температуры [9, 15]. Наличие иммунокомпрометирующих заболеваний, таких как ВИЧ-инфекция и лимфопролиферативные заболевания, а также регулярное применение стероидных препаратов предрасполагают к инвазии Demodex [16].
По некоторым оценкам, демодекозная инвазия при своем относительно незаметном течении обусловливает 29–74% случаев хронического блефарита, что составляет значительную долю пациентов, наблюдаемых в офтальмологической практике [17]. Дерматологические заболевания могут быть ассоциированы с присутствием на коже клеща Demodex: в частности, риск развития демодекозного блефарита повышается в 7–8 раз у пациентов с угревой розацеей [18]. Демодекозная инвазия более интенсивно развивается на структурах края века, менее доступных для тщательной гигиены и ухода по сравнению с выступающими частями лица, такими как нос, брови, скулы и щеки [18].
Анатомия и физиология клеща Demodex
Клещ Demodex — бесцветный, безволосый, имеет веретенообразную цилиндрическую форму тела с кольцами и четыре короткие конечности по обе стороны от передней трети тела (podosome). Строение тела позволяет клещам перемещаться со скоростью 8–16 см/ч. Нижние две трети тела (opisthosoma) вытянуты и сужаются к концу, причем opisthosoma у D. folliculorum длиннее, чем у D. brevis. Анатомия клеща включает хитиновый экзоскелет, генитальное отверстие на спинной стороне и пищеварительную систему, в которой отсутствует анальное отверстие [18].
После оплодотворения самка перемещается в волосяной фолликул или сальную железу, откладывает около 20 яиц размером 50–60 мкм, которые находятся на стадии развития яйца около 60 ч. Далее яйца переходят в стадию личинки (36 ч), затем в протонимфу (72 ч) и дейтонимфу (60 ч), после чего приобретают форму взрослой особи, которая возвращается в фолликулярное отверстие [18–22].
Клещ Demodex зависит от хозяина и выживает ex vivo не более нескольких дней. D. folliculorum встречается чаще крупными скоплениями вокруг ресниц, D. brevis более широко распространен по всему организму. D. folliculorum питается клетками фолликулярного эпителия с помощью пары прокалывающих ротовых придатков, называемых хелицерами, а D. brevis — эпителием сальных желез аналогичным образом.
Микроскопия ресниц и ДНК-анализ клещей показали, что у близкородственных лиц, страдающих демодекозным блефаритом, сходство между особями выше. Это свидетельствует о контактно-бытовом пути передачи инфекции [18]. Гены, связанные с регуляцией энергетического баланса и гликолиза, движением, кодированием аллергенов, детоксикацией и стресс-реакцией, имеют более высокую экспрессию у вида D. folliculorum по сравнению с особями других видов [23]. В клиническом контексте это указывает на его преимущественную роль в развитии аллергической реакции I типа с проявлениями в виде эритемы и зуда [23]. Аспартат протеаза, синтез которой кодируется генами клеща D. brevis, способна лизировать молекулы кожи и сыворотки крови хозяина, что облегчает проникновение паразита в кожу.
Патогенез
Воздействие клеща Demodex как патологического агента рассматривается с разных сторон. Наибольшее внимание уделяется его прямому повреждающему действию на ткани человека, роли в переносе патогенных бактерий, а также способности вызывать реакции гиперчувствительности.
Прямое повреждающее действие Demodex. Количество D. folliculorum увеличивается по направлению к корню ресницы, где паразит потребляет эпителиальные клетки волосяного фолликула, повреждая его структуру, что приводит к неправильному росту ресниц [9, 24, 25]. В качестве реакции может развиваться гиперкератинизация вокруг основания ресниц, что визуально определяется как муфты, или отложения цилиндрической формы. В то же время D. brevis способен механически блокировать отверстия мейбомиевых желез, дисфункция которых приводит к дефициту липидного слоя слезы. D. brevis наблюдается в центре мейбомиевых гранулем, окруженных эпителиоидными клетками, гистиоцитами, фибробластами, лимфоцитами и плазматическими клетками [26]. В связи с этим клещи рода Demodex могут быть причиной рецидивирующего халязиона [9].
Demodex как бактериальный переносчик. Demodex может переносить на своей поверхности бактерии, в том числе стрептококки и стафилококки. Установлено также, что размножение бактерий внутри клеща, в частности Bacillus oleronius, стимулирует пролиферацию мононуклеарных клеток периферической крови у пациентов с розацеа [27]. После гибели клеща уровень бактериальных антигенов многократно увеличивается. При разрушении клеща образуется субстрат для роста бактериальных колоний, что также способствует прогрессированию каскада воспалительных реакций организма хозяина [9]. Некоторые исследователи предполагают, что причиной воспаления могут быть токсины, вырабатываемые определенными штаммами Staphylococcus aureus или Staphylococcus epidermidis, адсорбированными на поверхности клеща [9]. Повышенная интенсивность реакций клеточного иммунитета к S. aureus была обнаружена у 40% пациентов с блефаритом [28, 29].
Реакция гиперчувствительности. Реакция гиперчувствительности замедленного типа может быть вызвана белками клеща Demodex при инвазии в фолликул ресницы, что подтверждается наличием Th-клеток в зоне воспаления. Повышенное число макрофагов и клеток Лангерганса наблюдалось только у лиц с положительным результатом исследования на D. folliculorum [9].
Клиническая картина
К типичным симптомам демодекозной инвазии относят зуд в области век, обструкцию протоков мейбомиевых желез, признаки хронического конъюнктивита, желтоватые отложения цилиндрической формы вокруг ресниц и трихиаз [8, 9]. Трихиаз, развивающийся в результате повреждения ресничного фолликула, может травмировать эпителий роговицы, вызывая точечные эрозии с последующим изъязвлением роговицы и образованием паннуса в тяжелых случаях [9]. При обструкции выводных протоков мейбомиевых желез клещами Demodex нарушается секреция липидного компонента слезы, что нередко приводит к ускоренному испарению и разрыву слезной пленки, усугубляя состояние роговицы [9].
При затягивании диагностики и лечения заболевания возможно развитие блефароконъюнктивита, не купируемого при проведении стандартной противовоспалительной терапии [9]. Наличие зуда в области век, отмечаемое пациентами при инвазии D. folliculorum, отек в области век и дискомфорт в глазах являются одними из важных клинических проявлений заболевания. Существует положительная корреляция между увеличением количества клеща Demodex и возрастанием интенсивности зуда, что, по всей вероятности, обусловлено повышенной экспрессией генов, кодирующих аллергены, ответственные за аллергическую реакцию I типа [18].
При осмотре на щелевой лампе в большинстве случаев можно обнаружить желтоватые отложения цилиндрической формы вокруг ресниц (рис. 1), представляющие скопление особей Demodex и продуктов их жизнедеятельности в виде кератина и липидов. Наличие подобных муфт считается высокоспецифичным для присутствия клеща Demodex [30–32].
Предполагается, что D. brevis, способный проникать глубоко в мейбомиевую железу, является фактором риска развития рецидивирующего халязиона, и это следует учитывать при жалобах пациентов на отсутствие эффекта при назначении консервативной терапии и хирургического лечения [33].
Диагностика
Микроскопия. Традиционная методика диагностики блефарита, ассоциированного с клещом Demodex, заключается в микроскопическом исследовании ресниц с оценкой количества, морфологии и подвижности клеща [34]. Забор материала выполняется при осмотре на щелевой лампе, при этом предпочтительно выбирать ресницы с цилиндрическими отложениями, так как на них обнаруживается большее количество клещей [35]. Пинцетом ресницу следует держать близко к основанию, а затем извлекать и помещать на предметное стекло для микроскопии (рис. 2). Возможна также модификация метода с использованием флуоресцеина для окрашивания хитиновых оболочек клещей с целью их лучшей визуализации [32]. При массивной инвазии, когда ресничные фолликулы переполнены, некоторые клещи скапливаются на ресничном валике рядом с фолликулом, однако из-за их фоточувствительности это случается редко [18].

|
Рис. 2. Световая микроскопия ресниц у пациента с демодекозным блефаритом
Стрелка указывает на взрослую особь клеща Demodex (фото из архива авторов) |
Микроскопия — наиболее распространенный метод диагностики вследствие невысоких требований к квалификации специалиста для проведения манипуляции. Существенным недостатком световой микроскопии является инвазивный характер мониторинга, при котором необходима неоднократная эпиляция ресниц, что приводит к дискомфорту пациента в связи с болезненностью процедуры. К ограничениям метода также следует отнести механическое воздействие при заборе материала и неполное извлечение клещей из фолликулярного отверстия. Добавление фиксирующих средств для световой микроскопии может повлиять на морфологическую структуру клеща и его подвижность, а также чувствительность методики [34]. Затруднительной для диагностики как in vivo, так и ex vivo является дифференцировка клеща, который внедрился в цилиндрические отложения на ресницах. Для диагностики демодекозного блефарита необходимы световой микроскоп с увеличением 100–200, фиксирующие средства, пипетки, предметные и покровные стекла и т.д. Все это накладывает ограничения на внедрение метода в широкую клиническую практику офтальмологической помощи.
Ротация и латеральное оттягивание ресниц. В качестве экспресс-метода диагностики предлагается способ ротационных движений, суть которого заключается в покачивании ресницы по или против часовой стрелки с целью выведения клещей из фолликула, а также метод латерального оттягивания ресницы. Дальнейший подсчет особей Demodex можно выполнять на щелевой лампе под большим увеличением [36].
Конфокальная микроскопия. Конфокальная микроскопия является видом световой микроскопии. Этот метод обеспечивает прижизненную визуализацию структур глаза и его придатков с очень высокой разрешающей способностью, что определило его широкое применение в диагностике заболеваний роговицы и конъюнктивы [37, 38]. Использование конфокальной микроскопии в диагностике блефаритов ограничено. Это связано с анатомическим расположением, подвижностью и неоднородной отражательной способностью плотно прилегающих гетерогенных гистологических структур края века [37].
Значительный опыт применения конфокальной микроскопии накоплен в дерматологической практике, где данная технология позволяет визуализировать клеща Demodex в поверхностных слоях кожи как возбудителя розацеа. В исследовании E.C. Sattler [38] с соавт. показано, что конфокальная микроскопия обеспечивает не только качественную, но и количественную оценку сканируемой площади с высокой скоростью.
В офтальмологических исследованиях с использованием конфокальной микроскопии D. folliculorum был выявлен внутри фолликула, на дне фолликула, рядом с мейбомиевой железой и между ресниц [39]. Погибшие особи D. folliculorum обнаружены прикрепленными к основанию ресниц. При высокой численности клещей наблюдались признаки воспалительной реакции [37]. D. brevis определялся на дне фолликула или внутри мейбомиевой железы. В случае обструкции протока железы паразитами установлена эпителиальная пролиферация. Яйца Demodex визуализировались с трудом из-за их малого размера. Инвазия клещей Demodex была выявлена у 60% пациентов с синдромом сухого глаза и у 100% с блефаритом [37].
Оптическая когерентная томография (ОКТ) является методом прижизненной визуализации структуры оптически неоднородных сред с высоким пространственным разрешением (5–10 мкм). Световое излучение в инфракрасном диапазоне позволяет исследовать структуры кожи на глубину порядка 750 мкм. В дерматологии ОКТ активно применяется для диагностики рака кожи, измерения толщины опухоли при меланоцитарных поражениях и оценки изменений эпидермиса после локально проводимых процедур [40–42]. Кроме того, ОКТ используют в качестве неинвазивного метода обнаружения и количественной оценки инвазии клещей у пациентов с демодекс-ассоциированными заболеваниями. С помощью ОКТ высокого разрешения в режиме en face особь Demodex описана как совокупность ярко гиперрефлективных круглых точек в группах по 3–5 единиц на волосяной фолликул. Чувствительность метода в диагностике демодекс-ассоциированных поражений кожи, по данным пилотного исследования на группе из 22 пациентов, приближается к 100%, специфичность достигает 65% [43].
Исследований, посвященных применению ОКТ для диагностики демодекозного блефарита, на момент написания статьи не обнаружено. Однако ОКТ представляется перспективным методом для исследования данной нозологии с учетом достаточной проникающей способности, неинвазивного характера исследования, высокой скорости выполнения и доступности технологии в современных офтальмологических клиниках.
Мейбография. Данная методика, в отличие от вышеупомянутых, не является способом прямой визуализации особей Demodex, однако позволяет судить о состоянии мейбомиевых желез и степени их дисфункции и атрофии. При дисфункции мейбомиевых желез нарушается нормальное выделение секрета, который замедляет испарение слезной пленки, необходимой для выравнивания поверхности роговицы и создания правильной оптической среды. Предполагается, что инвазия и отходы жизнедеятельности клещей вызывают закупорку протоков и провоцируют воспалительную реакцию, поэтому оценка состояния мейбомиевых желез может косвенно свидетельствовать о наличии клеща Demodex [6]. Метод мейбографии основан на прижизненной визуализации мейбомиевых желез с целью оценки их морфологии.
Искусственный интеллект. Благодаря развитию вычислительных мощностей, совершенствованию алгоритмов и архитектур машинного обучения, а также доступности больших объемов данных автоматизированная диагностика заболеваний становится одной из наиболее интенсивно развивающихся отраслей медицины во всем мире [44, 45]. Искусственные нейронные сети, уже широко применяемые в распознавании изображений, речи и обработке естественного языка, находятся на этапе активного внедрения в практическое здравоохранение [10].
В офтальмологии искусственный интеллект используют для распознавания фотографий глазного дна, ОКТ-сканов и анализа полей зрения, а также для диагностики диабетической ретинопатии и ретинопатии недоношенных, глаукомы, макулярного отека и возрастной макулярной дегенерации [45]. Основной целью развития данной технологии является повышение доступности медицинской помощи в рамках профилактики, диагностики и лечения заболеваний органа зрения [10, 46]. Разработаны методы распознавания кератоконуса по фотографиям переднего отрезка глаза на основе глубокого машинного обучения с точностью 97,6–99,3%, инфекционного кератита с вероятностью 90,7%, бактериальных и грибковых кератитов со специфичностью 76,5 и 100% соответственно [47, 48]. В связи с этим применение искусственного интеллекта для диагностики демодекозного блефарита по фотографиям краев век представляется перспективным ввиду простоты и неинвазивности способа получения первичных данных.
Применение машинного обучения для распознавания изображений конфокальной микроскопии демонстрирует многообещающие результаты. Разработанная нейронная сеть позволила классифицировать пациентов по наличию диабетической периферической нейропатии по длине нервных волокон роговицы с 92% чувствительностью и 80% специфичностью [49, 50]. Алгоритмы машинного обучения применяются также для автоматизированной оценки высоты, ширины, извилистости и плотности мейбомиевых желез при мейбографии [11]. У больных демодекозным блефаритом атрофия мейбомиевых желез характеризуется большей неравномерностью, чем у пациентов с дистрофическими изменениями мейбомиевых желез без подтвержденной инвазии Demodex. Изменение высоты и плотности мейбомиевых желез верхнего века имеет более значимую корреляцию с их дисфункцией по сравнению с железами нижнего века. Это может быть связано с тем, что края верхних век в большей степени подвержены воздействию клещей и железы в них длиннее, в результате чего атрофия приобретает более выраженные черты [11].
Дальнейшее внедрение алгоритмов искусственного интеллекта в протоколы конфокальной микроскопии и ОКТ позволяет снизить требования к подготовке персонала и объективизировать методику, делая ее более доступной. Мультимодальное исследование краев век с автоматизированным анализом при помощи нейронных сетей представляется перспективным этапом развития методов дифференциальной диагностики блефаритов [51].
Сравнение эффективности методов. A. Muntz с соавт. [34] сравнили эффективность различных методов диагностики: стандартную световую микроскопию, ротационную технику, латеральное оттягивание и конфокальную микроскопию. Существенных различий между ротацией ресниц и стандартной световой микроскопией эпилированных ресниц не установлено. При удалении цилиндрических отложений под световым микроскопом обнаружено в два раза больше клещей, чем при использовании ротационной техники. Метод латерального оттягивания позволил визуализировать наибольшее количество сигарообразных хвостов Demodex. При конфокальной микроскопии наблюдалась низкая информативность изображения, что затрудняло различение клеща Demodex, который ранее был обнаружен с помощью световой микроскопии.
Обобщая преимущества и недостатки различных методов, можно ранжировать известные диагностические модальности от наиболее специфичной и инвазивной световой микроскопии к наименее точным, но отличающимся бесконтактным характером исследования, таким как мейбография (см. таблицу). Кроме того, сравнение традиционных и современных подходов к диагностике блефарита, вызванного клещом рода Demodex, позволяет сформулировать диагностические признаки заболевания:
продолжительный анамнез заболевания, наличие подтвержденного демодекозного блефарита у близких родственников;
хронический блефарит, конъюнктивит, блефароконъюнктивит и рецидивирующий халязион, рефрактерные к традиционным методам лечения;
наличие мадароза, трихиаза, устойчивого зуда и покраснения век, цилиндрические отложения на ресницах;
обнаружение клеща Demodex различными методами визуализации на любой стадии жизненного цикла.
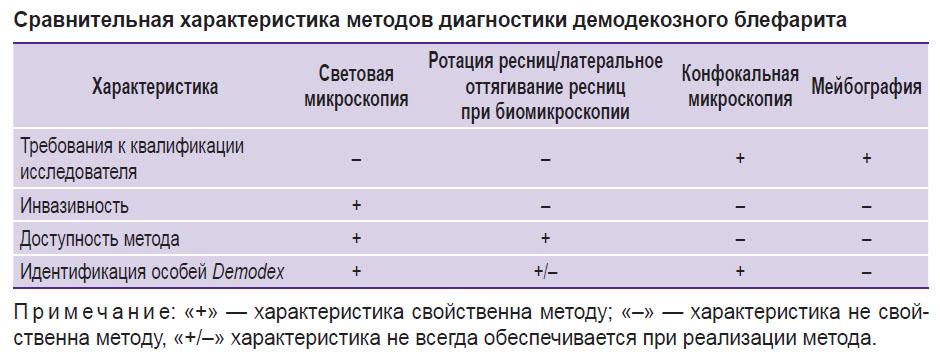
|
Сравнительная характеристика методов диагностики демодекозного блефарита |
Лечение
Лечение демодекозного блефарита направлено на элиминацию или значимое уменьшение числа особей клеща рода Demodex. Требованием к методам терапии является достижение высокой эффективности при наименьшей продолжительности использования и минимальных побочных реакциях.
Медикаментозные методы лечения. Исторически для лечения демодекозного блефарита проводили гигиену век с добавлением серной мази, желтой ртутной мази или пилокарпинового геля. В настоящее время серную и ртутную мази не применяют, так как они имеют сравнительно низкую эффективность. Пилокарпин в форме геля обладает достаточным антипаразитарным эффектом, который приводит к параличу дыхания и подвижности клещей посредством воздействия на парасимпатическую нервную систему [7].
Среди лекарственных препаратов следует выделить метронидазол и ивермектин. Метронидазол — противопротозойный и противомикробный препарат, первоначально разработанный для лечения инфекций, вызванных Trichomonasvaginalis, Entamoebahistolytica и Giardialamblia. Впоследствии данный препарат, ингибирующий синтез белка за счет деструкции микробной ДНК, нашел широкое применение в терапии бактериальных заболеваний [52–54]. Эффективность местного применения метронидазола при розацеа объясняется его противовоспалительным действием и способностью снижать плотность фолликулов, инфицированных клещами Demodex [55]. Монотерапия метронидазолом при лечении демодекозного блефарита требует тщательного изучения. На данный момент препарат показал высокую эффективность при комбинированном применении с ивермектином [56].
Ивермектин — противопаразитарный препарат широкого спектра действия, эффективность которого обусловлена его селективной активностью в отношении глутаматергических хлоридных ионных каналов периферической нервной системы беспозвоночных [8]. Связывание ивермектина с ионными каналами в нервных и мышечных клетках приводит к повышению проницаемости клеточной мембраны для ионов хлора, что вызывает гиперполяризацию с последующим параличом и гибелью паразита [57, 58]. Ивермектин с трудом проникает через гематоэнцефалический барьер человека, так как у млекопитающих имеются лиганд-управляемые хлорид-ионные каналы, благодаря которым риск воздействия препарата на центральную нервную систему минимален [58]. Исследование эффективности ивермектина у пациентов с устойчивым к лечению блефаритом демодекозной этиологии продемонстрировало сокращение количества особей D. folliculorum, а также улучшение показателей теста Ширмера и времени разрыва слезной пленки по итогам 28 дней терапии [8]. Применение 1% ивермектина в форме мази, наносимой 1 раз в день на протяжении 2 мес, позволило статистически значимо уменьшить степень выраженности цилиндрических муфт вокруг ресниц с 3,37±0,70 до 0,1±0,3 балла, а также покраснение конъюнктивы — с 1,32±0,30 до 0,94±0,40 балла (при оценке в баллах от 0 до 4, где 0 баллов — отсутствие симптома, 1 балл — наличие легких проявлений, 3 балла — умеренные проявления, 4 балла — выраженные проявления). Оценка индекса заболеваний глазной поверхности (OSDI) снизилась с 58,74±17,90 до 17,10±10,50 балла [59]. При монотерапии ивермектином уже на первой неделе лечения среднее количество особей Demodex сократилось, однако на 3-й неделе их количество увеличивалось [58]. У 21,7% пациентов, принимавших монотерапию ивермектином, клинического улучшения не наблюдалось, у 33,3% отмечалось выраженное улучшение, у 45% наступала полная ремиссия [58].
Использование комбинированной терапии метронидазолом и ивермектином приводило к значимому подавлению инвазии Demodex на протяжении всего срока наблюдения. Так, полная ремиссия фиксировалась у 71,6% пациентов, выраженное клиническое улучшение — у 26,7%. Клинического улучшения не отмечено только у 1,7% пациентов [58].
Использование комбинированного геля, содержащего 0,1% ивермектин и 1% метронидазол, приводило к полной эрадикации клеща Demodex у 96,6% исследуемых на 30-й день наблюдения [56].
Улучшение клинической картины в подгруппах, получавших комбинированную терапию, можно объяснить тем, что клещ Demodex способен вызывать иммунный ответ, приводящий к воспалительным изменениям, а метронидазол действует как противовоспалительный компонент [58–62].
В качестве дополнительного метода лечения в клинической практике были попытки использовать эфирное масло чайного дерева. Его получают методом паровой дистилляции из листьев Melaleuca alternifolia. Это масло издавна применяют аборигены Австралии для лечения ран и кожных инфекций [31, 63]. Оно обладает антибактериальным, противогрибковым, противовоспалительным и акарицидным эффектами [31, 64]. Масло чайного дерева содержит ряд веществ, основным механизмом действия которых является ингибирование ацетилхолинэстеразы, что приводит к накоплению ацетилхолина в нервных синапсах и вызывает нарушение нейротрансмиссии [65, 66]. Основное действующее вещество — терпинен-4-ол (T4O) [67–69].
Исследования in vitro показали, что клещи Demodex погибают за 90 мин воздействия 1% T4O и за 40 мин воздействия 4% T4O [33, 70]. В клинической практике использование масла чайного дерева в течение 1 мес привело к выздоровлению 7 из 9 пациентов с демодекозным блефаритом [31, 71].
При высокой эффективности компонентов масла чайного дерева вопрос безопасности его применения остается нерешенным, что обусловлено выявленными побочными реакциями. Особи D. brevis склонны располагаться глубоко в мейбомиевой железе, что может требовать более длительной экспозиции вещества и приводить к цитотоксичности Т4О, которую вызывает дозозависимое и времязависимое снижение выживаемости эпителиальных клеток мейбомиевых желез [33, 72]. Воздействие 1,0% T4O в течение 90 мин приводит к деструкции практически всех эпителиальных клеток. При снижении содержания T4O до 0,01% по-прежнему сохраняется цитотоксичность в отношении эпителиальных клеток мейбомиевых желез, однако данная концентрация не нарушает способности к их дифференцировке [33, 73]. В предлагаемых к продаже средствах гигиены концентрация Т4О выше, а схема рекомендуемого применения заключается в двукратном ежедневном использовании на протяжении 6 нед [74–77].
Известно, что масло чайного дерева вызывает аллергический контактный дерматит у 0,7% пациентов, прошедших патч-тест [78, 79]; образует вторичные органические аэрозоли, содержащие ультрамелкие частицы, которые могут вызывать воспаление и окислительный стресс [80, 81]; способствует развитию устойчивости к антибиотикам у патогенных и сапрофитных микроорганизмов при многократном использовании в сублетальных для бактерий концентрациях (0,10–0,25%) [82, 83].
Масло чайного дерева обладает эстрогенной (0,025% масло чайного дерева) и антиандрогенной (0,005% масло чайного дерева) активностью [84]. Эстрогены являются супрессорами секреции сальных желез и могут способствовать развитию дисфункции мейбомиевых желез [78, 85–88]. Антиандрогенные вещества могут индуцировать развитие синдрома сухого глаза, в то время как андрогены стимулируют липогенез и препятствуют излишней кератинизации мейбомиевых желез [89]. Известно, что мейбомиева железа является железой голокринового типа, поэтому ее клеткам необходима постоянная дифференцировка. Однако при использовании средств с концентрацией Т4О выше 0,01% этот процесс становится невозможным [33].
Импульсная лазерная терапия. Для лечения демодекоза возможно использование импульсного лазера с длиной волны 585 нм, который оказывает минимальное воздействие на окружающие ткани, однако механизм воздействия импульсной терапии на клеща Demodex до конца не изучен [90]. Предполагается, что поглощение кожей широкого спектра лучей от видимого до инфракрасного света приводит к выделению тепла [91]. Лазерная импульсная терапия может влиять на местный иммунитет, супрессия которого позволяет клещу Demodex персистировать в слоях кожи. Косвенно импульсная терапия способна действовать и на клеща, регулируя уровень трансформирующего фактора роста бета и связанные с ним иммунологические механизмы [92]. Эксперименты in vitro показали, что особи Demodex живут длительное время при температуре от 8 до 30°C, при этом оптимальная температура для их роста находится в диапазоне от 20 до 30°C [91, 93]. Температуры ниже 0°C и выше 37°C не благоприятствуют росту и развитию Demodex, 54°C — летальная температура, а 58°C — температура, необходимая для эффективного уничтожения клещей [91]. Группе авторов удалось in vitro при помощи видеомикроскопического наблюдения в режиме реального времени зафиксировать гибель клеща Demodex на предметном стекле при воздействии лазерного импульсного излучения. Отмечено прекращение двигательной активности особи после пяти последовательных сеансов импульсной терапии при нагревании предметного стекла до 49°C [94]. Можно предположить, что при использовании импульсной терапии достигается температура, при которой происходит коагуляция клеща Demodex с одновременным сохранением волосяных фолликулов [92, 93].
Особи Demodex содержат хромофоры, которые делают клеща более чувствительным к энергии, поступающей от лазера при импульсной терапии. Высказывается мнение, что более сферичные структуры, такие как клещ Demodex, не могут аккумулировать и рассеивать полученное количество энергии. По результатам проведенных исследований, общая частота эрадикации составила 55% через 1 мес лечения с помощью импульсной терапии, а к 3 мес она достигла 100% [91, 95]. При сравнительном анализе эффективности импульсной терапии и 5% масла чайного дерева уровень эрадикации клеща в первой группе пациентов составил 100%, а во второй — 75% [96]. Существует предположение, что импульсная терапия улучшает отток секрета мейбомиевых желез за счет уменьшения телеангиоэктазий по краю век в результате воздействия на оксигемоглобин, который как хромофор накапливает и преобразует полученную энергию в тепло, благодаря чему расширяются сосуды и снижается количество молекул маркеров воспаления [92, 95].
Лазер с длиной волны 577 нм применяется при лечении эритемы, телеангиэктазий, невусов и розацеа области лица [97]. В пилотном исследовании S.A. Temiz c соавт. [97] показано, что воздействие данного лазера снижало плотность Demodex на 4-й неделе терапии у 31 пациента и повышало у 3 пациентов. Данный факт требует дальнейшего изучения. По результатам другой группы исследователей, статистически значимых различий между плотностью особей Demodex до и после лечения лазером с длиной волны 577 нм не обнаружено [98].
В литературе описан опыт применения Nd:YAG-лазера с длиной волны 1064 нм для лечения эритемы лица с телеангиэктазиями демодекозной этиологии [99]. По результатам исследования, после двух процедур с интервалом в 1 мес наблюдалось уменьшение выраженности симптоматики и снижение количества клещей на 28,1%, что авторы связывают с тепловым воздействием на особь Demodex и последующим ее разрушением [99].
Сравнение методик лечения. При сравнении результативности различных методов терапии необходимо учитывать длительность их воздействия. При лечении в течение 1 мес наибольшая выраженность эффекта наблюдается на фоне системного приема ивермектина в сочетании с метронидазолом; при длительности лечения от 1 до 3 мес наилучшее воздействие оказывает местное применение ивермектина. Лазерная импульсная терапия демонстрирует высокие показатели эрадикации при длительности проведения более 3 мес [100]. Воздействие интенсивного импульсного света, местное применение ивермектина и масла чайного дерева могут обеспечить практически полную элиминации особей Demodex [100, 101].
Заключение
Блефарит демодекозной этиологии — достаточно распространенное заболевание, которое, однако, не всегда удается диагностировать. В связи с этим особую актуальность приобретает совершенствование неинвазивных технологий прижизненной визуализации с помощью нейронных сетей. Это позволит существенно повысить точность ранней диагностики и обеспечить своевременную инициацию этиотропного лечения. Консервативная терапия должна быть направлена на повышение эффективности лечения при одновременном снижении токсичности препаратов и сроков их применения. Одним из путей усовершенствования методов лечения демодекозного блефарита представляется комбинирование лекарственных средств и методов лазерного воздействия, однако такой подход требует дальнейшего изучения. Кроме того, необходима разработка стандартизированной шкалы тяжести, учитывающей клинические показатели, качество жизни и данные инструментальных методов исследования. Это позволит объективно оценивать динамику течения заболевания и выстраивать персонализированную тактику лечения.
Финансирование. Исследование выполнено за счет средств гранта Российского научного фонда №23-75-01007, https://rscf.ru/project/23-75-01007/.
Конфликт интересов отсутствует.
Литература
- Майчук Ю.Ф., Яни Е.В. Новые подходы в лечении блефаритов. Катарактальная и рефракционная хирургия 2012; 12(1): 59–62.
- Егоров Е.А., Романова Т.Б., Рыбакова Е.Г., Оганезова Ж.Г. Современные подходы к профилактике и лечению вторичного синдрома «сухого глаза». РМЖ. Клиническая офтальмология 2017; 17(1): 61–64.
- Белоусова Н.Ю., Полтанова Т.И. Демодекс vs человек (обзор литературы). Уральский медицинский журнал 2019; 12(180): 126–132.
- Дергачева Н.Н., Медведев И.Б. Клинико-лабораторная оценка эффективности средств на основе метронидазола и дегтя в лечении блефаритов демодекозной этиологии. Современные технологии в офтальмологии 2020; 4(35): 185–186, https://doi.org/10.25276/2312-4911-2020-4-185-186.
- Сидоренко Е.Е., Назаренко А.О., Суханова И.В., Мигель Д.В., Абрамова Т.В. Демодекоз век — современные аспекты лечения. Quantum Satis 2021; 4(1–4): 47–51.
- Lindsley K., Matsumura S., Hatef E., Akpek E.K. Interventions for chronic blepharitis. Cochrane Database Syst Rev 2012; 2012(5):CD005556, https://doi.org/10.1002/14651858.CD005556.pub2.
- Navel V., Mulliez A., Benoist d’Azy C., Baker J.S., Malecaze J., Chiambaretta F., Dutheil F. Efficacy of treatments for Demodex blepharitis: a systematic review and meta-analysis. Ocul Surf 2019; 17(4): 655–669, https://doi.org/10.1016/j.jtos.2019.06.004.
- Holzchuh F.G., Hida R.Y., Moscovici B.K., Villa Albers M.B., Santo R.M., Kara-José N., Holzchuh R. Clinical treatment of ocular Demodex folliculorum by systemic ivermectin. Am J Ophthalmol 2011; 151(6): 1030–1034.e1, https://doi.org/10.1016/j.ajo.2010.11.024.
- Liu J., Sheha H., Tseng S.C. Pathogenic role of Demodex mites in blepharitis. Curr Opin Allergy Clin Immunol 2010; 10(5): 505–510, https://doi.org/10.1097/ACI.0b013e32833df9f4.
- Ting D.S.W., Pasquale L.R., Peng L., Campbell J.P., Lee A.Y., Raman R., Tan G.S.W., Schmetterer L., Keane P.A., Wong T.Y. Artificial intelligence and deep learning in ophthalmology. Br J Ophthalmol 2019; 103(2): 167–175, https://doi.org/10.1136/bjophthalmol-2018-313173.
- Liu X., Fu Y., Wang D., Huang S., He C., Yu X., Zhang Z., Kong D., Dai Q. Uneven index: a digital biomarker to prompt Demodex blepharitis based on deep learning. Front Physiol 2022; 13: 934821, https://doi.org/10.3389/fphys.2022.934821.
- Alexander J.O. Arthropods and human skin. Germany: Springer-Verlag; 1984.
- Schaller M. Carl Gustav Theodor Simon (1810–1857). In: C. Löser, G. Plewig, W.H.C. Burgdorf (eds.). Pantheon of dermatology: outstanding historical figures. Berlin, Heidelberg: Springer; 2013; p. 1039–1045.
- Trattler W., Karpecki P., Rapoport Y., Sadri E., Schachter S., Whitley W.O., Yeu E. The prevalence of Demodex blepharitis in US eye care clinic patients as determined by collarettes: a pathognomonic sign. Clin Ophthalmol 2022; 16: 1153–1164, https://doi.org/10.2147/OPTH.S354692.
- Wilkin J.K. Oral thermal-induced flushing in erythematotelangiectatic rosacea. J Invest Dermatol 1981; 76(1): 15–18, https://doi.org/10.1111/1523-1747.ep12524458.
- Kulac M., Ciftci I.H., Karaca S., Cetinkaya Z. Clinical importance of Demodex folliculorum in patients receiving phototherapy. Int J Dermatol 2008; 47(1): 72–77, https://doi.org/10.1111/j.1365-4632.2007.03336.x.
- Tighe S., Gao Y.Y., Tseng S.C. Terpinen-4-ol is the most active ingredient of tea tree oil to kill Demodex mites. Transl Vis Sci Technol 2013; 2(7): 2, https://doi.org/10.1167/tvst.2.7.2.
- Bitton E., Aumond S. Demodex and eye disease: a review. Clin Exp Optom 2021; 104(3): 285–294, https://doi.org/10.1111/cxo.13123.
- Желтикова Т.М. Демодекоз: мифы и реальность. Педиатрия. Приложение к журналу Consilium Medicum 2011; 3: 73.
- Майчук Д.Ю. Блефариты — демодекоз, аллергия, инфекция — как это все связать? Новое в офтальмологии 2013; 3: 42–47.
- Дамиан Ч., Данута И.К.Б. Демодекоз век. Российский офтальмологический журнал 2014; 7(4): 107–110.
- Адаскевич В.П. Демодекоз: этиология, патогенез, клинические формы, диагностика, лечение. Дерматовенерология. Косметология 2015; 1(01): 60–71.
- Hu L., Zhao Y., Niu D., Gong X., Yang R. De novo transcriptome sequencing and differential gene expression analysis of two parasitic human Demodex species. Parasitol Res 2019; 118(12): 3223–3235, https://doi.org/10.1007/s00436-019-06461-0.
- English F.P., Nutting W.B. Feeding characteristics in demodectic mites of the eyelid. Aust J Ophthalmol 1981; 9(4): 311–313, https://doi.org/10.1111/j.1442-9071.1981.tb00928.x.
- English F.P., Zhang G.W., McManus D.P., Campbell P. Electron microscopic evidence of acarine infestation of the eyelid margin. Am J Ophthalmol 1990; 109(2): 239–240, https://doi.org/10.1016/s0002-9394(14)76003-9.
- Köksal M., Kargi S., Tayşi B.N., Uğurbaş S.H. A rare agent of chalazion: demodectic mites. Can J Ophthalmol 2003; 38(7): 605–606, https://doi.org/10.1016/s0008-4182(03)80117-5.
- Lacey N., Delaney S., Kavanagh K., Powell F.C. Mite-related bacterial antigens stimulate inflammatory cells in rosacea. Br J Dermatol 2007; 157(3): 474–481, https://doi.org/10.1111/j.1365-2133.2007.08028.x.
- Valenton M.J., Okumoto M. Toxin-producing strains of Staphylococcus epidermidis (albus). Isolates from patients with staphylococcic blepharoconjunctivitis. Arch Ophthalmol 1973; 89(3): 186–189, https://doi.org/10.1001/archopht.1973.01000040188004.
- Seal D., Ficker L., Ramakrishnan M., Wright P. Role of staphylococcal toxin production in blepharitis. Ophthalmology 1990; 97(12): 1684–1688, https://doi.org/10.1016/s0161-6420(90)32361-8.
- Gao Y.Y., Di Pascuale M.A., Li W., Liu D.T., Baradaran-Rafii A., Elizondo A., Kawakita T., Raju V.K., Tseng S.C. High prevalence of Demodex in eyelashes with cylindrical dandruff. Invest Ophthalmol Vis Sci 2005; 46(9): 3089–3094, https://doi.org/10.1167/iovs.05-0275.
- Gao Y.Y., Di Pascuale M.A., Li W., Baradaran-Rafii A., Elizondo A., Kuo C.L., Raju V.K., Tseng S.C. In vitro and in vivo killing of ocular Demodex by tea tree oil. Br J Ophthalmol 2005; 89(11): 1468–1473, https://doi.org/10.1136/bjo.2005.072363.
- English F.P. Demodex folliculorum and oedema of the eyelash. Br J Ophthalmol 1971; 55(11): 742–746, https://doi.org/10.1136/bjo.55.11.742.
- Chen D., Wang J., Sullivan D.A., Kam W.R., Liu Y. Effects of terpinen-4-ol on meibomian gland epithelial cells in vitro. Cornea 2020; 39(12): 1541–1546, https://doi.org/10.1097/ICO.0000000000002506.
- Muntz A., Purslow C., Wolffsohn J.S., Craig J.P. Improved Demodex diagnosis in the clinical setting using a novel in situ technique. Cont Lens Anterior Eye 2020; 43(4): 345–349, https://doi.org/10.1016/j.clae.2019.11.009.
- Zhong J., Tan Y., Li S., Peng L., Wang B., Deng Y., Yuan J. The prevalence of Demodex folliculorum and Demodex brevis in cylindrical dandruff patients. J Ophthalmol 2019; 2019: 8949683, https://doi.org/10.1155/2019/8949683.
- Mastrota K.M. Method to identify Demodex in the eyelash follicle without epilation. Optom Vis Sci 2013; 90(6): e172–e174, https://doi.org/10.1097/OPX.0b013e318294c2c0.
- Randon M., Liang H., El Hamdaoui M., Tahiri R., Batellier L., Denoyer A., Labbé A., Baudouin C. In vivo confocal microscopy as a novel and reliable tool for the diagnosis of Demodex eyelid infestation. Br J Ophthalmol 2015; 99(3): 336–341, https://doi.org/10.1136/bjophthalmol-2014-305671.
- Sattler E.C., Maier T., Hoffmann V.S., Hegyi J., Ruzicka T., Berking C. Noninvasive in vivo detection and quantification of Demodex mites by confocal laser scanning microscopy. Br J Dermatol 2012; 167(5): 1042–1047, https://doi.org/10.1111/j.1365-2133.2012.11096.x.
- Messmer E.M., Torres Suárez E., Mackert M.I., Zapp D.M., Kampik A. Konfokale In-vivo-Mikroskopie bei Blepharitis [In vivo confocal microscopy in blepharitis]. Klin Monbl Augenheilkd 2005; 222(11): 894–900, https://doi.org/10.1055/s-2005-858798.
- Welzel J., Lankenau E., Birngruber R., Engelhardt R. Optical coherence tomography of the human skin. J Am Acad Dermatol 1997; 37(6): 958–963, https://doi.org/10.1016/s0190-9622(97)70072-0.
- Соколова Т.В., Голицына М.В., Малярчук А.П., Лопатина Ю.В. Диагностика демодекоза: за и против. Клиническая дерматология и венерология 2022; 21(3): 383–389, https://doi.org/10.17116/klinderma202221031383.
- Кубанов А.А., Галлямова Ю.А., Гревцева А.С. Особенности клинической картины течения демодекоза. Лечащий врач 2015; 11: 24.
- Maier T., Sattler E., Braun-Falco M., Ruzicka T., Berking C. High-definition optical coherence tomography for the in vivo detection of Demodex mites. Dermatology 2012; 225(3): 271–276, https://doi.org/10.1159/000345364.
- Каталевская Е.А., Сизов А.Ю., Гилемзянова Л.И. Алгоритм искусственного интеллекта для сегментации патологических структур на сканах оптической когерентной томографии сетчатки глаза. Российский журнал телемедицины и электронного здравоохранения 2022; 8(3): 21–27, https://doi.org/10.29188/2712-9217-2022-8-3-21-27.
- Тахчиди Х.П., Глизница П.В., Светозарский С.Н., Бурсов А.И., Шустерзон К.А. Разметка цветных фотографий глазного дна улучшает распознавание макулярной патологии с помощью глубокого обучения. Вестник Российского государственного медицинского университета 2021; 4: 29–35, https://doi.org/10.24075/vrgmu.2021.040.
- Каталевская Е.А., Каталевский Д.Ю., Тюриков М.И., Велиева И.А., Большунов А.В. Перспективы использования искусственного интеллекта в диагностике и лечении заболеваний сетчатки. РМЖ. Клиническая офтальмология 2022; 22(1): 36–43, https://doi.org/10.32364/2311-7729-2022-22-1-36-43.
- Sitnova A.V., Svetozarskiy S.N. Modern technologies in diagnosis of fungal keratitis (review). Sovremennye tehnologii v medicine 2023; 15(2): 73–84, https://doi.org/10.17691/stm2023.15.2.07.
- Ting D.S.J., Foo V.H., Yang L.W.Y., Sia J.T., Ang M., Lin H., Chodosh J., Mehta J.S., Ting D.S.W. Artificial intelligence for anterior segment diseases: emerging applications in ophthalmology. Br J Ophthalmol 2021; 105(2): 158–168, https://doi.org/10.1136/bjophthalmol-2019-315651.
- Salahouddin T., Petropoulos I.N., Ferdousi M., Ponirakis G., Asghar O., Alam U., Kamran S., Mahfoud Z.R., Efron N., Malik R.A., Qidwai U.A. Artificial intelligence-based classification of diabetic peripheral neuropathy from corneal confocal microscopy images. Diabetes Care 2021; 44(7): e151–e153, https://doi.org/10.2337/dc20-2012.
- Preston F.G., Meng Y., Burgess J., Ferdousi M., Azmi S., Petropoulos I.N., Kaye S., Malik R.A., Zheng Y., Alam U. Artificial intelligence utilising corneal confocal microscopy for the diagnosis of peripheral neuropathy in diabetes mellitus and prediabetes. Diabetologia 2022; 65(3): 457–466, https://doi.org/10.1007/s00125-021-05617-x.
- Bao X.L., Sun Y.J., Zhan X., Li G.Y. Orbital and eyelid diseases: The next breakthrough in artificial intelligence? Front Cell Dev Biol 2022; 10: 1069248, https://doi.org/10.3389/fcell.2022.1069248.
- Samuelson J. Why metronidazole is active against both bacteria and parasites. Antimicrob Agents Chemother 1999; 43(7): 1533–1541, https://doi.org/10.1128/AAC.43.7.1533.
- Paichitrojjana A., Chalermchai T. Comparison of in vitro killing effect of Thai herbal essential oils, tea tree oil, and Metronidazole 0.75% versus Ivermectin 1% on Demodex folliculorum. Clin Cosmet Investig Dermatol 2023; 16: 1279–1286, https://doi.org/10.2147/CCID.S414737.
- Краснюк И.И. мл., Нарышкин С.Р., Беляцкая А.В., Тарасов В.В., Степанова О.И., Краснюк И.И., Грих В.В., Овсянникова Л.В., Мазяркин Е.В., Воробьев А.Н. Метронидазол — 60 лет применения. Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация 2020; 1: 81–90.
- Sattler E.C., Hoffmann V.S., Ruzicka T., Braunmühl T.V., Berking C. Reflectance confocal microscopy for monitoring the density of Demodex mites in patients with rosacea before and after treatment. Br J Dermatol 2015; 173(1): 69–75, https://doi.org/10.1111/bjd.13783.
- Ávila M.Y., Martínez-Pulgarín D.F., Rizo Madrid C. Topical ivermectin-metronidazole gel therapy in the treatment of blepharitis caused by Demodex spp.: a randomized clinical trial. Cont Lens Anterior Eye 2021; 44(3): 101326, https://doi.org/10.1016/j.clae.2020.04.011.
- Kane N.S., Hirschberg B., Qian S., Hunt D., Thomas B., Brochu R., Ludmerer S.W., Zheng Y., Smith M., Arena J.P., Cohen C.J., Schmatz D., Warmke J., Cully D.F. Drug-resistant Drosophila indicate glutamate-gated chloride channels are targets for the antiparasitics nodulisporic acid and ivermectin. Proc Natl Acad Sci U S A 2000; 97(25): 13949–13954, https://doi.org/10.1073/pnas.240464697.
- Salem D.A., El-Shazly A., Nabih N., El-Bayoumy Y., Saleh S. Evaluation of the efficacy of oral ivermectin in comparison with ivermectin-metronidazole combined therapy in the treatment of ocular and skin lesions of Demodex folliculorum. Int J Infect Dis 2013; 17(5): e343–e347, https://doi.org/10.1016/j.ijid.2012.11.022.
- Valvecchia F., Greco L., Perrone F., Logioco C., Caride G.G., Perrone L., Valvecchia G., Albertazzi R., Zanutigh V. Topical ivermectin ointment treatment of Demodex blepharitis: a 6-year retrospective study. Graefes Arch Clin Exp Ophthalmol 2024; 262(4): 1281–1288, https://doi.org/10.1007/s00417-023-06281-0.
- Persi A., Rebora A. Metronidazole in the treatment of rosacea. Arch Dermatol 1985; 121(3): 307–308, https://doi.org/10.1001/archderm.1985.01660030027007.
- Ayres S., Mihan R. Demodex folliculorum in rosacea. Arch Dermatol 1970; 101(6): 706, https://doi.org/10.1001/archderm.1970.04000060078024.
- Глизница П.В., Тахчиди Х.П., Светозарский С.Н., Бурсов А.И., Шустерзон К.А. Машинное обучение в диагностике и лечении офтальмологических заболеваний. Head and Neck/Голова и шея. Российское издание. Журнал Общероссийской общественной организации Федерация специалистов по лечению заболеваний головы и шеи 2022; 10(1): 83–90, https://doi.org/10.25792/HN.2022.10.1.83-90.
- Capasso L., Abbinante G., Coppola A., Salerno G., De Bernardo M. Recent evidence of tea tree oil effectiveness in blepharitis treatment. Biomed Res Int 2022; 2022: 9204251, https://doi.org/10.1155/2022/9204251.
- Рикс И.А., Труфанов С.В., Бутаба Р. Современные подходы к лечению дисфункции мейбомиевых желез. Вестник офтальмологии 2021; 137(1): 130–136, https://doi.org/10.17116/oftalma2021137011130.
- Thapa S., Lv M., Xu H. Acetylcholinesterase: a primary target for drugs and insecticides. Mini Rev Med Chem 2017; 17(17): 1665–1676, https://doi.org/10.2174/1389557517666170120153930.
- de Oliveira G.P., Barreto D.L.C., Ramalho Silva M., Augusti R., Evódio Marriel I., Gomes de Paula Lana U., Takahashi J.A. Biotic stress caused by in vitro co-inoculation enhances the expression of acetylcholinesterase inhibitors by fungi. Nat Prod Res 2022; 36(16): 4266–4270, https://doi.org/10.1080/14786419.2021.1975701.
- Mills C., Cleary B.J., Gilmer J.F., Walsh J.J. Inhibition of acetylcholinesterase by tea tree oil. J Pharm Pharmacol 2004; 56(3): 375–379, https://doi.org/10.1211/0022357022773.
- Man Peles I., Zahavi A., Chemodanova E., Vardizer Y. Novel in-office technique for visual confirmation of Demodex infestation in blepharitic patients. Cornea 2020; 39(7): 858–861, https://doi.org/10.1097/ICO.0000000000002254.
- Bulut A., Tanriverdi C. Anti-Demodex effect of commercial eyelid hygiene products. Semin Ophthalmol 2021; 36(8): 719–722, https://doi.org/10.1080/08820538.2021.1897859.
- Jacobi C., Doan S., Pavel V., Chiambaretta F., Kärcher T. Different approach to manage Demodex blepharitis — initial and maintenance treatment. Curr Eye Res 2022; 47(3): 352–360, https://doi.org/10.1080/02713683.2021.1978099.
- Lee Y.I., Seo M., Cho K.J. Demodex blepharitis: an analysis of nine patients. Korean J Parasitol 2022; 60(6): 429–432, https://doi.org/10.3347/kjp.2022.60.6.429.
- Tharmarajah B., Coroneo M.T. Corneal effects of tea tree oil. Cornea 2021; 40(10): 1363–1364, https://doi.org/10.1097/ICO.0000000000002776.
- Mohammad-Rabei H., Arabi A., Shahraki T., Rezaee-Alam Z., Baradaran-Rafii A. Role of blepharoexfoliation in Demodex blepharitis: a randomized comparative study. Cornea 2023; 42(1): 44–51, https://doi.org/10.1097/ICO.0000000000003046.
- Cheng A.M., Sheha H., Tseng S.C. Recent advances on ocular Demodex infestation. Curr Opin Ophthalmol 2015; 26(4): 295–300, https://doi.org/10.1097/ICU.0000000000000168.
- Zhang N., Wen K., Liu Y., Huang W., Liang X., Liang L. High prevalence of Demodex infestation is associated with poor blood glucose control in type 2 diabetes mellitus: a cross-sectional study in the guangzhou diabetic eye study. Cornea 2023; 42(6): 670–674, https://doi.org/10.1097/ICO.0000000000003116.
- Cheung I.M.Y., Xue A.L., Kim A., Ammundsen K., Wang M.T.M., Craig J.P. In vitro anti-demodectic effects and terpinen-4-ol content of commercial eyelid cleansers. Cont Lens Anterior Eye 2018; 41(6): 513–517, https://doi.org/10.1016/j.clae.2018.08.003.
- Fromstein S.R., Harthan J.S., Patel J., Opitz D.L. Demodex blepharitis: clinical perspectives. Clin Optom (Auckl) 2018; 10: 57–63, https://doi.org/10.2147/OPTO.S142708.
- Rutherford T., Nixon R., Tam M., Tate B. Allergy to tea tree oil: retrospective review of 41 cases with positive patch tests over 4.5 years. Australas J Dermatol 2007; 48(2): 83–87, https://doi.org/10.1111/j.1440-0960.2007.00341.x.
- Ambrogio F., Foti C., Cazzato G., Mortato E., Mazzoccoli S., De Caro A.P., Cassano N., Vena G.A., Calogiuri G., Romita P. Spreading allergic contact dermatitis to tea tree oil in an over-the-counter product applied on a wart. Medicina (Kaunas) 2022; 58(5): 561, https://doi.org/10.3390/medicina58050561.
- Hsu D.-J., Huang H.-L., Sheu S.-C. Characteristics of air pollutants and assessment of potential exposure in spa centers druing aromatherapy. Env Eng Sci 2012; 29: 79–85, https://doi.org/10.1089/ees.2011.0004.
- de Groot A.C., Schmidt E. Tea tree oil: contact allergy and chemical composition. Contact Dermatitis 2016; 75(3): 129–143, https://doi.org/10.1111/cod.12591.
- McMahon M.A., Blair I.S., Moore J.E., McDowell D.A. Habituation to sub-lethal concentrations of tea tree oil (Melaleuca alternifolia) is associated with reduced susceptibility to antibiotics in human pathogens. J Antimicrob Chemother 2007; 59(1): 125–127, https://doi.org/10.1093/jac/dkl443.
- Yasin M., Younis A., Javed T., Akram A., Ahsan M., Shabbir R., Ali M.M., Tahir A., El-Ballat E.M., Sheteiwy M.S., Sammour R.H., Hano C., Alhumaydhi F.A., El-Esawi M.A. River tea tree oil: composition, antimicrobial and antioxidant activities, and potential applications in agriculture. Plants (Basel) 2021; 10(10): 2105, https://doi.org/10.3390/plants10102105.
- Nielsen J.B. What you see may not always be what you get — bioavailability and extrapolation from in vitro tests. Toxicol In Vitro 2008; 22(4): 1038–1042, https://doi.org/10.1016/j.tiv.2007.12.013.
- Knop E., Knop N., Millar T., Obata H., Sullivan D.A. The international workshop on meibomian gland dysfunction: report of the subcommittee on anatomy, physiology, and pathophysiology of the meibomian gland. Invest Ophthalmol Vis Sci 2011; 52(4): 1938–1978, https://doi.org/10.1167/iovs.10-6997c.
- Han D., Kim H., Kim S., Park Y., Cho K.J. Comparative study on the effect of hyperthermic massage and mechanical squeezing in the patients with mild and severe meibomian gland dysfunction: an interventional case series. PLoS One 2021; 16(3):e0247365, https://doi.org/10.1371/journal.pone.0247365.
- Golebiowski B., Badarudin N., Eden J., You J., Hampel U., Stapleton F. Does endogenous serum oestrogen play a role in meibomian gland dysfunction in postmenopausal women with dry eye? Br J Ophthalmol 2017; 101(2): 218–222, https://doi.org/10.1136/bjophthalmol-2016-308473.
- Xiao J., Adil M.Y., Chen X., Utheim Ø.A., Ræder S., Tønseth K.A., Lagali N.S., Dartt D.A., Utheim T.P. Functional and morphological evaluation of meibomian glands in the assessment of meibomian gland dysfunction subtype and severity. Am J Ophthalmol 2020; 209: 160–167, https://doi.org/10.1016/j.ajo.2019.09.005.
- Krenzer K.L., Dana M.R., Ullman M.D., Cermak J.M., Tolls D.B., Evans J.E., Sullivan D.A. Effect of androgen deficiency on the human meibomian gland and ocular surface. J Clin Endocrinol Metab 2000; 85(12): 4874–4882, https://doi.org/10.1210/jcem.85.12.7072.
- Arita R., Fukuoka S. Therapeutic efficacy and safety of intense pulsed light for refractive multiple recurrent chalazia. J Clin Med 2022; 11(18): 5338, https://doi.org/10.3390/jcm11185338.
- Murube J. Demodex hominis. Ocul Surf 2015; 13(3): 181–186, https://doi.org/10.1016/j.jtos.2015.04.002.
- Ertaş R., Yaman O., Akkuş M.R., Özlü E., Avcı A., Ulaş Y., Ozyurt K., Atasoy M. The rapid effect of pulsed dye laser on Demodex density of facial skin. J Cosmet Laser Ther 2019; 21(3): 123–126, https://doi.org/10.1080/14764172.2018.1481509.
- Prieto V.G., Sadick N.S., Lloreta J., Nicholson J., Shea C.R. Effects of intense pulsed light on sun-damaged human skin, routine, and ultrastructural analysis. Lasers Surg Med 2002; 30(2): 82–85, https://doi.org/10.1002/lsm.10042.
- Fishman H.A., Periman L.M., Shah A.A. Real-time video microscopy of in vitro Demodex death by intense pulsed light. Photobiomodul Photomed Laser Surg 2020; 38(8): 472–476, https://doi.org/10.1089/photob.2019.4737.
- Gupta P.K., Vora G.K., Matossian C., Kim M., Stinnett S. Outcomes of intense pulsed light therapy for treatment of evaporative dry eye disease. Can J Ophthalmol 2016; 51(4): 249–253, https://doi.org/10.1016/j.jcjo.2016.01.005.
- Zhang X., Song N., Gong L. Therapeutic effect of intense pulsed light on ocular demodicosis. Curr Eye Res 2019; 44(3): 250–256, https://doi.org/10.1080/02713683.2018.1536217.
- Temiz S.A., Durmaz K., Işık B., Ataseven A., Dursun R. The effect of 577-nm pro-yellow laser on Demodex density in patients with rosacea. J Cosmet Dermatol 2022; 21(1): 242–246, https://doi.org/10.1111/jocd.14085.
- Altunisik N., Turkmen D., Sener S. Evaluation of the effect of 577-nm pro-yellow laser on Demodex intensity. J Cosmet Laser Ther 2021; 23(7-8): 221–224, https://doi.org/10.1080/14764172.2022.2075898.
- Yalici-Armagan B., Elcin G. The decrease of Demodex density after Nd:YAG laser application for facial telengiactasias: a case report. Dermatol Ther 2020; 33(6): e14108, https://doi.org/10.1111/dth.14108.
- Li J., Wei E., Reisinger A., French L.E., Clanner-Engelshofen B.M., Reinholz M. Comparison of different anti-Demodex strategies: a systematic review and meta-analysis. Dermatology 2023; 239(1): 12–31, https://doi.org/10.1159/000526296.
- Yurekli A., Botsali A. The comparative in vitro killing activity of tea tree oil versus permethrin on Demodex folliculorum of rosacea patients. J Cosmet Dermatol 2022; 21(5): 2268–2272, https://doi.org/10.1111/jocd.14701.