Возможности флуоресцентной спектроскопии биотканей человека в портативном мультимодальном исполнении
Патологические процессы в биотканях характеризуются смещением метаболического гомеостаза, что вызывает биохимические изменения, которые могут быть обнаружены с помощью методов флуоресцентной спектроскопии. Широкий спектр возможностей, простота реализации и ценность получаемой диагностической информации обусловливают высокий интерес к таким методам со стороны научного медицинского сообщества.
Цель исследования — анализ существующих проблем применения метода флуоресцентной спектроскопии биотканей и демонстрация ее новых возможностей в портативном мультимодальном исполнении для решения различных диагностических задач практической медицины.
Теоретическая часть исследования. Рассмотрены факторы, влияющие на регистрацию флуоресценции биотканей. Установлено, что оценка митохондриальной функции (окислительного метаболизма) по спектрам НАДН и ФАД возможна только с определенными допущениями из-за сложности учета вклада коллагена и ряда других флуорофоров во флуоресценцию. Изучены возможности мультимодального подхода: совмещение флуоресцентной спектроскопии и лазерной допплеровской флоуметрии в одном диагностическом устройстве, в частности в виде портативного варианта приборной реализации.
Экспериментальная часть исследования. Для демонстрации возможностей применения портативных анализаторов окислительного метаболизма биотканей проведены пилотные экспериментальные исследования с участием 8 условно здоровых добровольцев. Параметры микроциркуляторно-тканевых систем (окислительного метаболизма) регистрировали с помощью модифицированного мультимодального портативного анализатора, позволяющего измерять спектры флуоресценции кожи в широком спектральном диапазоне — от 320 до 900 нм. Кожную флуоресценцию регистрировали в области лба, дорсальной поверхности запястья, волярной поверхности дистальной фаланги третьего пальца кисти и плантарной поверхности дистальной фаланги первого пальца стопы при длине волны возбуждающего излучения 365 нм.
Проведенный эксперимент показал, что, несмотря на существенное влияние кровенаполнения биоткани совместно с уровнем меланина на регистрируемый спектр флуоресценции, оценка интенсивности кожной флуоресценции в динамике при использовании функциональных тестов отражает изменения метаболических процессов биотканей и может рассматриваться в качестве перспективного диагностического критерия.
Введение
В последние десятилетия методы флуоресцентной спектроскопии (ФС) и визуализации становятся все более востребованными для диагностики метаболических процессов в биологических тканях [1]. Метод ФС основан на зондировании биоткани оптическим излучением в ультрафиолетовом или видимом диапазоне с последующей записью спектров автофлуоресценции эндогенных и экзогенных флуорофоров биоткани [2, 3]. Биологические ткани являются многокомпонентными структурами со сложным химическим составом и содержат в себе большое разнообразие естественных эндогенных флуорофоров, характеризующихся различными областями поглощения и эмиссии, разными квантовыми выходами и временем жизни флуоресценции. Общий сигнал автофлуоресценции находится в зависимости как от количественного содержания флуорофоров в биологической ткани, так и от их пространственного распределения, а также тесно связан с метаболическим статусом биоткани и ее морфологией в нормальных или патологических условиях. К числу веществ, обладающих наиболее выраженной автофлуоресценцией в биологических тканях, относят такие коферменты, как восстановленный никотинамидадениндинуклеотид (НАДН) и флавинадениндинуклеотид (ФАД), структурные белки тканей — коллаген и эластин, аминокислоты — триптофан и тирозин, а также порфирины, липофусцины и меланин [4–6]. В клинической практике метод ФС применяется для диагностики патологических изменений в биологических тканях посредством анализа различий параметров интенсивности, времени жизни и спектрального состава сигнала флуоресценции нормальных и пораженных тканей [7, 8]. Флуоресцентные методы позволяют на ранних стадиях обнаруживать биохимические изменения в тканях, связанные с патологическими метаболическими перестройками. Среди указанных флуорофоров именно НАДН и ФАД принимают непосредственное участие в энергетических процессах в клетках и являются индикаторами их метаболического статуса. Клинические исследования показали, что вариации таких параметров, как интенсивность и время жизни флуоресценции НАДН и ФАД, обусловленные изменением их концентрации и взаимодействием с различными белками, отражают метаболические сдвиги, вызванные протеканием патологических процессов [7]. В связи с этим мониторинг параметров флуоресценции биотканей может быть использован для выявления окислительного метаболизма. Такой подход актуален как при диагностике заболеваний различной этиологии, так и при исследовании адаптационных процессов организма человека. Особенно перспективным мониторинг параметров флуоресценции представляется в функциональной диагностике, аэрокосмической и спортивной медицине [1, 9, 10].
Впервые оптические методы были применены в 50-е гг. XX в. для определения параметров дыхательной цепи и оценки митохондриальной функции in vitro [11]. В 1965 г. была опубликована работа, продемонстрировавшая возможности измерений флуоресценции НАДН для задач отслеживания динамики изменений метаболической активности биологических тканей in vivo [12]. В следующие десятилетия ФС зарекомендовала себя как метод, открывающий возможности для ранней диагностики патологических процессов за счет мониторинга окислительного метаболизма в биотканях [10]. В 1980–1990 гг. появляются результаты первых исследований по применению ФС для дифференциации доброкачественных и злокачественных новообразований молочных желез и легких [5, 13, 14]. К настоящему времени достигнут значительный прогресс в использовании флуоресценции для выявления опухолей различных органов [6, 15–17] и оценки метаболической активности тканей при воспалительных процессах [10, 18]. Одни из первых исследований по применению метода ФС в диагностике и лечении охватывали такие области медицины, как гастроэнтерология, урология, гинекология [19–22]. Особый интерес представляют исследования, сосредоточенные на диагностике и фотодинамической терапии онкологических заболеваний [23, 24]. В ряде работ ФС используется как основной диагностический метод в составе устройств с тонкоигольными оптоволоконными зондами малого диаметра для распознавания опухолей легких [25, 26] и молочных желез [27, 28]. В последние десятилетия в клинической практике изменение концентрации НАДН, ФАД и коллагена в тканях служит биомаркером опухолевых процессов [29–31] и применяется для оценки содержания конечных продуктов гликирования в тканях. Это особенно актуально для пациентов с сахарным диабетом [32, 33], для оценки состояния кожных покровов в дерматологии [34], а также для других областей биомедицинских исследований [35]. Таким образом, очевидно, что метод ФС нашел широкое применение в различных сферах медицины, в том числе в онкологии, трансплантологии, косметологии и хирургии [36–40].
Для анализа кровотока также применяют меченные флуоресцентными красителями наночастицы [41]. Данный метод имеет свои ограничения, связанные, например, с фототоксичностью ультрафиолетового излучения, применяемого в практике ФС для возбуждения флуоресценции. Безопасность измерений в живых тканях обеспечивается путем ограничения как плотности мощности светового излучения, так и времени проведения диагностических процедур (например, путем применения импульсных режимов работы источников для возбуждения флуоресценции).
Цель данной работы — анализ существующих проблем применения метода флуоресцентной спектроскопии биотканей и демонстрация ее новых возможностей в портативном мультимодальном исполнении для решения различных диагностических задач практической медицины.
Теоретическая часть исследования
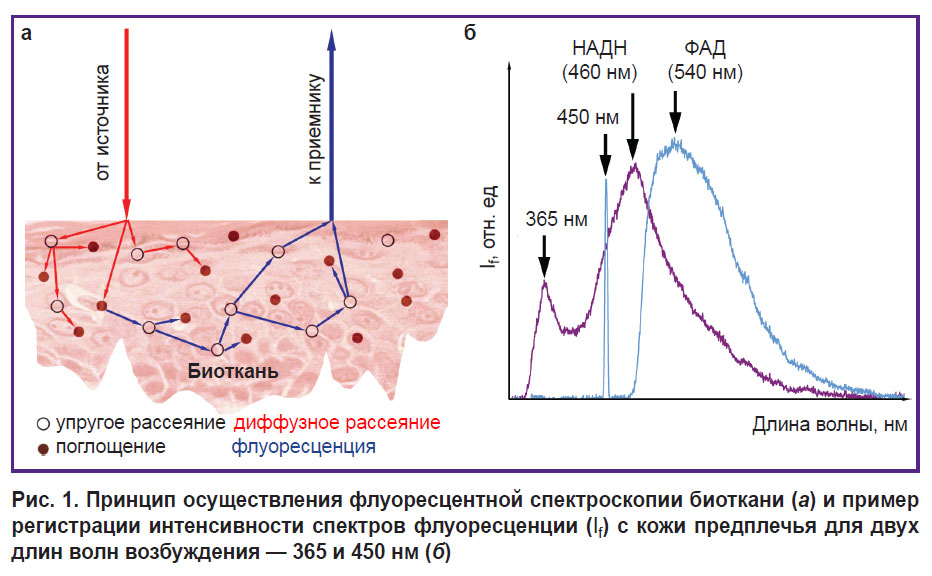
Анализ факторов, влияющих на регистрацию флуоресценции биотканей. В коже человека присутствует большое количество природных флуорофоров с близкими или перекрывающимися спектральными областями поглощения и флуоресценции, в результате чего флуоресцентное излучение, выходящее из биоткани, имеет сложный спектральный состав. На регистрируемый сигнал флуоресценции биоткани влияет множество факторов: температура, оптические свойства исследуемого образца (рассеяние и поглощение) [42], топологическая неоднородность, особенности приборов (качество источников возбуждающего излучения, характеристики фотоприемной части, особенности торца волоконного световода, расстояние между источником и приемником — база измерений) [43] и др. (рис. 1, а). В совокупности данные факторы оказывают непосредственное влияние на результаты измерений, их разброс и сходимость, что определяет достижение клинически значимых и достоверных результатов.
В настоящее время для исследования метаболических процессов в биоткани наиболее часто используются спектральные диапазоны возбуждения флуоресценции кожи: ультрафиолетовый (350–380 нм) для регистрации НАДН (максимум флуоресценции в диапазоне 450–470 нм) и синий свет (400–450 нм) для регистрации ФАД (максимум флуоресценции в диапазоне 530–550 нм) [36]. Пример регистрации спектров флуоресценции НАДН и ФАД с кожи предплечья здорового добровольца для двух длин волн возбуждения (365 и 450 нм соответственно) представлен на рис. 1, б.
Следует подчеркнуть, что при использовании данных длин волн (365 и 450 нм) для возбуждения кожной флуоресценции необходимо учитывать значительный вклад коллагена в регистрируемый спектр (он присутствует в дерме в виде коллагеновых волокон — 75% дермальной ткани) [44, 45]. Кроме того, помимо указанных флуорофоров (НАДН и ФАД), вклад в модификацию спектра кожи в диапазоне флуоресценции 400–480 нм вносят кератин, билирубин, порфирины и каротиноиды, что еще более усложняет анализ регистрируемых данных. На регистрируемые спектры кожной флуоресценции также оказывает существенное влияние кровенаполнение биотканей за счет поглощения оптического излучения гемоглобином: с увеличением объема крови в дерме интенсивность флуоресценции уменьшается [46]. Таким образом, локальное надавливание оптических зондов, с помощью которых производится регистрация флуоресценции, влияет на оптические характеристики биоткани за счет изменения содержания крови в поверхностном сосудистом сплетении дермы. Данный фактор в свою очередь необходимо учитывать при проведении исследований. Кроме того, содержание пигмента меланина в эпидермисе оказывает существенное воздействие на спектр кожной флуоресценции за счет высокого поглощения ультрафиолетового и видимого света [47].
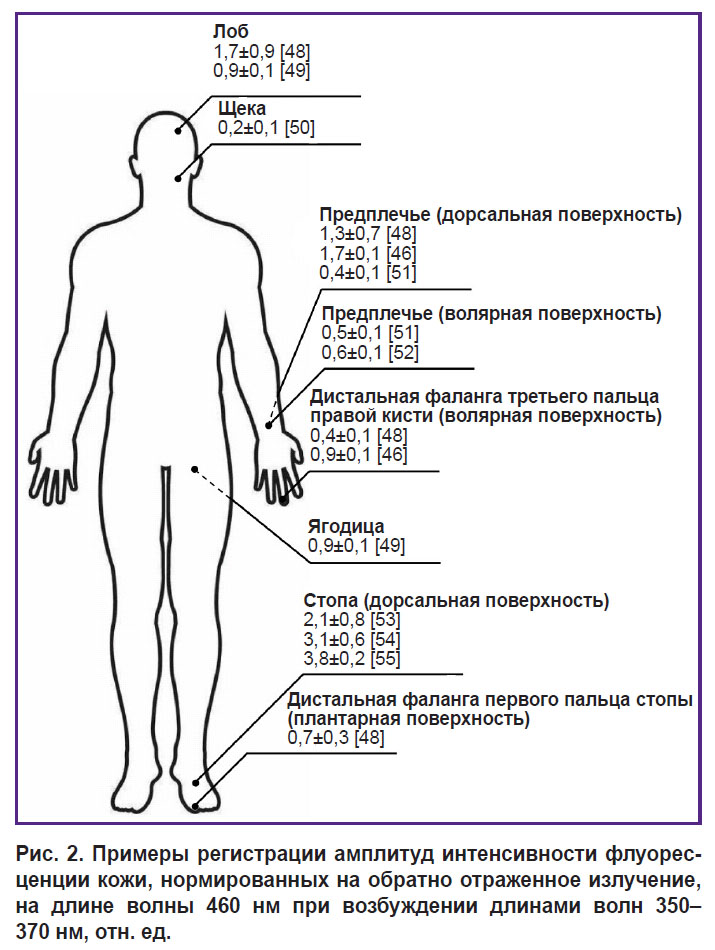
Одним из подходов для учета влияния различных факторов при регистрации кожной флуоресценции (в первую очередь кровенаполнения биоткани) является нормирование регистрируемых максимумов интенсивности флуоресценции на значение интенсивности обратно отраженного излучения на длине волны возбуждения. На рис. 2 представлены примеры регистрации амплитуд интенсивности флуоресценции (в относительных единицах), нормированных на обратно отраженное излучение, для различных участков кожи человека на длине волны 460 нм при возбуждении длинами волн 350–370 нм [46, 48–55]. Анализ приведенных данных демонстрирует их высокую вариабельность, что является результатом влияния всех вышеописанных факторов. В среднем индивидуальная вариабельность для интенсивности флуоресценции основных флуорофоров биоткани (например, при оценке результатов измерения НАДН и ФАД, включающих влияние коллагена) составляет порядка 30%, что необходимо учитывать при интерпретации данных ФС кожи [56].
|
Рис. 2. Примеры регистрации амплитуд интенсивности флуоресценции кожи, нормированных на обратно отраженное излучение, на длине волны 460 нм при возбуждении длинами волн 350–370 нм, отн. ед. |
Таким образом, из-за нерешенной проблемы влияния коллагена и других факторов на регистрацию флуоресценции биотканей оценивать митохондриальную функцию (окислительный метаболизм) по регистрируемым спектрам НАДH и ФАД можно только с определенными допущениями. При этом для учета различного уровня кровенаполнения биоткани необходимо применять нормирование интенсивности флуоресценции, например на обратно отраженное излучение.
Портативная реализация флуоресцентной спектроскопии биотканей на основе мультимодального подхода. В связи с рядом факторов, ограничивающих широкое внедрение ФС в клиническую практику, предлагается новый подход — совмещение ФС и лазерной допплеровской флоуметрии (ЛДФ) в одном диагностическом устройстве [1].
Лазерная допплеровская флоуметрия — широко распространенный метод неинвазивной оптической диагностики, применяемый для оценки функционального состояния микроциркуляторной части сосудистого русла. Метод основан на зондировании кожного покрова когерентным лазерным излучением с последующей регистрацией интенсивности обратно отраженного излучения от статичных структур ткани и движущихся форменных элементов крови — эритроцитов. После фотометрирования интенсивности отраженного излучения и его аналогово-цифровой обработки вычисляется показатель микроциркуляции крови, пропорциональный числу эритроцитов в диагностируемом объеме и средней скорости их движения. В полученном сигнале содержится информация о работе эндотелиального, нейрогенного, миогенного, дыхательного и пульсового механизмов модуляции микрокровотока [1].
Совмещение методов ЛДФ и ФС в одном диагностическом устройстве позволяет не только одновременно оценивать состояние периферического кровотока и метаболической активности клеток, но и проводить расчет комплексных параметров (например, окислительного метаболизма) [57, 58]. Этот показатель отражает эффективность и согласованность работы систем доставки питательных веществ и кислорода к биологическим тканям, а также их потребление при окислительном метаболизме. В более широком смысле с помощью данного показателя можно получать информацию о функциональном состоянии микроциркуляторно-тканевых систем организма человека (МТС) [59]. Применение показателя окислительного метаболизма в качестве одного из индикаторов гомеостаза организма является перспективным направлением в рамках развития персонифицированной медицины.
Мультимодальный подход вызвал широкий интерес со стороны научного сообщества и активно внедряется в клиническую практику для улучшения качества ранней диагностики метаболических и перфузионных нарушений при различных, в том числе и социально-значимых, заболеваниях. Так, в клинических условиях получены данные по различию накопления конечных продуктов гликирования в биоткани у пациентов с сахарным диабетом 2-го типа по отношению к условно здоровым волонтерам [55]. Разработанный на основе мультимодального подхода метод, основанный на регистрации сигналов с помощью ФС и ЛДФ, позволяет классифицировать состояние биотканей на классы отсутствия и наличия микроциркуляторно-метаболических нарушений с вероятностью ложноотрицательного результата диагностики менее 0,2 с последующей диффренциацией степени тяжести патологии.
До недавнего времени применение мультимодального подхода к диагностике состояния МТС было возможно преимущественно в условиях клинических исследований или научных лабораторий, что обусловлено использованием стационарных устройств с оптоволоконным зондом, требующих определенной квалификации оператора. Примером такого устройства является диагностический комплекс ЛАКК-М (ООО НПП «ЛАЗМА», Россия). Существенным фактором, влияющим на регистрируемый сигнал, служит наличие волоконно-оптического зонда. Сложность его установки и фиксации на теле испытуемого, а также высокая чувствительность к артефактам движения значительно усложняют процесс регистрации данных как для оператора, так и для самих испытуемых.
Благодаря развитию технологий производства оптических компонентов стало возможным создание компактных источников излучения и спектрометров. Это, в частности, привело к появлению портативного мультимодального анализатора ЛАЗМА ПФ (ООО НПП «ЛАЗМА», Россия), что значительно расширило спектр диагностических возможностей по сравнению со стационарной модификацией. Такие виды устройств могут быть закреплены на симметричных или произвольных участках кожи, создавая тем самым распределенную систему приборов на теле человека. Эти анализаторы реализуют методы ЛДФ и ФС, а также обеспечивают регистрацию температуры поверхности кожи испытуемого и артефактов движения с помощью акселерометра. Передача данных осуществляется по каналам беспроводной связи (Bluetooth или Wi-Fi). Реализация канала ФС в портативном исполнении происходит с помощью светодиода с длиной волны возбуждения 365 нм, работающего в импульсном режиме. В качестве приемника используется спектрометр, который позволяет получать спектральное распределение флуоресценции биологической ткани человека. Выбор длины волны светодиода обусловлен спектральной характеристикой возбуждения кофермента НАДН.
Одновременная реализация ЛДФ и ФС в устройстве ЛАЗМА ПФ позволяет комплексно оценивать состояние МТС с учетом метаболической активности биологической ткани. Портативные устройства постепенно находят широкое применение в диагностике осложнений, связанных с сахарным диабетом [60], гипертонией [61] и сосудистыми осложнениями коронавирусной инфекции [62]. Анализаторы ЛАЗМА ПФ прошли апробацию в оценке статуса курения [63], лекарственной терапии нарушений микроциркуляции крови [64] и качества выполнения дыхательных упражнений [65].
Таким образом, мультимодальный подход, включающий в себя несколько методов оптической неинвазивной диагностики и реализованный в портативном исполнении, позволяет синтезировать новые диагностические критерии для раннего выявления социально-значимых заболеваний, что говорит о высоком потенциале применения носимых устройств в различных областях медицины, в частности в сфере телемедицины.
Экспериментальная часть исследования
Для демонстрации возможностей и особенностей применения портативных анализаторов окислительного метаболизма биотканей проведены пилотные экспериментальные исследования с участием 8 условно здоровых добровольцев в возрасте от 18 до 23 лет (6 мужчин, 2 женщины). Все участники не имели диагностированных хронических заболеваний и не принимали лекарственные препараты на постоянной основе. Наличие вредных привычек являлось критерием исключения из выборки.
Исследование проведено в соответствии с Хельсинкской декларацией (2024) и одобрено Этическим комитетом Орловского государственного университета имени И.С. Тургенева. От каждого участника получено информированное согласие.
Для изучения параметров МТС использовали специально изготовленную модификацию мультимодальных портативных анализаторов ЛАЗМА ПФ, которая позволяет регистрировать спектры кожной флуоресценции в широком спектральном диапазоне 320–900 нм. В данной модификации имеется возможность оценивать спектральное распределение возбуждаемого флуорофора, уровень интенсивности флуоресценции, а также интенсивность обратно отраженного излучения на длине волны источника. Благодаря этому можно учитывать индивидуальные морфологические особенности биоткани путем нормирования сигнала флуоресценции.
Анализатор поочередно закреплялся на коже лба (которая кровоснабжается надглазничной артерией из бассейна внутренней сонной артерии) и на плантарной поверхности дистальных фаланг первых пальцев стопы (область с большим количеством артериоло-венулярных анастомозов). Во время измерений добровольцы находились в положении сидя за столом с прямой спиной, руки волонтеров располагались на столе на уровне сердца.
Для исследования влияния уровня кровенаполнения биоткани на спектр флуоресценции кожи проведена серия измерений интенсивности флуоресценции в коже пальцев кистей и предплечий. Протокол исследования включал одновременную регистрацию сигналов ЛДФ и ФС и состоял из 3 этапов окклюзионной пробы: в течение 7 мин выполнялась базовая запись параметров МТС; далее проводилась артериальная окклюзия путем пережатия плечевой артерии на 3 мин с помощью манжеты тонометра, в которую нагнетался воздух до достижения давления на уровне 200 мм рт. ст.; затем после снятия окклюзии и постокклюзионной реактивной гиперемии происходила запись восстановления параметров МТС в течение 8 мин.
Все измерения проводили в нормальных условиях при комнатной температуре 22±1°С и не ранее чем через 2 ч после приема пищи. Добровольцы находились в состоянии покоя и адаптировались к условиям окружающей среды в течение 20–30 мин перед началом измерений.
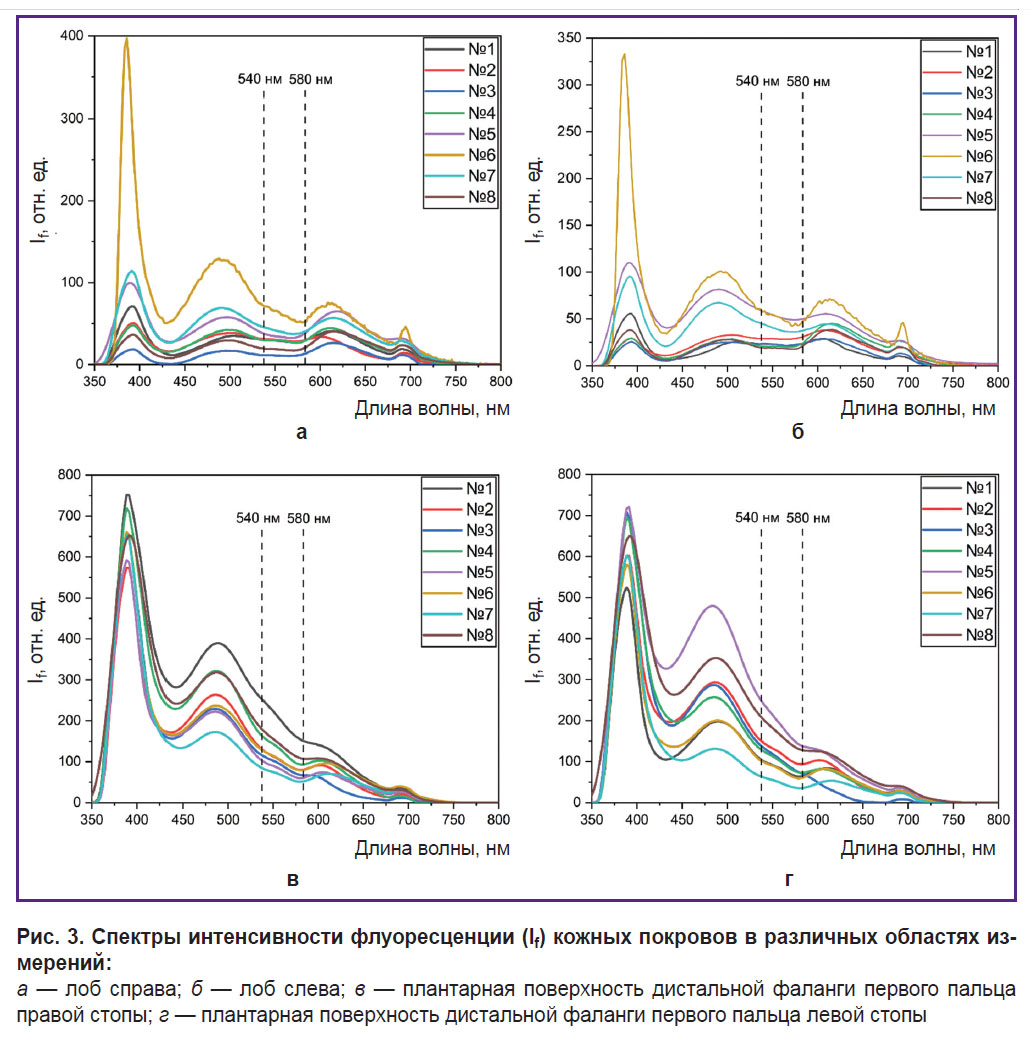
На рис. 3 представлены спектры флуоресценции в области кожи лба (а, б) и пальцев стопы (в, г), полученные для 8 условно здоровых добровольцев. При возбуждении длиной волны 365 нм наблюдается характерный пик флуоресценции кофермента НАДН на длине волны 460 нм.
Формы спектров флуоресценции волонтеров в каждой области исследования идентичны, однако наблюдаются отличия формы спектров разных областей измерения. Спектр флуоресценции волонтера №6 в области кожи лба характеризуется наибольшей амплитудой как обратно отраженного излучения, так и флуоресценции НАДН, что, скорее всего, связано с более светлой кожей, т.е. с меньшим содержанием меланина в эпидермисе. Полученные высокие значения вариабельности интенсивностей флуоресценции также могут быть обусловлены разным содержанием меланина в коже испытуемых. Для уменьшения разброса целесообразно нормировать значения интенсивности флуоресценции на обратно отраженное излучение. Это позволит учитывать индивидуальные особенности оптических свойств кожи участников исследования.
Стоит обратить внимание, что в области плантарной поверхности дистальных фаланг первых пальцев стопы вариабельность амплитуды интенсивности флуоресценции на длине волны 460 нм составила 42 и 25% слева и справа соответственно. Уменьшение вариабельности интенсивности флуоресценции может быть связано с тем, что меланин оказывает меньшее влияние на спектр флуоресценции, поскольку данная область практически не подвержена воздействию ультрафиолетовых лучей. Различия в форме и амплитуде спектров флуоресценции между мужчинами и женщинами не обнаружены.
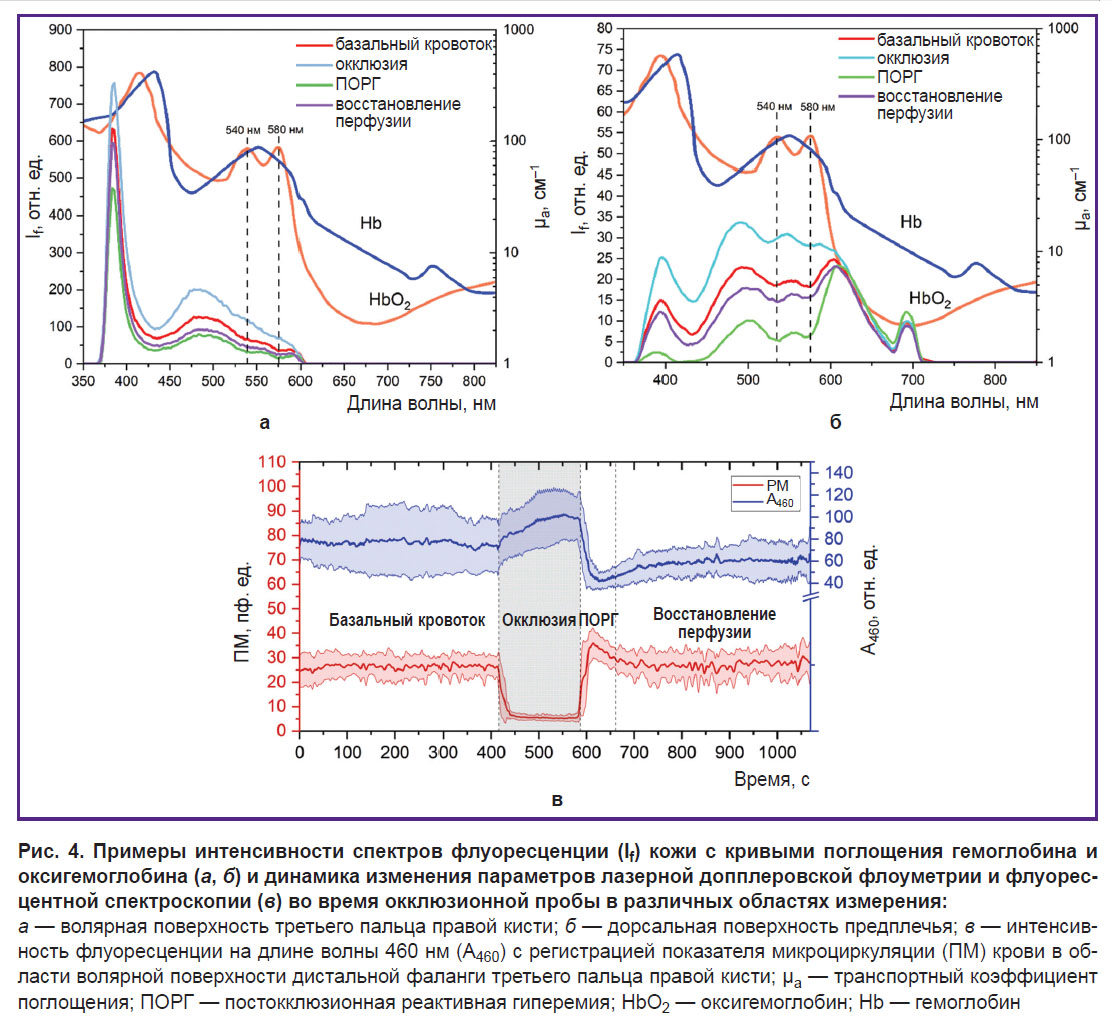
При анализе данных подтвердилось, что на регистрируемый спектр флуоресценции значительное влияние оказывает кровенаполнение биологической ткани в виде характерного снижения сигнала на длинах волн около 540 и 580 нм, соответствующих поглощению излучения оксигемоглобином (HbO2) крови, что необходимо учитывать при интерпретации полученных результатов. На рис. 4, а, б представлены спектры флуоресценции кожи для разных этапов окклюзионной пробы. Повышение интенсивности флуоресценции на этапе окклюзии и ее снижение при постокклюзионной реактивной гиперемии также подтверждает существенное влияние на регистрируемый сигнал кровенаполнения тканей. Более низкая интенсивность пика обратно отраженного излучения в области дорсальной поверхности запястья может быть следствием высокого поглощения излучения ввиду повышенного содержания меланина и ангиоархитектонических особенностей области исследования.
На рис. 4, в представлена динамика изменения показателя микроцирикуляции крови и интенсивности флуоресценции на длине волны 460 нм при проведении окклюзионной пробы. Несмотря на очевидную обратную зависимость интенсивности флуоресценции от кровенаполнения, наблюдается также влияние и других факторов. Например, после снятия окклюзии происходит восстановление тканевой перфузии до базовых значений, однако интенсивность флуоресценции остается на более низком уровне по сравнению с первоначальными значениями. Это, по всей вероятности, отражает компенсаторные изменения окислительного метаболизма в ответ на гипоксию в виде снижения количественного соотношения НАДН в клетках биоткани. Кроме того, стоит отметить, что после проведения окклюзионной пробы снижается разброс интенсивности флуоресценции по сравнению с периодом до окклюзии, что может являться следствием запуска каскада адаптационных реакций на раздражающее воздействие.
Таким образом, проведенный эксперимент показал: несмотря на то, что кровенаполнение биоткани совместно с уровнем меланина существенно влияет на регистрируемый спектр флуоресценции при возбуждении длиной волны 365 нм, оценка интенсивности кожной флуоресценции в динамике при использовании функциональных тестов отражает изменения метаболических процессов биотканей и является перспективным диагностическим критерием.
Заключение
Флуоресцентная спектроскопия биотканей является многообещающим неинвазивным методом, позволяющим осуществлять объективную оценку функционального состояния биологических тканей человека. Флуоресценция эндогенных флуорофоров может выступать в качестве эффективного диагностического критерия, позволяющего определять метаболическую активность дыхательной цепи клеток, благодаря чему возможно выявление новообразований, в том числе злокачественного происхождения.
Применение мультимодального подхода, который заключается в одновременной реализации флуоресцентной спектроскопии с другими методами биофотоники, позволяет получать комплексные сведения об эффективности и согласованности процессов доставки кислорода и питательных веществ кровеносной системой и их утилизации биологическими тканями, что существенно расширяет диагностические возможности. Новые форматы реализации флуоресцентной спектроскопии в виде интегрирования в распределенную систему портативных устройств открывают новые перспективы применения метода в области функциональной диагностики для улучшения качества персонализированной медицины.
Финансирование. Работа выполнена при финансовой поддержке гранта Российского научного фонда №25-25-00546, https://rscf.ru/project/25-25-00546/.
Конфликт интересов отсутствует.
Литература
- Дунаев А.В. Мультимодальная оптическая диагностика микроциркуляторно-тканевых систем организма человека. Старый Оскол: ТНТ; 2022; 440 с.
- Рогаткин Д.А. Физические основы лазерной клинической флюоресцентной спектроскопии in vivo. Медицинская физика 2014; 4: 78–96.
- Жеребцов Е.А., Дремин В.В., Жеребцова А.И., Потапова Е.В., Дунаев А.В. Флуоресцентная диагностика митохондриальной функции в эпителиальных тканях in vivo. Орел: ОГУ имени И.С. Тургенева; 2008; 107 с.
- Richards-Kortum R., Sevick-Muraca E. Quantitative optical spectroscopy for tissue diagnosis. Annu Rev Phys Chem 1996; 47: 555–606, https://doi.org/10.1146/annurev.physchem.47.1.555.
- Alfano R., Tata D.B., Cordero J., Tomashefsky P., Longo F., Alfano M. Laser induced fluorescence spectroscopy from native cancerous and normal tissue. IEEE J Quantum Electron 1984; 20(12): 1507–1511, https://doi.org/10.1109/JQE.1984.1072322.
- Georgakoudi I., Jacobson B.C., Müller M.G., Sheets E.E., Badizadegan K., Carr-Locke D.L., Crum C.P., Boone C.W., Dasari R.R., Van Dam J., Feld M.S. NAD(P)H and collagen as in vivo quantitative fluorescent biomarkers of epithelial precancerous changes. Cancer Res 2002; 62(3): 682–687.
- Koenig K., Schneckenburger H. Laser-induced autofluorescence for medical diagnosis. J Fluoresc 1994; 4(1): 17–40, https://doi.org/10.1007/BF01876650.
- Croce A.C., Bottiroli G. Autofluorescence spectroscopy and imaging: a tool for biomedical research and diagnosis. Eur J Histochem 2014; 58(4): 2461, https://doi.org/10.4081/ejh.2014.2461.
- Mayevsky A., Chance B. Oxidation-reduction states of NADH in vivo: from animals to clinical use. Mitochondrion 2007; 7(5): 330–339, https://doi.org/10.1016/j.mito.2007.05.001.
- Mayevsky A. Mitochondrial function in vivo evaluated by NADH fluorescence. Springer; 2015; 276 p.
- Chance B., Williams G.R. Respiratory enzymes in oxidative phosphorylation. I. Kinetics of oxygen utilization. J Biol Chem 1955; 217(1): 383–393.
- Chance B., Williamson J.R., Jamieson D., Schoener B. Properties and kinetics of reduced pyridine nucleotide fluorescence of the isolated and in vivo rat heart. Biochem Zeit 1965; 341: 357–377.
- Alfano R.R., Das B.B., Cleary J., Prudente R., Celmer E.J. Light sheds light on cancer — distinguishing malignant tumors from benign tissues and tumors. Bull N Y Acad Med 1991; 67(2): 143–150.
- Alfano R., Tang G.C., Pradhan A., Lam W., Choy D., Opher E. Fluorescence spectra from cancerous and normal human breast and lung tissues. IEEE J Quantum Electron 1987; 23(10): 1806–1811, https://doi.org/10.1109/JQE.1987.1073234.
- Palmer G.M., Keely P.J., Breslin T.M., Ramanujam N. Autofluorescence spectroscopy of normal and malignant human breast cell lines. Photochem Photobiol 2003; 78(5): 462–469, https://doi.org/10.1562/0031-8655(2003)0780462:asonam2.0.co;2.
- Palmer S., Litvinova K., Dunaev A., Yubo J., McGloin D., Nabi G. Optical redox ratio and endogenous porphyrins in the detection of urinary bladder cancer: a patient biopsy analysis. J Biophotonics 2017; 10(8): 1062–1073, https://doi.org/10.1002/jbio.201600162.
- Panjehpour M., Julius C.E., Phan M.N., Vo-Dinh T., Overholt S. Laser-induced fluorescence spectroscopy for in vivo diagnosis of non-melanoma skin cancers. Lasers Surg Med 2002; 31(5): 367–373, https://doi.org/10.1002/lsm.10125.
- Croce A.C., Bottiroli G. Autofluorescence spectroscopy and imaging: a tool for biomedical research and diagnosis. Eur J Histochem 2014; 58(4): 2461, https://doi.org/10.4081/ejh.2014.2461.
- Apolikhina L.A., Denisova E.D., Bulgakova N.N., Kuzmin S.G., Vorozhtsov G.N. Fluorescence detection and photodynamic therapy of human papilloma virus associated diseases of female genital organs. In: Proceedings of the 6th International Congress of the World Association of Laser Therapy, WALT 2006; 2006; p. 59–61.
- Bulgakova N., Sokolov V., Telegina L., Vereshchagin K., Frank G., Chissov V. Study of laser-induced autofluorescence emission spectra from normal and malignant bronchial epithelium. Photonics Lasers Med 2013; 2(2): 93–99, https://doi.org/10.1515/plm-2013-0002.
- Rusakov I.G., Sokolov V.V., Bulgakova N.N., Ul’ianov R.V., Teplov A.A. Fluorescent diagnostic methods and superficial cancer of the urinary bladder: current status. Urologiia 2008; 3: 67–72.
- Дронова О.Б., Третьяков А.А., Мищенко А.Н., Булгакова Н.Н. Исследование возможностей лазер-индуцированной аутофлуоресценции в диагностике пищевода Барретта. Сибирский онкологический журнал 2008; 4: 11–16.
- Bulgakova N.N., Kazachkina N.I., Sokolov V.V., Smirnov V.V. Local fluorescence spectroscopy and detection of malignancies using laser excitation at various wavelengths. Laser Phys 2006; 16: 889–895, https://doi.org/10.1134/s1054660x06050227.
- Bulgakova N., Ulijanov R., Vereschagin K., Sokolov V., Teplov A., Rusakov I., Chissov V. In vivo local fluorescence spectroscopy in PDD of superficial bladder cancer. Medical Laser Application 2009; 24(4): 247–255, https://doi.org/10.1016/j.mla.2009.08.005.
- Harris K., Rohrbach D.J., Attwood K., Qiu J., Sunar U. Optical imaging of tissue obtained by transbronchial biopsies of peripheral lung lesions. J Thorac Dis 2017; 9(5): 1386–1392, https://doi.org/10.21037/jtd.2017.03.113.
- Braun F., Schalk R., Nachtmann M., Hien A., Frank R., Beuermann T., Methner F.J., Kränzlin B., Rädle M., Gretz N. A customized multispectral needle probe combined with a virtual photometric setup for in vivo detection of Lewis lung carcinoma in an animal model. Meas Sci Technol 2019; 30(10): 104001, https://doi.org/10.1088/1361-6501/ab24a1.
- Mathieu M.C., Toullec A., Benoit C., Berry R., Validire P., Beaumel P., Vincent Y., Maroun P., Vielh P., Alchab L., Farcy R., Moniz-Koum H., Fontaine-Aupart M.P., Delaloge S., Balleyguier C. Preclinical ex vivo evaluation of the diagnostic performance of a new device for in situ label-free fluorescence spectral analysis of breast masses. Eur Radiol 2018; 28(6): 2507–2515, https://doi.org/10.1007/s00330-017-5228-7.
- Spliethoff J.W., Evers D.J., Jaspers J.E., Hendriks B.H., Rottenberg S., Ruers T.J. Monitoring of tumor response to Cisplatin using optical spectroscopy. Transl Oncol 2014; 7(2): 230–239, https://doi.org/10.1016/j.tranon.2014.02.009.
- Ostrander J.H., McMahon C.M., Lem S., Millon S.R., Brown J.Q., Seewaldt V.L., Ramanujam N. Optical redox ratio differentiates breast cancer cell lines based on estrogen receptor status. Cancer Res 2010; 70(11): 4759–4766, https://doi.org/10.1158/0008-5472.CAN-09-2572.
- Sivabalan S., Vedeswari C.P., Jayachandran S., Koteeswaran D., Pravda C., Aruna P.R., Ganesan S. In vivo native fluorescence spectroscopy and nicotinamide adinine dinucleotide/flavin adenine dinucleotide reduction and oxidation states of oral submucous fibrosis for chemopreventive drug monitoring. J Biomed Opt 2010; 15(1): 017010, https://doi.org/10.1117/1.3324771.
- Palmer S., Litvinova K., Rafailov E.U., Nabi G. Detection of urinary bladder cancer cells using redox ratio and double excitation wavelengths autofluorescence. Biomed Opt Express 2015; 6(3): 977–986, https://doi.org/10.1364/BOE.6.000977.
- Fokkens B.T., Smit A.J. Skin fluorescence as a clinical tool for non-invasive assessment of advanced glycation and long-term complications of diabetes. Glycoconj J 2016; 33(4): 527–535, https://doi.org/10.1007/s10719-016-9683-1.
- Bos D.C., de Ranitz-Greven W.L., de Valk H.W. Advanced glycation end products, measured as skin autofluorescence and diabetes complications: a systematic review. Diabetes Technol Ther 2011; 13(7): 773–779, https://doi.org/10.1089/dia.2011.0034.
- Галкина Е.М., Утц С.Р. Флуоресцентная диагностика в дерматологии. Саратовский научно-медицинский журнал 2013; 9(3): 566–572.
- Kang U.K., Папаян Г.В., Березин В.Б., Петрищев Н.Н., Галагудза М.М. Спектрометр для флуоресцентно-отражательных биомедицинских исследований. Оптический журнал 2013; 80(1): 56–67, https://doi.org/10.1364/JOT.80.000040.
- Тучин В. Оптическая биомедицинская диагностика. В 2 т. Т. 2. М: ФИЗМАТЛИТ; 2007; 368 с.
- Castro-e-Silva O., Sankarankutty A.K., Correa R.B., Ferreira J., Vollet Filho J.D., Kurachi C., Bagnato V.S. Autofluorescence spectroscopy in liver transplantation: preliminary results from a pilot clinical study. Transplant Proc 2008; 40(3): 722–725, https://doi.org/10.1016/j.transproceed.2008.03.005.
- Ershova E.Y., Karimova L.N., Kharnas S.S., Kuzmin S.G., Loschenov V.B. Photodynamic therapy of acne vulgaris. In: Lasers in surgery: advanced characterization, therapeutics, and systems XIII. SPIE; 2003; p. 62–67.
- De Veld D.C., Witjes M.J., Sterenborg H.J., Roodenburg J.L. The status of in vivo autofluorescence spectroscopy and imaging for oral oncology. Oral Oncol 2005; 41(2): 117–131, https://doi.org/10.1016/j.oraloncology.2004.07.007.
- Akbar N., Sokolovski S., Dunaev A., Belch J.J., Rafailov E., Khan F. In vivo noninvasive measurement of skin autofluorescence biomarkers relate to cardiovascular disease in mice. J Microsc 2014; 255(1): 42–48, https://doi.org/10.1111/jmi.12135.
- Tarakanchikova Y., Stelmashchuk O., Seryogina E., Piavchenko G., Zherebtsov E., Dunaev A., Popov A., Meglinski I. Allocation of rhodamine-loaded nanocapsules from blood circulatory system to adjacent tissues assessed in vivo by fluorescence spectroscopy. Laser Phys Lett 2018; 15: 105601, https://doi.org/10.1088/1612-202x/aad857.
- Lin Y., Gao H., Nalcioglu O., Gulsen G. Fluorescence diffuse optical tomography with functional and anatomical a priori information: feasibility study. Phys Med Biol 2007; 52(18): 5569–5585, https://doi.org/10.1088/0031-9155/52/18/007.
- Рогаткин Д.А., Приснякова О.А., Моисеева Л.Г., Черкасов А.С. Анализ точности лазерной клинической флюоресцентной диагностики. Измерительная техника 1998; 7: 58–61.
- Sinichkin Y.P., Utz S.R., Mavliutov A.H., Pilipenko H.A. In vivo fluorescence spectroscopy of the human skin: experiments and models. J Biomed Opt 1998; 3(2): 201–211, https://doi.org/10.1117/1.429876.
- Konig K., Riemann I. High-resolution multiphoton tomography of human skin with subcellular spatial resolution and picosecond time resolution. J Biomed Opt 2003; 8(3): 432–439, https://doi.org/10.1117/1.1577349.
- Dunaev A.V., Dremin V.V., Zherebtsov E.A., Rafailov I.E., Litvinova K.S., Palmer S.G., Stewart N.A., Sokolovski S.G., Rafailov E.U. Individual variability analysis of fluorescence parameters measured in skin with different levels of nutritive blood flow. Med Eng Phys 2015; 37(6): 574–583, https://doi.org/10.1016/j.medengphy.2015.03.011.
- Dremin V.V., Dunaev A.V. How the melanin concentration in the skin affects the fluorescence-spectroscopy signal formation. J Opt Technol 2016; 83: 43–48, https://doi.org/10.1364/JOT.83.000043.
- Паршакова В.Е., Жарких Е.В., Локтионова Ю.И., Коськин А.В., Дунаев А.В. Исследование физиологического разброса параметров микроциркуляторно-тканевых систем организма человека с помощью мультимодальных портативных анализаторов. Фундаментальные и прикладные проблемы техники и технологии 2024; 2(364): 165–176.
- Na R., Stender I.M., Ma L., Wulf H.C. Autofluorescence spectrum of skin: component bands and body site variations. Skin Res Technol 2000; 6(3): 112–117, https://doi.org/10.1034/j.1600-0846.2000.006003112.x.
- Kollias N., Zonios G., Stamatas G.N. Fluorescence spectroscopy of skin. Vib Spectrosc 2002; 28(1): 17–23, https://doi.org/10.1016/S0924-2031(01)00142-4.
- Ryzhkova E., Morgunova T., Potapova E., Ryzhkov I., Fadeyev V. Fluorescence spectroscopy with temperature functional tests in the assessment of markers of intracellular energy metabolism: spatial heterogeneity and reproducibility of measurements. J Biophotonics 2024; 17(10): e202400294, https://doi.org/10.1002/jbio.202400294.
- Gillies R., Zonios G., Anderson R.R., Kollias N. Fluorescence excitation spectroscopy provides information about human skin in vivo. J Invest Dermatol 2000; 115(4): 704–707, https://doi.org/10.1046/j.1523-1747.2000.00091.x.
- Potapova E.V., Dremin V.V., Zherebtsov E.A., Makovik I.N., Zharkikh E.V., Dunaev A.V., Pilipenko O.V., Sidorov V.V., Krupatkin A.I. A complex approach to noninvasive estimation of microcirculatory tissue impairments in feet of patients with diabetes mellitus using spectroscopy. Optics and Spectroscopy 2017; 123(6): 955–964, https://doi.org/10.1134/s0030400x1712013x.
- Дремин В.В. Аналитический обзор подходов к математическому моделированию флуоресценции биологических тканей. Фундаментальные и прикладные проблемы техники и технологии 2016; 6(320): 92–102.
- Dremin V.V., Zherebtsov E.A., Sidorov V.V., Krupatkin A.I., Makovik I.N., Zherebtsova A.I., Zharkikh E.V., Potapova E.V., Dunaev A.V., Doronin A.A., Bykov A.V., Rafailov I.E., Litvinova K.S., Sokolovski S.G., Rafailov E.U. Multimodal optical measurement for study of lower limb tissue viability in patients with diabetes mellitus. J Biomed Opt 2017; 22(8): 1–10, https://doi.org/10.1117/1.JBO.22.8.085003.
- Дунаев А.В., Дрёмин В.В., Жеребцов Е.А., Палмер С.Г., Соколовский С.Г., Рафаилов Э.У. Анализ индивидуальной вариабельности параметров в лазерной флуоресцентной диагностике. Биотехносфера 2013; 2(26): 38–45.
- Dunaev A. Wearable devices for multimodal optical diagnostics of microcirculatory-tissue systems: application experience in the clinic and space. J Biomed Photonics Eng 2023; 9(2): 020201, https://doi.org/10.18287/JBPE23.09.020201.
- Sidorov V.V., Rybakov Y.L., Gukasov V.M., Evtushenko G.S. A system of local analyzers for noninvasive diagnostics of the general state of the tissue microcirculation system of human skin. Biomed Eng (NY) 2022; 55(6): 379–382.
- Дунаев А.В. Принципы построения технических средств мультипараметрической оптической диагностики для оценки функционального состояния микроциркуляторно-тканевых систем. Фундаментальные и прикладные проблемы техники и технологии 2020; 344(6): 131–140.
- Локтионова Ю.И., Жарких Е.В., Жеребцова А.И., Козлов И.О., Жеребцов Е.А., Масалыгина Г.И., Дунаев А.В. Исследование возрастных и патологических особенностей параметров микрогемодинамики в норме и при сахарном диабете 2 типа с помощью носимых лазерных допплеровских флоуметров. Фундаментальные и прикладные проблемы техники и технологии 2019; 120: 13–20.
- Горшков А.Ю., Королев А.И., Федорович А.А., Омельяненко К.В., Дадаева В.А., Драпкина О.М. Параметры кожной перфузии по данным дистанционной лазерной допплеровской флоуметрии у мужчин с впервые выявленной артериальной гипертензией. Профилактическая медицина 2022; 25(5–2): 19–20.
- Федорович А.А., Марков Д.С., Малишевский М.В., Юдаков О.О., Горшков А.Ю., Балдин А.В., Жук Д.М., Спасенов А.Ю., Королев А.И., Коптелов А.В., Драпкиона О.М. Нарушения микроциркуляторного кровотока в коже предплечья в острую фазу COVID-19 по данным лазерной допплеровской флоуметрии. Регионарное кровообращение и микроциркуляция 2022; 21(3): 56–63, https://doi.org/10.24884/1682-6655-2022-21-3-56-63.
- Saha M., Dremin V., Rafailov I., Dunaev A., Sokolovski S., Rafailov E. Wearable laser doppler flowmetry sensor: a feasibility study with smoker and non-smoker volunteers. Biosensors (Basel) 2020; 10(12): 201, https://doi.org/10.3390/bios10120201.
- Zharkikh E.V., Loktionova Yu.I., Sidorov V.V., Krupatkin A.I., Masalygina G.I., Dunaev A.V. Control of blood microcirculation parameters in therapy with alpha-lipoic acid in patients with diabetes mellitus. Human Physiology 2022; 48(4): 456–464, https://doi.org/10.1134/s0362119722040156.
- Фролов А.В., Локтионова Ю.И., Жарких Е.В., Сидоров В.В., Крупаткин А.И., Дунаев А.В. Исследование изменений кожной микроциркуляции крови при выполнении дыхательной техники хатха-йоги. Регионарное кровообращение и микроциркуляция 2022; 20(4): 33–44, https://doi.org/10.24884/1682-6655-2021-20-4-33-44.