Оценка сердечного ритма и детекция аритмий по электромиографическому сигналу с помощью сверточной нейронной сети
Цель исследования — разработка и валидация алгоритма на основе сверточного автокодировщика для оценки сердечного ритма по сигналам поверхностной электромиографии (ЭМГ), регистрируемым «ЭМГ-системой Миокостюм», использование которой расширит возможности последующего создания интегрированных систем неинвазивного мониторинга функционального состояния (утомления, стресса и нарушений сердечного ритма).
Материалы и методы. В исследовании участвовали 6 здоровых мужчин (средний возраст 21±2 года). Синхронную запись сигналов ЭМГ проводили с использованием «ЭМГ-системы Миокостюм», электрокардиографа «ВНС-Микро» и монитора Polar H10 в состоянии покоя, а также при статической и динамической нагрузке на бицепс.
Результаты. Разработан полностью сверточный автокодировщик, обученный на бинарных масках R-зубцов, для извлечения данных компонентов кардиоциклов из записей ЭМГ. Качество работы модели оценивали по F-мере в трех сценариях: I — на объединенных данных всех испытуемых; II — с исключением одного испытуемого из обучения и тестированием на его данных; III — на персональных данных каждого испытуемого по отдельности. На основе сигналов ЭМГ, зарегистрированных с большой грудной мышцы датчиками «ЭМГ-системы Миокостюм», с помощью сверточного автокодировщика продемонстрирована возможность построения ритмограммы — последовательности R–R-интервалов необходимой для анализа вариабельности сердечного ритма и скрининга аритмий. В сценарии I для ЭМГ-сигналов в состоянии покоя и при статическом упражнении на бицепс достигнута максимальная F-мера, при динамическом упражнении на бицепс качество классификации также оказалось высоким. Результаты сценария II указывают на то, что система надежно работает при тестировании на данных испытуемого, исключенного из обучающей выборки. Сценарий III показал наихудшие результаты. С учетом высокой обобщающей способности алгоритма в отношении данных, не включенных в обучающую выборку, сценарий II представляет собой наиболее реалистичный вариант использования и демонстрирует наилучшие общие результаты.
Заключение. Подтверждена возможность использования универсальных ЭМГ-электродов «ЭМГ-системы Миокостюм» для одновременного мониторинга мышечной активности и сердечного ритма. Разработанный алгоритм демонстрирует высокую производительность при решении задачи извлечения ритмограммы из сигналов ЭМГ в условиях покоя и мышечной нагрузки. Это открывает перспективы для создания экономически эффективных носимых систем комплексной оценки функционального состоянияи скрининга нарушений сердечного ритма в режиме реального времени без необходимости использования отдельного ЭКГ-канала.
Введение
Современный образ жизни, характеризующийся ростом гиподинамии и хронического стресса, является значимым фактором риска развития широкого спектра патологий, включая мышечный гипертонус, психосоматические расстройства и сердечно-сосудистые заболевания [1]. Последние в свою очередь остаются ведущей причиной смертности, что подчеркивает критическую важность развития методов ранней диагностики и профилактики. Ключевую роль в донозологической диагностике и оценке функционального состояния организма играет анализ вариабельности сердечного ритма (ВСР) [2]. Метод ВСР, основанный на измерении временны́х интервалов между последовательными сердечными сокращениями (например, R–R-интервалов), является высокочувствительным инструментом для оценки нейрогуморальной регуляции сердца и баланса между симпатической и парасимпатической нервными системами [3]. Изменения показателей ВСР служат надежным индикатором развития общего утомления и реакций на стрессовые факторы, что нашло применение как в клинической практике, так и в спортивной медицине [3, 4]. Кроме того, анализ последовательности R–R-интервалов (ритмограммы) лежит в основе автоматизированного выявления нарушений сердечного ритма — аритмий [5].
Традиционно при регистрации сигнала, необходимого для анализа сердечного ритма и его вариабельности, применяется электрокардиография (ЭКГ). Однако необходимость использования специализированных электродов и отдельного канала регистрации может ограничивать применение ЭКГ в условиях длительного мониторинга, спортивных тренировок или повседневной активности, снижая комфорт пользователя и его приверженность к наблюдению.
В то же время возможности для неинвазивного мониторинга сердечной деятельности показал и другой широко используемый метод — поверхностная электромиография (ЭМГ). Его принцип заключается в регистрации биоэлектрических потенциалов скелетных мышц. При расположении электродов на коже грудной клетки регистрируемый сигнал представляет собой сложную суперпозицию потенциалов действия двигательных единиц мышц и компонента, обусловленного электрической активностью сердца [6]. Исторически кардиокомпонент в ЭМГ рассматривался как артефакт, мешающий анализу мышечной активности, и большинство исследовательских усилий было направлено на его подавление с помощью разнообразных методов: от частотной фильтрации [7] и адаптивных фильтров [8] до более сложных подходов, таких как анализ независимых компонентов [7, 9], вейвлет-преобразование [6, 10] и сингулярный спектральный анализ [11].
В настоящей работе предлагается рассматривать кардиосигнал в ЭМГ не как шум, а как ценный диагностический источник информации. Это открывает возможность создания гибридных систем мониторинга, использующих универсальные ЭМГ-электроды для одновременной оценки нервно-мышечного и кардиального состояния. Подобный подход позволяет исключить необходимость в отдельном специализированном оборудовании для ЭКГ, что особенно актуально для решения задач спортивной медицины, реабилитации и длительного профилактического наблюдения, где важны удобство и минимизация количества датчиков. Несмотря на отдельные попытки выделения сердечного ритма из смешанных записей (например, в работе [12] ЭМГ использовалась в качестве дополнительного канала, позволяющего уменьшать зашумленность классической ЭКГ), данное направление остается малоизученным.
Для решения задачи выделения ритмограммы из сложного ЭМГ-сигнала оптимальным инструментом являются искусственные нейронные сети (ИНС), в частности сверточные нейронные сети, которые успешно зарекомендовали себя в задачах распознавания паттернов в биомедицинских сигналах [13]. В данной работе используется архитектура сверточного автокодировщика — сети, способной обучаться сжатому представлению ключевых признаков входных данных. Для улучшения сегментации временны́х рядов часто применяются U-Net-подобные архитектуры [14], а для быстрого прототипирования и развертывания таких моделей эффективно используется высокоуровневый программный интерфейс API Keras [15].
Цель исследования — разработка и валидация алгоритма на основе сверточного автокодировщика для оценки сердечного ритма по сигналам поверхностной ЭМГ, регистрируемым «ЭМГ-системой Миокостюм», использование которой расширит возможности последующего создания интегрированных систем неинвазивного мониторинга функционального состояния (утомления, стресса и нарушений сердечного ритма).
Материалы и методы
Исследование проводили на базе Национального исследовательского Нижегородского государственного университета им. Н.И. Лобачевского. Дизайн исследования соответствовал стандартам, установленным Хельсинкской декларацией (2024 г.), и был одобрен биоэтической комиссией Национального исследовательского Нижегородского государственного университета им. Н.И. Лобачевского (протокол №70 от 01.03.2023 г.). Все участники исследования подписали добровольное информированное согласие.
В исследовании приняли участие 6 здоровых мужчин (средний возраст 21±2 года). Критерии включения: отсутствие неврологических, сердечно-сосудистых заболеваний и патологий опорно-двигательного аппарата. Критерии исключения: наличие имплантированных электронных устройств, кожные заболевания в местах наложения электродов.
Для регистрации биоэлектрических кардиосигналов были использованы:
интегрированная в одежду система мониторинга мышечной активности «ЭМГ-система Миокостюм» — экспериментальная разработка кафедры нейротехнологий Национального исследовательского Нижегородского государственного университета им. Н.И. Лобачевского [16–18]);
электрокардиограф «ВНС-Микро» («Нейрософт», Россия) в качестве референсного стандарта для ЭКГ;
монитор сердечного ритма Polar H10 (Polar Electro Oy, Финляндия).
«ЭМГ-система Миокостюм» представляет собой носимое устройство для мониторинга и визуализации активности мышц человека на основе компрессионного белья с интегрированными электромиографическими датчиками (рис. 1). «ЭМГ-система Миокостюм» поддерживает 8 каналов регистрации сигналов ЭМГ, электроды располагаются симметрично справа и слева на следующих мышцах: двуглавая мышца плеча, трехглавая мышца плеча, дельтовидная и большая грудная мышцы.
В предварительных экспериментах при визуализации данных, полученных при помощи «ЭМГ-системы Миокостюм», на ЭМГ cлевой большой грудной мышцы были обнаружены ритмичные пики, происхождение которых предположительно связано с электрической активностью сердца.
На первом этапе исследования для выявления возможности применения «ЭМГ-системы Миокостюм» в качестве регистратора не только биоэлектрических потенциалов скелетной мускулатуры, но и сердечной деятельности выполнена одновременная запись данных при помощи датчиков «ЭМГ-системы Миокостюм», электрокардиографа «ВНС-Микро» и нагрудного монитора Polar H10. Для записи данных использовали собственную программу ech_monitor_v1_5, а также Поли-Спектр.NET (v. 6.0.9) и Polar Sensor Logger соответственно.
К элементам монитора Polar H10 относятся ремень с электродами и блок сбора сигналов, передающий данные через Bluetooth на сопряженное принимающее устройство (рис. 2).
 |
Рис. 2. Схема наложения датчика Polar H10:
1 — ремень с электродами, 2 — блок сбора сигналов |
Перед проведением регистрации осуществляли подготовку устройств: увлажнение области ремня монитора Polar H10, где проходят электроды; наложение ремня вокруг груди, обеспечение его плотного прилегания; закрепление блока сбора сигналов. Затем обрабатывали электроды «ЭМГ-системы Миокостюм» спиртом, надевали ее на испытуемого, наносили гель на контактные поверхности электродов, присоединяли блок сбора сигналов. Далее на верхние конечности испытуемого накладывали электроды электрокардиографа «ВНС-Микро» в соответствии со схемой для стандартных и усиленных отведений от конечностей с предшествующим обезжириванием кожи спиртом для лучшего контакта с электродами и нанесением на точки наложения электродов контактного геля.
Протокол эксперимента включал регистрацию следующих данных:
в состоянии покоя (стоя) в течение 10 с;
во время выполнения статического упражнения на бицепс с удержанием грифов гантелей (1,5 кг) в согнутых руках в течение 10 с;
во время выполнения динамического упражнения на бицепс с гантелями по 6,5 кг в течение 3 подходов по 10 повторов, время отдыха между подходами составляло 60 с;
во время выполнения статического упражнения на бицепс с удержанием грифов гантелей (1,5 кг) в согнутых руках в течение 10 с;
в состоянии покоя (стоя) в течение 10 с.
Статистическая обработка данных. Обработка и анализ данных выполнены с использованием программного обеспечения Python 3.11.9 и библиотеки Keras 3.9.2. Качество распознавания R-зубцов автокодировщиком оценивали путем расчета F-меры [19] на основе значений точности (P) и полноты (R), полученных по результатам классификации:

где количество срабатываний нейронной сети подсчитывалось раздельно для истинно-положительных (TP), истинно-отрицательных (TN), ложноположительных (FP) и ложноотрицательных (FN) ответов.
F-мера определялась как

Анализ проводили в трех сценариях обработки данных:
сценарий I: обучение на 80% объединенных данных всех испытуемых, тестирование на оставшихся 20%;
сценарий II: обучение на данных всех испытуемых, кроме одного, тестирование на данных исключенного участника. В данном случае процедура повторялась для каждого испытуемого;
сценарий III: обучение и тестирование только на индивидуальных данных каждого испытуемого. Данные каждого испытуемого были разделены в соотношении 80% (обучающая выборка) на 20% (тестовая выборка). При этом обучение и тестирование не включали данных иных испытуемых. Процедура повторялась для каждого участника.
Результаты
Синхронная запись сигналов, выполненная с помощью «ЭМГ-системы Миокостюм», электрокардиографа «ВНС-Микро» и монитора Polar H10, подтвердила наличие кардиокомпонента в ЭМГ-сигнале, регистрируемом с левой большой грудной мышцы. Как показано на рис. 3, демонстрирующем нормализованные сигналы всех трех систем, пики биоэлектрической активности сердца совпадают на записях, что визуально подтверждает возможность детекции R-зубцов непосредственно через ЭМГ-электроды. Данное наблюдение согласуется с результатами предыдущих исследований [20], рассматривающих ЭКГ-компонент в качестве шума по отношению к ЭМГ-сигналу. В частности, отмечалось, что при использовании электродов достаточной площади в данной анатомической области регистрируемый сигнал представляет собой суперпозицию ЭМГ и ЭКГ-компонента [20]. Полученные данные свидетельствуют о принципиальной возможности регистрации R-зубцов и последующего построения ритмограммы с использованием универсальных ЭМГ-электродов без необходимости задействования специального отдельного канала.
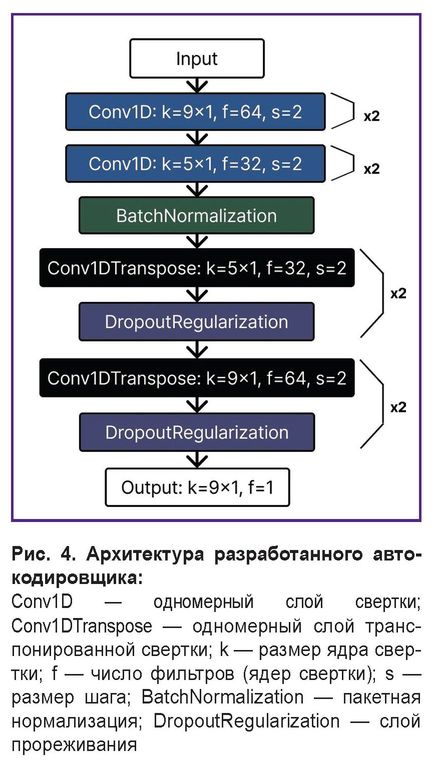
Для автоматизации обнаружения R-зубцов ЭКГ в сигналах ЭМГ разработан сверточный автокодировщик на основе программного интерфейса API Keras. Автокодировщик представляет собой нейронную сеть с двумя компонентами: блок кодировщика, преобразующий входные данные в латентное пространство меньшей размерности, и блок декодировщика, восстанавливающий исходные данные из этой сжатой формы. При обучении с целью минимизации ошибки реконструкции автокодировщик отдает приоритет значимым особенностям (в данном случае паттернам R-зубцов) и фильтрует шум.
Основу архитектуры разработанного автокодировщика (рис. 4) составляют одномерные сверточные слои (Conv1D), специально адаптированные для обработки ЭМГ-сигналов. В отличие от традиционных двумерных сверток, применяемых в компьютерном зрении, одномерный слой осуществляет анализ временнóго ряда, что позволяет эффективно детектировать ключевые особенности формы сигнала (пики различной полярности), критически важные для идентификации R-зубцов.
Для баланса глобального контекста и локальной точности архитектура комбинирует крупные ядра (размером 9×1) для захвата широкого окна сигнала и мелкие ядра (размером 5×1) для точной локализации R-зубцов. Процесс оптимизации модели включал тонкую настройку таких ключевых гиперпараметров, как количество сверточных слоев, размеры ядер свертки, число фильтров в каждом слое. Для этого применены методы байесовской оптимизации, позволившие достичь оптимального баланса между максимальной точностью извлечения R-зубцов и сложностью латентного пространства модели. Снижение размерности карт признаков в блоке кодировщика реализовано через свертки с шагом 2 (s=2) для сокращения вычислительных затрат по сравнению с традиционными слоями субдискретизации. Для стабилизации процесса обучения и ускорения сходимости после сверточных слоев блока кодировщика применена пакетная нормализация (batchnormalization).
В блоке декодировщика использованы транспонированные сверточные слои (Conv1DTranspose), обеспечивающие реконструкцию сигнала из сжатого представления и минимизирующие артефакты интерполяции. Для предотвращения переобучения в архитектуру интегрирован слой прореживания (dropout).
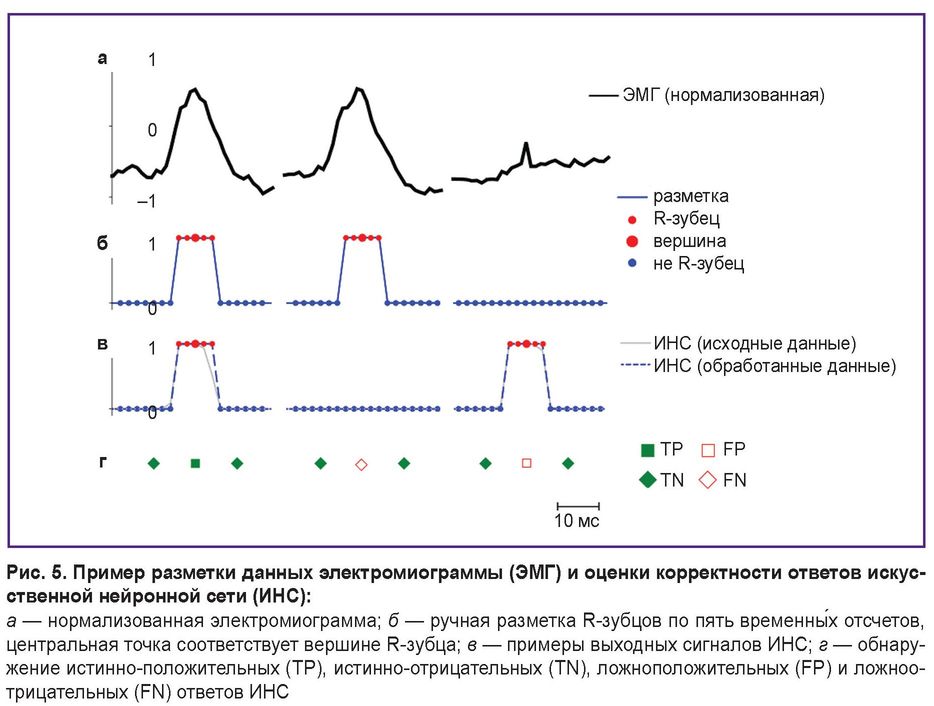
Несмотря на то, что автокодировщики, как правило, обучаются без учителя, в данном исследовании обучение реализовано на размеченных данных с использованием алгоритма обратного распространения ошибки. Стратегия разметки данных (рис. 5) включает признаки, специфичные для детектирования R-зубцов. ЭМГ регистрировали во время выполнения испытуемыми физических упражнений или в периоды отдыха, при этом каждая запись соответствовала одному подходу (или интервалу отдыха) длительностью от 13 с до 1,5 мин с частотой дискретизации 500 Гц. После регистрации проводили нормализацию данных к диапазону [–1, 1] (рис. 5, а) и фрагментацию на выборки по 1600 точек для подачи на вход сети.
Вектор меток реализован в виде бинарной маски (рис. 5, б), где каждый R-зубец обозначен пятью последовательными единицами с центром в его вершине. Все остальные точки отмечены нулями. Выход сети соответствует размерности входа (1600 точек), значения находятся в диапазоне [0, 1] и классифицируются как относящиеся (≥0,5) или не относящиеся к R-зубцу (<0,5) (рис. 5, в).
Для последующей оценки качества классификации каждая последовательность пяти единиц в векторах меток и выходных данных сети интерпретируется как отдельное событие — наличие R-зубца. Истинно-положительным результатом (TP, рис. 5, г) считается совпадение предсказанной последовательности и последовательности в разметке. Предсказанные пики без соответствующих меток классифицируются как ложноположительные (FP), а пропущенные метки — как ложноотрицательные (FN). Истинно-отрицательные ответы (TN) вычисляются как количество нулевых точек, совпадающих в разметке и на выходе модели, деленное на продолжительность события (5 точек) для нормализации по времени.
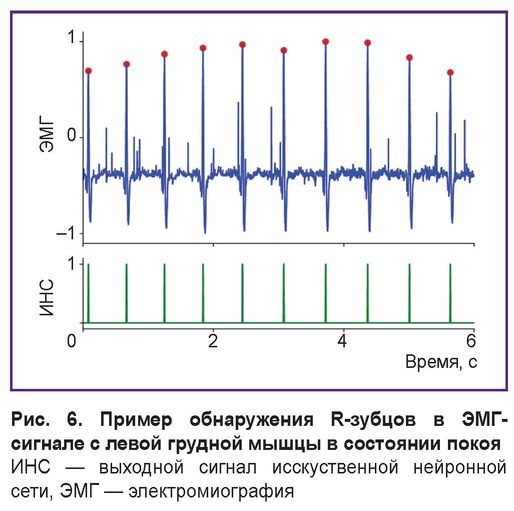
На рис. 6 представлены пример ЭМГ-сигнала с левой большой грудной мышцы, зарегистрированного в состоянии покоя (испытуемый стоит прямо), и результаты классификации автокодировщика. В этом положении грудные мышцы расслаблены и фоновый ЭМГ-сигнал имеет низкую амплитуду, что способствует надежному обнаружению R-зубца нейронной сетью. В результате ИНС достигает практически идеальной точности распознавания (100% в большинстве случаев). Это свидетельствует о том, что данные, релевантные для ВСР, действительно могут быть извлечены из ЭМГ-сигнала с левой грудной мышцы в состоянии покоя.
|
Рис. 6. Пример обнаружения R-зубцов в ЭМГ-сигнале с левой грудной мышцы в состоянии покоя
ИНС — выходной сигнал исскуственной нейронной сети, ЭМГ — электромиография |
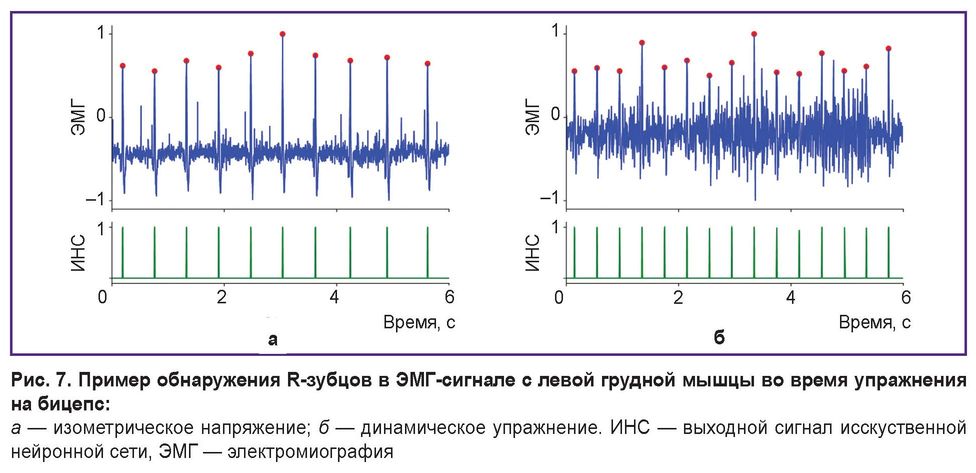
Однако данный результат справедлив не для всех реальных тренировочных сценариев, предполагающих физическую активность. Как мы выяснили, предложенный метод невозможно применить в случае активной работы грудных мышц, например при отжиманиях или жиме лежа. В этих упражнениях амплитуда сигнала ЭМГ резко возрастает, подавляя R-зубцы. С другой стороны, такие высокоинтенсивные упражнения на грудные мышцы обычно составляют лишь часть тренировочной программы. В большинстве тренировочных ситуаций доминируют другие группы мышц (например, конечностей или корпуса), в то время как грудные мышцы выполняют второстепенную стабилизирующую роль. Применение предложенного подхода к записям ЭМГ с левой грудной мышцы во время статических (рис. 7, а) и динамических (рис. 7, б) упражнений на другие мышцы (например, бицепс) показывает, что надежное извлечение R-зубцов возможно и в таком случае.
Статистический анализ качества классификации на основе F-меры, проведенный в разных сценариях обработки данных 6 испытуемых, подтверждает возможность надежного распознавания R-зубцов (и, соответственно, R–R-интервалов) автокодировщиком (см. таблицу).

|
Значения F-меры для предсказания положения R-зубцов в разных сценариях обработки данных |
Сценарий I с использованием объединенных данных всех испытуемых (80% — в обучающей выборке и 20% — в тестовой) позволяет оценить общую эффективность ИНС. Примечательно, что классификация достигла максимального качества (F=1) для сигналов, зарегистрированных в состоянии покоя и при статическом упражнении на бицепс, а также продемонстрировала достаточно высокую точность для динамического упражнения на бицепс (F=0,94).
Сценарий II моделирует использование ИНС в «ЭМГ-системе Миокостюм» в реальных условиях, требующих обучения модели на большой базе данных новых пользователей для классификации данных этих пользователей, не включенных в обучающую выборку. Соответственно в этом сценарии обучение проводится на данных всех испытуемых, кроме одного, а тестирование — на исключенном участнике с повторением данной процедуры для каждого испытуемого. Результаты классификации (медианные значения F-меры в покое F=1, в статическом упражнении F=1, в динамическом F=0,95) оказались не хуже, чем в случае с использованием объединенных данных всех испытуемых, что говорит о готовности предложенного подхода к использованию в реальной жизни.
Обучение ИНС на персональных наборах данных (сценарий III, 80% данных — в обучающей выборке, 20% — в тестовой) неожиданно дало наихудшие результаты (средние значения F=0,92 — в покое, F=0,88 — в статических и F=0,88 — в динамических упражнениях). Это ухудшение качества классификации, по всей вероятности, связано с ограниченным размером индивидуальных обучающих выборок, что приводит к переобучению ИНС.
Таким образом, с учетом обобщающей способности алгоритма в отношении данных, новых для обученной модели испытуемых, сценарий II представляет собой наиболее реалистичный вариант использования и демонстрирует наилучшие общие результаты.
Обсуждение
Полученные результаты демонстрируют принципиальную возможность решения актуальной медицинской задачи — неинвазивного мониторинга сердечного ритма — с использованием нетрадиционного источника сигналов, а именно поверхностной ЭМГ, регистрируемой многоканальной «ЭМГ-системой Миокостюм». Ключевым новшеством работы является не подавление ЭКГ-компонента как артефакта при оценке данных, а его целенаправленное извлечение для последующего анализа ритмограммы и расчета показателей ВСР. Такой подход позволяет рассматривать универсальные ЭМГ-электроды, расположенные на большой грудной мышце, в качестве многофункциональных сенсоров, способных одновременно регистрировать мышечную активность и сердечный ритм. Отказ от использования дополнительного специализированного оборудования для кардиомониторинга открывает большие возможности для развития носимых технологий в спортивной и профилактической медицине.
Важным достижением работы является разработка и успешная апробация специализированной архитектуры сверточного автокодировщика, адаптированной для обработки одномерных временны́х рядов ЭМГ. Использование одномерных сверточных слоев с ядрами разного размера позволяет эффективно захватывать как глобальный контекст сигнала, так и локальные особенности формы R-зубцов. Высокие значения F-меры, достигнутые в различных сценариях, свидетельствуют о том, что автокодировщик научился надежно идентифицировать кардиокомпонент даже на фоне мышечной активности.
Особый интерес для практического внедрения представляет анализ обобщающей способности ИНС. Наилучшие результаты, показанные в сценарии II (обучение на группе испытуемых с тестированием на новом участнике), указывают на то, что предложенный автокодировщик способен выделять универсальные признаки R-зубцов, инвариантные к индивидуальным особенностям сигнала. Это является значительным преимуществом в случаях клинического и прикладного использования, так как позволяет применять предобученную модель для новых пользователей без трудоемкого процесса сбора и разметки персональных данных. Более низкая эффективность, достигнутая в сценарии III (обучение на данных одного испытуемого), подчеркивает риск переобучения при работе с малыми объемами данных и подтверждает целесообразность использования именно групповых моделей для широкого внедрения.
Анализ существующих методов очистки ЭМГ от ЭКГ-артефактов [6–11] показывает, что данные подходы в основном решают обратную задачу — подавление кардиокомпонента для получения «чистого» миографического сигнала. Предлагаемый нами метод машинного обучения ориентирован на обратное выделение ритмограммы, что открывает новые возможности для интегральной физиологической оценки. Механизм работы сверточного автокодировщика можно интерпретировать как нелинейный адаптивный фильтр, который не просто ослабляет сигнал в определенной полосе частот, а активно распознает специфические паттерны R-зубцов, основанные на их форме и временны́х характеристиках, что является более робастным подходом в условиях изменяющегося уровня мышечной активности.
Полученные результаты могут сыграть ключевую роль для разработки систем мониторинга в отдельных медицинских и околомедицинских областях.
1. Спортивная медицина. Совместный анализ параметров ЭМГ (мышечное утомление) и ВСР (напряжение регуляторных систем) в режиме реального времени может стать основой для создания интеллектуальных систем, обеспечивающих раннее предупреждение о перетренированности и неблагоприятных функциональных состояниях у спортсменов.
2. Профилактическая медицина и реабилитация. Технология позволяет осуществлять длительный, незаметный для пользователя мониторинг стресса и общего функционального состояния по ВСР в условиях повседневной активности, а также в процессе реабилитации после перенесенных заболеваний.
3. Скрининг нарушений ритма при использовании в элементах «умной одежды». Получаемая ритмограмма пригодна для детекции эпизодов тахикардии, брадикардии и, потенциально, других видов аритмий в ситуациях, когда использование стандартного ЭКГ-монитора неудобно или невозможно.
Одним из ограничений метода является его зависимость от уровня мышечного напряжения. Как показали результаты, в периоды высокой активности грудных мышц (например, при отжиманиях) амплитуда ЭМГ-сигнала значительно превышает амплитуду ЭКГ-компонента, что затрудняет его выделение. Однако, учитывая, что во многих тренировочных и бытовых сценариях грудные мышцы играют стабилизирующую, а не основную роль, можно говорить о применении предлагаемого алгоритма для широкого спектра нагрузок на другие мышечные группы, что подтверждается успешной детекцией R-зубцов при упражнениях на бицепс.
Для дальнейшего развития технологии создания интегрированных систем неинвазивного мониторинга функционального состояния перспективными направлениями представляются:
расширение набора данных за счет включения большего числа испытуемых с различным уровнем физической подготовки и лиц с диагностированными нарушениями ритма для валидации метода в клинических условиях;
адаптация модели для работы с сигналами, записанными с других мышечных групп;
интеграция алгоритма в программное обеспечение «ЭМГ-системы Миокостюм» для онлайн-обработки сигналов и расчета ВСР в режиме реального времени.
Дополнительный интерес представляет исследование устойчивости алгоритма к различным типам артефактов, таким как движение электродов или дыхательная активность.
В целом проведенная работа закладывает основу для создания нового класса гибридных систем физиологического мониторинга, объединяющих оценку нервно-мышечного и кардиального компонентов функционального состояния человека, что крайне востребовано в современных условиях развития персонализированной медицины.
Заключение
Экспериментально подтверждена принципиальная возможность регистрации и автоматического выделения ритмограммы из сигналов поверхностной ЭМГ с электродов, расположенных на большой грудной мышце, что продемонстрировано на работе с «ЭМГ-системой Миокостюм». Разработанный сверточный автокодировщик продемонстрировал высокую эффективность автоматического выделения R-зубцов из смешанного ЭМГ-сигнала в условиях покоя и при умеренной физической нагрузке, что подтверждается высокими значениями F-меры.
Подтверждена гипотеза о том, что универсальные ЭМГ-электроды могут быть использованы для одновременного мониторинга мышечной активности и ключевых кардиологических параметров — сердечного ритма и его вариабельности. Это открывает прямые перспективы для создания интегрированных носимых систем, обеспечивающих комплексную оценку функционального состояния (утомления, стресса и базовых нарушений ритма) в режиме реального времени без необходимости применения дополнительных специализированных датчиков ЭКГ.
Полученные результаты имеют важное значение для использования в прикладных областях, таких как спортивная медицина, где важен контроль состояния спортсмена «здесь и сейчас», и профилактическая медицина, ориентированная на длительный мониторинг показателей здоровья.
Дальнейшее развитие работы связано с адаптацией алгоритма для онлайн-обработки, его валидацией на более широких и разнообразных группах испытуемых, включая пациентов с кардиологической патологией, и интеграцией в практику немедикаментозного контроля функционального состояния.
Финансирование. Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации, проект №FSMG-2024-0047 (разработка архитектуры автокодировщика) и №FSWR-2023–0029 (проведение экспериментальных работ и анализ данных).
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Teo K.K., Rafiq T. Cardiovascular risk factors and prevention: a perspective from developing countries. Can J Cardiol 2021; 37(5): 733–743, https://doi.org/10.1016/j.cjca.2021.02.009.
- Arakaki X., Arechavala R.J., Choy E.H., Bautista J., Bliss B., Molloy C., Wu D.A., Shimojo S., Jiang Y., Kleinman M.T., Kloner R.A. The connection between heart rate variability (HRV), neurological health, and cognition: a literature review. Front Neurosci 2023; 17: 1055445, https://doi.org/10.3389/fnins.2023.1055445.
- Ishaque S., Khan N., Krishnan S. Trends in heart-rate variability signal analysis. Front Digit Health 2021; 3: 639444, https://doi.org/10.3389/fdgth.2021.639444.
- Parin S., Polevaia A., Polevaia S. A neurochemical framework to stress and the role of the endogenous opioid system in the control of heart rate variability for cognitive load. COGNITIVE 2017: The Ninth International Conference on Advanced Cognitive Technologies and Applications 2017; 24: 16–20.
- Peltola M.A. Role of editing of R-R intervals in the analysis of heart rate variability. Front Physiol 2012; 3: 148, https://doi.org/10.3389/fphys.2012.00148.
- von Tscharner V., Eskofier B., Federolf P. Removal of the electrocardiogram signal from surface EMG recordings using non-linearly scaled wavelets. J Electromyogr Kinesiol 2011; 21(4): 683–688, https://doi.org/10.1016/j.jelekin.2011.03.004.
- Willigenburg N.W., Daffertshofer A., Kingma I., van Dieën J.H. Removing ECG contamination from EMG recordings: a comparison of ICA-based and other filtering procedures. J Electromyogr Kinesiol 2012; 22(3): 485–493, https://doi.org/10.1016/j.jelekin.2012.01.001.
- Lu G., Brittain J.S., Holland P., Yianni J., Green A.L., Stein J.F., Aziz T.Z., Wang S. Removing ECG noise from surface EMG signals using adaptive filtering. Neurosci Lett 2009; 462(1): 14–19, https://doi.org/10.1016/j.neulet.2009.06.063.
- Mak J.N., Hu Y., Luk K.D. An automated ECG-artifact removal method for trunk muscle surface EMG recordings. Med Eng Phys 2010; 32(8): 840–848, https://doi.org/10.1016/j.medengphy.2010.05.007.
- Nougarou F., Massicotte D., Descarreaux M. Efficient procedure to remove ECG from sEMG with limited deteriorations: extraction, quasi-periodic detection and cancellation. Biomed Signal Process Control 2018; 39: 1–10, https://doi.org/10.1016/j.bspc.2017.07.019.
- Hou C., Cai F., Liu F., Cheng S., Wang H. A method for removing ECG interference from lumbar EMG based on signal segmentation and SSA. IEEE Sensors Journal 2022; 22(13): 13309–13317, https://doi.org/10.1109/jsen.2022.3179434.
- Gierałtowski J., Ciuchciński K., Grzegorczyk I., Kośna K., Soliński M., Podziemski P. RS slope detection algorithm for extraction of heart rate from noisy, multimodal recordings. Physiol Meas 2015; 36(8): 1743–1761, https://doi.org/10.1088/0967-3334/36/8/1743.
- Weiss R., Karimijafarbigloo S., Roggenbuck D., Rödiger S. Applications of neural networks in biomedical data analysis. Biomedicines 2022; 10(7): 1469, https://doi.org/10.3390/biomedicines10071469.
- Ronneberger O., Fischer P., Brox T. U-Net: convolutional networks for biomedical image segmentation. In: Navab N., Hornegger J., Wells W., Frangi, A. (editors). Medical Image Computing and Computer-Assisted Intervention — MICCAI 2015. MICCAI 2015. Lecture Notes in Computer Science, vol 9351. Springer, Cham, https://doi.org/10.1007/978-3-319-24574-4_28.
- Chicho B.T., Bibo Sallow A. A comprehensive survey of deep learning models based on Keras framework. J Soft Comput Data Min 2021; 2(2): 49–62, https://doi.org/10.30880/jscdm.2021.02.02.005.
- Пимашкин А.С., Сесекин Г.Н., Хоружко М..А., Казанцев В.Б., Гордлеева С.Ю., Кастальский И.А., Ли А.Н., Лобов С.А., Миронов В.И., Мищенко М.А., Салихов Р.А., Храмов А.Е. Гибкий растяжимый кабель. Патент RU 223 063. 2024.
- Пимашкин А.С., Сесекин Г.Н., Хоружко М..А., Казанцев В.Б., Гордлеева С.Ю., Кастальский И.А., Ли А.Н., Лобов С.А., Миронов В.И., Мищенко М.А., Салихов Р.А., Храмов А.Е. Устройство в виде предмета одежды для регистрации и коррекции активности мышц. Патент RU 223 369. 2024.
- Kastalskiy I., Mironov V., Lobov S., Krilova N., Pimashkin A., Kazantsev V. A neuromuscular interface for robotic devices control. Comput Math Methods Med 2018; 2018: 8948145, https://doi.org/10.1155/2018/8948145.
- Obi J.C. A comparative study of several classificationmetrics and their performances on data. World J Adv Eng Technol Sci 2023; 8(1): 308–314, https://doi.org/10.30574/wjaets.2023.8.1.0054.
- Costa Junior J.D., de Seixas J.M., Ferreira Leite Miranda de Sá A.M. Reducing electrocardiographic interference in the multichannel electromyogram to help muscle fatigue assessment in low-intensity contractions. Franklin Open 2024; 9: 100177, https://doi.org/10.1016/j.fraope.2024.100177.