Децеллюляризированный каркас нерва в модели обширного повреждения периферического нерва крыс
Цель исследования — разработка модифицированного протокола децеллюляризации седалищного периневрия крыс и оценка его эффективности на модели протяженного дефекта периферического нерва у крыс.
Материалы и методы. Описан модифицированный детергентно-ферментативный протокол создания децеллюляризированного каркаса нерва. Процесс децеллюляризации (24 ч) включал последовательную обработку седалищного нерва крыс растворами трипсина–версена, 1% Triton X-100, 4% дезоксихолата натрия, а также фосфатно-буферным раствором и панкреатической ДНКазой I. Моделировали протяженный дефект седалищного нерва (15±2 мм), имплантировали аутотрансплантаты или децеллюляризированные нервные каркасы крысам линии Wistar. Восстановление нерва оценивали на 90-й день после имплантации с использованием иммуногистохимического анализа с подсчетом общего количества нервных волокон, интактных двигательных и миелинизированных волокон.
Результаты. Результаты гистологического исследования и окраски DAPI показали полное разрушение и вымывание ядерного материала при сохранении общей архитектуры нерва после удаления клеточных элементов. Содержание ДНК в децеллюляризированных каркасах составило 48,17±4,25 нг/мг ткани, в то время как в нативном нерве — 221,51±1,36 нг/мг. Анализ тканевой реакции на подкожную имплантацию децеллюляризированного нерва продемонстрировал отсутствие макрофагов. Гистологическая оценка выявила умеренное количество интактных нервных волокон в ортотопически имплантированном децеллюляризированном каркасе (835,6 [804,2; 866,0] на 1 мм2 ткани) по сравнению с аутотрансплантатом (1284,1 [1190,5; 1316,0] на 1 мм2 ткани). Имплантация децеллюляризированного нерва способствовала увеличению количества мелких миелинизированных волокон и восстановлению двигательных и чувствительных нервных волокон.
Заключение. Использование детергентно-ферментативной децеллюляризации седалищного нерва крыс продемонстрировало высокую эффективность, что подтверждалось отсутствием ядерного материала при сохранении гистологической структуры нерва. Наличие достаточного количества шванновских клеток через 3 мес имплантации и формирование периневрия являются положительными характеристиками при оценке эффективности протокола децеллюляризации нерва. Таким образом, децеллюляризированный каркас нерва представляет собой перспективную альтернативу аутотрансплантатам при лечении обширных дефектов периферических нервов.
Введение
Регенерация дефектов периферических нервов продолжает оставаться комплексной проблемой, несмотря на развитие новых биоматериалов и методов лечения [1]. Нервные трансплантаты используют для восстановления нервов в тех случаях, когда дефект превышает 5 мм и нет возможности для прямого сшивания без натяжения. Аутотрансплантация нерва остается основным методом хирургического лечения протяженных травм периферических нервов в клинической практике, направленным на восстановление их функциональности. Однако данный метод имеет свои недостатки, в число которых входят дефицит донорского материала, сложность его получения и продолжительный период послеоперационного восстановления [2]. Децеллюляризированные нервные каркасы представляют собой эффективный подход к лечению поврежденных периферических нервов, позволяя избежать недостатков аутотрансплантации [3]. Эти каркасы выполняют опорную функцию и стимулируют направленную регенерацию нерва [4]. Результаты недавних исследований, проведенных как in vitro, так и in vivo, подчеркивают стимулирующее воздействие децеллюляризированного внеклеточного матрикса (ВКМ) на восстановительные процессы. Компоненты ВКМ обладают репаративным потенциалом и положительно влияют на скорость аксонального восстановления [5–7]. Процесс получения аллогенных или ксеногенных тканевых каркасов на основе ВКМ включает разнообразные физические, химические и ферментативные методы обработки, однако существенной проблемой остается отсутствие стандартизированных протоколов получения децеллюляризированных тканей для регенеративной медицины [8, 9]. Оптимизация протокола получения децеллюляризированных нервов обеспечит получение наиболее подходящего материала для имплантации и стимуляции регенеративных процессов при лечении повреждений периферического нерва.
Цель данного исследования — разработка модифицированного протокола децеллюляризации седалищного нерва крыс и оценка его эффективности на модели протяженного дефекта периферического нерва у крыс.
Материалы и методы
Подготовка материала. Экспериментальное исследование с использованием половозрелых самцов крыс линии Wistar массой тела 190±10 г проведено на базе ФГБОУ ВО КубГМУ Минздрава России. Содержание, уход, маркировку и другие манипуляции cлабораторными животными проводили в соответствии с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и иных научных целей» (Страсбург, 1986) и после одобрения локального этического комитета ФГБОУ ВО КубГМУ Минздрава России (протокол №118 от 28.03.2023 г.). В ходе работы извлекали седалищный нерв у крыс (размер образцов составлял 15±2 мм) и помещали в пробирки типа «эппендорф» с натрий-фосфатным буфером и антибиотиком (1% раствор пенициллина–стрептомицина) для дальнейшего замораживания при температуре –80°С. После этого образцы седалищного нерва подвергали циклической детергентно-ферментативной децеллюляризации.
Методика децеллюляризации. Обработку растворами проводили в соотношении массы образца (г) к объему растворов (мл) — 1:10. Размороженные нервы обрабатывали раствором трипсина–версена («БиолоТ», Россия) при температуре 37°С на шейкере-инкубаторе при 100–150 об./мин в течение 6 ч с периодической сменой растворов каждые 2 ч. Далее образцы подвергали двум циклам последовательного воздействия 1% раствора Triton X-100 (Scharlab, Испания) в течение 3 ч на шейкере при 100–150 об./мин и 4% раствора дезоксихолата натрия (Sigma-Aldrich, США) в течение 3 ч при комнатной температуре. Образцы промывали дистиллированной водой после каждого раствора в течение 5–20 мин. Обработку свиной панкреатической ДНКазой I(2000 МЕ/200 мл кальций/магний фосфатного буфера; Sigma-Aldrich, США) проводили в течение 4 ч при температуре 37°С на шейкере-инкубаторе при 100–150 об./мин. Полученные образцы проверяли на качество децеллюляризации с помощью окрашивания гематоксилином и DAPI, а также путём измерения количества ДНК по сравнению с нативным нервом.
Количественный анализ ДНК. Количественное определение ДНК проводили на спектрофотометре NanoDropND-1000 (ThermoFisherScientific, США) с использованием набора реагентов (ExtractDNABlood& Cells; «Евроген», Россия) в соответствии с протоколом производителя.
Гистологический анализ. Все образцы выдерживали в 10% нейтральном буферном растворе формалина в течение 24 ч. Далее образцы заливали в парафин по стандартной методике с использованием гистопроцессора TP1020-1 (Leica, Германия). Парафиновые блоки получали с помощью модульной установки EG1150H (Leica, Германия), затем подготавливали слайды на роторном микротоме RM2235 (Leica, Германия). Препараты толщиной 5 мкм помещали на предметные стекла микроскопа, проводили депарафинизацию в ксилоле и в градуированной серии этиловых спиртов. На следующем этапе образцы окрашивали гематоксилином и эозином, промывали в проточной воде, фиксировали под покровными стеклами с использованием синтетической заливочной среды (Diapath, Италия) и фотографировали в трех полях зрения с помощью микроскопа OlympusCX41 (Olympus, Япония). Изображения и данные анализировали с помощью программного обеспечения CellSensEntry (Olympus, Япония).
Окрашивание DAPI. Гистологические срезы (4–5 мкм) нативного нерва и децеллюляризированного каркаса периферического нерва фиксировали 4% формальдегидом в течение 10 мин. Затем на срезы наносили DAPI (разведение 1:1000; Sigma-Aldrich, США), накрывали покровным стеклом и наблюдали характерную окраску под флуоресцентным микроскопом (синий фильтр) Olympus IX 51 (Olympus, Япония). Ядра клеток флуоресцировали ярко-синим цветом.
Оценка цитотоксичности материала. Для определения цитотоксичности децеллюляризированного нерва проведен анализ жизнеспособности клеток в присутствии полученного материала с помощью LIVE/DEAD теста (набор LIVE/DEAD Cell Imaging Kit; Thermo Fisher Scientific, США). Использовали линию человеческих дермальных фибробластов DF-1, полученную из Российской коллекции клеточных культур позвоночных Института цитологии РАН. В качестве контроля брали полную питательную среду без добавления децеллюляризированного нерва. Относительную флуоресценцию рассчитывали на основе трех изображений при 40-кратном увеличении, полученных случайным образом. Визуализацию флуоресцентного свечения проводили с помощью программного обеспечения Olympus cellSens Entry (Olympus, Япония).
Подкожная имплантация. Подкожную имплантацию выполняли в область холки животного по средней линии спины под изофлурановой анестезией (индукция 2–5%, поток 0,25–4,0%; MIRALEK, Китай). Экспериментальные животные (n=8) были случайным образом разделены на 2 группы. Группе А имплантировали децеллюляризированный каркас периферического нерва (15±2 мм), а группе Б — нативный седалищный нерв (13±2 мм). Децеллюляризированный каркас периферического нерва фиксировали в мышечно-фасциальном ложе, а кожу ушивали нитью Ethilon 3-0 (Ethicon, США). После операции каждая крыса получала инъекции антибиотика цефовецина в дозе 6,4 мг/кг и анальгетика кетопрофена — 12,8 мг/кг. Через две недели после имплантации животных подвергли эвтаназии с помощью внутримышечной инъекции 15 мг/кг золазепама и 15 мг/кг тилетамина. Эксплантировали образцы децеллюляризированных и нативных нервов с окружающими тканями и подготавливали срезы для гистологического анализа.
Проведение имплантации. Экспериментальное лечение дефекта периферического нерва у крыс Wistar проводили под анестезией изофлураном. Предоперационная подготовка включала удаление волос и обработку 70% этанолом участка кожи бедра крысы для предотвращения воспаления и инфицирования раны. Крысы (n=12) были случайным образом разделены на 2 группы. Моделировали повреждение периферического нерва с помощью иссечения седалищного нерва длиной 15±2 мм до бифуркации. Группа 1 — контрольная (n=6), нерв поворачивали на 180° вокруг продольной оси и имплантировали с помощью эпиневральных швов; группа 2 — опытная (n=6), децеллюляризированный каркас периферического нерва имплантировали ортотопически. Дефект ушивали 5–6 эпиневральными швами нитью Promilen 8-0 (Ethicon, США), а кожу — 5 простыми узловыми швами нитью Ethilon 3-0 (Ethicon, США). После операции каждой крысе вводили антибиотик цефовецин в дозе 6,4 мг/кг и анальгетик кетопрофен — 12,8 мг/кг. Послеоперационный шов обрабатывали аэрозолем «Террамицин» (Zoetis, США). На 90-й день крыс выводили из эксперимента с помощью внутримышечной инъекции 15 мг/кг золазепама и 15 мг/кг тилетамина. Децеллюляризированные каркасы периферических нервов и аутотрансплантаты изолировали и разделяли на проксимальные, медиальные и дистальные фрагменты относительно места имплантации, после чего подвергали гистологическому и иммуногистохимическому анализу.
Иммуногистохимический анализ. В ходе работы использовали следующие антитела: козьи антитела к холинацетилтрансферазе (ChAT, 1:100; Millipore, США); кроличьи антитела к нейрофиламентам (NF, 1:200; Novus, США), крысиные антитела к основному белку миелина (MBP, 1:50; Abcam, Великобритания). Оценивали количество неповрежденных двигательных волокон по окраске холинацетилтрансферазы (ChAT); количество нервных и миелинизированных волокон по окраске нейрофиламента (NF) и основного белка миелина (MBP) соответственно. Затем наносили видоспецифичные конъюгированные антитела с высоким содержанием Cy2 или Cy3 (Jackson ImmunoResearch, США). Степень изменения нервов оценивали полуколичественным методом с использованием относительной площади миелинизированных волокон, рассчитанной с помощью цифрового морфометрического метода на образцах. Для окрашивания ChAT применяли биотинилированные вторичные антитела и Cy2-конъюгированный стрептавидин (Jackson ImmunoResearch, США). Цифровые изображения получали с помощью Adobe Photoshop (Adobe Systems, США). Количество ChAT или NF-положительных нейронов, а также диаметров MBP-положительных волокон в трех срезах от каждого животного изучали с использованием программного обеспечения Image-Pro Plus (Media Cybernetics, США). Анализ проводили на фиксированных срезах 200×200 мкм, с каждого среза выполняли 3–4 измерения. Иммуногистохимическое окрашивание осуществляли в лаборатории Patho Logica (Израиль).
Статистический анализ. Результаты обработаны с помощью MS Excel (версия 6.0), GraphPad Prism для Windows (версия 6.04; GraphPad Software, США). Нормальность распределения данных определяли с использованием критерия Шапиро–Уилка. Результаты иммуногистохимического анализа и определения количества ДНК были проанализированы с использованием t-критерия Стьюдента и представлены в виде М±SD, где М — среднее арифметическое, SD — стандартная ошибка среднего. Результаты гистологического анализа проанализированы с помощью критерия Манна–Уитни и представлены в виде медианы с первым и третьим квартилем (Me [Q1; Q3]). Различия считали значимыми при p<0,05.
Результаты
Основным преимуществом децеллюляризации периферического нерва является возможность получения неиммуногенного биологического материала, который сохраняет функциональную структуру ткани, но при этом лишен клеточных компонентов, вызывающих иммунный ответ при имплантации. Децеллюляризированный каркас представлял собой скаффолд белого цвета с разволокненными краями, имел гладкую поверхность и более рыхлую структуру по сравнению с образцами нативных нервов (рис. 1).

|
Рис. 1. Внешний вид: а — нативный нерв; б — децеллюляризированный каркас периферического нерва |
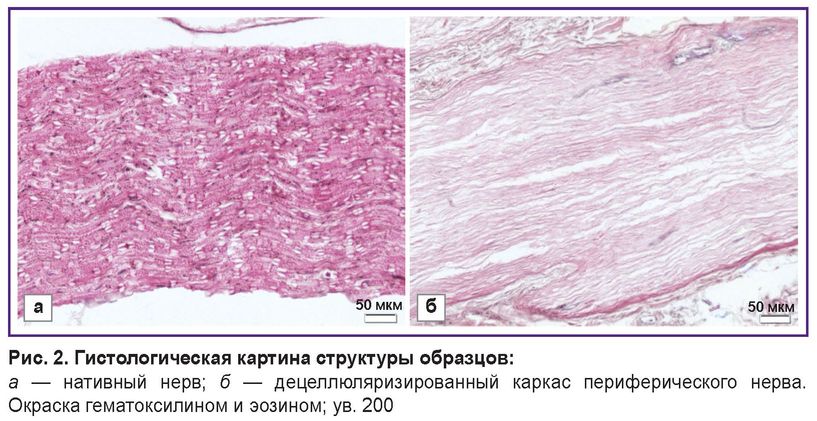
Изменения в структуре децеллюляризированного каркаса были оценены с помощью гистологического окрашивания в сравнении с нативным нервом. Окрашивание гематоксилином и эозином продемонстрировало сохранение общей гистологической архитектуры нерва после удаления клеточных элементов (рис. 2).
|
Рис. 2. Гистологическая картина структуры образцов: а — нативный нерв; б — децеллюляризированный каркас периферического нерва. Окраска гематоксилином и эозином; ув. 200 |
В образцах децеллюляризированного каркаса нерва отсутствовали клеточные ядра, что подтверждало эффективность процесса децеллюляризации. Содержание ДНК в нативных образцах составило 221,51±1,36 нг/мг ткани, в децеллюляризированном каркасе нерва — 48,17±4,25 нг/мг ткани, что в 4,59 раза ниже значений для нативного нерва (p<0,05) (рис. 3).
В результате проведенного теста LIVE/DEAD в контрольной лунке жизнеспособность линии клеток DF-1 составляла 87,60±5,41%, а в присутствии исследуемого материала — 83,2±4,6%. Это указывает на отсутствие токсических эффектов децеллюляризированного нерва на культивируемые клетки. Материалы считаются биосовместимыми при проценте жизнеспособности более 70% в соответствии с критериями ГОСТ ISO10993-5—2011 [10].
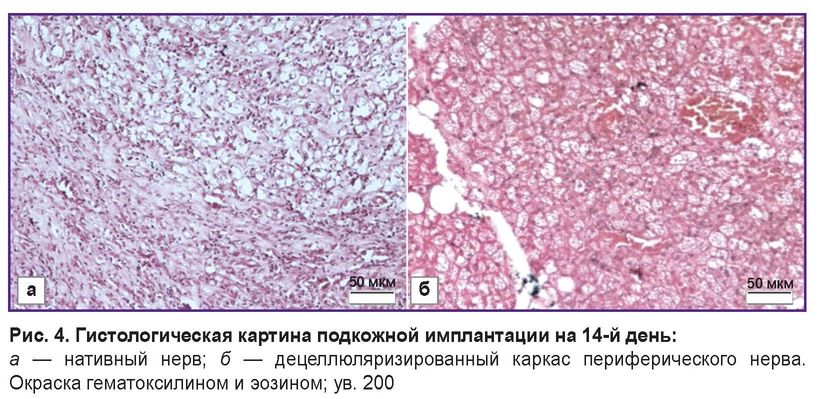
Подкожная имплантация продемонстрировала отсутствие воспалительного ответа на децеллюляризированный каркас. Гистологическая оценка показала отсутствие макрофагов и нейтрофилов в области между децеллюляризированным каркасом и прилегающей тканью (рис. 4, б). В то же время имплантация нативного нерва показала значительную лимфо-макрофагальную инфильтрацию (рис. 4, а).
|
Рис. 4. Гистологическая картина подкожной имплантации на 14-й день:
а — нативный нерв; б — децеллюляризированный каркас периферического нерва. Окраска гематоксилином и эозином; ув. 200 |
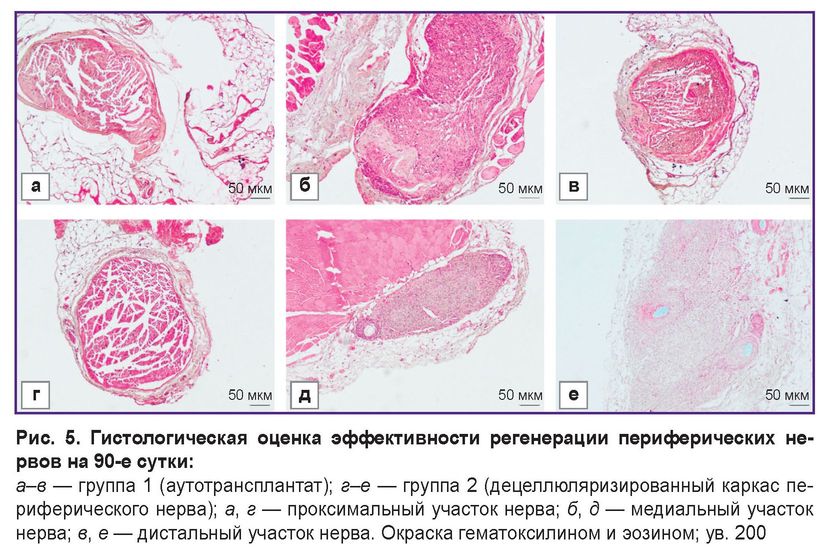
Визуальный осмотр животных во всех экспериментальных группах выявил уменьшение объема задних конечностей и нарушение походки, связанные с деформацией конечностей и сведением фаланг. Через 90 дней после имплантации в экспериментальных группах было отмечено преобладание нервных волокон в медиальной части нерва по данным гистологического анализа (рис. 5). Оценка образцов децеллюляризированного каркаса нерва в данных фрагментах показала умеренное количество интактных нервных волокон, которое составило 835,6 [804,2; 866,0] на 1 мм2 ткани, диаметр волокон — 10,1 [8,2; 12,4] мкм. Наблюдалось образование выраженного периневрия и уменьшение количества рыхлой соединительной ткани между тканевыми волокнами. Результаты гистологической оценки восстановления нервных волокон при имплантации аутотрансплантата были наилучшими среди всех экспериментальных групп. При аутотрансплантации в медиальных фрагментах образцов было зарегистрировано 1284,1 [1190,5; 1316,0] интактных волокон на 1 мм2 поперечного сечения, их диаметр составил 10,2 [9,7; 11,0] мкм. В области между имплантированными материалами выявлено незначительное количество рыхлого эндоневрия; периневрий представлял собой слой плотной соединительной ткани.
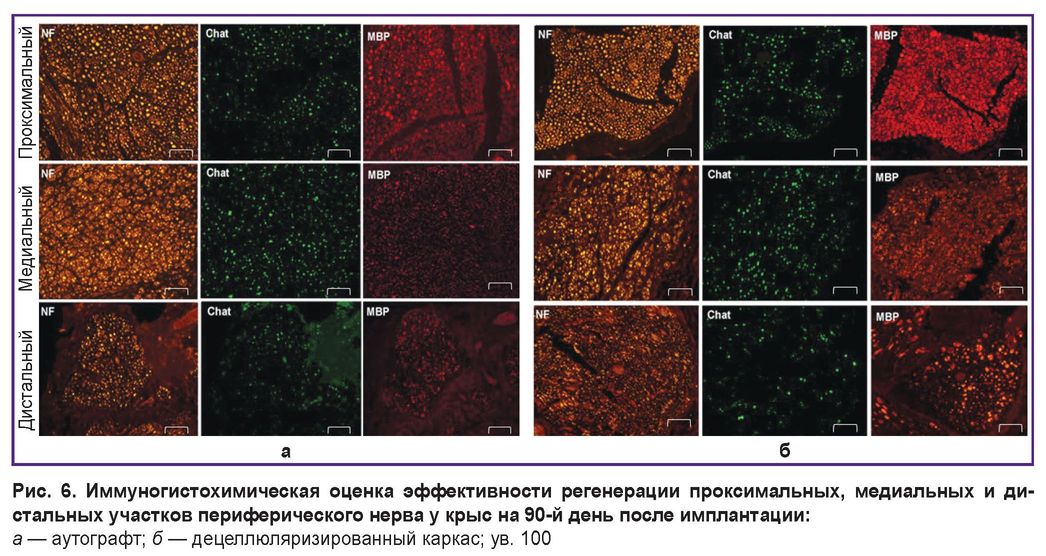
Иммуногистохимический анализ показал значительное восстановление двигательных нервных волокон в медиальной части трансплантата в опытной группе по сравнению с контрольной (см. таблицу).
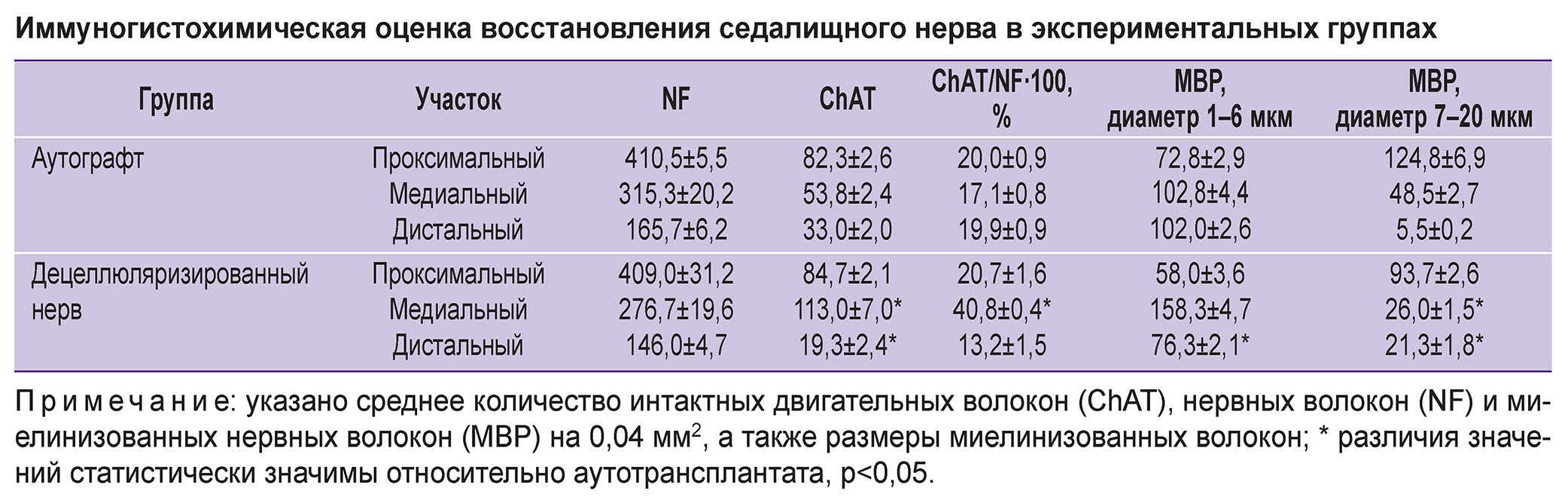
|
Иммуногистохимическая оценка восстановления седалищного нерва в экспериментальных группах |
После окрашивания антителом к MBP нервные волокна были разделены на два типа. Первый тип состоял из мелких волокон размером 1–6 мкм, которые свидетельствуют о регенерации нерва. Второй тип характеризовался большими волокнами размером 7–20 мкм, которые, вероятно, уже присутствовали до начала исследования. На рис. 6 показано, что наблюдалось четкое увеличение количества мелких волокон в медиальных сегментах по сравнению с другими фрагментами нерва. Кроме того, количество ChAT-позитивных волокон в общем количестве нервных волокон (NF) сохранялось в равновесии с лимитом для ChAT в 40%. В результате произошло восстановление двигательных и чувствительных волокон. Во всех образцах отмечено увеличение количества мелких миелинизованных волокон в медиальной зоне. Таким образом, полученные результаты демонстрировали высокую регенеративную способность экспериментального материала при повреждении периферического нерва у крыс.
Обсуждение
Ряд исследований [11–15] подтверждают как эффективность, так и безопасность использования децеллюляризированных каркасов нерва при восстановлении повреждений периферических нервов, что делает их перспективной альтернативой аутотрансплантации. Основное преимущество децеллюляризированных нервов заключается в их высокой биосовместимости, которая обусловлена низким содержанием клеточного компонента. При этом они сохраняют оптимальные характеристики механической прочности и эластичности. Наличие основных структурных компонентов ВКМ и сохранение трехмерной структуры способствуют процессу регенерации поврежденных участков периферических нервов [16].
Наиболее распространенным методом децеллюляризации является комбинация детергентов с ферментативной обработкой. Цвиттерионные и неионные детергенты: сульфобетаин-10 (SB-10), сульфобетаин-16 (SB-16) и Triton X-100 — часто используются для растворения ядерных, клеточных мембран и цитоплазматических белков. В работе A. Zaminy и соавт. [15] предложен протокол получения децеллюляризированных каркасов нервов с использованием комбинации SB-10, SB-16 и Triton X-100, который обеспечил высокий уровень элиминации клеток, сохранение структуры коллагеновых волокон нерва и отсутствие цитотоксичности. Количественный анализ ДНК показал, что в децеллюляризированном каркасе нерва содержалось на 93,5% меньше ДНК, чем в нативных образцах, а МТТ-анализ не выявил признаков цитотоксичности. Наш протокол децеллюляризации нервов предусматривал использование комбинации Triton X-100 в сочетании с ферментативной обработкой. Сравнительный анализ количества ДНК, оставшейся после обработки, показал, что образцы децеллюляризированного каркаса содержали на 78,25% меньше ДНК по сравнению с нативными образцами, при этом данный результат соответствует признанному критерию качества децеллюляризации (~50 нг/мг ткани) [17]. Еще одним существенным различием сравниваемых протоколов является время обработки. Цикл получения децеллюляризированных образцов у А. Zaminy с соавт. [15] составлял 62 ч, тогда как в нашем протоколе время обработки заняло 22 ч. Таким образом, децеллюляризированные каркасы нервов, полученные с использованием нашего протокола и протокола в исследовании А. Zaminy с соавт. [15], могут эффективно применяться для восстановления поврежденных периферических нервов.
Децеллюляризация с использованием только Triton X-100 не так эффективна для удаления ДНК, как сочетание различных детергентов. Так, B. Topuz и H.M. Aydin [18] провели сравнительный анализ комбинаций детергентов и пришли к выводу, что обработка образцов нервов с использованием Triton X-100 и дезоксихолата натрия позволяет получить оптимальный результат. Анализ ДНК в децеллюляризированном нерве показал меньшее количество ДНК, чем в нативных нервах, при этом не было выявлено более высокой степени цитотоксичности децеллюляризированного каркаса. Наш протокол также предусматривал использование Triton X-100 в сочетании с дезоксихолатом натрия. Сравнительный анализ содержания ДНК в образцах нативного и децеллюляризированного нервов продемонстрировал, что данная комбинация детергентов значительно уменьшает содержание клеточных компонентов.
В исследовании Q. Wang и соавт. [19] децеллюляризированный нерв был получен тремя различными способами децеллюляризации, два из которых включали обработку ферментом ДНКазой I. Сравнительные результаты протоколов децеллюляризации показали оптимальное удаление клеточных компонентов после обработки ферментами. Однако метод ферментативной обработки с предварительным замораживанием–оттаиванием нервов оказался более эффективным, чем два других метода децеллюляризации с химической экстракцией. Наш протокол децеллюляризации включал этап воздействия ДНКазой I, но время обработки было в 3 раза меньше, чем в работе Q. Wang и соавт. [19]. Гистологический анализ показал наличие ядер и упорядоченных коллагеновых фибрилл в образцах нативного нерва. Образцы децеллюляризированных нервов, полученных детергентно-ферментативным методом в соответствии с нашим протоколом, характеризовались меньшим количеством ядер и наличием разрывов в волокнах. При децеллюляризации по протоколу Q. Wang и соавт. [19] количество клеточного компонента после децеллюляризации было значительно ниже, а коллагеновые волокна хорошо сохранились и располагались параллельно друг другу.
В исследовании E. Contreras и соавт. [20] была проведена оценка эффективности восстановления дефекта (15 мм) седалищного нерва у крыс. Децеллюляризированный каркас нерва показал перспективные результаты при регенерации аксонов. Гистологическое исследование выявило оптимальную сохранность структуры ВКМ, а также наличие многочисленных регенерированных миелинизированных и немиелинизированных аксонов в медиальной и дистальной частях децеллюляризированного каркаса после имплантации. Иммуногистохимическое окрашивание продемонстрировало наличие многочисленных аксонов, окруженных шванновскими клетками вдоль децеллюляризированного нерва. У децеллюляризированного каркаса регенерация происходила медленнее, а шванновские клетки располагались более свободно по сравнению с аутотрансплантатом. В нашем исследовании применение децеллюляризованного каркаса нерва способствовало восстановлению протяженного дефекта периферического нерва крысы. Каркас обладал трехмерной сетчатой структурой нативных нервов, которая определяла направление роста аксонов. Результаты иммуногистохимического и гистологического окрашивания продемонстрировали способность децеллюляризованного каркаса нерва стимулировать процессы регенерации двигательных и чувствительных волокон в поврежденном периферическом нерве крысы. Наблюдалось также увеличение количества мелких миелинизированных волокон в медиальной части и умеренное количество неповрежденных нервных волокон по всему каркасу.
Заключение
Использование детергентно-ферментативной децеллюляризации седалищного нерва крысы обеспечило эффективное удаление клеточных компонентов, сохранение целостности эндоневрия и основных компонентов ВКМ. Децеллюляризированный каркас периферического нерва не вызвал отторжения или воспалительной инфильтрации при гетеро- и ортотопической имплантации. Децеллюляризированный каркас периферического нерва является перспективной альтернативой использованию аутотрансплантатов при замещении обширных дефектов периферических нервов.
Финансирование. Исследование поддержано грантом Российского научного фонда №23-25-00540, https://rscf.ru/en/project/23-25-00540/.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Литература
- Jahromi M., Razavi S., Bakhtiari A. The advances in nerve tissue engineering: from fabrication of nerve conduit to in vivo nerve regeneration assays. J Tissue Eng Regen Med 2019; 13(11): 2077–2100, https://doi.org/10.1002/term.2945.
- Boriani F., Fazio N., Bolognesi F., Pedrini F.A., Marchetti C., Baldini N. Noncellular modification of acellular nerve allografts for peripheral nerve reconstruction: a systematic critical review of the animal literature. World Neurosurg 2019; 122: 692–703.e2, https://doi.org/10.1016/j.wneu.2018.10.195.
- Brown M., Li J., Moraes C., Tabrizian M., Li-Jessen N.Y.K. Decellularized extracellular matrix: new promising and challenging biomaterials for regenerative medicine. Biomaterials 2022; 289: 121786, https://doi.org/10.1016/j.biomaterials.2022.121786.
- Zhang X., Chen X., Hong H., Hu R., Liu J., Liu C. Decellularized extracellular matrix scaffolds: recent trends and emerging strategies in tissue engineering. Bioact Mater 2021; 10: 15–31, https://doi.org/10.1016/j.bioactmat.2021.09.014.
- Ikegami Y., Ijima H. Decellularization of nervous tissues and clinical application. Adv Exp Med Biol 2021; 1345: 241–252, https://doi.org/10.1007/978-3-030-82735-9_19.
- Wüthrich T., Lese I., Haberthür D., Zubler C., Hlushchuk R., Hewer E., Maistriaux L., Gianello P., Lengelé B., Rieben R., Vögelin E., Olariu R., Duisit J., Taddeo A. Development of vascularized nerve scaffold using perfusion-decellularization and recellularization. Mater Sci Eng C Mater Biol Appl 2020; 117: 111311, https://doi.org/10.1016/j.msec.2020.111311.
- Xu S., Lu F., Cheng L., Li C., Zhou X., Wu Y., Chen H., Zhang K., Wang L., Xia J., Yan G., Qi Z. Preparation and characterization of small-diameter decellularized scaffolds for vascular tissue engineering in an animal model. Biomed Eng Online 2017; 16(1): 55, https://doi.org/10.1186/s12938-017-0344-9.
- Gilpin A., Yang Y. Decellularization strategies for regenerative medicine: from processing techniques to applications. Biomed Res Int 2017; 2017: 9831534, https://doi.org/10.1155/2017/9831534.
- Philips C., Cornelissen M., Carriel V. Evaluation methods as quality control in the generation of decellularized peripheral nerve allografts. J Neural Eng 2018; 15(2): 021003, https://doi.org/10.1088/1741-2552/aaa21a.
- ГОСТ ISO 10993-5—2011. Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro. М: Стандартинформ; 2010.
- Nasrollahi Nia F., Asadi A., Zahri S., Abdolmaleki A. Biosynthesis, characterization and evaluation of the supportive properties and biocompatibility of DBM nanoparticles on a tissue-engineered nerve conduit from decellularized sciatic nerve. Regen Ther 2020; 14: 315–321, https://doi.org/10.1016/j.reth.2020.03.004.
- Kuna V.K., Lundgren A., Anerillas L.O., Kelk P., Brohlin M., Wiberg M., Kingham P.J., Novikova L.N., Andersson G., Novikov L.N. Efficacy of nerve-derived hydrogels to promote axon regeneration is influenced by the method of tissue decellularization. Int J Mol Sci 2022; 23(15): 8746, https://doi.org/10.3390/ijms23158746.
- McCrary M.W., Vaughn N.E., Hlavac N., Song Y.H., Wachs R.A., Schmidt C.E. Novel sodium deoxycholate-based chemical decellularization method for peripheral nerve. Tissue Eng Part C Methods 2020; 26(1): 23–36, https://doi.org/10.1089/ten.TEC.2019.0135.
- Nakada M., Itoh S., Tada K., Matsuta M., Murai A., Tsuchiya H. Effects of hybridization of decellularized allogenic nerves with adipose-derive stem cell sheets to facilitate nerve regeneration. Brain Res 2020; 1746: 147025, https://doi.org/10.1016/j.brainres.2020.147025.
- Zaminy A., Sayad-Fathi S., Kasmaie F.M., Jahromi Z., Zendedel A. Decellularized peripheral nerve grafts by a modified protocol for repair of rat sciatic nerve injury. Neural Regen Res 2021; 16(6): 1086–1092, https://doi.org/10.4103/1673-5374.300449.
- Philips C., Campos F., Roosens A., Sánchez-Quevedo M.D.C., Declercq H., Carriel V. Qualitative and quantitative evaluation of a novel detergent-based method for decellularization of peripheral nerves. Ann Biomed Eng 2018; 46(11): 1921–1937, https://doi.org/10.1007/s10439-018-2082-y.
- Crapo P.M., Gilbert T.W., Badylak S.F. An overview of tissue and whole organ decellularization processes. Biomaterials 2011; 32(12): 3233–3243, https://doi.org/10.1016/j.biomaterials.2011.01.057.
- Topuz B., Aydin H.M. Preparation of decellularized optic nerve grafts. Artif Organs 2022; 46(4): 618–632, https://doi.org/10.1111/aor.14098.
- Wang Q., Zhang C., Zhang L., Guo W., Feng G., Zhou S., Zhang Y., Tian T., Li Z., Huang F. The preparation and comparison of decellularized nerve scaffold of tissue engineering. J Biomed Mater Res A 2014; 102(12): 4301–4308, https://doi.org/10.1002/jbm.a.35103.
- Contreras E., Traserra S., Bolívar S., Forés J., Jose-Cunilleras E., García F., Delgado-Martínez I., Holmgren S., Strehl R., Udina E., Navarro X. Repair of long nerve defects with a new decellularized nerve graft in rats and in sheep. Cells 2022; 11(24): 4074, https://doi.org/10.3390/cells11244074.