Биораспределение предшественника радиофармпрепарата BBN/C1-C2, нацеленного на бомбезиновые рецепторы, в модели рака предстательной железы
Рецептор пептида, высвобождающего гастрин (GRPR), представляет собой рецептор, сопряженный с G-белком, который экспрессируется в центральной нервной системе, желудочно-кишечном тракте, поджелудочной железе и тканях коры надпочечников, регулируя их физиологические функции. Помимо нормальных тканей, GRPR сверхэкспрессируется во многих солидных раковых опухолях. На сегодняшний день несколько радиоактивно-меченых лигандов, нацеленных на GRPR, были введены в клинику для диагностики рака и радиолигандной терапии. Однако были выявлены высокие дозы накопления радиофармпрепаратов в нормальных органах, а также их низкая биодоступность, обусловленная стабильностью. В связи с этим для повышения терапевтической эффективности в настоящее время ведется поиск радиоантагонистов GRPR с улучшенной протеолитической стабильностью и более длительным временем удержания в опухолевых очагах с низким поглощением в нецелевых органах.
Цель исследования — изучение биораспределения молекулы BBN/C1-C2, созданной на основе бомбезина и кноттина, и динамики ее накопления в опухоли в модели in vivo.
Материалы и методы. Анализировали биораспределение Cy7.5-меченного BBN/C1-C2, созданного на основе бомбезина и кноттина U5-Sth1a, и полученного с использованием твердофазного пептидного синтеза. Исследование проводили на мышиной модели Nu/Nu с перевитой в правый бок опухолью рака предстательной железы (культура PC-3) солидного типа, экспрессирующей GRPR, с использованием поверхностного флуоресцентного имиджинга в режиме реального времени на 2-е и 5-е сутки после внутривенного введения исследуемых молекул.
Результаты. Анализ биораспределения показал избирательное связывание молекулы BBN/C1-C2 с опухолью, а также ее способность удерживаться на поверхности опухоли до 5 дней без интернализации внутрь клеток при низком накоплении в нормальных органах и тканях.
Заключение. Нам удалось получить стабильную молекулу, однако в качестве каркаса использовался токсин U5-Sth1a, тропный к ионным каналам, в результате чего у полученной молекулы сохранился домен, отвечающий за прикрепление к каналу-мишени и характерный для кноттина. Это может в будущем, при использовании молекулы в качестве лиганда для радиотерапии, негативно сказаться на сердце пациента из-за дополнительной радиационной нагрузки. В связи с этим молекула BBN/C1-C2 требует дополнительного исследования.
Введение
Рецептор пептида, высвобождающего гастрин (GRPR), представляет собой рецептор, сопряженный с G-белком, который экспрессируется в центральной нервной системе, желудочно-кишечном тракте, поджелудочной железе и тканях коры надпочечников, регулируя их физиологические функции [1]. Помимо нормальных тканей GRPR сверхэкспрессируется во многих солидных раковых опухолях. Например, GRPR ассоциирован с ростом карциномы предстательной железы [2], аденокарциномы молочной железы [3] и колоректального рака [4]. В связи с этим разработка радиофармпрепаратов, нацеленных на GRPR, является перспективной целью для визуализации и терапии новообразований.
На сегодняшний день для диагностики рака и радиолигандной терапии в клинику были введены несколько радиоактивно-меченых лигандов, нацеленных на GRPR, которые основаны на аналоге гастрин-высвобождающего пептида (GRP), выделенного из амфибии, — бомбезине (BBN) [5–8]. Однако у пациентов и в доклинических животных моделях были обнаружены высокие дозы накопления радиофармпрепаратов в нормальных органах, особенно в поджелудочной железе [7, 8]. Помимо высокого накопления радиофармпрепаратов в нецелевых органах существует еще одна значительная проблема, усложняющая лечение новообразований, — стабильность фармпрепарата. Молекула бомбезина показывает хорошее накопление в опухоли, однако обладает низкой протеолитической стабильностью [9]. При попытке стабилизировать бомбезин, например используя мотив [DPhe6,Leu13-NHEt] (демобизин), улучшаются сродство молекулы с GRPR и накопление препарата опухолью, однако сохраняется низкая протеолитическая стабильность [10]. Еще одна модификация бомбезина N4-AMA-DIG-[DPhe6,Sar11,LeuNHEt13]BBN продемонстрировала повышенную устойчивость к протеолизу [11]. Это обусловило проводимые в настоящий момент активные исследования на пациентах. В связи с этим для повышения терапевтической эффективности актуален поиск радиоантагонистов GRPR с улучшенной протеолитической стабильностью и более длительным временем удержания в опухолевых очагах с низким поглощением в нецелевых органах.
В нашем предыдущем исследовании мы использовали кноттин из яда паука в качестве стабилизирующей молекулы, поместив короткий пептид бомбезин в домен между первым и вторым остатком цистеина (BBN/C1-C2) [12]. Доказав химическую и радиохимическую стабильность полученной молекулы, мы проанализировали способность молекулы BBN/C1-C2 связываться с поверхностью раковых клеток. В данном исследовании мы применяли метод in vivo визуализации, чтобы показать биораспределение созданной молекулы и динамику ее накопления в опухоли. Для сравнения использовался пептид GRP и нативный токсин, на основе которого создан BBN/C1-C2.
Материалы и методы
Синтез пептидов и контроль качества. Пептиды были синтезированы на автоматическом пептидном синтезаторе ResPep SL (Intavis, Германия). Синтез проводили на твердой подложке (TentaGel; Intavis, Германия) на основе Fmoc-химии. В качестве активатора использовали HBTU («Кемикал Лайн», Россия), растворенный в диметилфомамиде (ДМФА) («Кемикал Лайн», Россия). Депротекцию выполняли пиперидином (PanReac Applichem, Испания) в ДМФА, кэпирование — с помощью 5% уксусного ангидрида (Acros Organics, Бельгия). После синтеза пептиды снимали с подложки раствором, содержащим 95% трифторуксусной кислоты (Acros Organics, Бельгия), 5% триизопропилсилана (PanReac Applichem, Испания) и 5% деионизированной воды.
После синтеза химическую чистоту пептидов анализировали методом обращенно-фазовой хроматографии. Аппаратно-технический комплекс представлен системой высокоэффективной жидкостной хроматографии LC-20AD XR (Shimadzu, Япония), оснащенной спектрофотометрическим детектором и колонкой Luna C18(2) (Dr. Maisch, Германия). Элюирование — градиентное, подвижная фаза состояла из деионизированной воды и ацетонитрила. Содержание ацетонитрила в подвижной фазе увеличивали с 5% в начале до 100% в конце исследования в течение 40 мин. Скорость потока составляла 1 мл/мин. Детектирование осуществляли на длине волны 215 нм, а также с использованием масс-спектрометрии на масс-спектрометре MALDI-TOF MS FLEX (Bruker Daltonics, Германия).
Очистку пептидов выполняли на хроматографе AutoPure25 (Inscinstech, Китай) методом обращенно-фазовой хроматографии с использованием колонки Galaksil EF-C18H (GALAK Chromatography Technology Co., Ltd, Китай). Элюирование — градиентное, подвижная фаза состояла из деионизированной воды и ацетонитрила. Содержание ацетонитрила в подвижной фазе увеличивали с 5% в начале до 100% в конце исследования в течение 90 мин. Скорость потока составляла 3 мл/мин. Детектирование осуществляли на длине волны 215 нм.
После очистки токсин и BBN/C1-C2 подвергали фолдингу в растворе, содержащем 10 мМ восстановленного и 1 мМ окисленного глутатиона в 0,1 М Трис-HCl («ПанЭко», Россия) при pH=8,0. Пептиды инкубировали в растворе при 4°С в течение 24 ч при постоянном перемешивании.
Мечение пептидов флуоресцентным красителем. Для визуализации биораспределения пептидов in vivo использовали краситель Cyanine7.5 (далее Cy7.5) (ООО «Люмипроб РУС», Россия), который обеспечивает свечение в области ближнего инфракрасного спектра (Ex/Em — 788/808 нм), благодаря чему краситель подсвечивается в зоне, где не светят природные молекулы. Мечение проводили активированным эфиром Cy7.5 для связывания красителя с аминогруппой пептида по стандартному протоколу производителя. С этой целью пептиды растворяли в деионизированной воде в концентрации 1 мг/мл, затем раствор смешивали с 1 М бикарбоната натрия для достижения pH=8,3 всей реакционной смеси. Далее к раствору добавляли краситель, растворенный в ДМСО, в 8-кратном молярном избытке по отношению к пептиду. Смесь инкубировали 3 ч при комнатной температуре и при периодическом перемешивании. Через 3 ч смесь заливали 10-кратным избытком ледяного этилового спирта и центрифугировали при 21 000 g, 4°С в течение 30 мин. После этого очистку от несвязавшегося красителя повторяли.
Анализ стабильности пептидных комплексов. Изучали стабильность как целых структур (Cy7.5-BBN/C1-C2, Cy7.5-GRP, Cy7.5-U5-Sth1a), так и комплексов пептидов с красителем Cy7.5. Для этого все пептиды инкубировали в фосфатно-солевом буфере (pH=7,4) в течение 144 ч при 37°С. Пробы отбирали каждые 24 ч и анализировали с использованием высокоэффективной жидкостной хроматографии LC-20AD XR (Shimadzu, Япония), как описано выше. Фиксацию стабильности комплекса с красителем проводили аналогично фиксации стабильности пептида, исходя из накопления свободного красителя в пробах.
Флуоресцентная визуализация опухоли in vivo. Исследование проводили на самцах мышей линии Nu/Nu в возрасте 9–10 нед массой тела 26–28 г.
Работа с животными была одобрена комитетом Института медицины, экологии и физической культуры Ульяновского государственного университета. Комиссия по биоэтике до начала эксперимента оценивала дизайн исследования и согласовывала протокол на соответствие международным правовым и этическим нормам работы с лабораторными животными. Манипуляции выполняли в соответствии с этическими нормами обращения с животными, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006).
Поскольку стабильность пептида Cy7.5-GRP была ограничена в первую очередь 48 ч при 37°С в фосфатно-солевом буфере, для исследования использовали две временны́е точки — 2 и 5 сут. Животным за 2 нед подкожно в правый бок инокулировали клетки PC-3 (1 млн клеток в 100 мкл RPMI-1640 («ПанЭко», Россия) и 100 мкл матригеля (ABW, Китай)) для формирования опухоли. Когда опухоль достигала оптимальных размеров (150–200 мм3), животных (n=10) распределяли на группы: 1-я группа — введение чистого красителя (n=1); 2-я группа — введение пептида Cy7.5-GRP (n=3); 3-я группа — введение токсина Cy7.5-U5-Sth1a (n=3); 4-я группа — введение Cy7.5-BBN/C1-C2 (n=3). Животных анестезировали ингаляцией 3% изофлурана (Chemical Iberica, Испания) со скоростью 1 л/мин в течение 10 мин, затем дозу снижали до 2%. Пептиды вводили в хвостовую вену из расчета 19 нмоль/кг. Съемку проводили в вентродорсальной проекции при дорсальной укладке с помощью системы VISQUE InVivo Smart-LF (Vieworks, Корея) с использованием светодиодов (LED) на фильтре (Ex/Em — 740–790/810–860 нм), выдержка — 1000 мс, биннинг — 2×2. Полученные результаты обрабатывали с использованием программного обеспечения CleVue (Vieworks, Корея). На 5-е сутки животных выводили из эксперимента методом цервикальной дислокации, у них изымали основные органы (печень, желудок, легкие, сердце, поджелудочная железа, селезенка, тонкий кишечник и почки) для оценки биораспределения и также опухоль. Анализ сигнала флуоресценции с органов проводили в программе CleVue (Vieworks, Корея). Области интереса определяли вручную по границе органа, после чего с помощью программного обеспечения рассчитали общую флуоресценцию для каждой области. В итоге была получена средняя флуоресценция пептидов по органу, которая нормировалась на массу органа [13, 14].
Статистическая обработка данных. Обработку результатов проводили в OriginPro (v. b9.5.0.193; OriginLab Corporation, США;), где высчитывали статистическое различие с помощью критерия Манна–Уитни. Для определения характера распределения использовали критерий асимметрии и эксцесса. Для устранения эффекта множественных сравнений был применен критерий Бонферрони. Различия считали статистически значимыми при p<0,01.
Результаты
Получены 3 пептида с чистотой более 90%: GRP — короткий пептид, тропный к рецепторам GRPR; токсин U5-Sth1a, который использовали в качестве каркаса для стабилизации бомбезина; и BBN/C1-C2, созданный на основе бомбезина и кноттина U5-Sth1a (рис. 1).
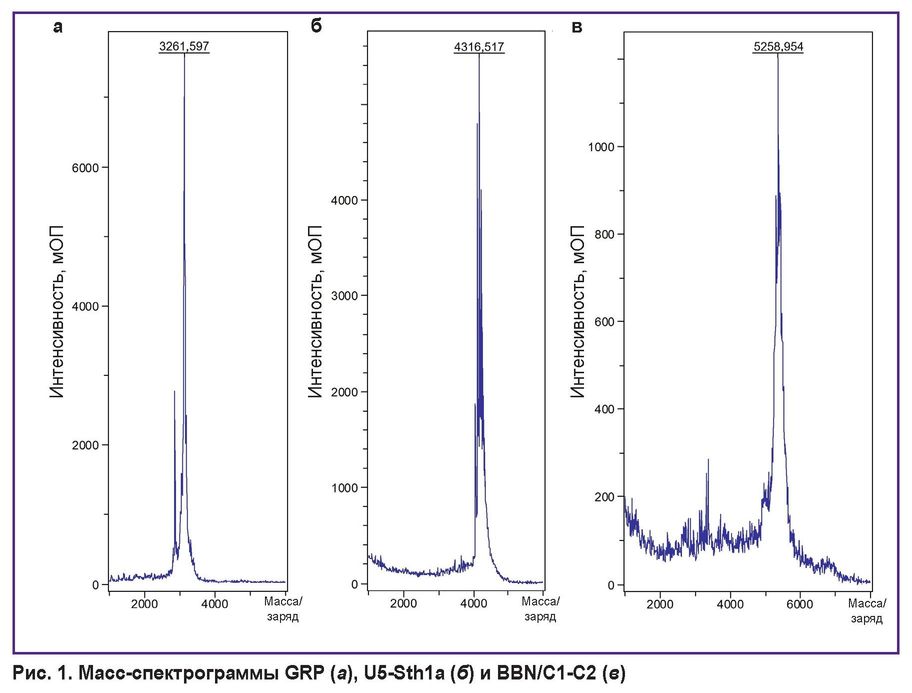
|
Рис. 1. Масс-спектрограммы GRP (а), U5-Sth1a (б) и BBN/C1-C2 (в) |
После синтеза пептиды были успешно помечены флуоресцентным зондом Cy7.5. Проанализирована стабильность как целых молекул, так и комплексов [Cy7.5]-пептид (рис. 2). Отмечено, что стабильность пептида Cy7.5-GRP значительно снижается в первые 48 ч (с 95,7 до 64,5%) и продолжает уменьшаться на протяжении следующих 144 ч, достигая 46,8%. Пептиды Cy7.5-BBN/C1-C2 и Cy7.5-U5Stha1 более стабильны в фосфатно-солевом буфере при нагревании. Химическая чистота Cy7.5-BBN/C1-C2 снижается с 96,4 до 87,4% за 144 ч, а Cy7.5-U5Stha1 — с 95,7 до 82,4%. Анализ стабильности комплексов пептидов с красителем показал, что в процессе инкубации в фосфатно-солевом буфере за 144 ч теряется около 5% красителя во всех группах.
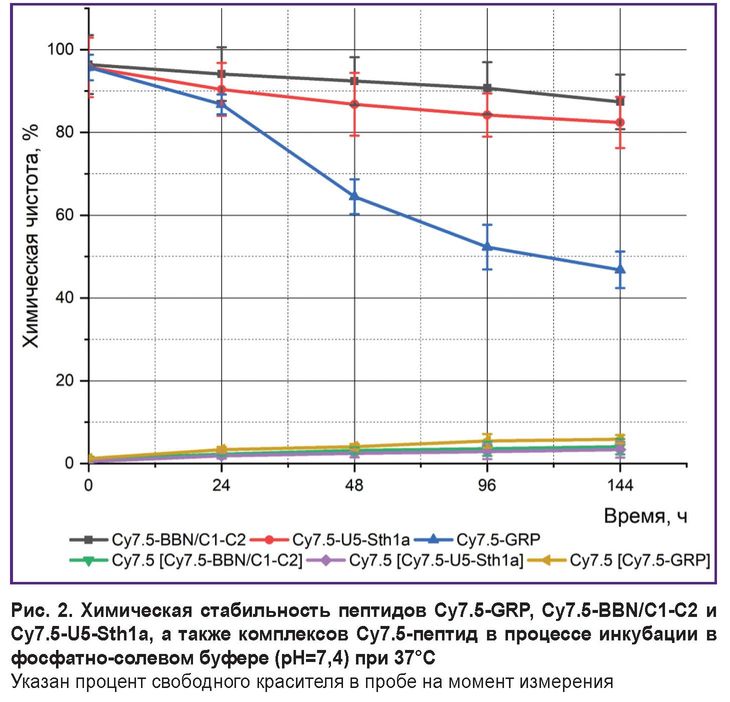
|
Рис. 2. Химическая стабильность пептидов Cy7.5-GRP, Cy7.5-BBN/C1-C2 и Cy7.5-U5-Sth1a, а также комплексов Cy7.5-пептид в процессе инкубации в фосфатно-солевом буфере (pH=7,4) при 37°С |
При визуализации распределения трех молекулярных структур по органам (рис. 3), видно, что на 2-е сутки основной областью связывания GRP являлась селезенка, а органом выведения из организма — почка. Это обусловлено значительно меньшим размером короткого пептида относительно U5-Sth1a и BBN/C1-C2. В первые 2 сут наблюдалось накопление BBN/C1-C2 в области печени и селезенки, а также мочевого пузыря и подчелюстных слюнных желез (повышенный сигнал в проекции мочевого пузыря всех трех молекул может быть связан с незначительными остатками свободного красителя). На 5-е сутки повышенный сигнал для GRP детектировался в проекции органов ЖКТ и поджелудочной железы (в проекции тонкого кишечника был зафиксирован сигнал остатков корма). U5-Sth1a и BBR/C1-C2 также продолжали выводиться мочевыми пузырем, однако сигнал в проекции желудка, поджелудочной железы, селезенки и печени оставался повышенным.

|
Рис. 3. Распределение Cy7.5-GRP (а, г), Cy7.5-U5-Sth1a (б, д) и Cy7.5-BBN/C1-C2 (в, е) в проекции органов у мышей Nu/Nu через 2 дня (а–в) и 5 дней (г–е) после внутривенной инъекции в дозе 19 нмоль/кг |
При анализе биораспределения на 5-е сутки после внутривенного введения пептидов наблюдалась следующая картина (рис. 4). Анализировали основные органы. Интенсивность сигнала флуоресценции органа была интегрирована, уменьшена с фоновым шумом и нормализована с массой органа. Основной орган накопления всех трех пептидов — селезенка. Короткий пептид GRP помимо селезенки локализовался в желудке и поджелудочной железе. Сигнал BBN/C1-C2 детектировался в данных органах значительно слабее, но был выше, чем сигнал токсина U5-Sth1a. Особо стоит отметить повышенный сигнал флуоресценции токсина U5-Sth1a и пептида BBN/C1-C2 в сердце (хотя и в меньшей степени), что, вероятно, связано с природной мишенью выбранного токсина. В остальных органах сигнал для всех трех молекул детектировался равномерно.
Отдельно рассматривалась локализация меченых пептидов в опухоли на 2-е и 5-е сутки (рис. 5). Видно, что на 2-е сутки GRP детектировался в опухоли в большей степени, чем BBN/C1-C2, однако на 5-е сутки картина изменилась. Сигнал BBN/C1-C2 стал значительно превышать сигнал GRP.
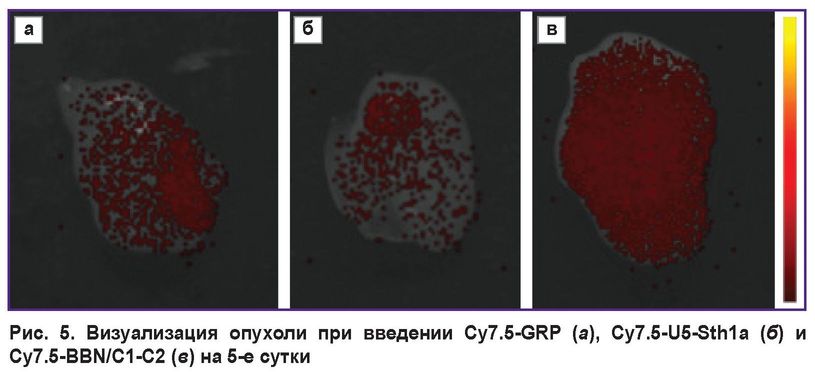
|
Рис. 5. Визуализация опухоли при введении Cy7.5-GRP (а), Cy7.5-U5-Sth1a (б) и Cy7.5-BBN/C1-C2 (в) на 5-е сутки |
Обсуждение
Пептиды семейства бомбезинов действуют как факторы роста для различных типов опухолей. Бомбезин и его аналог у млекопитающих — GRP — имеют структурное и функциональное сходство. Оба пептида выполняют функции желудочно-кишечных гормонов, нейротрансмиттеров, а также аутокринных факторов роста для опухолевых клеток [15]. Поскольку рецепторы GRPR сверхэкспрессируются в различных опухолях, GRPи BBN активно исследуются в качестве диагностических и терапевтических лигандов, нацеленных на опухолевые клетки. Например, было показано значительное накопление пептидов в клетках линий PC-3, DU-145, MDA-MB-231, T-47-D, HeLa [16, 17].
Ключевой особенностью этих пептидов является их способность интернализоваться внутрь клеток, выступая в роли агонистов рецептора. На ранних этапах разработки фармпрепаратов данная особенность считалась важным условием для высокого и длительного поглощения препарата опухолью [18, 19]. Однако в настоящее время это представляется существенным недостатком, поскольку радиоактивно-меченые агонисты обеспечивают высокое поглощение радионуклеотидов. Еще одним существенным недостатком лигандов на основе агонистов GRPR является их поглощение нормальными неопухолевыми клетками, в частности клетками поджелудочной железы. Так, мощный агонист GRPR — AMBA (DOTA-Gly-4-аминобензоил-BBN(7–14)) — демонстрирует отличные результаты при визуализации и терапии в моделях с ксенотрансплантатами рака предстательной и молочной желез [20, 21], что делает его одним из эффективных аналогов бомбезина, прошедших широкий спектр клинических испытаний. Несмотря на это, у пациентов, получавших лечение AMBA, наблюдалось значительное поглощение препарата поджелудочной железой и желудочно-кишечным трактом [22]. Кроме того, исследование фазы I, проведенное у пациентов с метастатическим кастрационно-резистентным раком простаты, было прекращено из-за серьезных побочных эффектов, вызванных активацией GRPRпосле инъекции терапевтических доз [23].
Стимулирующие эффекты агонистов бомбезина при нескольких видах рака у человека сформировали новый виток в разработке антагонистов GRPRв качестве противоопухолевых препаратов, способных связываться с рецептором с высокой степенью сродства без его активации. Обширные исследования [24–26] взаимосвязи структуры и биологической активности привели к появлению различных антагонистов GRPR, полученных путем модификации пептидного остова нативных мотивов BBN или GRP. К таким модификациям относят усечения последнего C-концевого метионина, алкиламидирование, этерификацию открытой карбоксильной группы предпоследнего остатка, уменьшение пептидных связей, а также замену ключевых аминокислот их D-аналогами или другими остатками. Это способствовало появлению множества мощных антагонистов GRPR, демонстрирующих антипролиферативную активность в клетках млекопитающих, экспрессирующих GRPR, а также в опухолях у мышей [17].
На следующем этапе разработок выявляется еще одна существенная проблема пептидных лигандов, нацеленных на GRPR. Низкая протеолитическая стабильность служит ключевым фактором в разработке фармпрепарата независимо от его биологической функции в роли агониста или антагониста. Модификации, связанные с превращением агониста в антагониста, частично, но недостаточно решают данную проблему [8, 27–30]. В нашем исследовании в качестве стабилизирующей молекулы был использован кноттин — токсин, который способен формировать цистиновый узел, стабилизированный несколькими дисульфидными связями, за счет наличия нескольких остатков цистеина. Молекула бомбезина (BBN) была помещена между первым и вторым цистеином с целью повысить стабильность, поскольку отличительной особенностью кноттинов является протеолитическая устойчивость. Однако, встраиваясь в относительно крупную молекулу токсина, бомбезин теряет способность интернализоваться внутрь клетки. В предыдущем исследовании [12] мы показали, что BBN/C1-C2 обладает повышенной химической стабильностью с сохранением способности связываться с GRPR на поверхности клеток без интернализации внутрь. В данном исследовании мы проанализировали биораспределение BBN/C1-C2 in vivo и способность связываться с клетками опухоли. Исследование проводилось при сравнении BBN/C1-C2 с коротким пептидом GRPи токсином U5-Sth1a, на основе которых была создана молекула BBN/C1-C2.
Показано, что зоной локализации пептида GRP, нацеленного на GRPR, являются желудок и поджелудочная железа (см. рис. 3 и 4). Пептид BBR/C1-C2 также наблюдается в данных органах, но в меньшей степени. Анализ динамики интенсивности флуоресценции в опухоли дополнительно подтверждает таргетность BBN/C1-C2. На 5-е сутки после введения также фиксировался повышенный сигнал BBN/C1-C2 относительно GRP (см. рис. 5). Однако возникает проблема, связанная с использованием кноттина в качестве каркаса для стабилизации бомбезина. Токсины из яда членистоногих (U5-Sth1a из паука Scytodes thoracica) имеют определенную биологическую мишень. В основном такая мишень ограничивается конкретным ионным каналом (потенциал-зависимые кальциевые, натриевые, калиевые и т.д.). При взаимодействии с каналом-мишенью токсины либо вызывают его закрытие, либо модулируют его проводимость. В конечном итоге такое взаимодействие ведет к изменению мембранного потенциала и концентрации ионов в клетках. В нашем случае для токсина U5-Sth1a неизвестна биологическая мишень. Однако по параллельным исследованиям команды было выяснено, что вероятной мишенью токсина служат кальциевые потенциал-зависимые каналы, а сам токсин выступает в роли блокатора [31]. Поскольку местом локализации потенциал-зависимых кальциевых каналов является в том числе и сердечная мышца (а также гладкие миоциты в стенках сосудов и любых полых органах, таких как желудок, кишечник, мочевой пузырь и др.) [32], то мы видим, что не только токсин крепится в области сердца (см. рис. 4), но и BBN/C1-C2, хотя и в значительно меньшей степени.
Заключение
Нам удалось получить стабильную молекулу, содержащую бомбезин, заключенный в каркас кноттина, способную длительное время удерживаться на поверхности опухоли, экспрессирующей GRPR, не интернализируясь внутрь. Однако, поскольку в качестве каркаса использовался токсин U5-Sth1a, тропный к ионным каналам, у полученной молекулы сохранился домен, отвечающий за прикрепление к каналу-мишени и характерный для кноттина. Это может в будущем, при использовании молекулы в качестве лиганда для радиотерапии, увеличить радиационную нагрузку на сердце пациента. В связи с этим молекула BBN/C1-C2 требует дополнительного исследования.
Финансирование. Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (проект №123020700216 (FEUF-2023-0004)).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Jensen R.T., Battey J.F., Spindel E.R., Benya R.V. International Union of Pharmacology. LXVIII. Mammalian bombesin receptors: nomenclature, distribution, pharmacology, signaling, and functions in normal and disease states. Pharmacol Rev 2008; 60(1): 1–42, https://doi.org/10.1124/pr.107.07108.
- Shimoda J. Effects of bombesin and its antibody on growth of human prostatic carcinoma cell lines. Nihon Hinyokika Gakkai Zasshi 1992; 83(9): 1459–1468, https://doi.org/10.5980/jpnjurol1989.83.1459.
- D’Onofrio A., Engelbrecht S., Läppchen T., Rominger A., Gourni E. GRPR-targeting radiotheranostics for breast cancer management. Front Med (Lausanne) 2023; 10: 1250799, https://doi.org/10.3389/fmed.2023.1250799.
- Liu P., Tu Y., Tao J., Liu Z., Wang F., Ma Y., Li Z., Han Z., Gu Y. GRPR-targeted SPECT imaging using a novel bombesin-based peptide for colorectal cancer detection. Biomater Sci 2020; 8(23): 6764–6772, https://doi.org/10.1039/d0bm01432j.
- Kähkönen E., Jambor I., Kemppainen J., Lehtiö K., Grönroos T.J., Kuisma A., Luoto P., Sipilä H.J., Tolvanen T., Alanen K., Silén J., Kallajoki M., Roivainen A., Schäfer N., Schibli R., Dragic M., Johayem A., Valencia R., Borkowski S., Minn H. In vivo imaging of prostate cancer using [68Ga]-labeled bombesin analog BAY86-7548. Clin Cancer Res 2013; 19(19): 5434–5443, https://doi.org/10.1158/1078-0432.CCR-12-3490.
- Stoykow C., Erbes T., Maecke H.R., Bulla S., Bartholomä M., Mayer S., Drendel V., Bronsert P., Werner M., Gitsch G., Weber W.A., Stickeler E., Meyer P.T. Gastrin-releasing peptide receptor imaging in breast cancer using the receptor antagonist (68)Ga-RM2 and PET. Theranostics 2016; 6(10): 1641–1650, https://doi.org/10.7150/thno.14958.
- Kurth J., Krause B.J., Schwarzenböck S.M., Bergner C., Hakenberg O.W., Heuschkel M. First-in-human dosimetry of gastrin-releasing peptide receptor antagonist [177Lu]Lu-RM2: a radiopharmaceutical for the treatment of metastatic castration-resistant prostate cancer. Eur J Nucl Med Mol Imaging 2020; 47(1): 123–135, https://doi.org/10.1007/s00259-019-04504-3.
- Nock B.A., Kaloudi A., Lymperis E., Giarika A., Kulkarni H.R., Klette I., Singh A., Krenning E.P., de Jong M., Maina T., Baum R.P. Theranostic perspectives in prostate cancer with the gastrin-releasing peptide receptor antagonist NeoBOMB1: preclinical and first clinical results. J Nucl Med 2017; 58(1): 75–80, https://doi.org/10.2967/jnumed.116.178889.
- Linder K.E., Metcalfe E., Arunachalam T., Chen J., Eaton S.M., Feng W., Fan H., Raju N., Cagnolini A., Lantry L.E., Nunn A.D., Swenson R.E. In vitro and in vivo metabolism of Lu-AMBA, a GRP-receptor binding compound, and the synthesis and characterization of its metabolites. Bioconjug Chem 2009; 20(6): 1171–1178, https://doi.org/10.1021/bc9000189.
- Lymperis E., Kaloudi A., Sallegger W., Bakker I.L., Krenning E.P., de Jong M., Maina T., Nock B.A. Radiometal-dependent biological profile of the radiolabeled gastrin-releasing peptide receptor antagonist SB3 in cancer theranostics: metabolic and biodistribution patterns defined by neprilysin. Bioconjug Chem 2018; 29(5): 1774–1784, https://doi.org/10.1021/acs.bioconjchem.8b00225.
- Nock B.A., Kaloudi A., Kanellopoulos P., Janota B., Bromińska B., Iżycki D., Mikołajczak R., Czepczynski R., Maina T. [99mTc]Tc-DB15 in GRPR-targeted tumor imaging with SPECT: from preclinical evaluation to the first clinical outcomes. Cancers (Basel) 2021; 13(20): 5093, https://doi.org/10.3390/cancers13205093.
- Beloborodov E.A., Iurova E.V., Fomin A.N., Saenko Y.V. Development and synthesis of bombesin-based radiopharmaceutical precursors modified with knottin. Sovremennye tehnologii v medicine 2024; 16(2): 5, https://doi.org/10.17691/stm2024.16.2.01.
- El-Gogary R.I., Rubio N., Wang J.T., Al-Jamal W.T., Bourgognon M., Kafa H., Naeem M., Klippstein R., Abbate V., Leroux F., Bals S., Van Tendeloo G., Kamel A.O., Awad G.A., Mortada N.D., Al-Jamal K.T. Polyethylene glycol conjugated polymeric nanocapsules for targeted delivery of quercetin to folate-expressing cancer cells in vitro and in vivo. ACS Nano 2014; 8(2): 1384–1401, https://doi.org/10.1021/nn405155b.
- Wang C., Pulli B., Jalali Motlagh N., Li A., Wojtkiewicz G.R., Schmidt S.P., Wu Y., Zeller M.W.G., Chen J.W. A versatile imaging platform with fluorescence and CT imaging capabilities that detects myeloperoxidase activity and inflammation at different scales. Theranostics 2019; 9(25): 7525–7536, https://doi.org/10.7150/thno.36264.
- Cuttitta F., Carney D.N., Mulshine J., Moody T.W., Fedorko J., Fischler A., Minna J.D. Bombesin-like peptides can function as autocrine growth factors in human small-cell lung cancer. Nature 1985; 316(6031): 823–826, https://doi.org/10.1038/316823a0.
- Begum A.A., Moyle P.M., Toth I. Investigation of bombesin peptide as a targeting ligand for the gastrin releasing peptide (GRP) receptor. Bioorg Med Chem 2016; 24(22): 5834–5841, https://doi.org/10.1016/j.bmc.2016.09.039.
- Okarvi S.M., Jammaz I.A. Preparation and evaluation of bombesin peptide derivatives as potential tumor imaging agents: effects of structure and composition of amino acid sequence on in vitro and in vivo characteristics. Nucl Med Biol 2012; 39(6): 795–804, https://doi.org/10.1016/j.nucmedbio.2012.01.002.
- Maina T., Nock B.A. From bench to bed: new gastrin-releasing peptide receptor-directed radioligands and their use in prostate cancer. PET Clin 2017; 12(2): 205–217, https://doi.org/10.1016/j.cpet.2016.12.002.
- Baratto L., Jadvar H., Iagaru A. Prostate cancer theranostics targeting gastrin-releasing peptide receptors. Mol Imaging Biol 2018; 20(4): 501–509, https://doi.org/10.1007/s11307-017-1151-1.
- Maddalena M.E., Fox J., Chen J., Feng W., Cagnolini A., Linder K.E., Tweedle M.F., Nunn A.D., Lantry L.E. 177Lu-AMBA biodistribution, radiotherapeutic efficacy, imaging, and autoradiography in prostate cancer models with low GRP-R expression. J Nucl Med 2009; 50(12): 2017–2024, https://doi.org/10.2967/jnumed.109.064444.
- Wild D., Frischknecht M., Zhang H., Morgenstern A., Bruchertseifer F., Boisclair J., Provencher-Bolliger A., Reubi J.C., Maecke H.R. Alpha- versus beta-particle radiopeptide therapy in a human prostate cancer model (213Bi-DOTA-PESIN and 213Bi-AMBA versus 177Lu-DOTA-PESIN). Cancer Res 2011; 71(3): 1009–1018, https://doi.org/10.1158/0008-5472.CAN-10-1186.
- Baum R., Prasad V., Mutloka N., Frischknecht M., Maecke H., Reubi J.C. Molecular imaging of bombesin receptors in various tumors by Ga-68 AMBA PET/CT: first results. J Nucl Med 2007; 48(Suppl 2): 79.
- Bodei L., Ferrari M., Nunn A., Llull J., Cremonesi M., Martano L., Laurora G., Scardino E., Tiberini S., Bufi G., Eaton S., de Cobelli O., Paganelli G. Lu-177-AMBA bombesin analogue in hormone refractory prostate cancer patients: a phase I escalation study with single-cycle administrations. Eur J Nucl Med Mol 2007; 34 (Suppl S2): S221.
- Cornelio D.B., Roesler R., Schwartsmann G. Gastrin-releasing peptide receptor as a molecular target in experimental anticancer therapy. Ann Oncol 2007; 18(9): 1457–1466, https://doi.org/10.1093/annonc/mdm058.
- Kenakin T. The potential for selective pharmacological therapies through biased receptor signaling. BMC Pharmacol Toxicol 2012; 13: 3, https://doi.org/10.1186/2050-6511-13-3.
- Thundimadathil J. Cancer treatment using peptides: current therapies and future prospects. J Amino Acids 2012; 2012: 967347, https://doi.org/10.1155/2012/967347.
- Hoppenz P., Els-Heindl S., Beck-Sickinger A.G. Identification and stabilization of a highly selective gastrin-releasing peptide receptor agonist. J Pept Sci 2019; 25(12): e3224, https://doi.org/10.1002/psc.3224.
- Valverde I.E., Bauman A., Kluba C.A., Vomstein S., Walter M.A., Mindt T.L. 1,2,3-triazoles as amide bond mimics: triazole scan yields protease-resistant peptidomimetics for tumor targeting. Angew Chem Int Ed Engl 2013; 52(34): 8957–8960, https://doi.org/10.1002/anie.201303108.
- De K., Banerjee I., Sinha S., Ganguly S. Synthesis and exploration of novel radiolabeled bombesin peptides for targeting receptor positive tumor. Peptides 2017; 89: 17–34, https://doi.org/10.1016/j.peptides.2017.01.002.
- Tu Y., Tao J., Wang F., Liu P., Han Z., Li Z., Ma Y., Gu Y. A novel peptide targeting gastrin releasing peptide receptor for pancreatic neoplasm detection. Biomater Sci 2020; 8(9): 2682–2693, https://doi.org/10.1039/d0bm00162g.
- Iurova E., Beloborodov E., Tazintseva E., Fomin A., Shutov A., Slesarev S., Saenko Y., Saenko Y. Arthropod toxins inhibiting Ca2+ and Na+ channels prevent AC-1001 H3 peptide-induced apoptosis. J Pept Sci 2021; 27(1): e3288, https://doi.org/10.1002/psc.3288.
- Аронов Д.М., Лупанов В.П. Антагонисты кальция в лечении больных с сердечно-сосудистыми заболеваниями. Фокус на амлодипин. Русский медицинский журнал 2007; 15(4): 275–281.











