Получение тромбоцитарного геля на основе аллогенных тромбоцитов, выделенных из цельной крови доноров
Цель исследования — провести морфофункциональный анализ аллогенных тромбоцитов, выделенных из цельной крови доноров, и оценить возможность получения тромбоцитарного геля на их основе.
Материалы и методы. В работе исследовали тромбоциты крови доноров; тромбоциты, заготовленные у доноров путем аппаратного афереза; тромбоциты, выделенные из цельной крови доноров (тромболейкоцитарные концентраты, ТЛК). Оценивали качество тромбоцитов до и после центрифугирования с ускорением 2500–4000 g, а также возможность получения тромбоцитарного геля на основе плазмы с тромбоцитами, выделенной из цельной крови. Морфофункциональный анализ тромбоцитов проводили с использованием оригинального метода, основанного на исследовании витально окрашенных клеток с помощью флуоресцентной микроскопии. В концентратах тромбоцитов, выделенных из цельной крови, оценивали цитокиновый состав с применением мультиплексного анализа.
Результаты. После центрифугирования с ускорением 2500–4000 g в тромбоцитной популяции увеличивается число тромбоцитов с поврежденными мембранами, прокоагулянтных тромбоцитов и тромбоцитов, склонных к спонтанной активации. Центрифугирование с ускорением 2500–2700 g является более щадящим, чем центрифугирование с ускорением 2701–4000 g и позволяет сохранить в тромбоцитах значительный объем ростовых факторов. Плазма с тромбоцитами, выделенная из ТЛК, может применяться для получения тромбоцитарного геля и тромбофибринового сгустка in vitro при 20–22°C без использования индукторов активации тромбоцитов. Наиболее эффективны для получения тромбоцитарного геля образцы ТЛК без тромбоцитарных конгломератов, содержащие тромбоциты с гранулами более 20% и тромбоциты с поврежденными мембранами менее 20%, с уровнем прокоагулянтных тромбоцитов менее 5%, с повышенной или высокой скоростью адгезии тромбоцитов с гранулами на стекле. Использование аллогенных тромбоцитов ТЛК дает возможность получить тромбоцитарный гель в течение 20–30 мин.
Заключение. Разработан способ получения тромбоцитарного геля и тромбофибринового сгустка при 20–22°C на основе аллогенных тромбоцитов, выделенных из цельной крови доноров. Эти материалы могут быть использованы в качестве раневых покрытий, аппликативных биологических конструкций для лечения тканевых дефектов различного генеза, а также при создании композитных биологических конструкций, предназначенных для применения в регенеративной медицине.
Введение
Тромбоциты человека обладают уникальным и разнообразным биологическим потенциалом, который может быть реализован для решения различных задач регенеративной медицины [1, 2]. Тромбоцитарный гель (ТГ) является одним из широко используемых биологических препаратов. ТГ образуется в результате активации тромбоцитов in vitro и имеет гелевидную структуру, содержащую ростовые факторы и другие биологически активные компоненты, секретируемые тромбоцитами [3]. ТГ представляет собой удобный материал для создания раневых покрытий и аппликативных биоконструкций и может быть эффективен при производстве композитных клеточно-тканевых конструкций и других биотехнологических изделий [4]. Как правило, для изготовления ТГ применяют аутологичную плазму, выделенную из крови пациента. Однако в ряде случаев собственные тромбоциты пациента имеют сниженный или низкий биологический потенциал, а также структурно-функциональные нарушения [5], в результате чего ТГ на их основе может быть малоэффективным. Препараты на основе аллогенных тромбоцитов в настоящее время редко используют для восстановления тканей, тем не менее аллогенные тромбоциты и их концентраты представляют интерес для регенеративной медицины. В частности, одним из потенциальных источников тромбоцитарных компонентов являются тромболейкоцитарные концентраты (ТЛК), выделенные в процессе сепарации цельной донорской крови. С помощью ТЛК получают пулированные концентраты тромбоцитов, предназначенные для применения в клинической трансфузиологии [6]. Кроме того, этот компонент может служить исходным материалом для создания тромбоцитных препаратов [7]. Аллогенные тромбоциты, выделенные из цельной крови доноров, представляют собой ценный резервуар ростовых, репаративных и регенеративных факторов и могут быть использованы в том числе для изготовления аппликативных биологических препаратов.
На сегодняшний день отсутствуют стандартизированные методики получения аппликативных биологических препаратов, в частности ТГ и тромбофибринового сгустка, и нет точного представления о качестве аллогенных тромбоцитов, применяемых для создания препаратов [8]. Часто ТГ готовят путем предварительной заморозки плазмы с тромбоцитами с последующей активацией плазмы препаратами кальция при температуре 37°С [9–11]. Однако такой подход сопровождается потерей многих ростовых факторов и не позволяет использовать функциональные особенности тромбоцитов при образовании ТГ в результате их криодеструкции. В связи с этим актуальным является поиск методов, направленных на повышение эффективности отбора и использования аллогенных тромбоцитов при создании аппликативных биологических препаратов.
Цель исследования — определить морфофункциональные особенности аллогенных тромбоцитов, выделенных из цельной крови донора, и оценить возможность получения тромбоцитарного геля на их основе.
Материалы и методы
В работе исследовали компоненты крови 10 доноров и 10 доноров-добровольцев, выделенные в пробирки объемом 4–5 мл с консервантом — цитратом или этилендиаминтетрауксусной кислотой. Были также изучены тромбоциты, заготовленные путем аппаратного афереза (АФКТ; 20 доноров) с консервантом CPD (цитрат-фосфат-декстрозный раствор) или SSP (сахарозный раствор с фосфатами), и тромбоциты, выделенные в составе ТЛК из цельной крови (20 доноров). Исследование проводили с разрешения этического комитета Научно-исследовательского института скорой помощи им. Н.В. Склифосовского (протокол ЛЭК №8-23 от 11.10.2023 г.) и в соответствии с Хельсинкской декларацией (2024). У всех доноров брали информированное согласие на проведение исследований.
Для получения АФКТ использовали аппарат Haemonetics MCS+ (Haemonetics Corporation, США) или Trima Accel (Terumo BCT, США); для получения ТЛК — аппарат Reveos (Terumo BCT, США). Тромбоциты крови доноров и добровольцев и тромбоциты, выделенные с помощью афереза, анализировали непосредственно после получения крови и через 2 сут хранения на шейкере при 20–22°C. Для оценки влияния «жесткого» центрифугирования на качество тромбоцитов in vitro образцы крови центрифугировали при 2500–4000 g в течение 10 мин, после этого отбирали тромболейкоцитарный слой, аналогичный ТЛК. Для получения ТГ из ТЛК in vitro использовали 10% раствор хлорида кальция и 1 мг/мл раствора адреналина. Для активации тромбоцитов на 95–100 мкл ТЛК вносили 5–7 мкл хлорида кальция и 1 мМ адреналина.
Морфофункциональный анализ тромбоцитов проводили с помощью оригинального метода, основанного на исследовании витально окрашенных клеток с помощью флуоресцентной микроскопии [12]. Для этого клетки окрашивали витальным (прижизненным) флуорохромным красителем на основе трипафлавина и акридинового оранжевого. В работе использовали конфокальный микроскоп Nikon Eclipse 80i, совмещенный с флуоресцентной лампой Nikon Intensilight C-HGFI (Nikon Corporation, Япония).
Для оценки качества клеток в составе ТЛК анализировали следующие параметры: концентрацию тромбоцитов; концентрацию лейкоцитов; уровень тромбоцитов с гранулами (ДТГ), норма 35–75%; долю адгезивно активных тромбоцитов (ААТ), норма 30–75%; уровень тромбоцитов с поврежденными мембранами (ТПМ), норма 2–3%; уровень прокоагулянтных тромбоцитов (КОАГТ), в норме КОАГТ отсутствуют в крови здоровых людей. ТПМ не содержат гранул и не обладают функциональной активностью. КОАГТ представляют собой особый морфологический тип тромбоцитов, который формируется на терминальной стадии активации этих клеток. В КОАГТ наблюдается массовая деформация внутрицитоплазматических структур со смещением их в область периферии с формированием характерной морфологической структуры в виде выпячивания («cap») или с образованием узкого цитоплазматического серпа. Основной объем тромбоцита при этом имеет очень низкую оптическую плотность [13]. Оценивали также наличие в пробе тромбоцитарных конгломератов; изучали рисунок распределения гранул внутри тромбоцитов; оценивали наличие среди тромбоцитов клеток измененной формы, указывающей на их активацию; оценивали скорость адгезии тромбоцитов на стекле. В норме продолжительность адгезии одного тромбоцита составляет 10–30 мин с момента внесения суспензии тромбоцитов на стекло. В течение этого срока происходят изменение формы тромбоцита и выброс тромбоцитарных гранул. Если эти процессы происходят в течение от 5 до 10 мин, скорость адгезии считается повышенной, от 3 до 5 мин — высокой, до 3 мин — очень высокой, более 30 мин — низкой. Цитокиновый состав оценивали в исходных ТЛК, а также в бедной тромбоцитами плазме, выделенной после осаждения тромбоцитов ТЛК. Для получения бедной тромбоцитами плазмы исходные ТЛК центрифугировали при 700 g в течение 10–17 мин. Цитокиновый состав изучали с помощью мультиплексного анализа на платформе Luminex 200 (технология xMAP), используя набор MILLIPLEX MAP Human Cytokine/Chemokine Magnetic Bead Panel (Merck Millipore, Германия). Определяли концентрацию тромбоцитарного фактора роста (PDGF AB/BB), фактора роста фибробластов (FGF-2), эпидермального фактора роста (EGF), интерлейкинов 1-бета (IL-1β) и 8 (IL-8), фактора роста эндотелия сосудов (VEGF).
Статистический анализ данных проводили при помощи программ Statistica 10.0 и BioStat Pro 5.9.8. Проверку распределения на нормальность выполняли с помощью теста Колмогорова–Смирнова. С учетом высокой вариабельности морфофункциональных параметров тромбоцитов было принято решение использовать непараметрические критерии статистического анализа. Для статистической обработки вычисляли медиану (Ме), 1-й и 3-й квартили [25%; 75%]. Для сравнения количественных данных в двух несвязанных между собой выборках использовали U-критерий Манна–Уитни для независимых переменных и критерий Вилкоксона для связанных выборок. Определяли величину статистической значимости различий значений (р) и скорректированную величину статистической значимости различий значений с поправкой Бонферрони (padjusted) при множественном сравнении. Различия считали статистически значимыми при p<0,05.
Результаты
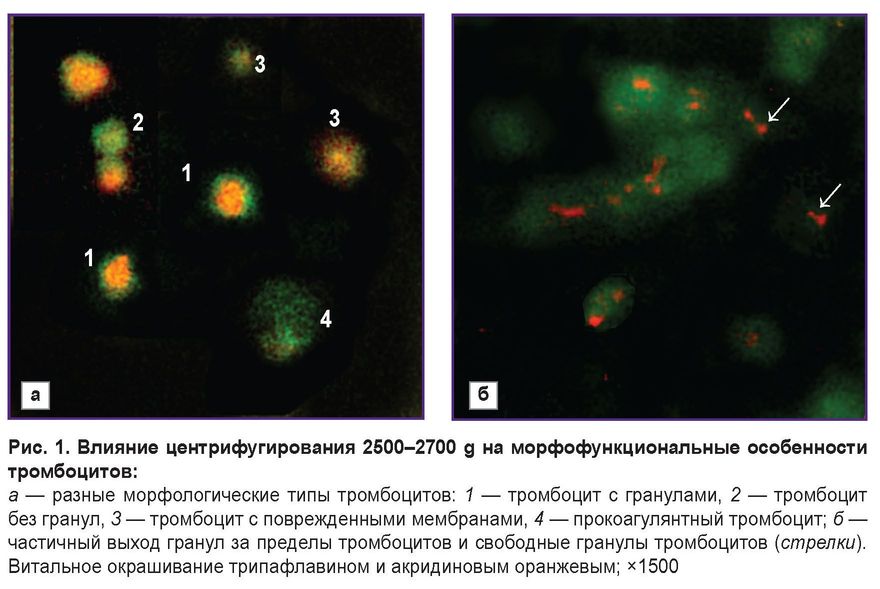
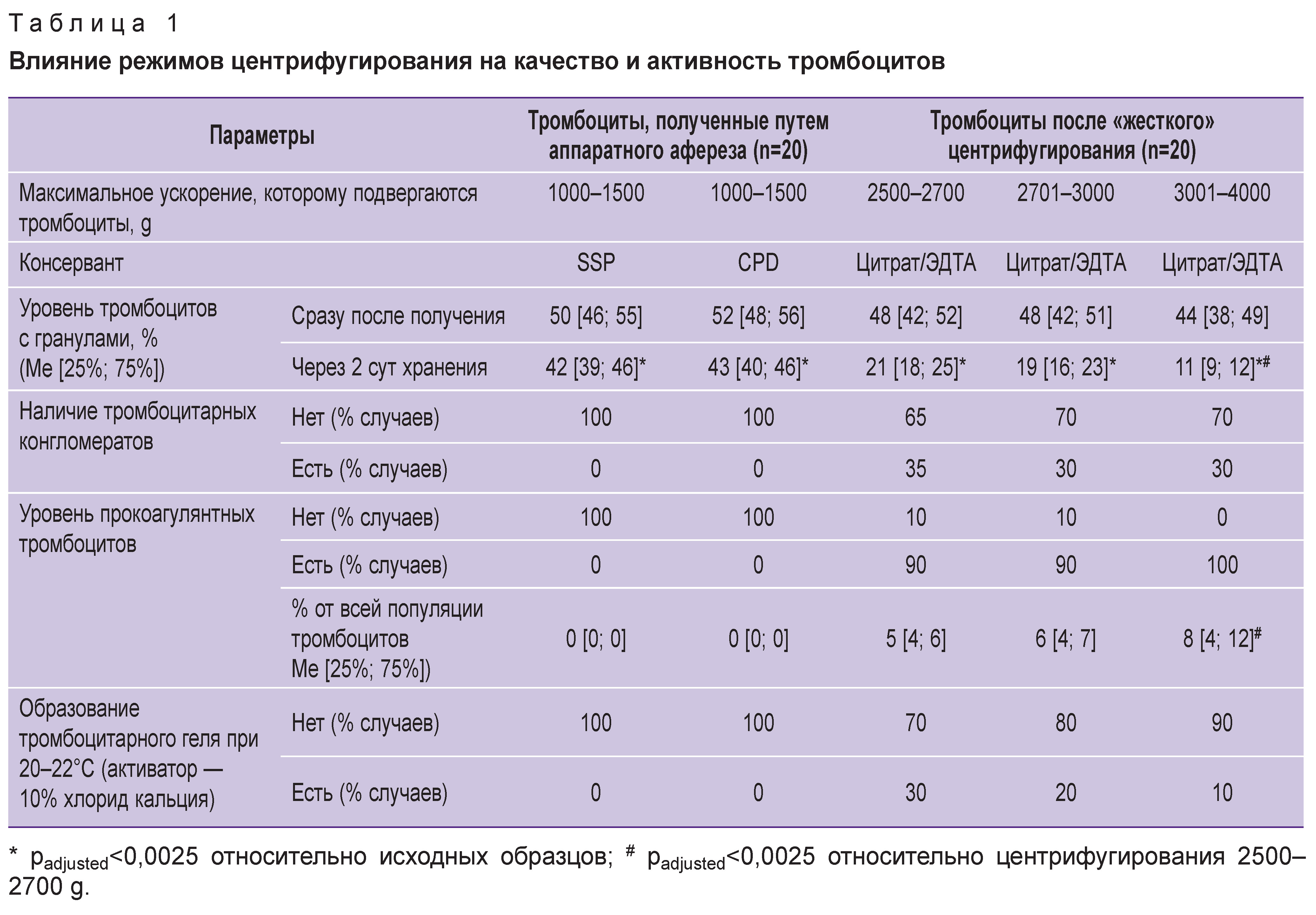
Ранее нами было показано, что «жесткое» центрифугирование тромбоцитов, выделенных путем аппаратного афереза (3000–4000 g), снижает их качество и способность сохранять свои функциональные и структурные характеристики в течение времени [14]. При этом не учитывалась как возможность тромбоцитов образовывать тромбофибриновый сгусток, так и наличие в тромбоцитной популяции клеток с повышенной реактивностью. В настоящей работе установлено, что при ускорении процесса центрифугирования in vitro увеличиваются потери качества тромбоцитов (табл. 1). В 30–35% случаев после центрифугирования с ускорением 2500–4000 g можно наблюдать тромбоцитарные конгломераты — структуры, образованные скоплением тромбоцитов и аналогичные тромбоцитным агрегатам. От агрегатов тромбоцитарные конгломераты отличаются меньшей плотностью расположения в них клеток и отсутствием морфологических изменений, характерных для необратимой активации тромбоцитов. При этом тромбоцитарные конгломераты могут иметь очень крупные размеры (до 100 мкм). В составе обследованных образцов тромбоцитарные конгломераты были образованы клетками без гранул и не распадались даже при длительном перемешивании. Уровень ДТГ в таких образцах во всех случаях не превышал 15–16%, нередко составляя менее 10%, что свидетельствует об очень низком качестве тромбоцитов. Массовая дегрануляция тромбоцитов указывает на их спонтанную активацию еще на этапе выделения из крови, поэтому после выделения такие тромбоциты обладали низкой биологической и функциональной активностью. Кроме того, при «жестком» центрифугировании формировались КОАГТ (рис. 1, а), обладающие способностью к адсорбции плазменных компонентов гемостаза. Такие тромбоциты являются одновременно необратимо активированными и апоптотическими клетками, не содержат гранул и ростовых факторов в своем составе [15]. КОАГТ могут участвовать в агрегации тромбоцитов, но в то же время они способны передавать сигнал о запуске апоптоза в неактивированных нормальных тромбоцитах, что повышает риск повреждения всей популяции тромбоцитов и потери ими биологического потенциала.
|
Таблица 1. Влияние режимов центрифугирования на качество и активность тромбоцитов |
В исходной крови доноров и АФКТ отсутствовали КОАГТ; в образцах, подвергшихся «жесткому» центрифугированию, их уровень варьировал от 3 до 10%, при этом увеличение доли КОАГТ сопровождалось снижением ДТГ и ААТ. Необходимо отметить, что в 15–20% АФКТ при нанесении тромбоцитов на предметное стекло наблюдалась ускоренная тромбоцитарная адгезия, которая часто сопровождалась образованием мелких уплощенных агрегатов уже через 5–15 мин с момента контакта тромбоцитов со стеклом. Это могло быть обусловлено как исходно повышенной реактивностью тромбоцитов донора, так и предактивацией тромбоцитов в процессе аппаратного афереза. При этом во всех случаях образцы крови доноров и АФКТ не содержали КОАГТ, уровни ДТГ и ААТ соответствовали норме, уровень ТПМ не превышал 2–4%. Тем не менее даже в АФКТ с повышенной скоростью адгезии тромбоцитов никогда не удавалось получить ТГ с помощью 10% хлорида кальция при 20–22°C. Таким образом, возможная предактивация тромбоцитов в АФКТ не была достаточной для активации всей их популяции в подобных условиях. Примечательно, что в некоторых образцах после «жесткого» центрифугирования можно было добиться образования ТГ при 20–22°C с использованием только хлорида кальция, при этом по мере увеличения скорости центрифугирования, уровня ТПМ и КОАГТ такая возможность снижалась. В образцах с уровнем КОАГТ выше 5% в отдельных случаях можно было получить ТГ при 20–22°C, однако время образования геля при данных условиях во всех случаях было выше, чем при 37°C стандартными способами. Таким образом, для получения ТГ из ТЛК необходимо выделять тромбоциты из цельной крови при ускорении 2500–2700 g. Стоит отметить, что независимо от величины ускорения (g) добиться образования геля можно было менее чем в 40% проб. Это указывает на необходимость отбора проб ТЛК с учетом подробного анализа морфофункционального статуса тромбоцитов в их составе.
В ТЛК концентрация тромбоцитов и лейкоцитов составляла 1870 [1650; 2050]·109/л и 6,0 [5,0; 7,5]·109/л соответственно; после центрифугирования ТЛК при 300–500 g для осаждения лейкоцитов в готовой плазме с тромбоцитами концентрация тромбоцитов не менялась, концентрация лейкоцитов не превышала 0,1·109/л. При этом морфофункциональный статус тромбоцитов ТЛК был изначально снижен по сравнению с нормой: значения ДТГ составили 24 [17; 25]%, ААТ — 22 [16; 25]%, ТПМ — 15 [13; 24]%, КОАГТ — 7 [5; 10]%. Среди ТЛК были выявлены дозы с очень низким содержанием тромбоцитов с гранулами (менее 10%) и дозы, где содержание тромбоцитов приближалось к норме (29–30%). Среди тромбоцитов с гранулами многие клетки имели измененный рисунок распределения гранул в цитоплазме — наблюдалось смещение гранул из области грануломера в периферическую часть клетки (см. рис. 1, а), связывание гранул с плазматической мембраной, частичное «выпячивание» крупных гранул за пределы цитоплазмы без окончательной дегрануляции (рис. 1, б). Такие тромбоциты имели повышенную скорость адгезии на предметном стекле. Кроме того, ТЛК содержали свободные тромбоцитарные гранулы диаметром до 600 нм. Тромбоцитарные гранулы способны стимулировать процессы свертывания крови независимо от тромбоцитов и адгезировать на фибрине и коллагене. Присутствие большого числа свободных тромбоцитарных гранул в плазме увеличивает ее коагулогический потенциал. Цельные тромбоцитарные гранулы также содержат многие ростовые факторы [16]. Таким образом, можно заключить, что тромбоциты ТЛК потенциально обладают повышенной реактивностью на фоне снижения ряда морфофункциональных характеристик.
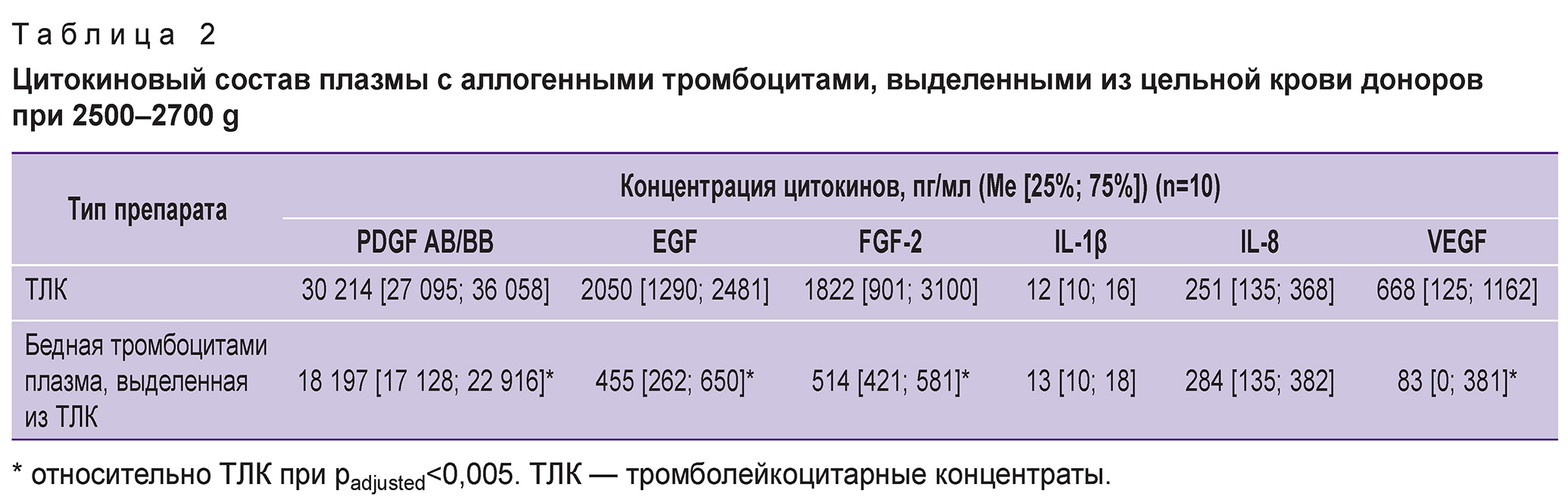
Цитокиновый анализ показал, что ростовые факторы присутствуют как в ТЛК, так и в выделенной из ТЛК бедной тромбоцитами плазме; уровень провоспалительных цитокинов значимо не различался между ТЛК и бедной тромбоцитами плазмой (табл. 2), что подтверждает данные о выходе части тромбоцитарных гранул за пределы тромбоцитов в процессе выделения ТЛК. Тем не менее уровень ростовых факторов EGF, FGF-2, VEGF превышал аналогичные значения в бедной тромбоцитами плазме в 3,5–7,0 раза, PDGF AB/BB — в 1,7 раза (padjusted=0,001). Следовательно, значительная часть ростовых факторов сохраняется в тромбоцитах даже после «жесткого» центрифугирования с ускорением 2500–2700 g.
|
Таблица 2. Цитокиновый состав плазмы с аллогенными тромбоцитами, выделенными из цельной крови доноров при 2500–2700 g |
Плазма с аллогенными тромбоцитами, выделенная из ТЛК, является потенциально богатым источником факторов роста клеток, факторов репарации и регенерации. Однако любое дополнительное воздействие на плазму с тромбоцитами может вызывать потерю и разрушение факторов. Поэтому для получения ТГ и тромбофибринового сгустка, насыщенного ростовыми факторами, из аллогенных тромбоцитов ТЛК необходимо по возможности минимизировать воздействие на плазму.
Было важно установить возможность получения геля при комнатной температуре (20–22°С) из плазмы с аллогенными тромбоцитами на основе ТЛК. Ранее нами была показана возможность получения ТГ при 20–22°С с использованием препарата адреналина в конечной концентрации 1 мМ [17]. В условиях повышенной реактивности тромбоцитов хлорид кальция может воздействовать как на плазменное, так и на клеточное звено гемостаза. Исследована возможность активации тромбоцитов, выделенных из ТЛК, под действием хлорида кальция и 1 мМ адреналина, а также хлорида кальция без адреналина. Установлено, что в плазме с концентрацией тромбоцитов 1700·109/л и ДТГ 24–25% ТГ образовывался как в присутствии, так и в отсутствие адреналина, время образования геля составляло 16 и 24 мин соответственно. Показано, что плазма с аллогенными тромбоцитами формирует ТГ при определенном соотношении плазмы и 10% хлорида кальция. Для получения ТГ необходимо смешать 5–7 мкл 10% хлорида кальция и 95–100 мкл плазмы с ДТГ 24–25%. В этих случаях гель формировался в течение 20–30 мин. При других соотношениях ТГ образовывался гораздо медленнее или не формировался вообще. Таким образом, соотношение 5–7 мкл 10% хлорида кальция и 95–100 мкл плазмы с тромбоцитами является наиболее оптимальным.
Исследование проб, выделенных из разных ТЛК, продемонстрировало, что скорость получения геля заметно варьирует в зависимости от качества тромбоцитов. В 80% случаях в пробах с ДТГ менее 20% ТГ не образовывался, также в 20% случаев это требовало очень длительной экспозиции (более 60 мин). Наличие в плазме тромбоцитарных конгломератов, большого числа тромбоцитов с выраженными дефектами мембран (20% и более от всей популяции тромбоцитов) и КОАГТ (5% и более) также снижало скорость образования ТГ и могло полностью препятствовать получению геля. Наиболее эффективно гель формировался в образцах, не содержащих тромбоцитарных конгломератов, с содержанием тромбоцитов с гранулами более 20%, уровнем ТПМ менее 20%, уровнем КОАГТ менее 5%, повышенной или высокой скоростью адгезии тромбоцитов с гранулами на стекле — в этих случаях время образования геля при 20–22°С составляло 20–30 мин (рис. 2) и было сопоставимо с тем, что мы наблюдали при получении ТГ из плазмы с нормальным качеством тромбоцитов [17]. Через 10–20 мин после формирования геля в нем начинается процесс ретракции (сжатия) с образованием тромбофибринового сгустка. При сильном механическом воздействии на гель тромбофибриновый сгусток возникает практически моментально. Тромбофибриновый сгусток сохраняет гелевидную консистенцию, содержит основной объем секретируемых тромбоцитами ростовых факторов.
Обсуждение
Гелевидные структуры на основе плазмы с тромбоцитами in vitro являются перспективными для применения в регенеративной медицине благодаря биологическому и репаративному потенциалу тромбоцитов. ТГ может быть получен в том числе из неконсервированной крови в процессе центрифугирования [18]. Однако особенностью данного геля является его быстрая ретракция с образованием сыворотки, в которую выходит значительная часть тромбоцитных компонентов, при этом уровень ростовых факторов в сыворотке заметно снижен по сравнению с исходной суспензией тромбоцитов [2, 16]. Инкорпорирование тромбоцитов или их компонентов внутри различных матриксов повышает сохранность и эффективность ростовых факторов, а также других биологически активных веществ, секретируемых тромбоцитами [19, 20].
Ранее нами было показано, что активация тромбоцитов при 20–22°C сопровождается более медленной дегрануляцией и способствует фиксации экзоцитированных тромбоцитарных гранул на коллагене или фибрине [5, 16]. Получение ТГ при 20–22°C позволяет увеличить насыщенность ростовыми факторами готового тромбофибринового сгустка. При этом в ряде случаев для активации тромбоцитов не требуется использование стандартных индукторов, взаимодействующих с рецепторами на плазматической мембране. Тромбоциты являются высокочувствительными и высокореактивными клетками, которые могут очень быстро реагировать на изменения физико-химических условий среды, в которой они находятся [21–23]. В настоящем исследовании установлено, что центрифугирование тромбоцитов с ускорением 2500–2700 g приводит к снижению уровня биологически полноценных клеток, а также может вызывать их предактивацию, т.е. переход в состояние повышенной реактивности и чувствительности. При центрифугировании наблюдается частичная дегрануляция тромбоцитов, что повышает концентрацию в плазме секретируемых ими прокоагулянтных факторов и способствует активации тромбоцитов при 20–22°С. Кроме того, часть тромбоцитных гранул выделяется в виде цельных микрочастиц, которые также могут усиливать тромбоцитарную активность. Это делает возможным получение ТГ при 20–22°С без использования индукторов, непосредственно активирующих тромбоциты.
Заключение
В составе ТЛК, выделенных из цельной крови при центрифугировании с ускорением 2500–2700 g, наблюдается пониженное содержание биологически полноценных тромбоцитов, которое в ряде случаев сопровождается их повышенной реактивностью. Высокая реактивность тромбоцитов позволяет получать тромбоцитарный гель на основе ТЛК при 20–22°С. Полученный тромбоцитарный гель и тромбофибриновый сгусток на основе аллогенных тромбоцитов ТЛК крови доноров могут быть использованы в качестве раневых покрытий, аппликативных биологических конструкций для лечения тканевых дефектов различного генеза, а также при создании композитных биологических конструкций, предназначенных для применения в регенеративной медицине.
Финансирование. Исследование выполнено без использования внешнего финансирования.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Golebiewska E.M., Poole AW. Secrets of platelet exocytosis — what do we really know about platelet secretion mechanisms? Br J Haematol 2013; 165(2): 204–216, https://doi.org/10.1111/bjh.12682.
- Amable P.R., Carias R.B., Teixeira M.V., da Cruz Pacheco I., Corrêa do Amaral R.J., Granjeiro J.M., Borojevic R. Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors. Stem Cell Res Ther 2013; 4(3): 67, https://doi.org/10.1186/scrt218.
- Palumbo V.D., Rizzuto S., Damiano G., Fazzotta S., Gottardo A., Mazzola G., Lo Monte A.I. Use of platelet concentrate gel in second-intention wound healing: a case report. J Med Case Rep 2021; 15(1): 85, https://doi.org/10.1186/s13256-020-02649-6.
- Everts P.A., Lana J.F., Alexander R.W., Dallo I., Kon E., Ambach M.A., van Zundert A., Podesta L. Profound properties of protein-rich, platelet-rich plasma matrices as novel, multi-purpose biological platforms in tissue repair, regeneration, and wound healing. Int J Mol Sci 2024; 25(14): 7914, https://doi.org/10.3390/ijms25147914.
- Макаров М.С. Физиологическое и прогностическое значение тромбоцитов без гранул. Медицинский алфавит 2018; 3(26): 32–38.
- Рожков Е.В., Кожемяко О.В., Понасенко М.А., Карасева И.А., Рожкова Н.С., Мадзаев С.Р., Жибурт Е.Б. Совершенствование производства концентрата пулированных патогенредуцированных тромбоцитов. Трансфузиология 2022; 23(1): 16–21.
- Akbarzadeh S., McKenzie M.B., Rahman M.M., Cleland H. Аllogeneic platelet-rich plasma: is it safe and effective for wound repair? Eur Surg Res 2021; 62(1): 1–9, https://doi.org/10.1159/000514223.
- Asadi M., Alamdari D.H., Rahimi H.R., Aliakbarian M., Jangjoo A., Abdollahi A., Bahar M.M., Azadmand A., Forghani N., Sadegh M.N., Khayamy M.E., Seifalian A. Treatment of life-threatening wounds with a combination of allogenic platelet-rich plasma, fibrin glue and collagen matrix, and a literature review. Exp Ther Med 2014; 8(2): 423–429, https://doi.org/10.3892/etm.2014.1747.
- Wang S., Ding W., Du Y., Qi Q., Luo K., Luan J., Shen Y., Chen B. Allogeneic platelet gel therapy for refractory abdominal wound healing: a preliminary study. Adv Clin Exp Med 2023; 32(8): 865–872, https://doi.org/10.17219/acem/159088.
- Fujioka-Kobayashi M., Schaller B., Mourão C.F.A.B., Zhang Y., Sculean A., Miron R.J. Biological characterization of an injectable platelet-rich fibrin mixture consisting of autologous albumin gel and liquid platelet-rich fibrin (Alb-PRF). Platelets 2021; 32(1): 74–81, https://doi.org/10.1080/09537104.2020.1717455.
- Fan Y., Perez K., Dym H. Сlinical uses of platelet-rich fibrin in oral and maxillofacial surgery. Dent Clin North Am 2020; 64(2): 291–303, https://doi.org/10.1016/j.cden.2019.12.012.
- Макаров М.С., Хубутия М.Ш., Хватов В.Б., Высочин И.В., Кобзева Е.Н., Конюшко О.И. Способ оценки морфофункционального статуса тромбоцитов человека. Патент РФ 2485502. 2013.
- Podoplelova N.A., Sveshnikova A.N., Kotova Y.N., Eckly A., Receveur N., Nechipurenko D.Y., Obydennyi S.I., Kireev I.I., Gachet C., Ataullakhanov F.I., Mangin P.H., Panteleev M.A. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood 2016; 128(13): 1745–1755, https://doi.org/10.1182/blood-2016-02-696898.
- Макаров М.С., Боровкова Н.В., Хватов В.Б., Кобзева Е.Н. Влияние центрифугирования на биологическую полноценность тромбоцитов человека. Вестник службы крови России 2015; 1: 41–44.
- Denorme F., Campbell R.A. Procoagulant platelets: novel players in thromboinflammation. Am J Physiol Cell Physiol 2022; 323(4): C951–C958, https://doi.org/10.1152/ajpcell.00252.2022.
- Italiano J.E. Jr, Mairuhu A.T., Flaumenhaft R. Clinical relevance of microparticles from platelets and megakaryocytes. Curr Opin Hematol 2010; 17(6): 578–584, https://doi.org/10.1097/MOH.0b013e32833e77ee.
- Макаров М.С., Сторожева М.В., Боровкова Н.В., Пономарев И.Н. Способ приготовления тромбофибринового сгустка, обладающего ростстимулирующими свойствами. Патент РФ 2679616. 2019.
- Santhakumar M., Yayathi S., Retnakumari N. A clinicoradiographic comparison of the effects of platelet-rich fibrin gel and platelet-rich fibrin membrane as scaffolds in the apexification treatment of young permanent teeth. J Indian Soc Pedod Prev Dent 2018; 36(1): 65–70, https://doi.org/10.4103/JISPPD.JISPPD_180_17.
- Nadra M., Niu W., Kurisawa M., Rousson D., Spector M. Platelet-rich plasma lysate-incorporating gelatin hydrogel as a scaffold for bone reconstruction. Bioengineering (Basel) 2022; 9(10): 513, https://doi.org/10.3390/bioengineering9100513.
- Tang S., Wang L., Zhang Y., Zhang F. A biomimetic platelet-rich plasma-based interpenetrating network printable hydrogel for bone regeneration. Front Bioeng Biotechnol 2022; 10: 887454, https://doi.org/10.3389/fbioe.2022.887454.
- Ситкова Е.С., Драгунова М.А., Огуркова О.Н., Сморгон А.В., Московских Т.В., Баталов Р.Е., Суслова Т.Е. Спонтанная и стимулированная агрегационная активность тромбоцитов у пациентов с фибрилляцией предсердий и тромботическими осложнениями. Сибирский журнал клинической и экспериментальной медицины 2023; 38(4): 116–124, https://doi.org/10.29001/2073-8552-2023-38-4-116-124.
- Moskalensky A.E., Litvinenko A.L. The platelet shape change: biophysical basis and physiological consequences. Platelets 2019; 30(5): 543–548, https://doi.org/10.1080/09537104.2018.1514109.
- Murphy D.D., Reddy E.C., Moran N., O'Neill S. Regulation of platelet activity in a changing redox environment. Antioxid Redox Signal 2014; 20(13): 2074–2089, https://doi.org/10.1089/ars.2013.5698.