Композиция поли-D,L-лактида-со-гликолида и эноксапарина натрия — перспективное покрытие сосудистых стентов: оценка биосовместимости и эффективности стент-графтов в эксперименте на крупных животных
Цель исследования — оценить в эксперименте на крупных животных биосовместимость сосудистых стентов, покрытых мембраной на основе сополимера поли-D,L-лактида-со-гликолида и эноксапарина натрия.
Материалы и методы. На металлические коронарные стенты «Калипсо» длиной 8 мм методом электроспиннинга наносили биодеградируемое покрытие на основе сополимера поли-D,L-лактида-со-гликолида с соотношением полилактида и гликолида 50:50 и низкомолекулярного эноксапарина натрия. Покрытые стенты (стент-графты) и стенты без покрытия имплантировали в сонную артерию овец. Проходимость в динамике оценивали с помощью цветного дуплексного сканирования. Через 3 мес фрагменты «артерия–стент» были эксплантированы, зафиксированы забуференным формалином с постфиксацией тетраоксидом осмия, обезвожены в этаноле и ацетоне и затем пропитаны эпоксидной смолой. После полимеризации образцы шлифовали до необходимой глубины и полировали. Для повышения контрастности после полировки образцы обрабатывали цитратом свинца по Рейнольдсу. Образцы визуализировали посредством сканирующей электронной микроскопии в режиме обратно-рассеянных электронов.
Результаты. На протяжении 3 мес эксперимента случаев тромбозов и стенозов стентов и стент-графтов не отмечено. На внутренней поверхности стент-графтов сформирована равномерная плотная неоинтима толщиной до 165 мкм, превышающая в два раза интиму интактной сонной артерии, которая примыкает к стент-графту. На внутренней части стентов без полимерной мембраны сформировалась рыхлая неоинтима, толщина которой достигает местами 380 мкм. Во всех образцах наблюдали классическую картину образования плотной фиброзной капсулы, которая отделяет металлические балки стента от кровотока и структурных элементов артерии, однако ее морфология и клеточный состав в образцах значительно различались. Балки стента без мембраны окружали многочисленные клетки воспалительного ряда. Окружение стент-графтов представлено в основном гладкомышечными клетками, фиброцитами, фрагментами эластической мембраны, расположенными в межклеточном матриксе; клетки воспаления отсутствуют. Полимерное покрытие стент-графтов полностью деградировало без образования рубцовой ткани.
Заключение. Разработанное полимерное покрытие сосудистого стента на основе сополимера поли-D,L-лактида-со-гликолида с соотношением полилактида и гликолида 50:50 и низкомолекулярного эноксапарина натрия показало свою эффективность. При имплантации овцам в сонную артерию стент-графты не вызывают развития тромбоза и стеноза, успешно интегрируются с артерией животного. Через 3 мес происходит полная резорбция полимерного покрытия без признаков хронической воспалительной реакции.
Введение
Заболевания системы кровообращения продолжают занимать лидирующие позиции среди причин смертности трудоспособного населения, при этом значительная часть летальных исходов (до 50%) приходится на ишемическую болезнь сердца [1–4]. В связи с этим своевременная диагностика и эффективное лечение сердечно-сосудистых заболеваний остаются одной из приоритетных задач современной медицины.
Восстановление коронарного кровотока может быть осуществлено как методами «открытой» хирургии, так и путем использования малоинвазивных эндоваскулярных вмешательств. Однако в последние десятилетия рентгенэндоваскулярные методы значительно опередили аортокоронарное шунтирование по числу выполняемых процедур, что обусловлено их меньшей травматичностью, сокращением сроков реабилитации и хорошими клиническими исходами. В частности, при лечении пациентов с острым коронарным синдромом соотношение аортокоронарного шунтирования и чрескожных коронарных вмешательств (ЧКВ) составляет 8–12% и 50–60% соответственно [2].
С развитием технологий рентгенэндоваскулярной хирургии наблюдается неуклонный рост количества вмешательств не только на коронарных артериях, но и на сосудах других бассейнов, включая брахиоцефальные, интра- и экстракраниальные артерии, а также артерии нижних конечностей. В таких процедурах широко применяются различные конструкции стентов, позволяющие обеспечивать восстановление кровотока в пораженных сосудах [2]. Однако, несмотря на значительные достижения в области рентгенэндоваскулярной хирургии, проблема осложнений, возникающих как при лечебных, так и при диагностических вмешательствах, остается актуальной [5–7].
Одним из наиболее опасных осложнений ЧКВ является ятрогенная перфорация коронарных артерий, частота которой, по данным клинических исследований, составляет 0,2–0,6% всех вмешательств [6]. Риск возникновения данных осложнений увеличивается пропорционально сложности выполняемой процедуры: при рутинном ЧКВ частота их составляет около 0,43%, тогда как при вмешательствах, направленных на реканализацию хронических окклюзий коронарных артерий, этот показатель возрастает до 2,9% [7]. Наибольшему риску развития перфорации подвержены пациенты с выраженной извитостью сосудов и наличием кальцифицированных бляшек, что значительно затрудняет проведение процедуры.
Перфорация коронарных артерий сопряжена с высоким риском жизнеугрожающих осложнений, включая тампонаду сердца, массивные кровоизлияния и кардиогенный шок. Летальность данных осложнений достигает 10,7% [5], что обусловливает актуальность поиска новых методов профилактики и лечения ятрогенных перфораций, а также совершенствования эндоваскулярных технологий, направленных на снижение риска таких осложнений.
Для остановки кровотечений труднодоступных артерий оптимальным решением является использование стент-графтов, т.е. стентов, имеющих с внешней стороны покрытие, закрывающее диссекцию/перфорацию артерии и восстанавливающее кровоток. В настоящее время на рынке представлены стент-графты с покрытием из различных материалов: недеградируемых полимеров (например, политетрафторэтилен, полиуретан) и биологических тканей (например, перикард лошади) [8–10]. При этом недеградируемые полимеры, как и биоматериалы, остаются в стенке артерии на долгое время и могут вызывать хроническое воспаление и, как следствие, нередко приводить к кальцификации в зоне имплантации [11, 12].
Биодеградируемые полимеры, особенно с коротким сроком резорбции, могут служить более успешной альтернативой, поскольку, выполнив свою защитную функцию при закрытии перфорации и во время ремоделирования перфорированной артерии, далее деградируют, не вызывая хронического воспаления. При этом в полимерное покрытие можно включать лекарственные препараты по принципу производства стентов с лекарственным покрытием: лекарственное вещество будет дозированно выделяться по мере деградации полимерной композиции и оказывать локальное терапевтическое действие.
Ранее [13, 14] нами был проведен скрининг различных полимеров с целью создания стент-графта с позиции упругодеформативных свойств, био- и гемосовместимости. Сополимер поли-D,L-лактид-со-гликолид с соотношением полилактида и гликолида 50:50 был выбран как наиболее оптимальный, отвечающий всем требованиям: сохранность покрытия при раздувании баллоном, высокая био- и гемосовместимость и короткие сроки биодеградации — не более 3 мес. Для нанесения покрытия использован метод электроспиннинга, который позволяет равномерно наносить покрытие требуемой толщины, включать лекарственные вещества в состав микроволокон, что приводит к их дозированному выделению после имплантации по мере деструкции полимерной нити. В качестве лекарственного вещества был выбран низкомолекулярный гепарин — эноксапарин натрия, поскольку помимо антитромботических и антикоагулянтных свойств он обладает также противовоспалительным действием [15].
Для оценки клинической эффективности выбранного покрытия in vivo решено имплантировать стент-графты в артерию крупного животного с последующей оценкой рисков тромбозов, рестенозов, а также реакции окружающих тканей на полимерное покрытие.
Цель исследования — оценить в эксперименте на крупных животных биосовместимость сосудистых стентов, покрытых мембраной на основе сополимера поли-D,L-лактида-со-гликолида и эноксапарина натрия.
Материалы и методы
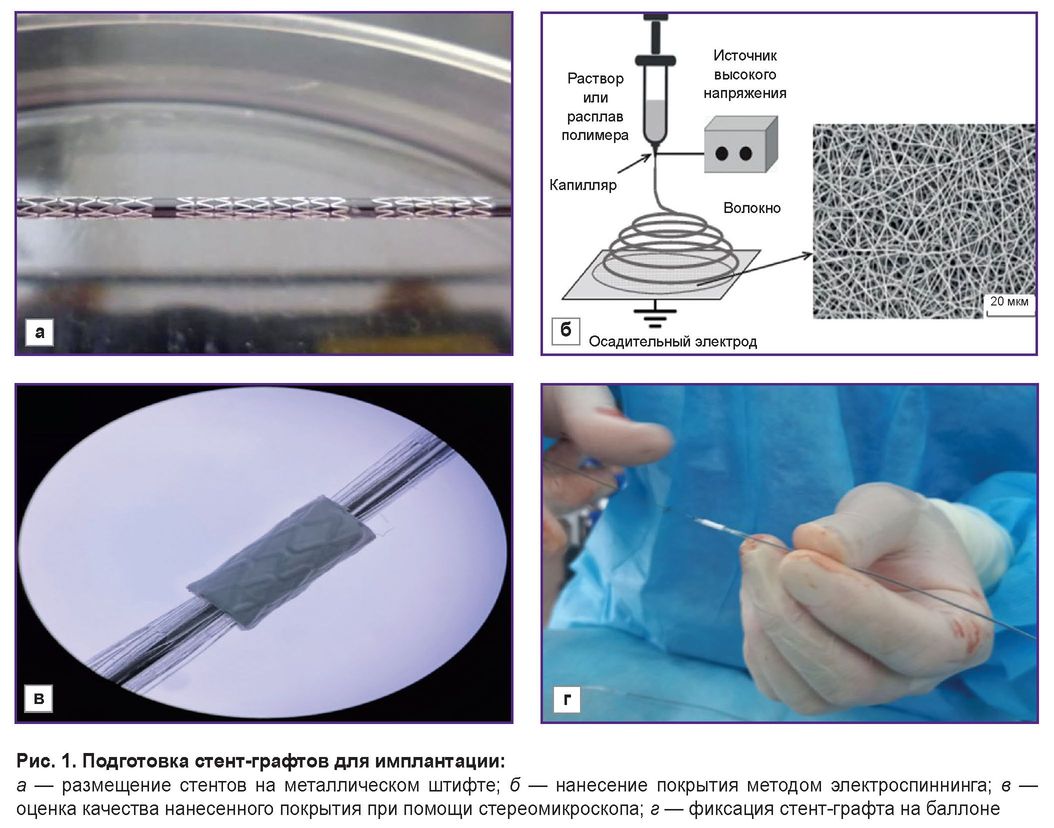
Для покрытия биополимерной мембраной были использованы металлические коронарные стенты «Калипсо» («Ангиолайн», Россия) длиной 8 мм, диаметром 4 и 4,5 мм. Для получения покрытия готовили 15% раствор сополимера поли-D,L-лактида-со-гликолида с молекулярной массой 30 000–45 000 г/моль и соотношением лактида и гликолида 50:50 («Новохим», Россия), растворенного в гексафторпропаноле (1,1,1,3,3,3-гексафтор-2-пропанол), чистота ≥99,8% (Sigma-Aldrich, США). Полимер размешивали на магнитной мешалке в течение 12 ч при комнатной температуре до полного растворения. Для придания гемосовместимости и снижения риска тромбоза в раствор полимера добавляли низкомолекулярный гепарин Эниксум (эноксапарин натрия), после чего размешивали раствор еще в течение 30 мин. Стенты размещали на металлическом штифте диаметром 1,0 мм (рис. 1, а). Полимерное покрытие наносили методом электроспиннинга (рис. 1, б) на установке Nanon-01A (MECC CO, Япония). При помощи стереомикроскопа оценивали качество нанесенного покрытия (рис. 1, в). Толщина полимерного покрытия составляла 80–90 мкм. После высыхания стент-графт помещали на баллон (рис. 1, г) и стерилизовали методом радиационного излучения.
Основные этапы исследования:
1) имплантация стент-графта во внутреннюю сонную артерию лабораторного животного с предварительной оценкой состояния нативного сосуда с помощью внутрисосудистого ультразвукового исследования (ВСУЗИ) под контролем цветного дуплексного сканирования (ЦДС);
2) динамическое наблюдение при помощи ЦДС, контрольные точки — 3-й день, 1 и 3 мес;
3) эксплантация стент-графтов через 3 мес;
4) гистологическое исследование эксплантатов.
Экспериментальные исследования проведены в соответствии с Guide for the Care and Use of Laboratory Animals (National Research Council, 2011); с принципами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006); Хельсинкской декларацией Всемирной медицинской ассоциации о гуманном обращении с животными (2024) и одобрены Локальным этическим комитетом Научно-исследовательского института комплексных проблем сердечно-сосудистых заболеваний (протокол №11 от 20.11.2023 г.).
С целью профилактики раннего тромбоза стент-графта перед оперативным вмешательством накануне вечером лабораторному животному давали нагрузочную дозу 300 мг клопидогрела и 300 мг ацетилсалициловой кислоты. Операции проведены в условиях эндотрахеального наркоза. Покрытые полимерной мембраной стент-графты имплантированы животным во внутреннюю сонную артерию с двух сторон. В эксперименте участвовали овцы (n=5) массой 32–35 кг. Использовано 7 стент-графтов (опытная группа) и 3 стента без покрытия (контрольная группа). Неравное количество стентов в группах обусловлено тем, что результаты имплантации стентов без покрытия ранее уже описаны в работе [16]. Кроме того, в экспериментальном исследовании [17] мы подтвердили уже имеющиеся данные работы [16]. Имплантация стентов с разработанным биополимерным покрытием предусматривала тщательный анализ, что потребовало увеличения количества наблюдений.
Имплантацию стент-графта в общую сонную артерию выполняли следующим образом. После введения экспериментального животного в наркоз с использованием аппарата УЗИ с функцией ЦДС Mindray M5 (Mindray, Китай) визуализировали общую сонную артерию (рис. 2, а) с последующей ее пункцией и установкой интродьюсера 6 Fr (рис. 2, б). После системного введения гепарина (2500 ЕД) для оценки референсного диаметра сосуда и выбора необходимого размера стента или графта (рис. 2, в) использовали систему ВСУЗИ iLab Polarisс датчиками OptiCross (Boston Scientific, США). Измерение диаметра артерии двумя различными методами показало существенную разницу: при использовании ВСУЗИ диметр артерии был в среднем на 0,8–1,0 мм больше, чем при предварительном измерении с помощью УЗИ. На основании показателей ВСУЗИ выбирали диаметр стент-графта.
После этого параллельно датчику ВСУЗИ дистальнее на 0,5–1,0 см заводили стент-графт. После позиционирования под контролем чрескожного и внутрисосудистого УЗИ стент-графт имплантировали в общую сонную артерию. Затем проводили контроль раскрытия стент-графта с помощью ВСУЗИ, при выявлении мальпозиции и/или недораскрытия выполняли постдилатацию баллоном (до 16 атм) с повторной оценкой результата. Методом ВСУЗИ оценивали площадь раскрытия, аппозицию, а также наличие диссекций (рис. 2, г).
После имплантации стент-графта удаляли баллон и интродьюсер, отверстие герметизировали с помощью ушивающего устройства Angio-Seal (Terumo Medical Corporation, США).
В интраоперационный период всем животным вводили антибиотик цефтриаксон (750 мг однократно). В послеоперационном периоде им назначали следующую терапию: инъекции цефуроксима (по 750 г 2 раза в сутки в течение до 5 сут после операции); кетопрофена 50 мг/мл (по 2 мл внутримышечно 2 раза в сутки в течение до 5 сут после операции); двойная антиагрегантная терапия до 90 сут после операции: клопидогрел (75 мг перорально) и ацетилсалициловая кислота (75 мг перорально).
Функциональность стентов оценивали методом ЦДС на 3-и сутки, а также через 1 и 3 мес после операции. Вывод животных из эксперимента осуществляли через 3 мес после имплантации стента. Для сравнения в качестве эталона был забран фрагмент интактной (нативной) сонной артерии, примыкающей к стент-графту. Эксплантированные стент-графты/стенты подвергли макро- и микроскопическому исследованию. Интеграцию стентов с сонной артерией, наличие воспалительной реакции, характер деградации полимерного покрытия, особенности образования неоинтимы оценивали оригинальным методом EM-BSEM, который заключается в заливке цельных фрагментов эксплантированного материала в эпоксидную с смолу с последующим изучением с помощью сканирующей электронной микроскопии (СЭМ) в обратно-рассеянных электронах [17]. Этот метод позволяет получать микрофотографии высокого разрешения, визуально сходные со снимками, сделанными при просвечивающей электронной микроскопии.
Для этого удаленные комплексы «стент–сонная артерия» и фрагмент интактной артерии, примыкающей к имплантированному стент-графту, промывали в охлажденном физиологическом растворе хлорида натрия и помещали в забуференный (рН 7,4) 10% водный раствор формалина (B06-003; «БиоВитрум», Россия) на 24 ч с однократной сменой формалина через первые 12 ч. На следующем этапе образцы постфиксировали в 1% тетраоксиде осмия (19110; Electron Microscopy Sciences, США), приготовленном на 0,1 М фосфатном буфере, в течение 12 ч, и далее окрашивали 2% водным раствором тетраоксида осмия в течение 48 ч. Затем образцы обезвоживали в этаноле возрастающей концентрации (50, 60, 70, 80, 95%) — по две 15-минутных смены в каждой из указанных концентраций. После этого образцы докрашивали 2% спиртовым (95% этанол) раствором уранилацетата (22400-2; Electron Microscopy Sciences, США) в течение 5 ч и обезвоживали в изопропаноле (06-002; «БиоВитрум», Россия) в течение 5 ч и ацетоне (150495; «ЛенРеактив», Россия) в течение 1 ч. Затем образцы пропитывали смесью эпоксидной смолы Araldite 502 (13900; Electron Microscopy Sciences) и ацетона в соотношении 1:1 в течение 6 ч, чистой эпоксидной смолой в течение 24 ч и полимеризовали в свежей эпоксидной смоле в емкостях FixiForm (40300085; Struers, Дания) при 60°C в течение 24 ч. Получившиеся эпоксидные блоки шлифовали до поверхности образца и полировали на установке TegraPol-11 (Struers, Дания) с последовательным использованием шлифовальных дисков с диаметром зерна 9, 6 и 3 мкм. После полировки образцы контрастировали цитратом свинца по Рейнольдсу (17810; Electron Microscopy Sciences, США) в течение 15 мин путем нанесения раствора на отполированную поверхность блока. После отмывки в бидистиллированной воде на эпоксидные блоки наносили углеродное напыление толщиной 10–15 нм с помощью вакуумной напылительной системы EM ACE200 (Leica, Германия).
Визуализацию структуры образцов выполняли при помощи СЭМ в режиме вторичных (обратно-рассеянных) электронов на сканирующем электронном микроскопе S-3400N (Hitachi, Япония) при ускоряющем напряжении 10 или 15 кВ.
Результаты и обсуждение
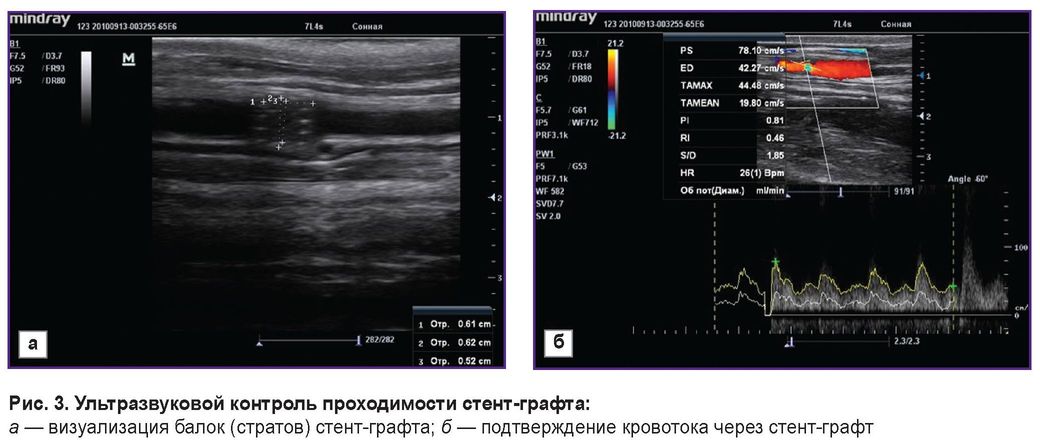
С целью оценки проходимости установленных стентов и стент-графтов на 3-и сутки, через 1 и 3 мес всем животным проводили УЗИ. Полученные результаты подтвердили проходимость всех имплантированных изделий: стенты и стент-графты визуализировались хорошо, отчетливо были видны балки (страты) (рис. 3, а). Кровоток через имплантированный стент-графт сохранен (рис. 3, б). Случаев тромбоза не зафиксировано.
|
Рис. 3. Ультразвуковой контроль проходимости стент-графта: а — визуализация балок (стратов) стент-графта; б — подтверждение кровотока через стент-графт |
После эксплантации отмечена деформация имплантированных изделий: стенты и стент-графты принимали овальную форму вместо ожидаемой круглой. Данный факт обусловлен тем, что сонная артерия находится близко к коже, а коронарные стенты, используемые в данном исследовании, достаточны хрупкие. Это и привело к сжатию стента и принятию им овальной формы при проведении УЗИ в динамике из-за прижатия датчика плотно к коже животного. Необходимо отметить, что кровоток через деформированный стент был сохранен и случаев тромбоза стента либо стент-графта не отмечено.
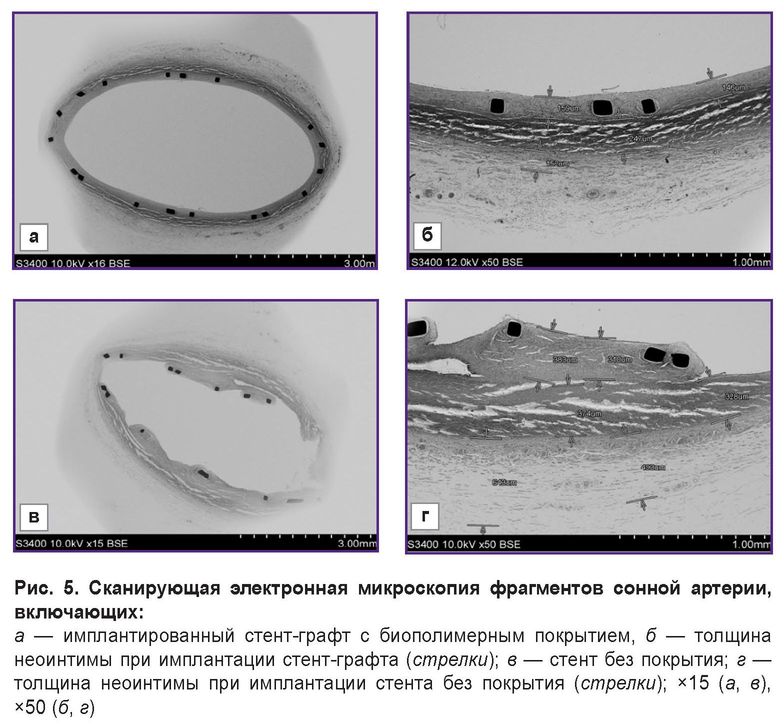
При сравнении методом СЭМ состояния интактной артерии, примыкающей к имплантированному стент-графту, и фрагмента артерии с имплантированным стент-графтом, установлено, что строение слоев артерий схоже: отчетливо визуализируются интима/неоинтима, слои медии и адвентиции (рис. 4). При увеличении в 100 раз видно, что размеры слоев медии и адвентиции в среднем составили 250 и 200 мкм соответственно как в интактной артерии, так и в артерии, содержащей стент-графт (рис. 4, б, г). Различались только размеры внутреннего слоя: толщина интимы в интактной артерии не превышала 85 мкм, в то время как толщина неоинтимы в зоне имплантации стент-графта была в 2 раза больше и достигала 165 мкм.
При этом следует отметить, что неоинтима была равномерной, плотноупакованной, на поверхности встречались единичные эндотелиальные клетки. Признаки пристеночного тромбоза отсутствовали во всех образцах. В отличие от интактной артерии внутренняя эластическая мембрана в артерии со стент-графтом не визуализируется по причине ее сжатия стентом при имплантации.
Совсем иную картину наблюдали при сравнении артерий с имплантированными стентами без покрытия биополимерной мембраной и с покрытием (рис. 5). Неоинтима в случае имплантации металлического стента без биополимерной мембраны была неравномерной, рыхлой, бугристой (рис. 5, в), достигая местами толщины до 380 мкм (рис. 5, г).
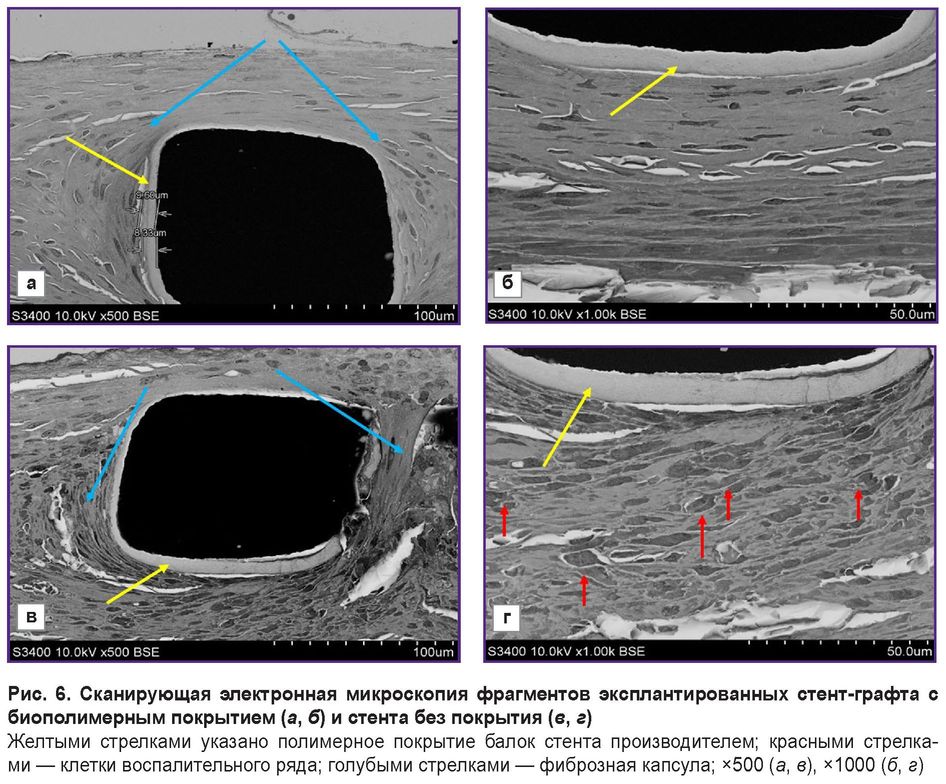
При увеличении в 500 раз отчетливо видны балки (страты) стентов и полимерное покрытие, нанесенное изготовителем (рис. 6, а, в). Согласно инструкции, для снижения риска разрастания неоинтимы и рестеноза изготовитель покрывает балки стента биодеградируемым полимером — полилактидом-со-гликолидом с добавлением сиролимуса. Данное покрытие сохранилось через 3 мес имплантации и отчетливо визуализировалось вокруг балок, его толщина составляла 8–9 мкм.
У артерий с имплантированными стентами и стент-графтами различались не только толщина и морфология неоинтимы, но и клеточный состав. Во всех образцах наблюдали классическую картину образования плотной фиброзной капсулы, которая отделяет металлические балки стента от кровотока и структурных элементов артерии. При увеличении в 1000 раз (рис. 6, б, г) видно сохранившееся полимерное покрытие, нанесенное при изготовлении стента, а вокруг — новообразованные ткани, состав которых значительно различается. Балки стента без мембраны окружают многочисленные клетки воспалительного ряда (см. рис. 6, г), балки стент-графтов окружает компактный слой без признаков воспаления (см. рис. 6, б).
Наиболее презентативно выглядят различия в окружении балок стента и стент-графта на больших увеличениях (рис. 7). Окружение балок стент-графтов представлено в основном гладкомышечными клетками, фиброцитами, фрагментами эластической мембраны, расположенными в межклеточном матриксе, клетки воспаления отсутствуют (рис. 7, б). Периферия балок непокрытого стента состоит из макрофагов, фибробластов, встречаются единичные гигантские клетки инородного тела, что свидетельствует о хроническом воспалении (рис. 7, г). На границе фиброзной капсулы также отмечено наличие фибробластов (рис. 7, д).
На всех образцах стент-графтов через 3 мес после имплантации полимерная мембрана — нанесенное методом электроспиннинга биополимерное покрытие — не визуализируется (рис. 7, а). Можно утверждать, что полимерное покрытие полностью деградировало без образования рубцовой ткани.
Поверхность неоинтимы, обращенной к кровотоку, у изучаемых образцов также существенно различалась: при имплантации стент-графта на поверхности визуализировали ровный слой эндотелиальных клеток (рис. 7, в), в то время как на поверхности стента без покрытия — эндотелиоподобные клетки, под которыми располагался рыхлый субэндотелиальный слой, представленный фибробластами и макрофагами (рис. 7, е).
В случае имплантации стентов без полимерной мембраны наблюдается формирование более рыхлой и утолщенной неоинтимы. Однако разрастание неоинтимы в просвет артерии (в сторону кровотока) оставалось умеренным по сравнению с имплантацией стент-графтов без лекарственного покрытия согласно результатам других исследований [17]. Вероятно, это обусловлено действием сиролимуса, включенного в состав полимерного покрытия стентов «Калипсо».
Существует мнение, что рестеноз сосудов, включая область имплантации стента, связан с пролиферацией сосудистых гладкомышечных клеток (СГМК), рост которых может стимулироваться стентами с лекарственным покрытием [4]. Этот факт объясняет различие в толщине неоинтимы у разработанных нами стент-графтов и стентов с полимерным покрытием, содержащим сиролимус. Полимерная мембрана на основе поли-D,L-лактида-со-гликолида изолировала металлические элементы стента от внутреннего слоя артерии, препятствуя прямому контакту лекарственного покрытия, содержащего сиролимус, с СГМК. Помимо механического разделения конструкции стента от окружающих тканей положительный эффект также оказал инкорпорированный в полимерную мембрану эноксапарин натрия, оказывая локальный антикоагулянтный и противовоспалительный эффект.
Наши данные согласуются с результатами исследований [15], в которых установлено, что эноксапарин натрия в составе композиционных покрытий стентов снижает скорость апоптоза эндотелиальных клеток и уменьшает локальное воспалительное повреждение при имплантации кроликам.
Следует обратить внимание на еще одно различие между тканями, окружающими стент-графт и стент без покрытия. В последнем случае наблюдалось присутствие фиброкластов — клеток, участвующих в ремоделировании коллагеновых и эластиновых волокон в процессе репаративной регенерации. Фиброкласты содержат большое количество лизосом, которые выделяют лизосомальные ферменты и, разрушая коллаген и эластин, способствуют их перестройке и формированию рубцов в зоне повреждения [18]. Напротив, в тканях, окружающих стенты с биодеградируемой мембраной, обнаружены лишь единичные фиброциты (конечная форма фибробластов) и СГМК, что может свидетельствовать о завершении репаративного процесса через 3 мес после имплантации.
Выбор трехмесячного периода наблюдения обусловлен характеристиками используемого сополимера, который обладает высокой скоростью гидролитической деградации за счет низкой молекулярной массы [19]. Мы подтвердили это свойство как в случае с подкожной имплантацией [14], так и в настоящем исследовании. По истечении 3 мес следов полимерной мембраны между металлическими элементами стента и стенкой артерии не обнаружено.
Гистологическая картина также свидетельствует о минимальной воспалительной реакции при использовании сополимера в соотношении полилактида и гликолида 50:50 по сравнению с другими соотношениями, например с покрытиями стентов сополимерами с более высоким содержанием полилактида, когда к концу 3-го месяца полимер сохранял целостность [19].
Заключение
Экспериментальное исследование на крупных животных показало, что разработанное полимерное покрытие сосудистого стента на основе сополимера поли-D,L-лактида-со-гликолида с соотношением полилактида и гликолида 50:50 и низкомолекулярного эноксапарина натрия является весьма эффективным. При имплантации в сонную артерию овцы стент-графт с таким покрытием предотвращает тромбоз и стеноз, способствует успешной интеграции с сосудистой стенкой и не вызывает хронического воспаления.
Источник финансирования. Исследование выполнено в рамках гранта Фонда поддержки молодых ученых в области биомедицинских наук №2024_2 «Разработка стент-графтов с биополимерным покрытием для закрытия перфораций артерий в сердечно-сосудистой хирургии».
Конфликт интересов отсутствует.
Литература
- Timmis A., Townsend N., Gale C.P., Torbica A., Lettino M., Petersen S.E., Mossialos E.A., Maggioni A.P., Kazakiewicz D., May H.T., De Smedt D., Flather M., Zuhlke L., Beltrame J.F., Huculeci R., Tavazzi L., Hindricks G., Bax J., Casadei B., Achenbach S., Wright L., Vardas P.; European Society of Cardiology. European Society of Cardiology: cardiovascular disease statistics 2019. Eur Heart J 2020; 41(1): 12–85, https://doi.org/10.1093/eurheartj/ehz859.
- Алекян Б.Г., Бойцов С.А., Маношкина Е.М., Ганюков В.И. Реваскуляризация миокарда в Российской Федерации при остром коронарном синдроме 2016–2022 гг. Кардиология 2021; 61(12): 4–15, https://doi.org/10.18087/cardio.2021.12.n1879.
- Collet J.P., Thiele H., Barbato E., Barthélémy O., Bauersachs J., Bhatt D.L., Dendale P., Dorobantu M., Edvardsen T., Folliguet T., Gale C.P., Gilard M., Jobs A., Jüni P., Lambrinou E., Lewis B.S., Mehilli J., Meliga E., Merkely B., Mueller C., Roffi M., Rutten F.H., Sibbing D., Siontis G.C.M.; ESC Scientific Document Group 2020. ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2021; 42(14): 1289–1367, https://doi.org/10.1093/eurheartj/ehaa575.
- Рябов В.В., Кретов Е.И., Попов С.В., Хасанов И.Ш., Яковлев М.Ю. Технология коронарного стентирования и роль воспаления в атерогенезе: проблемы и перспективы. Бюллетень сибирской медицины 2021; 20(1): 200–21, https://doi.org/10.20538/1682-0363-2021-1-200-212.
- Lemmert M.E., van Bommel R.J., Diletti R., Wilschut J.M., de Jaegere P.P., Zijlstra F., Daemen J., Van Mieghem N.M. Clinical characteristics and management of coronary artery perforations: a single-center 11-year experience and practical overview. J Am Heart Assoc 2017; 6(9): e007049, https://doi.org/10.1161/JAHA.117.007049.
- Rao G., Sheth S., Grines C. Percutaneous coronary intervention: 2017 in review. J Interv Cardiol 2018; 31(2): 117–128, https://doi.org/10.1111/joic.12508.
- Patel V.G., Brayton K.M., Tamayo A., Mogabgab O., Michael T.T., Lo N., Alomar M., Shorrock D., Cipher D., Abdullah S., Banerjee S., Brilakis E.S. Angiographic success and procedural complications in patients undergoing percutaneous coronary chronic total occlusion interventions: a weighted meta-analysis of 18,061 patients from 65 studies. JACC Cardiovasc Interv 2013; 6(2): 128–136, https://doi.org/10.1016/j.jcin.2012.10.011.
- Kufner S., Schacher N., Ferenc M., Schlundt C., Hoppmann P., Abdel-Wahab M., Mayer K., Fusaro M., Byrne R.A., Kastrati A. Outcome after new generation single-layer polytetrafluoroethylene-covered stent implantation for the treatment of coronary artery perforation. Catheter Cardiovasc Interv 2019; 93(5): 912–920, https://doi.org/10.1002/ccd.27979.
- Chen S., Lotan C., Jaffe R., Rubinshtein R., Ben-Assa E., Roguin A., Varshitzsky B., Danenberg H.D. Pericardial covered stent for coronary perforations. Catheter Cardiovasc Interv 2015; 86(3): 400–404, https://doi.org/10.1002/ccd.26011.
- Kandzari D.E., Birkemeyer R. PK Papyrus covered stent: device description and early experience for the treatment of coronary artery perforations. Catheter Cardiovasc Interv 2019; 94(4): 564–568, https://doi.org/10.1002/ccd.28306.
- Agathos E.A., Tomos P.I., Kostomitsopoulos N., Koutsoukos P.G. Calcitonin as an anticalcification treatment for implantable biological tissues. J Cardiol 2019; 73(2): 179–182, https://doi.org/10.1016/j.jjcc.2018.07.010.
- Глушкова Т.В., Овчаренко Е.А., Севостьянова В.В., Клышников К.Ю. Особенности кальцификации элементов сердечно-сосудистой системы и их заменителей: состав, структура и локализация кальцификатов. Кардиология 2018; 58(5): 72–81, https://doi.org/10.18087/cardio.2018.5.10110.
- Rezvova M.A., Ovcharenko E.A., Klyshnikov K.Y., Glushkova T.V., Kostyunin A.E., Shishkova D.K., Matveeva V.G., Velikanova E.A., Shabaev A.R., Kudryavtseva Y.A. Electrospun bioresorbable polymer membranes for coronary artery stents. Front Bioeng Biotechnol 2024; 12: 1440181, https://doi.org/10.3389/fbioe.2024.1440181.
- Шабаев А.Р., Каноныкина А.Ю., Богданов Л.А., Шишкова Д.К., Кудрявцева Ю.А. Выбор полимера для покрытия стент-графта с позиции биосовместимости и особенности биодеградации. Комплексные проблемы сердечно-сосудистых заболеваний 2024; 13(4): 77–89, https://doi.org/10.17802/2306-1278-2024-13-4-77-89.
- Hao K., Sang L., Ding L., Shen X., Fu D., Qi X. Enoxaparin sodium bone cement displays local anti-inflammatory effects by regulating the expression of IL-6 and TNF-α. Heliyon 2023; 9(6): e16530, https://doi.org/10.1016/j.heliyon.2023.e16530.
- Nakamura K., Keating J.H., Edelman E.R. Pathology of endovascular stents. Interv Cardiol Clin 2016; 5(3): 391–403, https://doi.org/10.1016/j.iccl.2016.02.006.
- Мухамадияров Р.А., Евтушенко А.В., Тарасов Р.С., Халивопуло И.К., Ляпин А.А., Кутихин А.Г. Различия структуры неоинтимы на голометаллическом стенте и заплате из политетрафторэтилена у детей после двухэтапной хирургической коррекции тетрады Фалло. Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского 2022; 10(3): 64–75, https://doi.org/10.33029/2308-1198-2022-10-3-64-75.
- Шурыгина И.А., Шурыгин М.Г., Аюшинова Н.И., Каня О.В. Фибробласты и их роль в развитии соединительной ткани. Сибирский медицинский журнал (Иркутск) 2012, 3: 8–12.
- Сорокоумова М.В., Компанцев Д.В., Щербакова Л.И., Компанцев В.А., Медвецкий А.И., Зяблицева Н.С., Васина Т.М., Санникова Е.Г. Поли-D,L-лактид-ко-гликолид — перспективный полимер для разработки наносистем доставки лекарственных средств (обзор). Медико-фармацевтический журнал «Пульс» 2022; 24(8): 42–52, https://doi.org/10.26787/nydha-2686-6838-2022-24-8-42-52.