Современные технологии контроля бронхиальной астмы у детей (обзор)
Бронхиальная астма принадлежит к числу наиболее распространенных аллергических заболеваний у детей. Это хроническое воспалительное заболевание респираторного тракта, в котором участвуют многие клетки врожденной и адаптивной иммунной системы совместно с эпителиальными клетками, вызывая основные клинические синдромы, характерные для данного заболевания. Целью терапии бронхиальной астмы на настоящем этапе является достижение контроля над симптомами и течением заболевания, что реализуется в ходе проведения базисной противовоспалительной терапии с привлечением различных групп фармакологических средств: ингаляционных глюкокортикостероидов, антагонистов лейкотриеновых рецепторов, кромонов, бета-2-агонистов и теофиллинов длительного действия, системных глюкокортикостероидов и анти-IgE-терапии. Однако, несмотря на наличие широкого спектра подходов к проведению противовоспалительной базисной терапии БА, сложность достижения контроля заболевания у значительной доли пациентов остается проблемой, что свидетельствует о необходимости поиска новых терапевтических подходов. В этой связи для оптимизации патогенетической терапии бронхиальной астмы в настоящее время проводится работа по совершенствованию противовоспалительных препаратов имеющихся классов и их сочетаний. Кроме того, ведется поиск принципиально новых подходов к терапии астмы, в том числе с учетом фенотипов и эндотипов болезни, включая создание и внедрение в практику лекарственных препаратов антицитокинового и антимедиаторного действия. Возможно, что по мере детализации знаний о молекулярных характеристиках эндотипов астмы и внедрения в практику биомаркеров, позволяющих диагностировать фенотипы и эндотипы болезни, а также мониторировать уровень контроля, будет реализован персонализированный подход в назначении индивидуальной терапии каждому конкретному пациенту.
По данным эпидемиологических исследований, бронхиальной астмой (БА) страдает 5–10% детского населения [1]. БА — хроническое воспалительное заболевание респираторного тракта, в котором участвуют многие клетки врожденной и адаптивной иммунной системы совместно с эпителиальными клетками, вызывая основные клинические синдромы, характерные для данного заболевания [2, 3]. Существует мнение, что БА гетерогенна. Выделяют различные ее фенотипы и эндотипы, которые определяются особенностями взаимодействия генетических и средовых факторов, различаются возрастом начала заболевания, клиническими проявлениями, спектром биомаркеров, прогнозом и ответом на традиционные и новые терапевтические воздействия [4–7]. При этом продемонстрировано, что фенотипы астмы, диагностированные с учетом превалирования тех или иных воспалительных клеточных популяций в мокроте, в течение 12-месячного периода наблюдения не были стабильными [8].
Иммунологические механизмы, лежащие в основе БА, преимущественно опосредованы Т-лимфоцитами-хелперами 2-го типа (Th2), ассоциированы с гиперпродукцией иммуноглобулинов Е и формированием эозинофильного варианта воспаления в респираторном тракте [2]. Однако некоторые аспекты эозинофильного воспаления могут быть ассоциированы с активацией лимфоидных клеток 2-го типа врожденного иммунитета (innate lymphoid cells 2 — ILC-2), действующих совместно с базофилами [9]. Кроме того, для некоторых фенотипов БА характерно преимущественно нейтрофильное воспаление, контролируемое подмножеством Th17 хелперных Т-клеток [10–12].
У большинства детей формирование БА связано с Th2-вариантом иммунного ответа, атопией, врожденной склонностью к гиперпродукции общего и специфического IgE, снижением функциональной активности T-reg-клеток (Тh3, Tr1, CD4+, CD25+) и дисбалансом Th1/Th2 [4, 13–16]. Взаимодействие на поверхности тучных клеток и базофилов специфических IgE с причинно-значимыми аллергенами индуцирует высвобождение преформированных и синтезируемых de novo медиаторов, вызывающих развитие острого воспаления бронхов, сопровождающегося миграцией клеток в слизистую оболочку дыхательных путей и формированием клеточного инфильтрата, включающего эозинофилы, базофилы, Th2-лимфоциты с участием макрофагов, моноцитов, дендритных, тучных и эпителиальных клеток, тромбоцитов, нейтрофилов, фибробластов [17]. Выделяемые тучными клетками, эозинофилами, базофилами, Th2-лимфоцитами провоспалительные цитокины способствуют формированию хронического воспаления. Миграция провоспалительных клеток из сосудистого русла в межклеточное пространство происходит под влиянием хемокинов и адгезивных молекул [2].
Персистированию аллергического воспаления в дыхательных путях при БА способствуют длительная экспозиция причинно-значимых аллергенов, наличие у больного высокого индекса атопии, высвобождение нервными клетками воспалительных нейрокинов (субстанции Р, нейрокинов А и В), наслоение вирусной, бактериальной или атипичной (хламидийной, микоплазменной) инфекций [18–22].
Так как астма характеризуется рецидивирующей вариабельной обструкцией дыхательных путей, уровень контроля данного заболевания можно оценить, опираясь на выраженность его симптомов, значения параметров внешнего дыхания, результаты функциональных тестов, отражающих вариабельность проходимости бронхов и бронхиальную гиперреактивность [23, 24]. В связи с тем, что центральное место в патогенезе астмы занимает воспаление дыхательных путей, его мониторинг должен стать составной частью планов ведения пациентов. В настоящее время наиболее изученным биомаркером воспаления при БА является уровень оксида азота и его метаболитов в выдыхаемом воздухе [25–28]. Активно в этой связи изучаются также клеточный состав индуцированной мокроты, компоненты конденсата выдыхаемого воздуха (рН, лейкотриены, альдегиды и другие параметры) [29–35]. Новым аналитическим методом детекции биомаркеров в конденсате выдыхаемого воздуха является метаболомика [36]. Биомаркеры могут быть использованы также для диагностики основных фенотипов и эндотипов астмы. Так, например, уровни Feno, сывороточного периостина, эозинофильного нейротоксина и остеопонтина могут быть использованы для диагностики и мониторирования Th2-зависимого эозинофильного варианта воспаления при БА [37, 38].
Персистирование аллергического воспаления в дыхательных путях лежит в основе неконтролируемого течения БА. Достижение у больного полного контроля над течением астмы является главной целью проводимого лечения при данном заболевании [23]. В связи с тем, что воспаление дыхательных путей — это основное патогенетическое звено, определяющее течение БА, возникает необходимость проведения противовоспалительной терапии в качестве базисного лечения [39]. Для достижения и поддержания контроля над симптомами и течением БА в настоящее время используются следующие группы фармакологических средств: ингаляционные глюкокортикостероиды (ГКС), антагонисты лейкотриеновых рецепторов, кромоны, бета-2-агонисты и теофиллины длительного действия [40, 41]. При тяжелой и резистентной к указанным фармакологическим препаратам астме применяются системные ГКС и анти-IgE-терапия [42]. Кроме того, для патогенетической терапии БА в настоящее время разрабатываются и иные лекарственные препараты — антицитокинового и антимедиаторного действия [43].
Глюкокортикостероиды
Глюкокортикостероиды обладают высоким противовоспалительным и противоаллергическим действием, связанным с их способностью активировать противовоспалительные гены и подавлять многие из провоспалительных генов, которые были инициированы в процессе воспаления (табл. 1). В результате наблюдаются ингибирование синтеза провоспалительных цитокинов, липидных медиаторов (лейкотриенов, простагландинов), торможение участия эозинофилов в развитии аллергического воспаления и экскреции эозинофильных медиаторов [44–46].
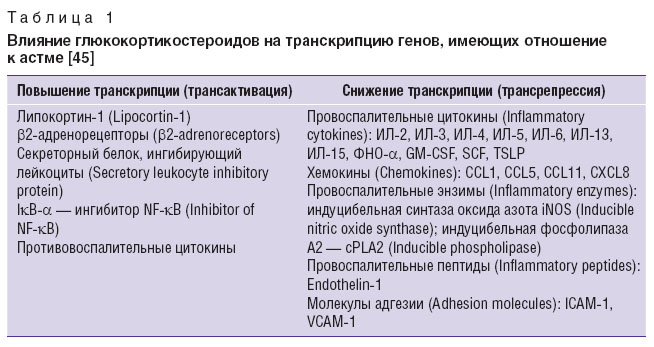 Таблица 1. Влияние глюкокортикостероидов на транскрипцию генов, имеющих отношение к астме [45] Таблица 1. Влияние глюкокортикостероидов на транскрипцию генов, имеющих отношение к астме [45]
|
При БА назначаются прежде всего ингаляционные ГКС, что позволяет нивелировать возникновение системных побочных эффектов, свойственных этим препаратам. В результате лечения ими на 5–7-й день от начала терапии у большинства пациентов с недостаточным уровнем контроля БА отмечается исчезновение бронхообструктивного синдрома. К 3-й неделе лечения наблюдаются нормализация или значительное улучшение функции внешнего дыхания, снижение неспецифической бронхиальной гиперреактивности. Терапия стартовой дозой ингаляционных ГКС проводится, как правило, в течение 3 мес и затем, при отсутствии симптомов, их суточная доза постепенно снижается до поддерживающей, предупреждающей обострение астмы. Поддерживающую дозу больные могут получать в течение нескольких лет. Применение ингаляционных ГКС повышает качество жизни больных БА.
Для проведения базисной противовоспалительной терапии при БА у детей в настоящее время используются следующие ингаляционные ГКС: беклометазона дипропионат, будесонид, циклесонид, флутиказона пропионат, мометазона фуроат. Эти препараты обладают высоким сродством к глюкокортикостероидным рецепторам, способны достигать высоких и длительно сохраняющихся терапевтических концентраций в тканях при местном использовании, быстро инактивируются за счет биотрансформации в печени после системной абсорбции. Наличие высокой местной противовоспалительной активности и низкой системной биодоступности является важным фактором эффективности и безопасности ингаляционных ГКС [45]. В табл. 2 представлены эквипотентные суточные дозы таких препаратов для детей с БА.
 Таблица 2. Эквипотентные суточные дозы ингаляционных глюкокортикостероидов для детей с бронхиальной астмой Таблица 2. Эквипотентные суточные дозы ингаляционных глюкокортикостероидов для детей с бронхиальной астмой
|
Беклометазона дипропионат — ингаляционный ГКС, обладающий значительной противовоспалительной активностью при наличии небольшого системного действия. Более 40 лет используется в терапии БА и продемонстрировал клиническую эффективность и благоприятный профиль безопасности у детей и взрослых с хронической персистирующей астмой [47, 48]. Беклометазона дипропионат представляет собой пролекарство, которое в легких гидролизуется до беклометазона монопропионата, а он в свою очередь гидролизуется до беклометазона. Суточная доза беклометазона дипропионата составляет 200–1200 мкг и вводится в 3–4 приема.
Беклометазона дипропионат является действующей субстанцией в аэрозоли «Кленил с Джет-системой». Джет-система повышает депозицию аэрозоля в легких и снижает отложение его частиц в ротоглотке, что позволяет уменьшить риск развития орофарингеального кандидоза, кашля, осиплости голоса и системное воздействие препарата. Одна ингаляционная доза содержит 200 или 250 мкг беклометазона дипропионата. Детям 6–12 лет назначается по 250 мкг 2 раза в сутки, у детей старше 12 лет при легкой БА суточная доза составляет 200–600 мкг за 2 ингаляции, при астме средней тяжести — 600–1000 мкг за 2–4 ингаляции, при тяжелой астме — 1000–2000 мкг за 2–4 ингаляции [49].
Кленил УДВ представляет собой препарат на основе беклометазона дипропионата для небулайзерной терапии БА, выпускается в виде суспензии в ампулах, содержащих 800 мкг беклометазона дипропионата. Детям старше 6 лет препарат назначается по половине одноразовой ампулы для небулизации в дозе 400 мкг 1–2 раза в день [48].
Будесонид, уже 35 лет использующийся для терапии астмы, является единственным негалогенизированным ингаляционным ГКС. Препарат на 90% метаболизируется в печени и выводится из организма в виде неактивных продуктов обмена. В клетках при взаимодействии будесонида с жирными кислотами образуются комплексы, которые представляют собой внутриклеточные депо препарата [50].
Пульмикорт Турбухалер — это порошок будесонида, доставляемый в бронхи с помощью турбухалера. Одна ингаляционная доза Пульмикорта Турбухалера содержит 200 мкг препарата. Пульмикорт Турбухалер назначают детям старше 7 лет в суточной дозе 400–800 мкг в 2–4 приема.
Для лечения обострений БА у детей широкое применение находит суспензия Пульмикорта на основе будесонида, выпускаемая в небулах (для небулайзерной терапии). Используется также аналог Пульмикорта — Буденит Стери-Неб, дозированная суспензия. Для лечения детей с БА доза Пульмикорта в суспензии подбирается индивидуально, для детей в возрасте 6 мес и старше начальная доза этого препарата составляет 0,25–0,5 мг/сут. При необходимости доза может быть увеличена до 1 мг/сутки.
Бенакорт — отечественный глюкокортикостероидный препарат на основе будесонида. Препарат представляет собой порошок в ингаляторе циклохалер, содержащем 400 доз будесонида. В качестве наполнителя используется бензоат натрия, обладающий противогрибковой активностью [51]. Другой формой Бенакорта является порошок для ингаляций в виде капсул (200 доз). Применяется у детей старше 7 лет в суточной дозе 400–800 мкг в 2–3 приема [52].
Флутиказона пропионат обладает выраженной противовоспалительной активностью [53]. Терапия этим ингаляционным ГКС в течение 6 мес и более дает возможность добиться контроля над БА и достичь клинической ремиссии болезни.
Фликсотид — дозированный аэрозоль для ингаляций, выпускается во флаконах, 60 (120) ингаляционных доз по 125/250 мкг препарата, а также в виде порошка в ротодисках, в которых одна ингаляционная доза препарата может содержать 50, 100, 250 и 500 мкг флутиказона пропионата. В зависимости от тяжести течения БА Фликсотид назначается детям старше 4 лет в суточной дозе 100–500 мкг в 2 приема.
Циклесонид является экстрамелкодисперсным ингаляционным ГКС. Депозиция циклесонида происходит как в центральных, так и в периферических отделах бронхов. По своему механизму действия препарат является пролекарством, которое активируется в эндотелиальных клетках дыхательных путей с образованием активного метаболита дезциклесонида, имеющего в 100 раз большее сродство к глюкокортикостероидным рецепторам по сравнению с циклесонидом. Лечение циклесонидом способствует улучшению контроля БА, препарат обладает высокой клинической эффективностью.
Альвеско выпускается в виде аэрозольных упаковок с содержанием 40, 80 и 160 мкг в 1 ингаляционной дозе. Применяется при БА у детей с шестилетнего возраста. Доза препарата в зависимости от тяжести БА составляет 80–300 мкг [54, 55].
Мометазона фуроат — ГКС, обладающий самой высокой аффинностью к глюкокортикостероидным рецепторам по сравнению с другими ГКС для ингаляционного применения при БА, что наряду с продолжительным периодом полужизни коррелирует с высоким уровнем терапевтической эффективности и безопасности.
Преимуществом Асманекса Твистхейлер является возможность применения препарата 1 раз в день, что способствует повышению приверженности больных лечению. Форма выпуска препарата в разных дозах (200 и 400 мкг) соответствует требованиям, предъявляемым к ступенчатой терапии БА, и позволяет повышать или снижать дозу в соответствии с характеристиками достигаемого контроля астмы [56].
Терапия низкими и средними дозами ингаляционных ГКС сводит к минимуму возможность возникновения системных побочных эффектов. Однако при терапии ингаляционными ГКС следует учитывать рост ребенка и рекомендовать использовать минимальные эффективные дозы препаратов у всех детей с БА [57]. Ингаляционные ГКС являются наиболее эффективными противовоспалительными препаратами, обеспечивающими достижение и поддержание контроля над симптомами и течением большинства случаев БА. Однако встречаются случаи стероидорезистентности, что требует увеличения доз препаратов и сопряжено с повышением риска формирования нежелательных побочных эффектов.
Понимание молекулярных механизмов действия ГКС позволяет детализировать причины формирования глюкокортикостероидной резистентности [58]. В настоящее время установлено, что врожденная стероидорезистентность, связанная с мутациями в генах, кодирующих глюкокортикостероидные рецепторы, встречается при БА очень редко [59, 60]. Чаще наблюдается приобретенная стероидорезистентность, которая при астме обусловлена главным образом модификацией глюкокортикостероидных рецепторов: под влиянием Th2-провоспалительных цитокинов, продуктов нитрозилирующего и оксидативного стресса, микробных и грибковых суперантигенов, а также деградацией их под влиянием протеаз [61]. Проблему стероидорезистентности в настоящее время пытаются решить двояко. С одной стороны, продолжается интенсивное изучение фенотипов и эндотипов БА с целью определения когорт пациентов, у которых патогенетические особенности заболевания обусловливают исходную резистентность к ГКС (например, Th17-опосредованные, преимущественно нейтрофильные варианты воспаления при БА) [62]. С другой стороны, интенсивно разрабатываются подходы к увеличению противовоспалительной активности ГКС, снижению вероятности нежелательных побочных эффектов данных препаратов. Эта работа осуществляется по трем направлениям.
1. Комбинированная терапия — добавление к ингаляционным ГКС второго препарата для того, чтобы преодолеть стероидорезистентность и уменьшить дозы ГКС, необходимые для достижения клинического эффекта. Такими свойствами обладают пролонгированные бета-2-агонисты. В настоящее время в клинической разработке имеются и новые препараты, такие как селективные ингибиторы p38-МАРК (митогенактивированной протеинкиназы) [63]. Ингибитор p38-МАРК оказывает влияние на транскрипцию генов, кодирующих синтез многих провоспалительных цитокинов, включая ФНО-α, ИЛ-4, ИЛ-5, ИЛ-8, RANTES и эотаксин, и тем самым на патогенез астмы. Некоторые проявления стероидорезистентности могут быть нивелированы малыми дозами теофиллина [64]. В качестве перспективных направлений рассматривается и применение антиоксидантов [61].
2. Создание пропрепаратов (по типу циклесонида, превращаемого в легких в его активную форму — С21-де-метилпропионил-циклесонид, что сопровождается низкой орально-глоточной абсорбцией), а также препаратов с высоким сродством к глюкокортикостероидным рецепторам, что позволяет вводить препараты 1 раз в день (циклесонид, флутиказона фуроат, мометазона фуроат) [65].
3. Разработка диссоциированных ГКС, которые оказывали бы различные по силе эффекты на процессы трансрепрессии и трансактивации генов, что позволило бы модулировать и нежелательные побочные эффекты данных препаратов [45].
Фиксированные комбинации ГКС и бета-2-агонистов длительного действия
Одним из способов повышения эффективности ингаляционных ГКС и преодоления стероидорезистентности при БА является использование комбинированной терапии. Наибольшее практическое применение в этой связи получили фиксированные комбинации ГКС и бета-2-агонистов длительного действия: флутиказона пропионат и сальметерола ксинафоат (Серетид, Тевакомб), будесонид и формотерола фумарат (Симбикорт), беклометазона дипропионат и формотерола фумарат (Фостер). Комбинированная терапия сочетаниями препаратов такого рода является более эффективным методом лечения детей с тяжелым и среднетяжелым течением БА по сравнению с изолированным использованием ингаляционных ГКС.
Флутиказона пропионат + сальметерола ксинафоат (оригинальная комбинация — Серетид, GlaxoSmithKline, Великобритания) выпускается в форме порошкового ингалятора — Серетид Мультидиск, каждая доза которого содержит 50 мкг сальметерола ксинафоата и 100, 250 и 500 мкг флутиказона пропионата, и в форме дозированного аэрозольного ингалятора (без фреона), каждая доза которого содержит 25 мкг сальметерола ксинафоата и 50, 125 и 250 мкг флутиказона пропионата. Применяется в режиме стабильного дозирования с четырех лет жизни. Доза Серетида определяется возрастом ребенка и тяжестью БА. Эффективность лечения проявляется уменьшением симптомов и обострений БА, достижением у ряда больных клинической ремиссии. Отмечается хорошая переносимость препарата.
Будесонид + формотерола фумарат (оригинальная комбинация — Симбикорт Турбухалер, Astra Zeneca, Швеция) — препарат для ингаляционного применения у детей с 6 лет жизни. Больным 6–12 лет препарат рекомендован в режиме 80/4,5 мкг/дозу по 1–2 ингаляции 2 раза в сутки, детям 12 лет и старше — 160/4,5 мкг/дозу по 1–2 ингаляции 2 раза в сутки. При терапии Симбикортом Турбухалером возможен гибкий режим дозирования с увеличением дозы в период обострения (до 2 ингаляций 2 раза в сутки) и снижением до поддерживающей дозы (по 1 ингаляции 1 раз в сутки) при стабильном состоянии больных. Наблюдается хорошая переносимость препарата.
Беклометазона дипропионат + формотерола фумарат (оригинальная комбинация — Фостер, Сhiesi, Италия) представляет собой фиксированную комбинацию 100 мкг экстрамелкодисперсного беклометазона дипропионата и 6 мкг формотерола фумарата в разовой дозе в дозированном аэрозольном ингаляторе технологии «Модулит». Препарат применяется у детей старше 12 лет по 1–2 ингаляции 2 раза в день. Лечение способствует уменьшению частоты симптомов БА и количества ее обострений, отмечена хорошая переносимость препарата [66–68].
В последние годы на фармацевтическом рынке появились новые комбинированные препараты (табл. 3).
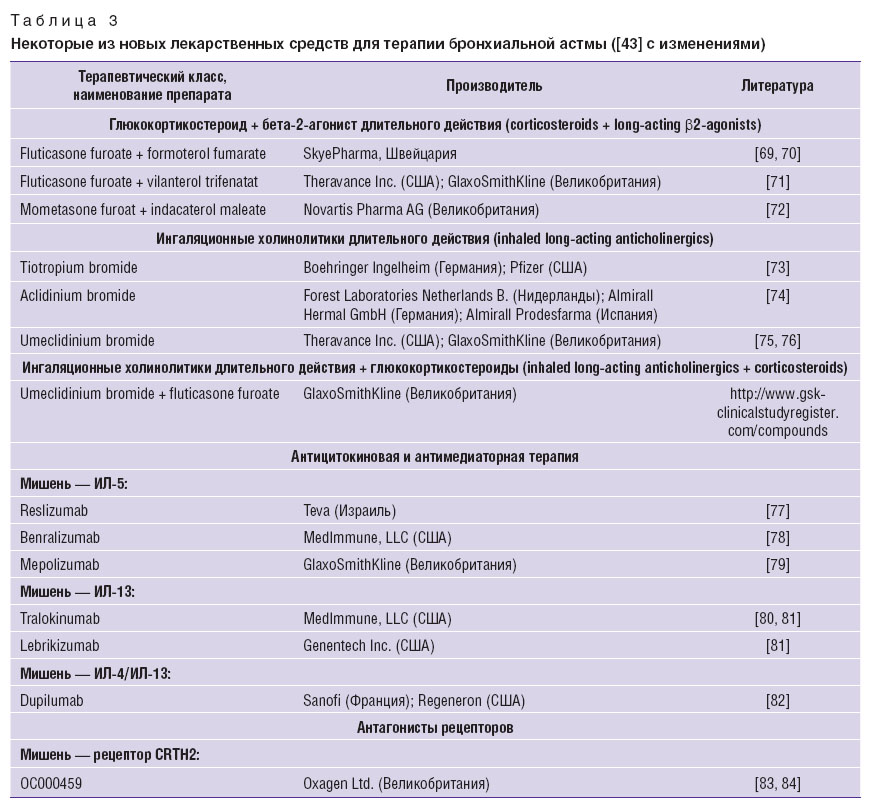 Таблица 3. Некоторые из новых лекарственных средств для терапии бронхиальной астмы ([43] с изменениями) Таблица 3. Некоторые из новых лекарственных средств для терапии бронхиальной астмы ([43] с изменениями)
|
Флутиказона фуроат + вилантерола трифенатат — это комбинация ингаляционного ГКС и бета-2-агониста ультрадлительного действия (оригинальная комбинация — Breo Ellipta, GlaxoSmithKline, Великобритания) с введением один раз в день. Проведены клинические исследования III фазы у подростков в возрасте от 12 лет и старше и у взрослых пациентов с астмой. Эффективность однократного применения 100/25 мкг препарата в день сопоставима с результатами применения 250/50 мкг флутиказона пропионата + сальметерол дважды в день у больных с персистирующей астмой, не контролируемой ингалационными ГКС в средних дозах после 24 нед лечения [71].
Мометазона фуроат+формотерола фумарат — оригинальная комбинация Зенхейл, 3M Health Care Ltd. (США); Organon (Ирландия). В дозировках 100/5 и 200/5 мкг 2 раза в день рекомендован для лечения БА у подростков и взрослых [72].
Флутиказона пропионат + формотерола фумарат — оригинальная комбинация Flutiform, SkyePharma (Швейцария). Продемонстрировано, что в дозе 250/10 мкг обеспечивает более высокую эффективность по сравнению с монотерапией флутиказоном пропионатом для контролирования среднетяжелой и тяжелой БА, с профилем безопасности, аналогичным монотерапии флутиказоном пропионатом [69, 70].
Назначение ингаляционных ГКС и комбинированных препаратов целесообразно прежде всего при персистирующей среднетяжелой или тяжелой БА. Их применение при легкой персистирующей форме астмы эффективно, но не всегда является столь необходимым, поскольку достичь контроля течения можно и нестероидной противовоспалительной терапией (кромоны, антагонисты лейкотриеновых рецепторов).
Предполагают, что в некоторых случаях альтернативой бета-2-агонистам длительного действия при БА могут быть антихолинергические средства длительного действия, в том числе в сочетании с ингаляционными ГКС. Данная идея в настоящее время вызывает большой интерес [85–87]. В этой связи активно изучаются антихолинергические средства длительного действия.
Тиотропия бромид, в том числе в сочетании с ингаляционными ГКС, находится в III фазе клинических исследований возможностей применения для лечения детской и подростковой астмы. У взрослых пациентов с астмой введение в терапию данного препарата было связано со значительным снижением частоты развития обострений [73].
Умеклидиниума бромид находится в настоящее время на этапе II фазы клинических исследований возможности использования для лечения астмы в качестве как монотерапии, так и варианта комбинированного с ингаляционными ГКС лечения [75, 76].
Аклидиниума бромид — проводимые исследования свидетельствуют о бронходилатирующем и противовоспалительном эффекте [74].
Нестероидные противовоспалительные препараты
Антагонисты лейкотриеновых рецепторов имеют широкое применение в лечении БА у детей.
Монтелукаст натрия (Cингуляр, Монтелар, Монтеласт, Синглон) ингибирует цистеиниловые лейкотриеновые рецепторы, применяется у детей с 2 лет. Доза его в 2–5 лет составляет 4 мг в жевательной таблетке, в 6–14 лет — 5 мг в жевательной таблетке 1 раз в сутки, для детей 15 лет и старше — 1 таблетка, покрытая оболочкой, 10 мг в сутки. Этот препарат предупреждает возникновение дневных и ночных симптомов БА, снижает частоту ее обострений при аспириновой, вирусиндуцированной астме и астме физического усилия, уменьшает проявления сопутствующего аллергического ринита, персистирующего и интермиттирующего [88, 89]. Монтелукаст натрия используется в качестве монотерапии для контроля легкой астмы; в комбинации с ингаляционными ГКС может быть эффективным при среднетяжелой и тяжелой астме, позволяя снизить дозу ГКС. Препарат также применяется на этапе отмены или снижения дозы ГКС для сохранения достигнутого контроля БА. Переносимость монтелукаста натрия хорошая, сравнительно редко отмечаются головная боль, тошнота [90].
Теофиллин используется для лечения заболеваний дыхательных путей уже более 100 лет. Первоначально он применялся как бронхолитическое средство, но относительно высокие дозы, необходимые для купирования бронхиальной обструкции данным препаратом, вызывают нежелательные побочные эффекты, поэтому его использование с данной целью сократилось. Однако при более низких концентрациях для теофиллина свойственны противовоспалительные эффекты, обусловленные ингибированием PDE4 и активацией гистондезацетилазы-2, в результате чего происходит выключение активированных воспалительных генов. Благодаря этому механизму теофиллин уменьшает стероидорезистентность, что может иметь особое значение у пациентов с тяжелой астмой. Препараты метилксантинового ряда ингибируют А1-рецепторы к аденозину, вызывая бронходилатирующий эффект, тормозят высвобождение тучными клетками и базофилами медиаторов воспаления, усиливают апоптоз эозинофилов, ингибируя развитие воспаления в дыхательных путях. В настоящее время в терапии БА используются преимущественно небольшие дозы медленно высвобождаемых теофиллинов (Неотеопек А, Теопэк, Вентакс, Теотард, Этифиллин и др.). У детей с БА пролонгированные теофиллины могут быть назначены с противовоспалительной целью в невысоких дозах как компонент базисной терапии в течение 1–2 мес. Терапия дюрантными теофиллинами способствует урежению приступов астмы, повышению толерантности к физической нагрузке, снижению у некоторых больных дозы ингаляционных ГКС. Переносимость теофиллинов в данных дозах у большинства детей хорошая. В единичных случаях отмечаются нарушение сна, тахикардия, тошнота, рвота, головные боли из-за ингибирования фосфодиэстеразы, при более высоких концентрациях наблюдаются сердечные аритмии [64].
У детей с тяжелым течением БА при недостаточной эффективности лечения ингаляционными ГКС и длительного действия бета-2-агонистами дополнительное назначение монтелукаста натрия и дюрантных теофиллинов позволяет повысить эффективность терапии и достичь контроля заболевания.
Рофлумиласт — ингибитор фосфодиэстеразы 4 — одобрен для применения у пациентов с хронической обструктивной болезнью легких. Его потенциальные противовоспалительные эффекты были продемонстрированы в небольшом рандомизированном плацебоконтролируемом клиническом исследовании у пациентов с мягкой аллергической астмой [91].
Кромоны (кромоглициевая кислота и недокромил натрия) способны при экспозиции с причинно-значимым аллергеном предотвращать развитие бронхоспазма, ранней и поздней фазы аллергической реакции, тормозить повышение реактивности бронхов, эффективны преимущественно у детей с легким течением БА [92]. Данная группа препаратов мало влияет на уже развившееся обострение заболевания [93].
Кромогликат натрия выпускается как в виде дозированных аэрозолей, так и в виде 2% раствора по 2 мл для ингаляций через небулайзер. Кратность ингаляций препаратов кромоглициевой кислоты составляет 4 раза в день. Для базисной терапии целесообразно длительное, не менее 3 мес применение препарата. При легкой астме кромогликат натрия используют для профилактики сезонных обострений заболевания и для предупреждения обострений БА при физическом напряжении. Препарат хорошо переносится. Побочные явления редки, проявляются в основном местной реакцией в виде раздражения верхних дыхательных путей, кашля, редко — бронхоспазма [94].
Недокромил натрия (Тайлед) подавляет высвобождение медиаторов воспаления из тучных клеток, эозинофилов, нейтрофилов, моноцитов, макрофагов и тромбоцитов, тормозит развитие бронхоспазма, поздние аллергические реакции, снижает неспецифическую гиперреактивность бронхов и частоту обострений БА. Препарат выпускается в виде дозированного аэрозоля, применяется у детей старше 2 лет по 2 мг (1 ингаляционная доза) 2–4 раза в сутки [93].
Биологические методы терапии бронхиальной астмы
Анти-IgE-терапия. При тяжелом, рефрактерном к традиционной фармакотерапии течении БА эффективной может быть анти-IgE-терапия, основанная на парентеральном введении анти-IgE-антител в виде препарата омализумаб (Ксолар). Омализумаб связывает свободноциркулирующие в крови IgE, снижает продукцию высокоаффинных рецепторов на мембране тучных клеток и базофилов, что приводит к уменьшению экскреции медиаторов, выраженности аллергического воспаления и обратному развитию обострения БА [95–97]. Перед началом лечения рассчитывается индивидуальная доза омализумаба с учетом уровня общего IgE в периферической крови и массы тела ребенка, препарат вводится подкожно. Омализумаб способствует снижению частоты обострений БА, количества госпитализаций и обращений за неотложной помощью, уменьшению объема базисной терапии с достижением в большинстве случаев полного контроля болезни. После начала терапии в отдельных случаях может отмечаться головная боль, а в месте его подкожного введения — возникновение отека, эритемы, зуда. Основным показанием к назначению омализумаба является тяжелая БА у детей 6 лет и старше, рефрактерная к проводимой фармакотерапии [98].
Антицитокиновая терапия. Основываясь на традиционных сведениях о Th2-зависимом генезе астмы и эозинофильном воспалении дыхательных путей при данном заболевании, мишенями антицитокиновой терапии помимо IgE следует рассматривать также интерлейкины ИЛ-5, ИЛ-13, ИЛ-4, ИЛ-9 [99].
Анти-интерлейкин-5-антитела. ИЛ-5 задействован в активации и созревании эозинофилов. Меполизумаб анти-ИЛ-5-антитела — в ходе III фазы клинического исследования DREAM, включавшем пациентов в возрасте 12–74 лет с рецидивирующим тяжелым течением БА и признаками эозинофильного воспаления, продемонстрировал эффективность терапии, в том числе в виде снижения обострений БА на 52% в год [79, 100]. В настоящее время в рамках III этапа клинических исследований проводится изучение антител к рецептору ИЛ-5 (Benralizumab), эффекты истощения эозинофилов наблюдаются в течение нескольких месяцев после одной инъекции данного препарата [78].
Анти-интерлейкин-13-антитела. ИЛ-13 является важным медиатором БА и воспроизводит большинство ее характеристик в экспериментальных моделях, в том числе ремоделирование, гиперпродукцию слизи, синтез IgE, рекрутирование эозинофилов и базофилов [101]. Для оценки эффективности анти-ИЛ-13-терапии используется новый сывороточный биомаркер астмы периостин, который является компонентом внеклеточного матрикса, полученного из эпителиальных клеток дыхательных путей в ответ на воздействие ИЛ-13 и ИЛ-4, высвобождение его подавляется ГКС [102, 103]. Содержание сывороточного периостина позволяет дифференцировать пациентов с «выраженным» и с «невыраженным» Th2-фенотипом БА [12, 104]. Специфические анти-ИЛ-13-антитела — препараты Lebrikizumab, Tralokinumab, Anrukinzumab [80, 81]. Lebrikizumab вводят подкожно один раз в месяц. В рандомизированном многоцентровом исследовании (219 пациентов) препарат был эффективнее у пациентов с исходным более высоким уровнем периостина в сыворотке крови [80, 100, 105].
Анти-интерлейкин-4-антитела. ИЛ-4 участвует в дифференцировке Th2-клеток, переключении на синтез IgE, рекрутировании эозинофилов и тучных клеток. Altrakincept — растворимые рекомбинантные человеческие рецепторы к ИЛ-4, предназначенные для ингаляционной терапии. Данный препарат нейтрализует активацию иммунных и иных клеток, вызываемую ИЛ-4. Однократная ингаляция этого препарата у взрослых с умеренной астмой приводит к улучшению функции легких и снижению уровня выдыхаемого оксида азота [106]. Pitrakinra — антагонист гетеродимерного рецепторного комплекса — ИЛ-4R-ИЛ-13Ра — разработан для преодоления биологической избыточности ИЛ-4 и ИЛ-13, что, возможно, компенсирует неэффективность стратегий, направленных только на учет ИЛ-4 [107]. Pitrakinra ингибирует аллергениндуцированные аллергические реакции и обострение заболевания у взрослых с эозинофильной астмой [108]. AMG 317 является моноклональным антителом, направленным на рецепторы к ИЛ-4, оно блокирует связывание ИЛ-4 с его рецептором, а также ингибирует сигнал трансдукции ИЛ-13. У взрослых с умеренной и тяжелой астмой AMG 317 производит значительное клиническое улучшение только в подгруппе с отсутствием контроля заболевания [109]. Dupilumab — одна из последних разработок анти-ИЛ-4-терапии, воздействует на альфа-субъединицу рецептора ИЛ-4. Его применение у больных с эозинофильной астмой вследствие ингибирования как ИЛ-4 и ИЛ-13 сопровождается значительным сокращением обострений БА и улучшением функции легких у взрослых с персистирующей астмой, отменой бета-агонистов и уменьшением дозы ингаляционных ГКС [82].
OC000459 — оральный антагонист CRTH2 (хемоаттрактант рецептор-гомологичной молекулы Тh2-хелперов). В рандомизированном двойном слепом исследовании (фаза II клинических исследований) у взрослых с умеренной персистирующей астмой применение орального антагониста CRTH2 сопровождалось улучшением функции легких, купированием ночных симптомов и улучшением качества жизни по сравнению с плацебо [83, 84].
MEDI-528 — анти-ИЛ-9-антитела. Применение данного препарата продемонстрировало тенденцию к улучшению показателей контроля у взрослых с легкой и умеренной астмой, а также протективный эффект против бронхоспазма [110].
Возможными мишенями при разработке новых подходов в лечении БА являются молекулы TSLP, ИЛ-25 и ИЛ-33, которые продуцируются эпителиальными клетками дыхательных путей в ответ на воздействие аллергенов или вирусных триггеров, поэтому рассматриваются в качестве возможных мишеней при создании новых подходов в лечении астмы [103, 111].
Терапия, ориентированная на нейтрофильное воспаление. Нейтрофильное воспалениепри БА ассоциировано с интерлейкинами ИЛ-17 и ИЛ-23. Secukinumab — анти-ИЛ-17-антитела — в настоящее время проходит II этап клинических исследований [112].
Следует отметить, что национальные и международные согласительные документы рекомендуют ступенчатый подход для достижения и поддержания контроля БА. Переход на следующую или предыдущую ступень может быть осуществлен через определенное время в зависимости от тяжести БА, на фоне оценки уровня контроля заболевания при регулярном наблюдении врача. Достижению контроля при атопической БА способствует проведение аллергенспецифической иммунотерапии причинно-значимыми аллергенами и снижение их уровня в окружении больного [15, 99, 113–115]. Осуществление мониторинга, выполняемого при БА у детей, включает исследование функций внешнего дыхания и концентрации оксида азота в выдыхаемом воздухе, оценку реактивности бронхов [27, 116]. Достижению и поддержанию контроля астмы способствует реализация образовательных программ для родителей и больных астмой детей. В случае возникновения приступов БА проводится ингаляционная терапия бета-2-агонистами короткого действия или комбинированными препаратами (Беродуал), дозированными ингаляторами или через небулайзер. При тяжелых приступах проводится лечение ингаляционными и системными ГКС (per оs или парентерально). При астматическом статусе эффективна инфузионная терапия Эуфиллином и ГКС.
Заключение. Несмотря на наличие широкого спектра препаратов для базисной противовоспалительной терапии и препаратов для неотложной помощи, сохраняется проблема неконтролируемого или плохо контролируемого течения бронхиальной астмы, что обусловливает потребность в разработке дополнительных диагностических и терапевтических подходов. В этой связи для оптимизации патогенетической терапии бронхиальной астмы в настоящее время проводится работа по совершенствованию противовоспалительных препаратов имеющихся классов и их сочетаний. Кроме того, ведется поиск принципиально новых подходов к терапии астмы, в том числе с учетом фенотипов и эндотипов болезни, включая создание и внедрение в практику лекарственных препаратов антицитокинового и антимедиаторного действия. Есть надежда, что по мере детализации знаний о молекулярных характеристиках эндотипов астмы и внедрения в практику биомаркеров, позволяющих диагностировать фенотипы и эндотипы болезни, а также мониторировать уровень контроля, будет реализован персонализированный подход в назначении индивидуальной терапии каждому конкретному пациенту.
Литература
- Asher M.I. The asthma epidemic — global and time trends of asthma in children. In: Global atlas of asthma. Akdis C.A., Agache I. (editors). EAACI; 2013; p. 7–9.
- Lambrecht B.N., Hammad H. The immunology of asthma. Nat Immunol 2014; 16(1): 45–56, http://dx.doi.org/10.1038/ni.3049.
- Гущин И.С. Аллергенная проницаемость барьерных тканей — стратегическая проблема аллергологии. Пульмонология 2006; 3: 5–13.
- Holgate S.T. Innate and adaptive immune responses in asthma. Nat Med 2012; 18(5): 673–683, http://dx.doi.org/10.1038/nm.2731.
- Esposito S., Tenconi R., Lelii M., Preti V., Nazzari E., Consolo S., Patria M.F. Possible molecular mechanisms linking air pollution and asthma in children. BMC Pulm Med 2014; 14(1): 31, http://dx.doi.org/10.1186/1471-2466-14-31.
- Wenzel S.E. Asthma phenotypes: the evolution from clinical to molecular approaches. Nat Med 2012; 18(5): 716–725, http://dx.doi.org/10.1038/nm.2678.
- Anderson G.P. Endotyping asthma: new insights into key pathogenic mechanisms in a complex, heterogeneous disease. Lancet 2008; 372(9643): 1107–1119, http://dx.doi.org/10.1016/s0140-6736(08)61452-x.
- Leung T.F., Ko F.W.S., Wong G.W.K. Recent advances in asthma biomarker research. Ther Adv Respir Dis 2013; 7(5): 297–308, http://dx.doi.org/10.1177/1753465813496863.
- Li B.W.S., Hendriks R.W. Group 2 innate lymphoid cells in lung inflammation. Immunology 2013; 140(3): 281–287, http://dx.doi.org/10.1111/imm.12153.
- Vroman H., van den Blink B., Kool M. Mode of dendritic cell activation: the decisive hand in Th2/Th17 cell differentiation. Implications in asthma severity? Immunobiology 2015; 220(2): 254–261, http://dx.doi.org/10.1016/j.imbio.2014.09.016.
- Essilfie A.-T., Simpson J.L., Horvat J.C., Preston J.A., Dunkley M.L., Foster P.S., Gibson P.G., Hansbro P.M. Haemophilus influenzae infection drives IL-17-mediated neutrophilic allergic airways disease. PLoS Pathog 2011; 7(10): e1002244, http://dx.doi.org/10.1371/journal.ppat.1002244.
- Woodruff P.G., Modrek B., Choy D.F., Jia G., Abbas A.R., Ellwanger A., Koth L.L., Arron J.R., Fahy J.V. T-helper type 2-driven inflammation defines major subphenotypes of asthma. Am J Respir Crit Care Med 2009; 180(5): 388–395, http://dx.doi.org/10.1164/rccm.200903-0392oc.
- Mantzouranis E., Papadopouli E., Michailidi E. Childhood asthma: recent developments and update. Curr Opin Pulm Med 2014; 20(1): 8–16, http://dx.doi.org/10.1097/mcp.0000000000000014.
- Балаболкин И.И. Бронхиальная астма у детей. М; 2003; 320 с.
- Гущин И.С., Курбачева О.М. Аллергия и аллергенспецифическая иммунотерапия. М; 2010; 228 с.
- Kuipers H., Lambrecht B.N. The interplay of dendritic cells, Th2 cells and regulatory T cells in asthma. Curr Opin Immunol 2004; 16(6): 702–708, http://dx.doi.org/10.1016/j.coi.2004.09.010.
- Kudo M., Ishigatsubo Y., Aoki I. Pathology of asthma. Front Microbiol 2013; 4: 263, http://dx.doi.org/10.3389/fmicb.2013.00263.
- Rowe R.K., Gill M.A. Asthma: the interplay between viral infections and allergic diseases. Immunol Allergy Clin North Am 2015; 35(1): 115–127, http://dx.doi.org/10.1016/j.iac.2014.09.012.
- Aydogan M., Ozen A., Akkoc T., Eifan A.O., Aktas E., Deniz G., Gocmen I., Bahceciler N.N., Barlan I. Risk factors for persistence of asthma in children: 10-year follow-up. J Asthma 2013; 50(9): 938–944, http://dx.doi.org/10.3109/02770903.2013.831872.
- Елисеева Т.И., Балаболкин И.И., Прахов А.В. Структура сенсибилизации к аэроаллергенам у детей с бронхиальной астмой. В кн.: Актуальные вопросы педиатрии, перинатологии и репродуктологии: межвузовский сборник научных трудов. Н. Новгород; 2013; c. 31–38.
- Елисеева Т.И., Большова E.В., Кульгина Ю.С., Конышкина Т.М., Прахов А.В., Новикова Н.А. Антитела к Chlamydophila pneumoniae и Mycoplasma pneumoniae у детей с различным уровнем контроля бронхиальной астмы. Медицинский альманах 2011; 4(17): 235–238.
- Булгакова В.А. Клиническое значение изучения маркеров активации апоптоза иммунокомпетентных клеток при атопической бронхиальной астме у детей. Педиатрия 2009; 87(2): 12–18.
- GINA. Global strategy for asthma management and prevention 2014 (Revision 2014), http://www.ginasthma.org/local/uploads/files/GINA_Report_2014_Aug12.pdf.
- Елисеева Т.И., Балаболкин И.И., Прахов А.В. Вариабельность бронхиальной проходимости при оценке уровня контроля бронхиальной астмы у детей. В кн.: Практические задачи и актуальные вопросы детской аллергологии и иммунологии. М; 2013; с. 19.
- Ritz T., Trueba A.F. Airway nitric oxide and psychological processes in asthma and health: a review. Ann Allergy Asthma Immunol 2014; 112(4): 302–308, http://dx.doi.org/10.1016/j.anai.2013.11.022.
- Turner S. Exhaled nitric oxide in the diagnosis and management of asthma. Curr Opin Allergy Clin Immunol 2008; 8(1): 70–76, http://dx.doi.org/10.1097/aci.0b013e3282f3b4b0.
- Елисеева Т.И., Геппе Н.А., Соодаева С.К. Комплексная оценка уровня контроля над бронхиальной астмой у детей на основе определения содержания метаболитов оксида азота в конденсате выдыхаемого воздуха и спирографических параметров. Пульмонология 2013; 6: 51–56.
- Волкова Л.И., Капитанова Д.В., Боярко В.В., Сапрыкина Э.В. Клеточный состав индуцированной мокроты и оксид азота в конденсате выдыхаемого воздуха при бронхиальной астме. Сибирский медицинский журнал 2007; 4: 17–21.
- Rahman I., Kelly F. Review Biomarkers in breath condensate: a promising new non-invasive technique in free radical research. Free Radic Res 2003; 37(12): 1253–1266, http://dx.doi.org/10.1080/10715760310001623331.
- Corradi M., Zinelli C., Caffarelli C. Exhaled breath biomarkers in asthmatic children. Inflamm Allergy Drug Targets 2007; 6(3): 150–159, http://dx.doi.org/10.2174/187152807781696437.
- Grob N.M., Aytekin M., Dweik R. Biomarkers in exhaled breath condensate: a review of collection, processing and analysis. J Breath Res 2008; 2(3): 1–18, http://dx.doi.org/10.1088/1752-7155/2/3/037004.
- Анаев Э.Х. Исследование РН конденсата выдыхаемого воздуха при воспалительных заболеваниях легких. Пульмонология 2005; 5: 75–79.
- Елисеева Т.И. Новый метод определения Н2О2 в конденсате выдыхаемого воздуха. Аллергология и иммунология в педиатрии 2008; 14(3): 44.
- Елисеева Т.И. Объективизация диагностики уровня контроля бронхиальной астмы у детей с применением рН-метрии конденсата выдыхаемого воздуха. Современные медицинские технологии 2010; 3: 44–47.
- Murugan A., Prys-Picard C., Calhoun W.J. Biomarkers in asthma. Curr Opin Pulm Med 2009; 15(1): 12–18, http://dx.doi.org/10.1097/mcp.0b013e32831de235.
- Luxon B.A. Metabolomics in asthma. Adv Exp Med Biol 2014; 795: 207–220, http://dx.doi.org/10.1007/978-1-4614-8603-9_13.
- Kim M.A., Shin Y.S., Pham le D., Park H.S. Adult asthma biomarkers. Curr Opin Allergy Clin Immunol 2014; 14(1): 49–54, http://dx.doi.org/10.1097/ACI.0000000000000028.
- Lang J.E., Blake K.V. Role of biomarkers in understanding and treating children with asthma: towards personalized care. Pharmgenomics Pers Med 2013; 6: 73–84, http://dx.doi.org/10.2147/pgpm.s30626.
- Балаболкин И.И., Булгакова В.А., Тюменцева Е.С. Терапия бронхиальной астмы у детей: современные подходы к лечению. Медицинский совет 2010; 1–2: 34–39.
- Crompton G. A brief history of inhaled asthma therapy over the last fifty years. Prim Care Respir J 2006; 15(6): 326–331, http://dx.doi.org/10.1016/j.pcrj.2006.09.002.
- Kupczyk M., Dahlén B., Dahlén S.E. Which anti-inflammatory drug should we use in asthma? Pol Arch Med Wewn 2011; 121(12): 455–459.
- Olin J.T., Wechsler M.E. Asthma: pathogenesis and novel drugs for treatment. BMJ 2014; 349: g5517, http://dx.doi.org/10.1136/bmj.g5517.
- Wechsler M.E. Getting control of uncontrolled asthma. Am J Med 2014; 127(11): 1049–1059, http://dx.doi.org/10.1016/j.amjmed.2014.05.006.
- Shahid S.K. Newer glucocorticosteroids and corticosteroid resistance reversal in asthma. Pharm Pat Anal 2013; 2(3): 373–385, http://dx.doi.org/10.4155/ppa.13.14.
- Barnes P.J. Glucocorticosteroids: current and future directions. Br J Pharmacol 2011; 163(1): 29–43, http://dx.doi.org/10.1111/j.1476-5381.2010.01199.x.
- Емельянов А.В. Эффективность и безопасность ингаляционных глюкокортикостероидов. Российский аллергологический журнал 2005; 2: 3–21.
- Brown H.M., Storey G., George W.H.S. Beclomethasone dipropionate: a new steroid aerosol for the treatment of allergic asthma. Br Med J 1972; 1: 585–590, http://dx.doi.org/10.1136/bmj.1.5800.585.
- Nicolini G., Cremonesi G., Melani A.S. Inhaled corticosteroid therapy with nebulized beclometasone dipropionate. Pulm Pharmacol Ther 2010; 23(3): 145–155, http://dx.doi.org/10.1016/j.pupt.2009.11.003.
- Vaghi A., Berg E., Liljedahl S., Svensson J.O. In vitro comparison of nebulised budesonide (Pulmicort Respules) and beclomethasone dipropionate (Clenil per Aerosol). Pulm Pharmacol Ther 2005; 18(2): 151–153, http://dx.doi.org/10.1016/j.pupt.2004.10.004.
- Ellul-Micallef R., Hansson E., Johansson S.A. Budesonide: a new corticosteroid in bronchial asthma. Eur J Respir Dis 1980; 61(3): 167–173.
- Кисляк Л.В., Соколов А.С., Чучалин А.Г. Бенакорт в амбулаторном лечении больных бронхиальной астмой. Пульмонология 2002; 1: 90–94.
- Светлаков В.И. Бенакорт™ — первый отечественный ингаляционный глюкокортикостероид для ингаляций через небулайзер. Пульмонология 2005; 2: 113–116.
- Fabbri L.M., Burge P.S., Croonenborgh L., Warlies F., Weeke B., Ciaccia A., Parker C. Comparison of fluticasone propionate with beclomethasone dipropionate in moderate to severe asthma treated for one year. International Study Group. Thorax 1993; 48(8): 817–823, http://dx.doi.org/10.1136/thx.48.8.817.
- Buczyłko K. Safety and efficacy of inhaled ciclesonide in asthma. Pol Merkur Lekarski 2003; 14(84): 623–626.
- Gelfand E.W., Georgitis J.W., Noonan M., Ruff M.E. Once-daily ciclesonide in children: efficacy and safety in asthma. J Pediatr 2006; 148(3): 377–383, http://dx.doi.org/10.1016/j.jpeds.2005.10.028.
- Milgrom H. Mometasone furoate in children with mild to moderate persistent asthma: a review of the evidence. Paediatr Drugs 2010; 12(4): 213–221, http://dx.doi.org/10.2165/11316220-000000000-00000.
- Pruteanu A.I., Chauhan B.F., Zhang L., Prietsch S.O., Ducharme F.M. Inhaled corticosteroids in children with persistent asthma: dose-response effects on growth. Evid-Based Child Health 2014; 9(4): 931–1046, http://dx.doi.org/10.1002/ebch.1989.
- Barnes P.J., Adcock I.M. Glucocorticoid resistance in inflammatory diseases. Lancet 2009; 373(9678): 1905–1917, http://dx.doi.org/10.1016/s0140-6736(09)60326-3.
- Lamberts S.W. Hereditary glucocorticoid resistance. Ann Endocrinol (Paris) 2001; 62(2): 164–167.
- Quax R.A., Manenschijn L., Koper J.W., Hazes J.M., Lamberts S.W.J., van Rossum E.F.C., Feelders R.A. Glucocorticoid sensitivity in health and disease. Nat Rev Endocrinol 2013; 9(11): 670–686, http://dx.doi.org/10.1038/nrendo.2013.183.
- Barnes P.J. Corticosteroid resistance in patients with asthma and chronic obstructive pulmonary disease. J Allergy Clin Immunol 2013; 131(3): 636–645, http://dx.doi.org/10.1016/j.jaci.2012.12.1564.
- Al-Ramli W., Hamid Q. Th-17 cell-related cytokines’ potential role in the pathogenesis of severe asthma. J Asthma 2008; 45(s1): 41–44, http://dx.doi.org/10.1080/02770900802594759.
- Duan W., Wong W.S. Targeting mitogen-activated protein kinases for asthma. Curr Drug Targets 2006; 7(6): 691–698, http://dx.doi.org/10.2174/138945006777435353.
- Barnes P.J. Theophylline. Am J Respir Crit Care Med 2013; 188(8): 901–906, http://dx.doi.org/10.1164/rccm.201302-0388pp.
- Allen A., Bareille P.J., Rousell V.M. Fluticasone furoate, a novel inhaled corticosteroid, demonstrates prolonged lung absorption kinetics in man compared with inhaled fluticasone propionate. Clin Pharmacokinet 2013; 52(1): 37–42, http://dx.doi.org/10.1007/s40262-012-0021-x.
- Ильина Н.И., Павлова К.С. Эффективность и безопасность препарата Фостер у больных бронхиальной астмой в реальной клинической практике. Российский аллергологический журнал 2010; 5: 82–90.
- Papi A. Inhaled BDP/formoterol extra-fine combination. Evidence and future perspectives. Pneumologie 2009; 63(S 02): S102–S106, http://dx.doi.org/10.1055/s-0029-1214716.
- Papi A., Paggiaro P., Nicolini G., Vignola A.M., Fabbri L.M. Beclomethasone/formoterol vs fluticasone/salmeterol inhaled combination in moderate to severe asthma. Allergy 2007; 62(10): 1182–1188, http://dx.doi.org/10.1111/j.1398-9995.2007.01493.x.
- Pertseva T., Dissanayake S., Kaiser K. Superiority of fluticasone propionate/formoterol fumarate versus fluticasone propionate alone in patients with moderate-to-severe asthma: a randomised controlled trial. Current Curr Med Res Opin 2013; 29(10): 1357–1369, http://dx.doi.org/10.1185/03007995.2013.825592.
- Tan R.A., Corren J. Clinical utility and development of the fluticasone/formoterol combination formulation (Flutiform®) for the treatment of asthma. Drug Des Devel Ther 2014; 8: 1555–1561, http://dx.doi.org/10.2147/dddt.s36556.
- Woodcock A., Bleecker E.R., Lötvall J., O’Byrne P.M., Bateman E.D., Medley H., Ellsworth A., Jacques L., Busse W.W. Efficacy and safety of fluticasone furoate/vilanterol compared with fluticasone propionate/salmeterol combination in adult and adolescent patients with persistent asthma: a randomized trial. Chest 2013; 144(4): 1222–1229, http://dx.doi.org/10.1378/chest.13-0178.
- Berger W.E., Bensch G.W., Weinstein S.F., Skoner D.P., Prenner B.M., Shekar T., Nolte H., Teper A.A. Bronchodilation with mometasone furoate/formoterol fumarate administered by metered-dose inhaler with and without a spacer in children with persistent asthma. Pediatr Pulmonol 2014; 49(5): 441–450, http://dx.doi.org/10.1002/ppul.22850.
- Price D., Kaplan A., Jones R., Freeman D., Burden A., Gould S., von Ziegenweidt J., Ali M., King C., Thomas M. Long-acting muscarinic antagonist use in adults with asthma: real-life prescribing and outcomes of add-on therapy with tiotropium bromide. J Asthma Allergy 2015; 8: 1–13, http://dx.doi.org/10.2147/JAA.S76639.
- Price D., Fromer L., Kaplan A., van der Molen T., Román-Rodríguez M. Is there a rationale and role for long-acting anticholinergic bronchodilators in asthma? NPJ Prim Care Respir Med 2014; 24: 14023, http://dx.doi.org/10.1038/npjpcrm.2014.23.
- Spina D. Current and novel bronchodilators in respiratory disease. Curr Opin Pulm Med 2014; 20(1): 73–86, http://dx.doi.org/10.1097/mcp.0000000000000012.
- Prakash A., Babu K.S., Morjaria J.B. Profile of inhaled glycopyrronium bromide as monotherapy and in fixed-dose combination with indacaterol maleate for the treatment of COPD. Int J Chron Obstruct Pulmon Dis 2015; 10(1): 111–123, http://dx.doi.org/10.2147/copd.s67758.
- Lim H., Nair P. Efficacy and safety of reslizumab in patients with moderate to severe eosinophilic asthma. Expert Rev Respir Med 2015; 9(2): 135–142, http://dx.doi.org/10.1586/17476348.2015.1000867.
- Laviolette M., Gossage D.L., Gauvreau G., Leigh R., Olivenstein R., Katial R., Busse W.W., Wenzel S., Wu Y., Datta V., Kolbeck R., Molfino N.A. Effects of benralizumab on airway eosinophils in asthmatic patients with sputum eosinophilia. J Allergy Clin Immunol 2013; 132(5): 1086–1096, http://dx.doi.org/10.1016/j.jaci.2013.05.020.
- Ortega H.G., Liu M.C., Pavord I.D., Brusselle G.G., FitzGerald J.M., Chetta A., Humbert M., Katz L.E., Keene O.N., Yancey S.W., Chanez P.; MENSA Investigators. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014; 371(13): 1198–1207, http://dx.doi.org/10.1056/nejmoa1403290.
- Corren J., Lemanske R.F., Hanania N.A., Korenblat P.E., Parsey M.V., Arron J.R., Harris J.M., Scheerens H., Wu L.C., Su Z., Mosesova S., Eisner MD, Bohen S.P., Matthews J.G. Lebrikizumab treatment in adults with asthma. N Engl J Med 2011; 365(12): 1088–1098, http://dx.doi.org/10.1056/NEJMoa1106469.
- Antohe I., Croitoru R., Antoniu S. Tralokinumab for uncontrolled asthma. Expert Opin Biol Ther 2013; 13(2): 323–326, http://dx.doi.org/10.1517/14712598.2012.748740.
- Wenzel S., Ford L., Pearlman D., Spector S., Sher L., Skobieranda F., Wang L., Kirkesseli S., Rocklin R., Bock B., Hamilton J., Ming J.E., Radin A., Stahl N., Yancopoulos G.D., Graham N., Pirozzi G. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med 2013; 368(26): 2455–2466, http://dx.doi.org/10.1056/nejmoa1304048.
- Barnes N., Pavord I., Chuchalin A., Bell J., Hunter M., Lewis T., Parker D., Payton M., Collins L.P., Pettipher R., Steiner J., Perkins C.M. A randomized, double-blind, placebo-controlled study of the CRTH2 antagonist OC000459 in moderate persistent asthma. Clin Exp Allergy 2012; 42(1): 38–48, http://dx.doi.org/10.1111/j.1365-2222.2011.03813.x.
- Pettipher R., Hunter M.G., Perkins C.M., Collins L.P., Lewis T., Baillet M., Steiner J., Bell J., Payton M.A. Heightened response of eosinophilic asthmatic patients to the CRTH2 antagonist OC000459. Allergy 2014; 69(9): 1223–1232, http://dx.doi.org/10.1111/all.12451.
- Bateman E.D., Kornmann O., Schmidt P., Pivovarova A., Engel M., Fabbri L.M. Tiotropium is noninferior to salmeterol in maintaining improved lung function in B16-Arg/Arg patients with asthma. J Allergy Clin Immunol 2011; 128(2): 315–322, http://dx.doi.org/10.1016/j.jaci.2011.06.004.
- Kerstjens H.A.M., Disse B., Schröder-Babo W., Bantje T.A., Gahlemann M., Sigmund R., Engel M., van Noord J.A. Tiotropium improves lung function in patients with severe uncontrolled asthma: a randomized controlled trial. J Allergy Clin Immunol 2011; 128(2): 308–314, http://dx.doi.org/10.1016/j.jaci.2011.04.039.
- Kerstjens H.A.M., Engel M., Dahl R., Paggiaro P., Beck E., Vandewalker M., Sigmund R., Seibold W., Moroni-Zentgraf P., Bateman E.D. Tiotropium in asthma poorly controlled with standard combination therapy. N Engl J Med 2012 Sep 27; 367(13): 1198–11207, http://dx.doi.org/10.1056/nejmoa1208606.
- Балаболкин И.И., Смирнов И.Е., Ляпунов А.А., Лукина Ф., Горюнов А.В., Гончарова Н.В., Реутова В.С. Эффективность лечения монтелукастом детей с бронхиальной астмой. Вопросы современной педиатрии 2006; 5(5): 35–39.
- Ciółkowski J., Mazurek H., Stasiowska B. Evaluation of step-down therapy from an inhaled steroid to montelukast in childhood asthma. Allergol Immunopathol (Madr) 2014; 42(4): 282–228, http://dx.doi.org/10.1016/j.aller.2013.01.005.
- Bush A. Montelukast in paediatric asthma: where we are now and what still needs to be done? Paediatr Respir Rev 2015; 16(2): 97–100, http://dx.doi.org/10.1016/j.prrv.2014.10.007.
- Gauvreau G.M., Boulet L.-P., Schmid-Wirlitsch C., Côté J., Duong M., Killian K.J., Milot J., Deschesnes F., Strinich T., Watson R.M., Bredenbröker D., O’Byrne P.M. Roflumilast attenuates allergen-induced inflammation in mild asthmatic subjects. Respir Res 2011; 12(1): 140, http://dx.doi.org/10.1186/1465-9921-12-140.
- Геппе Н.А., Озерская И.В. Роль кромонов в лечении бронхиальной астмы и аллергического ринита у детей. Атмосфера. Пульмонология и аллергология 2009; 1: 11–14.
- Howrylak J.A., Fuhlbrigge A.L., Strunk R.C., Zeiger R.S., Weiss S.T., Raby B.A. Classification of childhood asthma phenotypes and long-term clinical responses to inhaled anti-inflammatory medications. J Allergy Clin Immunol 2014; 133(5): 1286–1300, http://dx.doi.org/10.1016/j.jaci.2014.02.006.
- Netzer N.C., Küpper T., Voss H.W., Eliasson A.H. The actual role of sodium cromoglycate in the treatment of asthma: a critical review. Sleep Breath 2012; 16(4): 1027–1032, http://dx.doi.org/10.1007/s11325-011-0639-1.
- Вишнева Е.А., Намазова-Баранова Л.С., Алексеева А.А., Эфендиева К.Е., Левина Ю.Г., Вознесенская Н.И., Томилова А.Ю., Селимзянова Л.Р., Промыслова Е.А. Детская астма: ключевые принципы достижения контроля на современном этапе. Педиатрическая фармакология 2013; 10(4): 60–72.
- Цыпленкова С.Э., Мизерницкий Ю.Л., Соколова Л.В., Сорокина Е.В. Новые возможности контроля эффективности анти-IgE-терапии при тяжелой бронхиальной астме у детей. Российский вестник перинатологии и педиатрии 2012; 3: 47–52.
- Hanania N.A., Alpan O., Hamilos D.L., Condemi J.J., Reyes-Rivera I., Zhu J., Rosen K.E., Eisner MD, Wong D.A., Busse W. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial. Ann Intern Med 2011; 154(9): 573–582, http://dx.doi.org/10.7326/0003-4819-154-9-201105030-00002.
- Giovannini-Chami L., Albertini M., Scheinmann P., de Blic J. New insights into the treatment of severe asthma in children. Paediatr Respir Rev 2014, http://dx.doi.org/10.1016/j.prrv.2014.07.006.
- Pajno G.B., Nadeau K.C., Passalacqua G., Caminiti L., Hobson B., Jay D.C., Arasi S., Chiera F., Salzano G. The evolution of allergen and non-specific immunotherapy: past achievements, current applications and future outlook. Expert Review of Clinical Immunology 2015; 11(1): 141–154, http://dx.doi.org/10.1586/1744666X.2015.977260.
- Pavord I.D., Korn S., Howarth P., Bleecker E.R., Buhl R., Keene O.N., Ortega H., Chanez P. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet 2012; 380(9842): 651–659, http://dx.doi.org/10.1016/s0140-6736(12)60988-x.
- Grunig G., Warnock M., Wakil A.E., Venkayya R., Brombacher F., Rennick D.M., Sheppard D., Mohrs M., Donaldson D.D., Locksley R.M., Corry D.B. Requirement for IL-13 independently of IL-4 in experimental asthma. Science 1998; 282(5397): 2261–2263, http://dx.doi.org/10.1126/science.282.5397.2261.
- Sidhu S.S., Yuan S., Innes A.L., Kerr S., Woodruff P.G., Hou L., Muller S.J., Fahy J.V. Roles of epithelial cell-derived periostin in TGF-beta activation, collagen production, and collagen gel elasticity in asthma. Proc Natl Acad Sci USA 2010; 107(32): 14170–1475, http://dx.doi.org/10.1073/pnas.1009426107.
- Masuoka M., Shiraishi H., Ohta S., Suzuki S., Arima K., Aoki S., Toda S., Inagaki N., Kurihara Y., Hayashida S., Takeuchi S., Koike K., Ono J., Noshiro H., Furue M., Conway S.J., Narisawa Y., Izuhara K. Periostin promotes chronic allergic inflammation in response to Th2 cytokines. J Clin Invest 2012; 122(7): 2590–2600, http://dx.doi.org/10.1172/JCI58978.
- Giovannini-Chami L., Marcet B., Moreilhon C., Chevalier B., Illie M.I., Lebrigand K., Robbe-Sermesant K., Bourrier T., Michiels J.F., Mari B., Crénesse D., Hofman P., de Blic J., Castillo L., Albertini M., Barbry P. Distinct epithelial gene expression phenotypes in childhood respiratory allergy. Eur Respir J 2012; 39(5): 1197–1205, http://dx.doi.org/10.1183/09031936.00070511.
- Castro M., Mathur S., Hargreave F., Boulet L.P., Xie F., Young J., Wilkins H.J., Henkel T., Nair P.; Res-5-0010 Study Group. Reslizumab for poorly controlled, eosinophilic asthma: a randomized, placebo-controlled study. Am J Respir Crit Care Med 2011; 184(10): 1125–1132, http://dx.doi.org/10.1164/rccm.201103-0396oc.
- Borish L.C., Nelson H.S., Lanz M.J., Claussen L., Whitmore J.B., Agosti J.M., Garrison L. Interleukin-4 receptor in moderate atopic asthma. A phase I/II randomized, placebo-controlled trial. Am J Respir Crit Care Med 1999; 160(6): 1816–1823, http://dx.doi.org/10.1164/ajrccm.160.6.9808146.
- Getz E.B., Fisher D.M., Fuller R. Human pharmacokinetics/pharmacodynamics of an interleukin-4 and interleukin-13 dual antagonist in asthma. J Clin Pharmacol 2009; 49(9): 1025–1036, http://dx.doi.org/10.1177/0091270009341183.
- Wenzel S., Wilbraham D., Fuller R., Getz E.B., Longphre M. Effect of an interleukin-4 variant on late phase asthmatic response to allergen challenge in asthmatic patients: results of two phase 2a studies. Lancet 2007; 370(9596): 1422–1431, http://dx.doi.org/10.1016/s0140-6736(07)61600-6.
- Corren J., Busse W., Meltzer E.O., Mansfield L., Bensch G., Fahrenholz J., Wenzel S.E., Chon Y., Dunn M., Weng H.H., Lin S.L. A randomized, controlled, phase 2 study of AMG 317, an IL-4Ralpha antagonist, in patients with asthma. Am J Respir Crit Care Med 2010; 181(8): 788–796, http://dx.doi.org/10.1164/rccm.200909-1448oc.
- Parker J.M., Oh C.K., LaForce C., Miller S.D., Pearlman D.S., Le C., Robbie G.J., White W.I., White B., Molfino N.A.; MEDI-528 Clinical Trials Group. Safety profile and clinical activity of multiple subcutaneous doses of MEDI-528, a humanized anti-interleukin-9 monoclonal antibody, in two randomized phase 2a studies in subjects with asthma. BMC Pulm Med 2011; 11: 14, http://dx.doi.org/10.1186/1471-2466-11-14.
- Gauvreau G.M., O’Byrne P.M., Boulet L.P., Wang Y., Cockcroft D., Bigler J., FitzGerald J.M., Boedigheimer M., Davis B.E., Dias C., Gorski K.S., Smith L., Bautista E., Comeau M.R., Leigh R., Parnes J.R. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med 2014; 2102–2110, http://dx.doi.org/10.1056/nejmoa1402895.
- Reichert J.M. Antibodies to watch in 2015. MAbs 2015; 7(1): 1–8, http://dx.doi.org/10.4161/19420862.2015.988944.
- Демко И.В., Собко Е.А., Ищенко О.П. Клиническая эффективность специфической иммунотерапии при бронхиальной астме. Сибирское медицинское обозрение 2010; 62(2): 72–76.
- Балаболкин И.И., Рылеева И.В., Юхтина Н.В., Ксензова Л.Д., Капустина Е.Ю. Аллергенспецифическая иммунотерапия у детей с аллергическими заболеваниями и возможности повышения ее эффективности. Педиатрия 2006; 2: 81–85.
- Балаболкин И.И., Булгакова В.А., Седова М.С., Сенцова Т.Б. Аллергенспецифическая иммунотерапия у детей с бронхиальной астмой и частыми острыми респираторными инфекциями. Аллергология и иммунология 2007; 8: 116.
- Елисеева Т.И., Князева Е.В., Бочкова Ю.С., Кононова С.В., Геппе Н.А., Балаболкин И.И. Спирографические параметры и их изменение в тестах на вариабельность бронхиальной проходимости при оценке уровня контроля бронхиальной астмы у детей. Современные технологии в медицине 2013; 5(4): 94–101.










