Нейромодуляция в терапии медикаментозно-резистентного болевого синдрома у пациентов с болезнью оперированного позвоночника
Цель исследования — оценить возможности процедуры стимуляции спинного мозга и сравнить ее эффективность с традиционным консервативным лечением при синдроме оперированного позвоночника.
Материалы и методы. В исследование включали пациентов, имевших в анамнезе не менее одной из анатомически успешных операций по удалению грыжи межпозвонкового диска поясничного отдела позвоночника и коррекции посттравматической деформации позвоночника, при этом продолжавших испытывать нейропатическую боль.
Пациентам 1-й, основной, группы (n=45) помимо традиционного лечения выполняли стимуляцию спинного мозга. Пациенты 2-й группы, сравнения (n=35), принимали медикаменты, получали лечебные блокады, физиотерапию, психотерапию.
Результаты. Использование эпидуральной стимуляции спинного мозга в лечении хронического болевого синдрома позволило значительно улучшить состояние больных: снизить уровень боли, увеличить функциональные возможности и улучшить качество жизни.
Заключение. Нейромодуляция, являясь малоинвазивной терапией, позволяет добиться хороших результатов лечения болезни оперированного позвоночника при высокой безопасности метода.
Первая операция по стимуляции спинного мозга при медикаментозно-резистентном болевом синдроме была проведена 47 лет назад Норманом Шелли пациенту в терминальной стадии рака [1]. Стимуляция подразумевает помещение в эпидуральное пространство электрода, который соединен с имплантируемым нейростимулятором, создающим электрическое поле над структурами спинного мозга. Многоконтактные электроды для создания электрического поля размещают над задними столбами спинного мозга, а программируемое устройство позволяет пациенту самостоятельно контролировать параметры процедуры при помощи пульта [2].
С 1967 г. было сделано более 200 тыс. операций по имплантации нейростимуляторов, сейчас ежегодно в мире по разным показаниям имплантируют более 25 тыс. стимуляторов [3]. Технологический прорыв в применении нейромодуляции при новых показаниях был совершен в последнее десятилетие.
Аксиальный болевой синдром каждый год является причиной операций на позвоночнике более чем у 1 млн. человек. К сожалению, 40% хирургических вмешательств не достигают желаемого результата, и пациенты после операции продолжают испытывать хроническую боль [4]. Части таких больных ставят диагноз «синдром оперированного позвоночника», для которого характерна боль в ногах, ягодицах или в пояснице [5]. Название этого синдрома по-английски звучит как failed back surgery syndrome (FBSS), что дословно переводят как «cиндром неудавшейся операции», несправедливо оценивая труд хирургов. Операция по коррекции патологии позвоночника может пройти успешно, в то время как долгосрочного противоболевого эффекта достичь не удается, что, по нашему мнению, исчерпывающе объясняет теория академика Г.Н. Крыжановского о возникновении патологической алгической системы [6]. Пациенты с хронической болью, возникшей после множественных спинальных операций, страдают от депрессии, нарушений сна, ухудшения функциональных возможностей и других сопутствующих расстройств, что часто приводит к потере работы, снижению социальной активности и коммуникации. Традиционно при лечении FBSS применяют консервативную терапию: медикаментозную, в том числе лечебные блокады и эпидуральные инъекции стероидов, физиопроцедуры, однако большинство пациентов не отвечают на данные виды терапии, в связи с чем синдром оперированного позвоночника — самое актуальное показание для проведения операции по нейростимуляции [5, 7].
Цель исследования — оценить возможности процедуры стимуляции спинного мозга и сравнить ее эффективность с традиционным консервативным лечением при синдроме оперированного позвоночника.
Материалы и методы. В исследование включали пациентов, имевших в анамнезе не менее одной из анатомически успешных операций по удалению грыжи межпозвонкового диска поясничного отдела позвоночника, коррекции поясничного стеноза, спондилолистеза, посттравматической деформации позвоночника, при этом продолжавших испытывать нейропатическую боль, больше в ногах, чем в спине, в зоне дерматомов L4, L5, S1, без отрицательной динамики неврологического дефицита. Условием исследования являлось наличие боли интенсивностью не менее 50 мм по визуально-аналоговой шкале, где 0 — отсутствие боли, 100 мм — самая сильная боль [8].
Наличие неустраненной компрессии нервных структур, ноцицептивной боли, психиатрических или поведенческих расстройств, неиспользованные резервы медикаментозного лечения служили критериями исключения.
В исследовании приняли участие 80 пациентов в возрасте 16–76 лет (средний возраст 44 года) и сроком страдания 2–30 лет (средний возраст — 7,5 года). Пациенты были рандомизированы по двум группам, сопоставимым по полу, возрасту и выраженности клинической симптоматики. Пациентам 1-й, основной, группы (n=45) помимо традиционного лечения выполняли стимуляцию спинного мозга. Пациенты 2-й группы, сравнения (n=35), принимали медикаменты (нестероидные противовоспалительные средства, антидепрессанты, антиконвульсанты), получали лечебные блокады, физиотерапию, психотерапию. Пациентам 1-й группы проводили операцию по имплантации эпидурального электрода и генератора импульсов «Медтроник» для стимуляции спинного мозга в том случае, если во время тестового периода отмечали не менее 80% перекрытия зоны боли парестезиями и как минимум вдвое снижалась интенсивность боли. Пациентов оперировали в нейрохирургическом отделении Приволжского федерального медицинского исследовательского центра Минздрава России в 2012–2014 гг.
Исследование проведено в соответствии с Хельсинкской декларацией (принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия)) и одобрено Этическим комитетом Приволжского федерального медицинского исследовательского центра Минздрава России. От каждого пациента получено информированное согласие.
Процедура эпидуральной электрической стимуляции спинного мозга предполагала чрескожную имплантацию под местной анестезией и рентгенологическим контролем 4- или 8-контактного тестового электрода (рис. 1), размещение его по физиологической средней линии спинного мозга (рис. 2) с последующей активацией положительного и отрицательного контактов путем последовательного перемещения электрического диполя по длине электрода. При наращивании амплитуды стимуляции добивались получения комфортной парестезии, покрывающей зону указанной пациентом боли. Если не удавалось добиться соответствующих по локализации и обезболивающему эффекту ощущений, меняли положение электрода. Оптимальным считали расположение верхнего контакта электрода на уровне ThIX–X позвонка. Уменьшение боли на 50% от исходной за период тестовой стимуляции (3–10 дней) принимали за достаточный критерий для имплантации постоянного электрода и генератора импульсов.
 Рис. 1. Чрескожная имплантация электродов под контролем С-дуги Рис. 1. Чрескожная имплантация электродов под контролем С-дуги
|
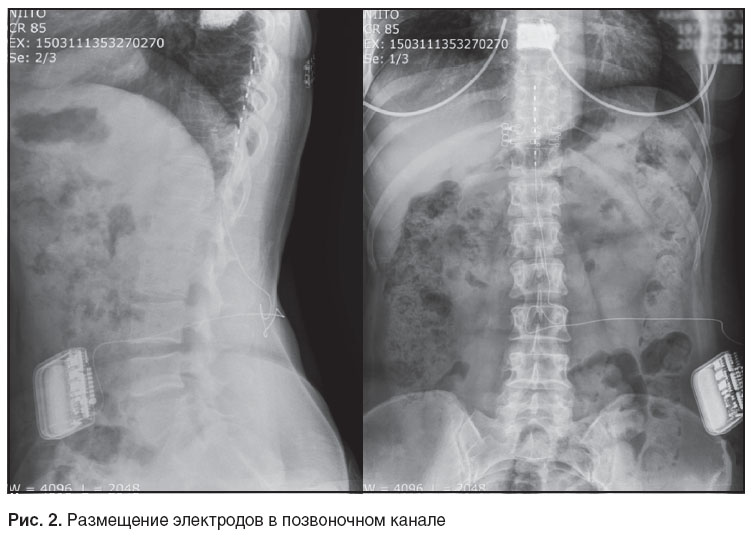 Рис. 2. Размещение электродов в позвоночном канале Рис. 2. Размещение электродов в позвоночном канале
|
Процедуру считали эффективной, если через 6 мес после операции интенсивность боли в ноге оставалась сниженной на 50% от начальной. Пациенты оценивали интенсивность боли по визуальной аналоговой шкале. Для оценки нарушения жизнедеятельности, обусловленной болевым синдромом, использовали опросник Oswestry — Освестровский опросник нарушения жизнедеятельности при боли в нижней части спины [8].
Статистическую обработку результатов исследования проводили с помощью компьютерной программы Statistica 10.0. При условии, что распределение изучаемых параметров не отличалось от нормального, применяли параметрические методы — вычисляли медиану и интерквартильный размах (Ме [25%; 75%]). Проверку гипотезы о динамике количественных показателей в процессе наблюдения проводили с помощью критерия Вилкоксона. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Результаты. Из 45 пациентов, составивших 1-ю группу, у пяти не было получено эффекта при проведении тестовой стимуляции, таким образом, имплантацию постоянного электрода и генератора импульсов выполняли только 40 пациентам. Оценку результатов проводили через 2 нед и 6 мес после имплантации электродов.
Через 2 нед с начала лечения 27 пациентов из 1-й группы (67,5%) и 5 (14,3%) из группы сравнения отметили регресс болевого синдрома не менее чем на 50% (p<0,001).
Через полгода использования нейромодуляции у пациентов из 1-й группы выраженность боли в ноге и спине была ниже, удовлетворенность лечением — выше, чем в группе сравнения (p=0,001). В частности, регресс боли по визуальной аналоговой шкале составил с 7,9 [10,0; 5,0] до 5,1 [6,0; 2,0] в 1-й группе и с 8,0 [10,0; 5,0] до 6,9 [10,0; 5,0] — в группе сравнения. 32 пациента (80%) из 1-й группы были удовлетворены степенью снижения боли, тогда как в группе сравнения — только 7 (20%). Кроме того, 4 пациента из 1-й группы прекратили прием полунаркотических анальгетиков (трамадола) и 6 — противосудорожных средств (габапентина). Качество повседневной жизни на фоне уменьшения болевого синдрома (опросник Oswestry) через полгода наблюдения было статистически значимо лучше (p=0,017) у пациентов из 1-й группы: сумма баллов по 10 пунктам опросника сократилась с 31 [14; 40] до 17 [8; 26]. В группе сравнения динамика восстановления повседневной жизнедеятельности была менее значима: с 32 [16; 39] до 26 [14; 38] баллов. Таким образом, результаты исследования говорят в пользу применения процедуры стимуляции спинного мозга у пациентов с болезнью оперированного позвоночника: 80% из них и лишь 20% пациентов из группы с традиционным консервативным лечением достигают 50% снижения интенсивности боли.
В процессе наблюдения было отмечено 8 осложнений, связанных с использованными устройствами. Инфицирование/загноение раны случилось у 4 пациентов, миграция электрода, которая потребовала повторной операции — перепроведения электрода (рис. 3), — у 4 пациентов. Следует отметить, что эти осложнения признаны наиболее распространенными при операциях по имплантации нейростимуляторов [9].
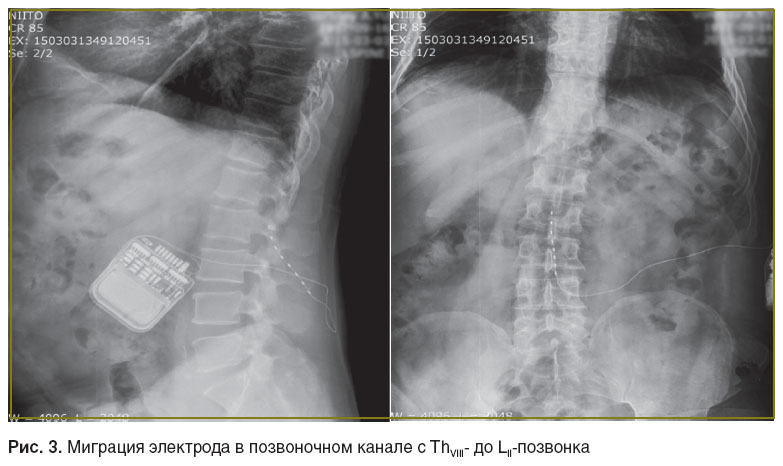 Рис. 3. Миграция электрода в позвоночном канале с ThVIII- до LII-позвонка Рис. 3. Миграция электрода в позвоночном канале с ThVIII- до LII-позвонка
|
Заключение. У пациентов с нейропатической болью при синдроме оперированного позвоночника стимуляция спинного мозга в сравнении с обычными методами лечения значительно снижает интенсивность боли, повышает функциональные возможности, активность в повседневной жизни, а также уровень удовлетворенности лечением.
Финансирование исследования. Исследование не финансировалось какими-либо источниками.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Shealy C.N., Mortimer J.T., Reswick J.B. Electrical inhibition of pain by stimulation of the dorsal columns: preliminary clinical report. Anesth Analg 1967; 46(4): 489–491, http://dx.doi.org/10.1213/00000539-196707000-00025.
- Molnar G., Barolat G. Principles of cord activation during spinal cord stimulation. Neuromodulation 2014; 17(Suppl S1): 12–21, http://dx.doi.org/10.1111/ner.12171.
- Kreis P., Fishman S. Spinal cord stimulation percutaneous implantation techniques. New York: Oxford University Press; 2009.
- Морозов И.Н. Восстановительное лечение больных после оперативного удаления грыж межпозвонковых дисков поясничного отдела позвоночника. Автореф. дис. … канд. мед. наук. Н. Новгород; 2001.
- Schu S., Slotty P.J., Bara G., von Knop M., Edgar D., Vesper J. A prospective, randomized, double-blind, placebo-controlled study to examine the effectiveness of burst spinal cord stimulation patterns for the treatment of failed back surgery syndrome. Neuromodulation 2014; 17(5): 443–450, http://dx.doi.org/10.1111/ner.12197.
- Крыжановский Г.Н. Детерминантные структуры в патологии нервной системы: генераторные механизмы нейропатологических синдромов. М: Медицина; 1980; 360 с.
- Zucco F., Lavano A. Spinal cord stimulation for refractory failed back surgery syndrome patients: a cost-effective treatment in Italy (precise study). In: INS 11th World Congress in Berlin. Neuromodulation: technology transforming chronic illness management. Berlin; 2013.
- Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии. М; 2014; 434 c.
- Deer T.R., Mekhail N., Provenzano D., Pope J., Krames E., Thomson S., Raso L., Burton A., DeAndres J., Buchser E., Buvanendran A., Liem L., Kumar K., Rizvi S., Feler C., Abejon D., Anderson J., Eldabe S., Kim P., Leong M., Hayek S., McDowell G. 2nd, Poree L., Brooks E.S., McJunkin T., Lynch P., Kapural L., Foreman R.D., Caraway D., Alo K., Narouze S., Levy R.M., North R.; Neuromodulation Appropriateness Consensus Committee. The appropriate use of neurostimulation: avoidance and treatment of complications of neurostimulation therapies for the treatment of chronic pain. Neuromodulation 2014; 17(6): 571–597; discussion 597–598, http://dx.doi.org/10.1111/ner.12206.










