Синтез цитокинов лимфоцитами in vitro у детей в ремиссии ювенильного идиопатического артрита на фоне терапии генно-инженерными биологическими препаратами
Цель исследования — оценить способность лимфоцитов к спонтанному и стимулированному синтезу цитокинов in vitro у детей, находящихся в ремиссии ювенильного идиопатического артрита, на фоне терапии генно-инженерными биологическими препаратами в сочетании с иммуносупрессантами.
Материалы и методы. Обследовано 18 детей (8 девочек и 10 мальчиков) в возрасте от 2 до 12 лет с различными вариантами ювенильного идиопатического артрита, в лечении которых применялись генно-инженерные биологические препараты в сочетании с иммуносупрессантами, без назначения глюкокортикоидов. Средняя длительность терапии биологическими агентами составила 3,8 года. На момент включения в исследование у всех пациентов была зафиксирована ремиссия болезни в соответствии с критериями Wallace. Контрольную группу составили 12 детей без хронических заболеваний, которые не получали никаких лекарственных препаратов. Оценивали спонтанную и индуцированную фитогемагглютинином (ФГА) выработку цитокинов (IL-2, IL-4, IL-6, IL-8, IL-10, G-CSF, IFN-γ, TNF-α), а также индекс стимуляции их синтеза. Концентрацию цитокинов в культуре цельной крови определяли методом проточной флюориметрии с использованием готовых мультиплексных тест-систем (панели Bio-Plex Pro Human Cytokine) для анализатора Bio-Plex 200 (программа Bio-Plex Manager, версия 5.0) (Bio-Rad, США).
Результаты. При сопоставлении активности спонтанной и стимулированной продукции цитокинов у детей с ювенильным идиопатическим артритом и детей группы контроля у больных выявлено значимое снижение уровня спонтанного синтеза IL-4, IL-6, IL-8, G-CSF, IFN-γ, TNF-α и отсутствие значимых различий спонтанной продукции IL-2 и IL-10. При исследовании культур, стимулированных ФГА, у детей с артритом отмечена более высокая продукция IL-2, IL-4, IL-6, сниженная — IL-10 и отсутствие статистически значимых различий в продукции IL-8, G-CSF, IFN-γ, TNF-α. Вычисленные индексы стимуляции в обеих группах детей не различались для G-CSF, IL-8 и TNF-α, были значимо выше для IL-2, IL-4, IL-6, IFN-γ и снижены для IL-10.
Заключение. Отсутствие значимых различий уровней стимулированной продукции IL-8, G-CSF, IFN-γ, TNF-α у больных ювенильным идиопатическим артритом и у детей группы сравнения в сочетании с повышением стимулированного синтеза IL-2, IL-4, IL-6 у детей с артритом свидетельствует о сохраненной реактивности организма в условиях длительной терапии генно-инженерными биологическими препаратами у детей с ювенильным идиопатическим артритом.
Вопрос о том, насколько существенно угнетаются функциональные возможности иммунной системы при проведении длительной иммуносупрессивной терапии, важен для выработки оптимальной тактики ведения больных со многими аутоиммунными заболеваниями, в частности для пациентов с ювенильным идиопатическим артритом (ЮИА). ЮИА — заболевание мультифакториальной природы, протекающее с генерализованным поражением опорно-двигательного аппарата, прогрессирующей костно-хрящевой деструкцией суставов, развитием функциональной недостаточности. Наиболее тяжелая системная форма заболевания сопровождается вовлечением в иммунопатологический процесс внутренних органов с развитием кардита, серозита, интерстициальных поражений легких. В формировании патологических изменений при ЮИА принимают участие многие клеточные популяции, включая В-клетки, Т-клетки, дендритные клетки, макрофаги, моноциты и фибробласты [1, 2]. Таким образом, данное заболевание является следствием нарушения многоуровневого межклеточного взаимодействия. В настоящее время для лечения ЮИА разработаны и широко применяются современные препараты, направленно блокирующие тот или иной этап патологического иммунного ответа — генно-инженерные биологические препараты (ГИБП): ингибиторы TNF-α, анти-В-клеточные препараты, антагонисты рецептора IL-6. Проведенные исследования подтверждают высокую эффективность ГИБП при ревматоидном артрите у взрослых пациентов и детей с ЮИА. Их широкое применение значительно улучшило прогноз и течение ЮИА [3].
В перечне побочного действия многих ранее используемых традиционных схем иммуносупрессивного лечения системного ЮИА с длительным применением гормональной терапии и базовым назначением метотрексата или комбинации метотрексата и циклоспорина одно из первых мест занимали инфекционные осложнения [4–8]. Терапия ГИБП не только более эффективна, но и характеризуется меньшей частотой развития тяжелых нежелательных последствий [9, 10]. Учитывая необходимость длительного (в течение нескольких лет) применения ГИБП, актуальным является изучение способности иммунной системы адекватно осуществлять противоинфекционную защиту в условиях длительной иммуносупрессии.
Все перечисленное определяет важность оценки функционального состояния различных звеньев иммунной системы у детей с ЮИА при проведении длительной иммуносупрессивной терапии современными биологическими препаратами.
Цель исследования — оценить способность лимфоцитов к спонтанному и стимулированному синтезу цитокинов in vitro у детей, находящихся в ремиссии ювенильного идиопатического артрита, на фоне терапии генно-инженерными биологическими препаратами в сочетании с иммуносупрессантами.
Материалы и методы. В исследование были включены 18 пациентов (8 девочек и 10 мальчиков) в возрасте от 2 до 12 лет с различными вариантами ЮИА, получающих иммуносупрессивную терапию по протоколам, принятым в детской ревматологической практике [1, 11]. Исследование проведено в соответствии с Хельсинкской декларацией (принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия)) и одобрено Этическим комитетом Научного центра здоровья детей Минздрава РФ. От родителей пациентов получено информированное согласие.
В лечении всех детей использовались различные ГИБП: ингибиторы TNF-α (инфликсимаб, адалимумаб, этанерцепт), антитела к рецептору CD20 (ритуксимаб) и антагонисты рецептора IL-6 (тоцилизумаб) в комбинации с метотрексатом. Средняя длительность терапии биологическими агентами составляла 3,8 года. На момент включения в исследование все пациенты находились в состоянии ремиссии болезни в соответствии с критериями Wallace (2011) [12]. У всех на момент исследования не отмечено никаких клинических признаков вторичного иммунодефицита, к которым относятся частые длительно текущие, трудно поддающиеся адекватному этиотропному лечению инфекционно-воспалительные заболевания, в том числе вызванные условно-патогенными микроорганизмами, а также плохое заживление ран, хроническая диарея и мальабсорбция [13].
Контрольную группу составили 12 детей без хронических заболеваний, которые не получали никаких лекарственных препаратов и были обследованы при проведении вакцинопрофилактики. Обе группы были сопоставимы по возрасту и полу.
По дизайну исследование являлось ретроспективным, обсервационным, когортным с группой контроля.
Методика исследования. Исследовалась культура цельной крови пациентов с ЮИА и детей контрольной группы по стандартной методике, применяемой для проведения квантиферонового теста (исследование было назначено по клиническим показаниям). У каждого пациента методом стандартной венопункции собирали по 1 мл крови непосредственно в две специальные пробирки. Тестовая пробирка (положительный контроль) содержала сорбированный на стенках фитогемагглютинин (ФГА); пробирка, служившая отрицательным контролем, стимуляторов не содержала. Пробирки инкубировали при температуре 37°С в течение 24 ч, затем центрифугировали 15 мин при 2000 g. После окончания процедуры отбирали плазму в количестве 100 мкл и хранили при температуре –70°С для дальнейшего определения уровня цитокинов.
Концентрацию цитокинов определяли методом проточной флюориметрии с использованием в качестве твердой фазы флюоресцентных меченых микрочастиц на платформе двулучевого лазерного анализатора Bio-Plex 200 (Bio-Rad, США), оснащенного программой Bio-Plex Manager, версия 5.0, с использованием готовых мультиплексных тест-систем того же производителя (панели Bio-Plex Pro Human Cytokine).
Оценивались следующие показатели:
спонтанная и ФГА-индуцированная выработка цитокинов IL-2, IL-4, IL-6, IL-8, IL-10, G-CSF, IFN-γ, TNF-α;
индекс стимуляции (ИС) — отношение уровня продукции цитокинов после стимуляции ФГА к уровню их выработки в культуре нестимулированных клеток.
Обработка данных. Анализ результатов проводили с помощью пакета программ Statistica 6.0 (StatSoft Inc., США). В тексте результаты представлены в виде медианы и 25-го и 75-го квартилей (Q). Статистическую значимость различий независимых переменных определяли с использованием критерия Манна–Уитни. Различия считали статистически значимыми при p≤0,05. Направление и силу связи переменных оценивали с помощью коэффициента корреляции Спирмена (r). Полученные результаты считали статистически значимыми при p≤0,05.
Результаты. Среди пациентов с ЮИА не отмечено детей со значительной лейкопенией или лимфопенией. Абсолютное число лейкоцитов в момент обследования у всех пациентов находилось в пределах возрастных норм и составляло (6–15)·109/л. Абсолютное количество лимфоцитов составляло (1,5–3,6)·109/л, и только у двух детей было отмечено их умеренное снижение — (1,0–1,4)·109/л.
Уровень спонтанного синтеза IL-2 не имел статистически значимых различий у пациентов с ЮИА и детей группы сравнения (см. таблицу); продукция IL-2 после стимуляции у детей с артритом значимо превышала аналогичные показатели группы сравнения и составила 132,2 (104,8; 266,8) пг/мл. ИС для IL-2 оказался значимо выше у детей с ЮИА.
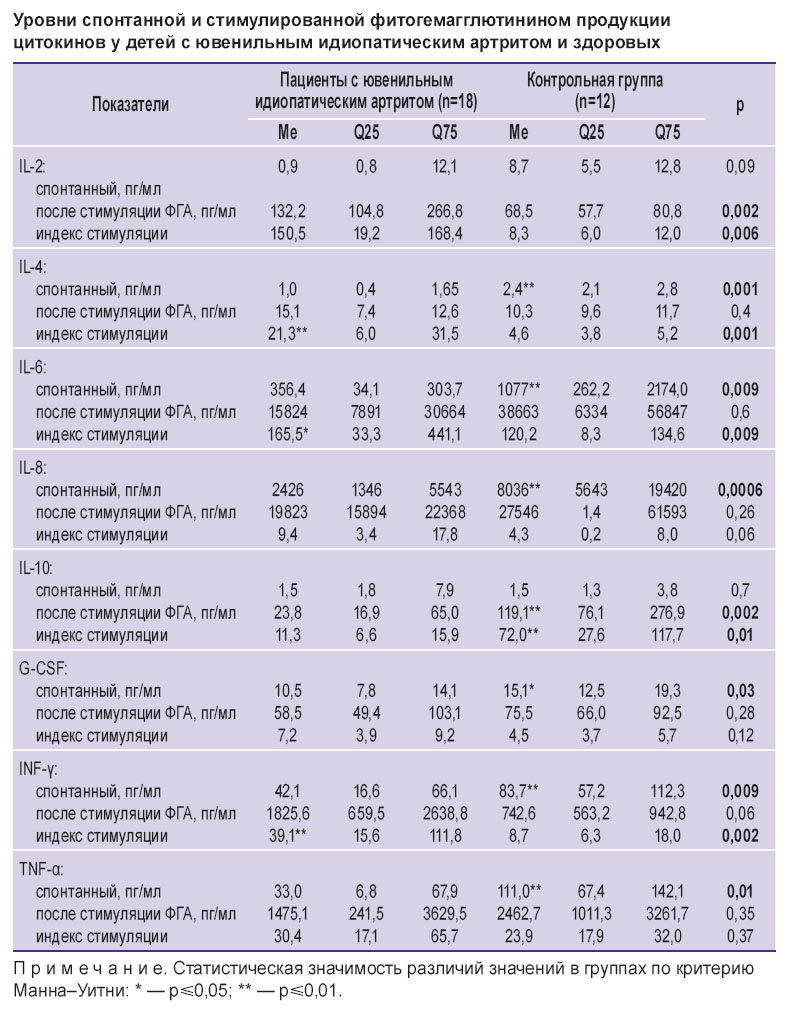 Уровни спонтанной и стимулированной фитогемагглютинином продукции цитокинов у детей с ювенильным идиопатическим артритом и здоровых Уровни спонтанной и стимулированной фитогемагглютинином продукции цитокинов у детей с ювенильным идиопатическим артритом и здоровых
|
Уровень спонтанного синтеза IL-4 у пациентов с ЮИА был относительно низким и составил 1,0 (0,4; 1,65) пг/мл при показателях группы сравнения 2,5 (2,1; 2,8) пг/мл (p=0,0006). Стимулированная продукция IL-4 отличалась в обеих группах незначимо, за счет чего ИС для IL-4 у больных детей существенно превысил показатели группы сравнения: 21,3 (6,0; 31,5) и 4,6 (3,8; 5,2) соответственно (p=0,006) (см. таблицу).
Спонтанный синтез IL-6 и IL-8 у детей с ЮИА также был ниже, чем в группе сравнения. При стимулированном синтезе статистически значимых различий между показателями не обнаружено. ИС для IL-6 и IL-8 у детей обеих групп также не имели значимых различий (см. таблицу).
Уровень спонтанного синтеза IL-10 у пациентов с ЮИА и детей контрольной группы значимо не отличался, а уровень стимулированной продукции и ИС оказались статистически значимо ниже показателей группы сравнения.
Спонтанная продукция G-CSF и IFN-γ у пациентов с ЮИА была ниже, чем в контрольной группе. Стимулированный синтез G-CSF и его ИС не имели значимых различий в обеих группах. Стимулированный синтез IFN-γ показал отчетливую тенденцию к повышению в группе пациентов с ЮИА, при этом медиана ИС данного цитокина у них оказалась значимо выше, чем в группе сравнения (39,1 против 8,7 пг/мл; p=0,002).
Медиана спонтанной продукции TNF-α у пациентов с ЮИА была ниже, чем в контрольной группе (33,0 против 111,0 пг/мл; p=0,01), однако значимых различий в стимулированной выработке данного цитокина не выявлено, так же как и различий в ИС.
Для оценки зависимости продукции цитокинов от количества лимфоцитов в пробе был проведен корреляционный анализ, при котором установлена положительная связь между абсолютным числом лимфоцитов в пробе и стимулированной продукцией IL-4 (r=0,5; p=0,02) и IL-6 (r=0,5; p=0,04), а также ИС IL-2 (r=0,6; p=0,003), IL-4 (r=0,5; p=0,04), IL-6 (r=0,7; p=0,003), IL-10 (r=0,5; p=0,04), G-CSF (r=0,7; p=0,001), INF-γ (r=0,5; p=0,02), TNF-α (r=0,6; p=0,004). Статистически значимых корреляций между уровнями продуцируемых цитокинов и уровнем моноцитов крови не обнаружено.
Обсуждение. Патогенетические механизмы системного ЮИА затрагивают многие звенья иммунной системы, связаны с нарушением толерантности к собственным антигенам, результатом которого является активация T- и B-лимфоцитов, а также макрофагов. Эта активация приводит к изменениям продукции многих цитокинов и в свою очередь усиливает патологические клеточные реакции [1, 2].
У 18 обследованных детей наблюдались различные варианты ЮИА, лечение ГИБП проводилось в течение длительного времени. Исследование концентрации цитокинов в культуре цельной крови показало в целом сохраненную способность иммунокомпетентных клеток этих пациентов адекватно реагировать на неспецифическую стимуляцию ФГА. Это особенно наглядно продемонстрировала высокая ФГА-индуцированная продукция IL-2, IL-4, IL-6.
При сопоставлении активности спонтанной и стимулированной продукции цитокинов у детей, получавших длительную терапию ЮИА по современным протоколам с применением ГИБП [1, 11], с аналогичными показателями детей без хронических заболеваний выявлено значимое снижение уровня спонтанного синтеза IL-4, IL-6, IL-8, G-CSF, IFN-γ, TNF-α и отсутствие статистически значимых различий спонтанной продукции IL-2, IL-10. При исследовании культур, стимулированных ФГА, у детей с ЮИА отмечена более высокая продукция IL-2, IL-4, IL-6, сниженная — IL-10 и отсутствие статистически значимых различий в продукции IL-8, G-CSF, IFN-γ, TNF-α. В результате этого вычисленные ИС у детей с ЮИА не отличались от показателей группы сравнения для G-CSF и TNF-α, были статистически значимо выше дляIL-2, IL-4, IL-6, IFN-γ и снижены для L-10.Отсутствие статистически значимых различий уровней стимулированной продукции IL-8, G-CSF, IFN-γ, TNF-α у больных ЮИА и у детей группы сравнения в сочетании с повышением стимулированного синтеза IL-2, IL-4, IL-6 свидетельствует о сохраненной реактивности организма в условиях длительной иммуносупрессивной терапии без применения глюкокортикоидов.
Поскольку исследовалась культура цельной крови, в выработке цитокинов вместе с лимфоцитами принимали участие и моноциты. Однако статистически значимых корреляций между уровнями продуцируемых цитокинов и уровнем моноцитов в крови не получено. Это позволяет предположить, что вклад моноцитов в активацию синтеза исследованных цитокинов при использовании данной методики оценки был минимальным.
При исследовании цельной крови нельзя исключить колебаний уровня синтеза цитокинов в зависимости от содержания лимфоцитов в каждой конкретной пробе, при этом низкая суммарная продукция может быть связана с лекарственно-индуцированной лимфопенией. В нашем исследовании число лейкоцитов в момент обследования у всех пациентов соответствовало установленным возрастным нормам — (6–15)·109/л; абсолютное количество лимфоцитов у всех пациентов находилось в пределах (1,5–3,6)·109/л, только у двух детей отмечены умеренно сниженные показатели — (1,0–1,5)·109/л. Если предположить, что основной причиной умеренного снижения спонтанной продукции IL-4, IL-6, IL-8, G-CSF, IFN-γ, TNF-α может являться относительно невысокое абсолютное число лимфоцитов в исследованных образцах крови, то стимулированная продукция, не отличающаяся от показателей группы сравнения, и высокие индексы стимуляции говорят не только о сохраненных возможностях, но, по всей видимости, и о повышенной способности лимфоцитов обследованных больных реагировать на антигенную стимуляцию. Это может быть расценено двояко: и как признак отсутствия медикаментозного угнетения функции лимфоцитов, и как возможность активации иммунных реакций (в том числе и обострения основного заболевания) в условиях значительной антигенной стимуляции.
Данные о сохраненной пролиферативной реактивности лимфоцитов в ответ на влияние митогена позволяют говорить о возможности проведения вакцинопрофилактики у больных с ЮИА, находящихся в состоянии клинико-лабораторной ремиссии. В клинических исследованиях [14, 15] было показано, что вакцинация пациентов с ревматоидным артритом против гриппа, дифтерии, столбняка и менингококковой инфекции не приводила к ухудшению клинической ситуации. В то же время было установлено, что одновременное применение поддерживающей иммуносупрессивной терапии в средних возрастных дозах не ингибировало выработку защитных антител при вакцинации против дифтерии [15, 16], коклюша [15, 17], гепатита В [15, 18], гриппа [15, 19]. При вакцинации против менингококковой инфекции дети с ЮИА также продемонстрировали способность к синтезу достаточного уровня защитных антител, хотя иммунный ответ у них был менее напряженным, чем у здоровых сверстников. При этом у детей, получавших анти-TNF-α-терапию в комбинации с метотрексатом, отмечалось более выраженное угнетение иммунного ответа, чем при использовании одного метотрексата [15, 20].
Таким образом, полученный в нашем исследовании сохраненный клеточный ответ на митогенную стимуляцию у пациентов с ЮИА позволяет надеяться, что при проведении их иммунизации в период клинико-лабораторной ремиссии заболевания на фоне длительной терапии ГИБП в комбинации с метотрексатом может быть получен адекватный вакцинальный ответ.
Заключение. Результаты исследования стимулированного синтеза цитокинов лимфоцитами крови in vitro у детей, находящихся в ремиссии ювенильного идиопатического артрита, позволяют сделать вывод о сохраненной способности иммунной системы отвечать на антигенную стимуляцию на фоне длительного лечения генно-инженерными биологическими препаратами. Это является дополнительным преимуществом данного вида терапии и, с нашей точки зрения, может учитываться при принятии решения о тактике ведения детей с ювенильным идиопатическим артритом.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Алексеева Е.И., Литвицкий П.Ф., Баранов А.А. Ювенильный ревматоидный артрит: этиология, патогенез, клиника, алгоритмы диагностики и лечения. Под ред. Баранова А.А. М; 2007.
- Алексеева Е.И., Валиева С.И., Акулова С.С., Бзарова Т.М., Денисова Р.В., Исаева К.Б., Слепцова Т.В., Митенко Е.В., Чистякова Е.Г., Фетисова А.Н., Семикина Е.Л. Эффективность и безопасность длительного применения ритуксимаба у пациентов с системным ювенильным идиопатическим артритом. Вопросы современной педиатрии 2013; 12(2): 89–100.
- Yokota S., Imagawa T., Miyamae T. Safety and efficacy of up to three years of continuous tocilizumab therapy in children with systemic-onset juvenile idiopathic arthritis [SAT0536]. Ann Rheum Dis 2009; 68(Suppl. 3): 715.
- Smitten A.L., Choi H.K., Hochberg M.C., Suissa S., Simon T.A., Testa M.A., Chan K.A. The risk of hospitalized infection in patients with rheumatoid arthritis. J Rheumatol 2008; 35(3): 387–393.
- Doran M.F., Crowson C.S., Pond G.R., O’Fallon W.M., Gabriel S.E. Frequency of infection in patients with rheumatoid arthritis compared with controls: a population-based study. Arthritis Rheum 2002; 46(9): 2287–2293, http://dx.doi.org/10.1002/art.10524.
- Au K., Reed G., Curtis J.R., Kremer J.M., Greenberg J.D., Strand V., Furst D.E.; CORRONA Investigators. High disease activity is associated with an increased risk of infection in patients with rheumatoid arthritis. Ann Rheum Dis 2011; 70(5): 785–791, http://dx.doi.org/10.1136/ard.2010.128637.
- Doran M.F., Crowson C.S., Pond G.R., O’Fallon W.M., Gabriel S.E. Predictors of infection in rheumatoid arthritis. Arthritis Rheum 2002; 46(9): 2294–2300, http://dx.doi.org/10.1002/art.10529.
- Beukelman T., Xie F., Chen L., Baddley J.W., Delzell E., Grijalva C.G., Lewis J.D., Ouellet-Hellstrom R., Patkar N.M., Saag K.G., Winthrop K.L., Curtis J.R.; SABER Collaboration. Rates of hospitalized bacterial infection associated with juvenile idiopathic arthritis and its treatment. Arthritis Rheum 2012; 64(8): 2773–2780, http://dx.doi.org/10.1002/art.34458.
- Бзарова Т.М., Алексеева Е.И., Валиева С.И., Алексеева А.М., Денисова Р.В., Исаева К.Б., Чистякова Е.Г., Лисицын А.О. Безопасность применения ингибиторов фактора некроза опухоли во взрослой и детской ревматологической практике. Вопросы современной педиатрии 2010; 9(1): 82–94.
- Halbig M., Horneff G. Improvement of functional ability in children with juvenile idiopathic arthritis by treatment with etanercept. Rheumatol Int 2009; 30(2): 229–238, http://dx.doi.org/10.1007/s00296-009-0942-3.
- Алексеева Е.И., Бзарова Т.М. Алгоритм диагностики и лечения ювенильного артрита. Вопросы современной педиатрии 2010; 9(6): 78–104.
- Wallace C.A., Giannini E.H., Huang B., Itert L., Ruperto N.; Childhood Arthritis Rheumatology Research Alliance; Pediatric Rheumatology Collaborative Study Group; Paediatric Rheumatology International Trials Organisation. American College of Rheumatology provisional criteria for defining clinical inactive disease in select categories of juvenile idiopathic arthritis. Arthritis Care Res 2011; 63(7): 929–936, http://dx.doi.org/10.1002/acr.20497.
- Хаитов Р.М., Ярилин А.А., Пинегин Б.В. Иммунология: атлас. М; 2011.
- Pileggi G.S., de Souza C.B., Ferriani V.P. Safety and immunogenicity of varicella vaccine in patients with juvenile rheumatic diseases receiving methotrexate and corticosteroids. Arthritis Care Res 2010; 62(7): 1034–1039, http://dx.doi.org/10.1002/acr.20183.
- Dell’ Era L., Esposito S., Corona F., Principi N. Vaccination of children and adolescents with rheumatic diseases. Rheumatology 2011; 50(8): 1358–1365, http://dx.doi.org/10.1093/rheumatology/ker102.
- Koshcheeva Iu.V., Kharit S.M., Kalinina N.M. Specific features of diphtheria vaccinal process in children with rheumatic diseases. Zh Mikrobiol Epidemiol Immunobiol 2001; 6: 44–49.
- Kostinov M.P., Tarasova A.A., Zaitsev E.M. Contents of antibodies to Bordetella pertussis antigens in patients with rheumatic diseases. Zh Mikrobiol Epidemiol Immunobiol 2007; 6: 61–64.
- Kasapçopur O., Cullu F., Kamburoğlu-Goksel A., Cam H., Akdenizli E., Calýkan S., Sever L., Arýsoy N. Hepatitis B vaccination in children with juvenile idiopathic arthritis. Ann Rheum Dis 2004; 63(9): 1128–1130.
- Kanakoudi-Tsakalidou F., Trachana M., Pratsidou-Gertsi P., Tsitsami E., Kyriazopoulou-Dalaina V. Influenza vaccination in children with chronic rheumatic diseases and long-term immunosuppressive therapy. Clin Exp Rheumatol 2001; 19(5): 589–594.
- Elkayam O., Caspi D., Reitblatt T., Charboneau D., Rubins J.B. The effect of tumor necrosis factor blockade on the response to pneumococcal vaccination in patients with rheumatoid arthritis and ankylosing spondylitis. Semin Arthritis Rheum 2004; 33(4): 283–288, http://dx.doi.org/10.1053/j.semarthrit.2003.10.003.










