Современные возможности ультразвуковой диагностики состояния почек у детей
Цель исследования — изучение возможностей использования комплексной ультразвуковой оценки состояния паренхиматозного слоя почек (методами эластографии сдвиговой волной и энергетического доплеровского картирования внутрипочечных сосудов) в качестве ранней неинвазивной диагностики у детей, страдающих ожирением и метаболическим синдромом.
Материалы и методы. Ультразвуковое исследование почек проводили с использованием цифровой ультразвуковой портативной системы АНГИОДИН-Соно/П-Ультра (НПФ «БИОСС», Россия). Обследовано 42 ребенка, которым проведены эластография сдвиговой волной паренхиматозного слоя почек и оценка внутрипочечных сосудов методом энергетического доплеровского картирования.
Результаты. У детей с ожирением и метаболическим синдромом определяется высокая частота регистрации 2, 3 и 4-го типов почечного кровотока, характеризующих его снижение.По результатам эластографии сдвиговой волной выявлены статистически значимые различия жесткости почечной паренхимы у детей с метаболическим синдромом и детей с ожирением, а также у детей с метаболическим синдромом и у детей контрольной группы (с нормальной массой тела). Показатель жесткости почечной паренхимы у детей с ожирением имел тенденцию к повышению (p>0,05) по сравнению с детьми контрольной группы. Выявленные изменения показателей жесткости почечной паренхимы у детей с метаболическим синдромом могут свидетельствовать о вазоспазме на капиллярном уровне (клубочки почек), что в последующем может сопровождаться ремоделированием их сосудистой стенки, в том числе и на фоне системного повышения артериального давления. Это усиливает риск формирования порочного круга: ишемия паренхимы почек и активация юкста-гломерулярного аппарата ↔ сохранение и усиление артериальной гипертензии. У детей с ожирением и метаболическим синдромом режим энергетического доплера с применением стандартизированной схемы оценки позволяет более точно определить интенсивность почечного кровотока за счет высокой воспроизводимости методики.
Заключение. Комплексное использование современных методов ультразвуковой диагностики состояния почек (эластография сдвиговой волной+ энергетическое доплеровское картирование)дает возможность выявить группу высокого кардиоваскулярного риска у детей с ожирением.
Ожирение и избыточная масса тела тесно ассоциированы с развитием метаболического синдрома, маркерами которого являются сахарный диабет 2-го типа, артериальная гипертензия (АГ), ранний атеросклероз, патология желудочно-кишечного тракта, репродуктивные нарушения, окислительный стресс [1−6]. Исследования последних лет показывают, что ожирение служит независимым фактором риска хронических почечных заболеваний. Инсулинорезистентность, гиперинсулинемия и дислипидемия, регистрируемые при метаболическом синдроме, способствуют развитию АГ. Гормонально-метаболические нарушения и АГ, в свою очередь, сказываются на структурно-функциональном состоянии почек и приводят к формированию гломерулопатии [7, 8].
Количественно оценить жесткость почечной ткани (повышение этого показателя говорит о начавшихся изменениях в паренхиме) можно с помощью нового метода ультразвуковой диагностики — эластографии сдвиговой волной [9]. Принцип действия метода основан на генерации в тканях сдвиговой волны и последующей оценке скорости ее распространения [10]. Метод эластографии сдвиговой волной на сегодняшний день используется в диагностике заболеваний печени, молочной железы, щитовидной железы [9, 11]. Встречаются лишь единичные исследования об использовании этого метода для диагностики заболеваний почек, указывающие на влияние различных факторов, в том числе и почечного кровотока, на скорость распространения сдвиговой волны [12]. В настоящее время для оценки состояния почечной гемодинамики используются метод цветного доплеровского картирования и его разновидности, получившие название энергетического доплера. В режимах цветного и энергетического доплеровского картирования определяется диаметр сосудов, оценивается положение внутрипочечных сосудов, степень васкуляризации паренхимы почек [13, 14].
Энергетический доплер благодаря способности регистрировать низкоскоростные потоки превосходит цветовую доплерографию в визуализации нормальной внутрипочечной сосудистой сети и используется для выявления зон ишемии в почках [15, 16]. Проведение комплексного ультразвукового исследования почек в В-режиме, режиме эластографии сдвиговой волной и энергетического доплеровского картирования позволяет получить наиболее объективную картину, характеризующую структурно-функциональное состояние почек, а также диагностировать ренальные нарушения на начальных этапах развития.
Таким образом, оценить возможности современных методов ультразвуковой диагностики (эластография сдвиговой волной, энергетическое доплеровское картирование внутрипочечных сосудов) при различных патологических состояниях почек, особенно в детском возрасте, интересно с научной и практической точек зрения.
Цель исследования — изучение возможностей использования комплексной ультразвуковой оценки состояния паренхиматозного слоя почек (методами эластографии сдвиговой волной и энергетического доплеровского картирования внутрипочечных сосудов) в качестве ранней неинвазивной диагностики у детей, страдающих ожирением и метаболическим синдромом.
Материалы и методы. Обследовано 42 пациента в возрасте от 11 до 17 лет, находившихся на стационарном лечении в педиатрическом отделении №1 Детской клинической больницы Смоленска в 2014−2015 гг. Антропометрические измерения включали определение массы тела (кг), роста (см), окружности талии (см), индекса массы тела. Общеклиническое обследование включало общие анализы крови и мочи. Биохимический анализ крови проводили на аппарате Hitachi 912 (Hitachi, Япония) с определением параметров липидного (общий холестерин, триглицериды, ЛПВП, ЛПНП, ЛПОНП) и углеводного (глюкоза) обменов, фибриногена и С-реактивного белка. Функции почек определяли по пробе Зимницкого, скорость клубочковой фильтрации — расчетным методом по формуле Шварца. Пероральный глюкозотолерантный тест выполняли на биохимическом автоматическом экспресс-анализаторе Innova Star (Diasys Diagnostic System, Германия). Экскрецию альбумина с мочой определяли полуколичественным анализом с помощью диагностической системы «Микроальбуфан» («Эрба Лахема», Чехия). Суточное мониторирование артериального давления осуществляли на аппарате BPLAB (Россия).
В работе была использована классификация ожирения, основанная на перцентильных таблицах индекса массы тела, ее сопоставляли с полом и возрастом конкретного ребенка.
Все пациенты были разделены на три группы. В 1-ю группу вошли 14 детей и подростков с метаболическим синдромом. Согласно рекомендациям Международной федерации диабета (IDF, 2007), критериями включения в группу были наличие абдоминального ожирения, АГ, атерогенной дислипидемии (гипертриглицеридемия и/или снижение холестерина ЛПВП). Во 2-ю группу вошли 16 человек с первичным неосложненным экзогенно-конституциональным ожирением. Контрольную группу составили 12 детей и подростков 2-й группы здоровья с нормальной массой тела. Дети всех групп не имели в анамнезе поражения мочевыделительной системы.
Исследование проведено в соответствии с Хельсинкской декларацией, принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия), и одобрено Этическим комитетом Смоленского государственного медицинского университета. Информированное согласие получено от всех пациентов в возрасте 15–17 лет и от родителей пациентов, не достигших 15-летнего возраста, согласно Федеральному закону «Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июля 1993 г. №54871.
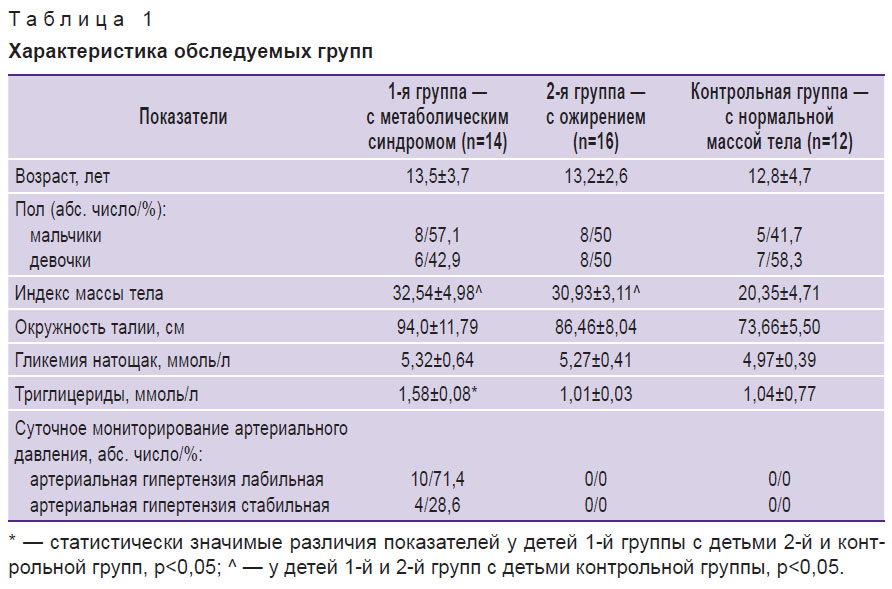
При оценке антропометрических показателей была выявлена тенденция (p>0,05) к более высоким показателям массы тела в группе детей с метаболическим синдромом по сравнению с детьми с ожирением. Аналогичная тенденция отмечена и относительно показателей индекса массы тела (табл. 1).
|
Таблица 1. Характеристика обследуемых групп |
При оценке углеводного обмена в группе детей с метаболическим синдромом выявлен один случай показателей глюкозы крови, соответствующих нарушенной гликемии натощак. В целом различий по уровню гликемии у детей 1-й и 2-й групп не установлено. Анализ показателей липидного спектра продемонстрировал статистически значимое повышение триглицеридов у детей с метаболическим синдромом по сравнению с детьми с ожирением. Показатели средних уровней общего холестерина, ЛПВП, ЛПНП, коэффициента атерогенности статистически значимых различий не имели.
У всех детей с метаболическим синдромом отмечалась АГ I степени, высокого риска. По результатам суточного мониторирования артериального давления у 71,4% детей регистрировалась лабильная АГ, у 28,6% — стабильная.
Ультразвуковое исследование почек выполняли с использованием цифровой ультразвуковой портативной системы АНГИОДИН-Соно/П-Ультра (НПФ «БИОСС», Россия) электронным конвексным датчиком 3−6 МГц в положении больного лежа на животе. Проводили анатомическую оценку почек в В-режиме с определением размеров, расположения, контуров почек, эхогенности коркового слоя паренхимы.
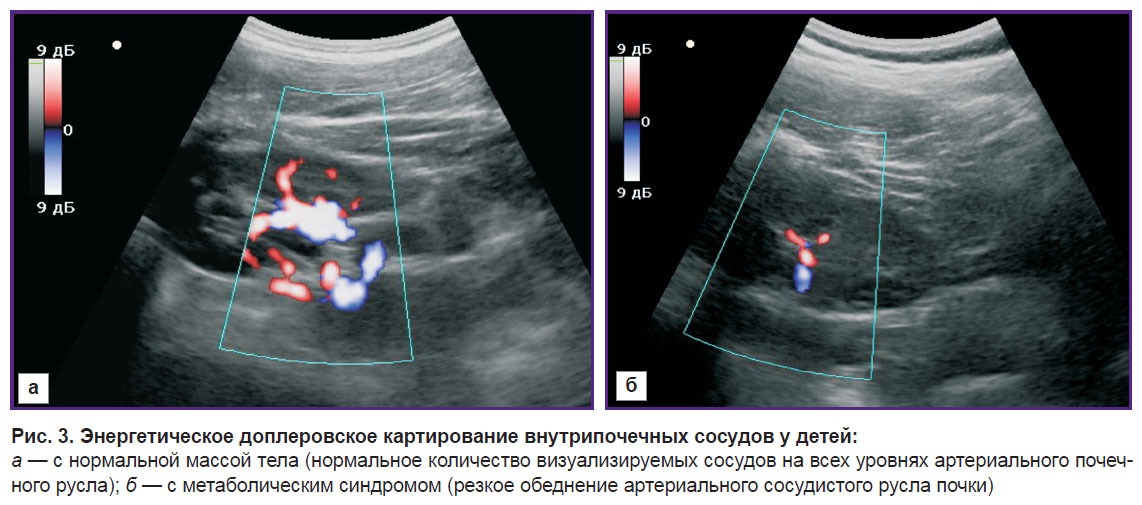
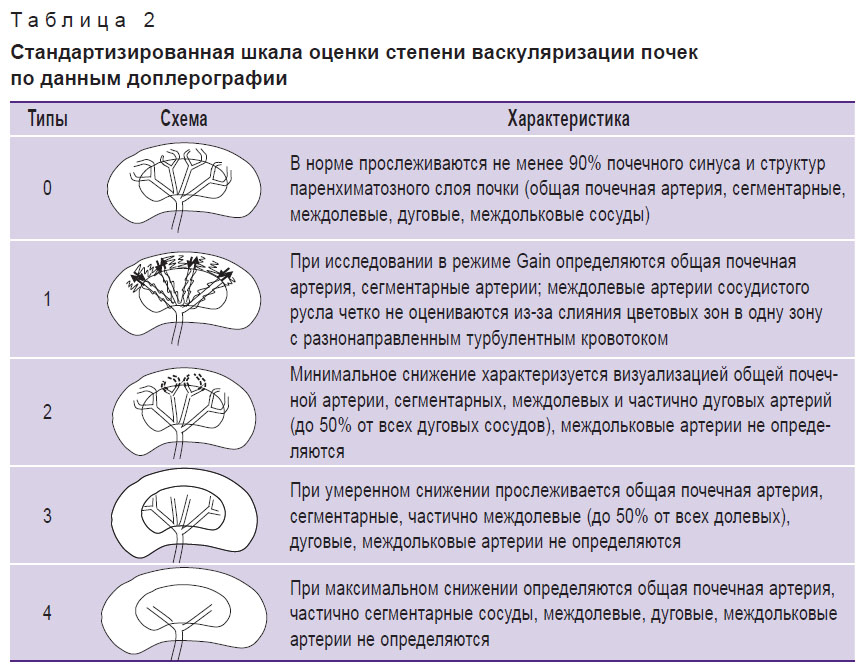
Режим энергетического доплеровского картирования этой установки включал качественную оценку интенсивности кровотока в продольном сечении площади почек. Выполняли многоплоскостное сканирование с выведением в процессе исследования в зону оценки 4–5 сегментарных артерий, что повышает достоверность проводимого исследования. Такое выведение 4–5 артерий подразумевает многоплоскостное сканирование для получения визуализации сосудистого русла в течение одного ультразвукового исследования одним специалистом в течение 1–5 мин. Для оценки степени васкуляризации паренхимы почек у взрослых M. Bertolotto и соавт. в 2000 г. предложили пятибалльную шкалу оценки внутрипочечного кровотока: сохраненный кровоток до почечной капсулы оценивали в 4 балла с постепенным уменьшением его до 0 баллов, когда паренхиматозный кровоток не определялся. Для оценки степени васкуляризации паренхимы почек у детей в исследовании использовалась модифицированная пятибалльная шкала M. Bertolotto, предложенная А.В. Борсуковым с соавт. [17] (табл. 2). По данным энергетического доплеровского картирования был выделен 1-й тип кровотока у детей, при котором регистрируется его усиление, а при 2–4-м типах кровотока — уменьшение.
|
Таблица 2. Стандартизированная шкала оценки степени васкуляризации почек по данным доплерографии |
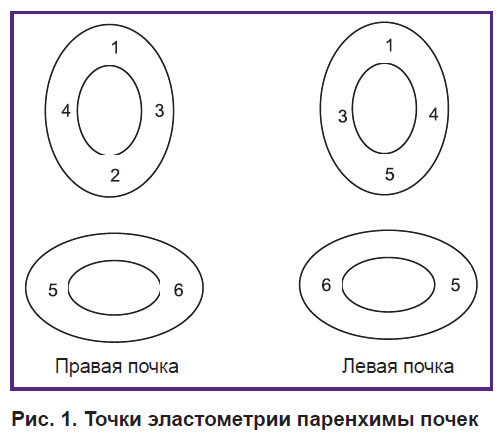
Эластографию сдвиговой волной паренхиматозного слоя почек проводили в 6 точках в продольном и поперечном сканировании. Выбор точек был обусловлен анатомическим строением почки (рис. 1). Технология сдвиговой волны — это количественная эластометрия с возможностью выбора зоны исследования. При оптимальном серошкальном исследовании почек в условиях хорошей и устойчивой визуализации использовали режим эластометрии сдвиговой волной для определения цифрового значения жесткости в килопаскалях (кПа) исследуемого объема паренхимы почек. Регистрировали средний показатель жесткости, когда определяемое при этом отклонение было не более 30% от среднего значения [18]. На экране на фоне серошкального изображения в виде цветовой эластограммы кодировалась жесткость исследуемого отдела почечной паренхимы. Паренхима почек, характеризующаяся высокими показателями жесткости, картировалась в красной цветовой гамме, а с низкими показателями жесткости — в голубой цветовой гамме. На экране при этом регистрировался показатель жесткости в кПа.
|
Рис. 1. Точки эластометрии паренхимы почек |
Статистическую обработку данных проводили с помощью пакетов прикладных программ Microsoft Excel 2000 и Statistica 7.0. Результаты представлены в виде средних значений и стандартного отклонения (для нормально распределенных признаков) и медианы и межквартильного интервала (для ненормально распределенных признаков). Статистическую значимость различий констатировали при p<0,05.
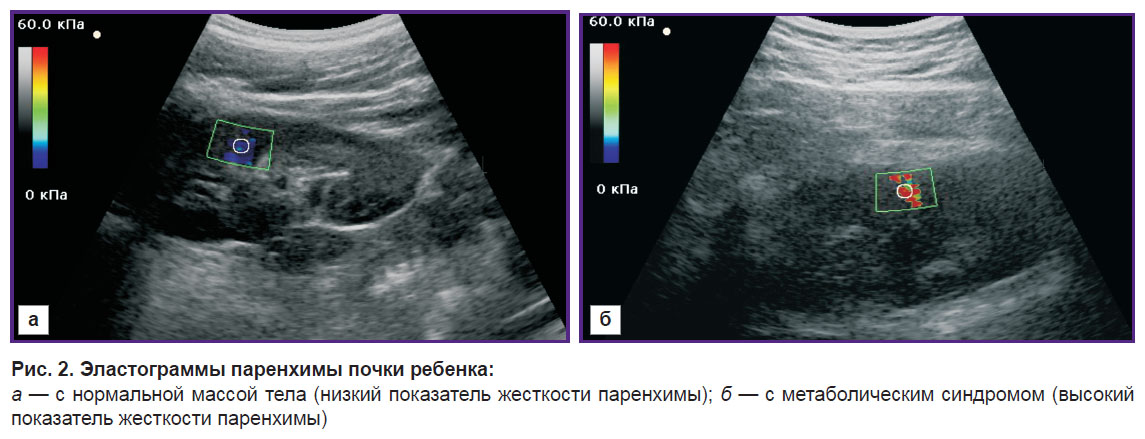
Результаты. Данные эластографии сдвиговой волной (табл. 3) показали статистически значимые различия жесткости почечной паренхимы у детей с метаболическим синдромом и детей с ожирением, а также у детей с метаболическим синдромом и детей контрольной группы. Показатель жесткости почечной паренхимы у детей с ожирением по сравнению с детьми контрольной группы имел тенденцию к повышению (p>0,05). На рис. 2 представлены эхограммы почки ребенка контрольной группы и ребенка с метаболическим синдромом.

|
Таблица 3. Показатели жесткости почечной паренхимы по данным эластографии сдвиговой волной у обследованных детей (Me [25; 75]) |
|
Рис. 2. Эластограммы паренхимы почки ребенка: а — с нормальной массой тела (низкий показатель жесткости паренхимы); б — с метаболическим синдромом (высокий показатель жесткости паренхимы) |
Корреляционный анализ параметров суточного мониторирования артериального давления — индекса времени систолического артериального давления и жесткости паренхимы почек по данным эластографии сдвиговой волной выявил наличие статистически значимой слабой прямой корреляционной связи между индексом времени систолического артериального давления (день) и жесткостью паренхимы почек у детей с метаболическим синдромом (табл. 4). При этом у детей с ожирением такая корреляционная связь была очень слабой.
При проведении качественной оценки кровотока почек в режиме энергетического доплеровского картирования по стандартизированной методике регистрировали следующие типы кровотока (табл. 5). Нормальный почечный кровоток (тип 0) отмечен у 2 детей 1-й группы, у 6 детей 2-й группы и у всех 12 детей контрольной группы.
|
Таблица 5. Встречаемость различных типов кровотока почек по данным энергетического доплеровского картирования у обследованных детей |
На рис. 3 представлены эхограммы энергетического доплеровского картирования внутрипочечных сосудов у ребенка контрольной группы (тип 0) и ребенка с метаболическим синдромом (тип 4).
Обсуждение. Оценка состояния внутрипочечного кровотока — одного из важнейших участков системы кровообращения — является необходимой для выявления факторов риска сердечно-сосудистых осложнений. Роль почки в регуляции сосудистого тонуса и артериального давления значительна. Доказано, что АГ при метаболическом синдроме развивается на фоне гиперактивации ренин-ангиотензин-альдостероновой системы [7]. Жировая ткань человека продуцирует многие звенья этой системы: ангиотензин I, II, ренин, ангиотензиноген, рецепторы ангиотензина 1-го и 2-го типов, ангиотензинпревращающий энзим [3, 19]. При ожирении на фоне эндотелиальной дисфункции регистрируется избыточная продукция вазоконстриктивных факторов. Так, ангиотензин II вызывает следующие неблагоприятные эффекты: вазоконстрикцию, секрецию альдостерона, вазопрессина, норадреналина, задержку жидкости, пролиферацию гладкомышечных клеток, активацию симпатоадреналовой системы. Действуя на почечные структуры, ангиотензин II вызывает их гипертрофию, гиперплазию. По мере увеличения частоты эпизодов повышения артериального давления и их длительности нарастает структурная перестройка сосудов, отмечается умеренная гипертрофия медии [20].
Выявленные в исследовании изменения показателей жесткости почечной паренхимы по данным эластографии сдвиговой волной у детей и подростков с метаболическим синдромом могут свидетельствовать о вазоспазме на капиллярном уровне (клубочки почек), что согласуется и с результатами энергетического доплеровского картирования, которые говорят о снижении внутрипочечного кровотока. В последующем это может сопровождаться ремоделированием сосудистых стенок почек, в том числе и на фоне системного повышения артериального давления у детей с ожирением. В итоге увеличивается риск формирования порочного круга: ишемия паренхимы почек и активация юкста-гломерулярного аппарата ↔ сохранение и усиление АГ. Данное рассуждение основано на непрямых методах оценки структурных изменений в почках. Использование прямых методов исследования в виде ангиографии и биопсии почек у детей резко ограничено, они назначаются по жизненным показаниям. Поэтому неинвазивные методы диагностики в педиатрической практике приобретают особую актуальность.
Заключение. У детей и подростков с ожирением и метаболическим синдромом целесообразно проводить комплексное ультразвуковое исследование паренхимы почек. Пациентов с ожирением, имеющих высокие показатели жесткости паренхимы почек по данным эластографии сдвиговой волной и снижение интраренального кровотока по результатам энергетического доплеровского картирования, следует относить к группе высокого риска по формированию маркеров метаболического синдрома, включая артериальную гипертензию. Выявленные структурно-функциональные изменения со стороны почек у детей и подростков с ожирением и метаболическим синдромом свидетельствуют о необходимости назначения в комплексном лечении курсов метаболической терапии: эндотелиопротекторных препаратов (антиоксиданты и др.), препаратов, улучшающих микроциркуляцию (антиагреганты и др.).
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Бекезин В.В., Козлова Л.В., Коваленко О.М., Леонов С.Д., Федоров Г.Н., Пересецкая О.В. Особенности свободнорадикального окисления у детей и подростков с ожирением и метаболическим синдромом. Профилактическая и клиническая медицина 2009; 2: 49–53.
- Бокова Т.А. Этиопатогенез метаболического синдрома у детей. Лечение и профилактика 2011; 1: 50–55.
- Дедов И.И., Мельниченко Г.А., Бутрова С.А. Жировая ткань как эндокринный орган. Ожирение и метаболизм 2006; 1: 6–13.
- Павловская Е.В., Каганов Б.С., Строкова Т.В. Ожирение у детей и подростков — патогенетические механизмы, клинические проявления, принципы лечения. Международный журнал педиатрии, акушерства и гинекологии 2013; 3(2): 67–79.
- Петеркова В.А., Васюкова О.В. К вопросу о новой классификации ожирения у детей. Проблемы эндокринологии 2015; 61(2): 39–44.
- Шилов А.М., Авшалумов А.Ш., Синицина Е.Н., Еремина И.В. Коррекция факторов риска у пациентов с избыточной массой тела, сочетающейся с инсулинорезистентностью и артериальной гипертонией. Русский медицинский журнал 2011; 19(13): 805–811.
- Ивашкин В.Т., Драпкина О.М., Корнеева О.Н. Клинические варианты метаболического синдрома. М: Издательство «Mедицинское информационное агентство»; 2012; 216 с.
- Palm F., Nordquist L. Renal oxidative stress, oxygenation, and hypertension. Am J Physiol Regul Integr Comp Physiol 2011; 301(5): R1229–R1241, https://doi.org/10.1152/ajpregu.00720.2010.
- Зыкин Б.И., Постнова Н.А., Медведев М.Е. Эластография: анатомия метода. Променева дiагностика, променева терапiя 2012; 2–3: 107–113.
- Руденко О.В., Сафонов Д.В., Рыхтих П.И., Гурбатов С.Н., Романов С.В. Физические основы эластографии. Часть 2. Эластография на сдвиговой волне (лекция). Радиология — практика 2014; 4: 62–71.
- Борсуков А.В., Крюковский С.Б., Покусаева В.Н., Никифоровская Е.Н., Перегудов И.В., Морозова Т.Г. Эластография в клинической гепатологии (частные вопросы). Смоленск: Смоленская городская типография; 2011; 276 с.
- Bob F., Bota S., Sporea I., Sirli R., Petrica L., Schiller A. Kidney shear wave speed values in subjects with and without renal pathology and inter-operator reproducibility of acoustic radiation force impulse elastography (ARFI) — preliminary results. PLoS One 2014; 9(11): e113761, https://doi.org/10.1371/journal.pone.0113761.
- Глазун Л.О., Полухина Е.В. Ультразвуковая диагностика заболеваний почек. М: Видар; 2014; 296 с.
- Полещук Л.А. Характеристика почечной гемодинамики у детей с заболеваниями почек (обзор литературы). Нефрология и диализ 2006; 8(3): 225–231.
- Bude R.O., Rubin J.M., Adler R.S. Power versus conventional color Doppler sonography: comparison in the depiction of normal intrarenal vasculature. Radiology 1994; 192(3): 777–780, https://doi.org/10.1148/radiology.192.3.8058946.
- Babcock D.S., Patriquin H., LaFortune M., Dauzat M. Power Doppler sonography: basic principles and clinical applications in children. Pediatr Radiol 1996; 26(2): 109–115, https://doi.org/10.1007/bf01372087.
- Борсуков А.В., Бекезин В.В., Козлова Е.Ю. Cтандартизация качественной оценки допплерографии почек у детей с ожирением и метаболическим синдромом. Вестник Смоленской государственной медицинской академии 2015; 14(2): 34–37.
- Дынник О.Б., Линская А.В., Кобыляк Н.Н. Cдвигововолновая эластография и эластометрия паренхимы печени (методические аспекты). Променева дiагностика, променева терапiя 2014; 1–2: 73–82.
- Шестакова М.В. Активность ренин-ангиотензиновой системы (РАС) жировой ткани: метаболические эффекты блокады РАС. Ожирение и метаболизм 2011; 1: 21–25.
- Назаренко Г.И., Хитрова А.Н., Краснова Т.В. Современные медицинские технологии и допплерографические исследования в уронефрологии. М: Медицина; 2002; 152 с.