Инфракрасная спектроскопия в дифференциальной диагностике тромбоэмболии легочных артерий
Цель исследования — оценить эффективность применения метода инфракрасной спектроскопии в верификации тромбоэмболии легочных артерий (ТЭЛА) и ряда клинически сходных заболеваний.
Материалы и методы. С помощью инфракрасной спектроскопии исследовали сыворотку крови 19 здоровых добровольцев и 30 пациентов с интраоперационно подтвержденной легочной тромбоэмболией, а также c хронической обструктивной болезнью легких — ХОБЛ (n=10), пневмонией (n=10), туберкулезом (n=10), абсцессом (n=10) и раком легкого (n=10), острым нарушением мозгового кровообращения — ОНМК (n=10), ишемической болезнью сердца — ИБС (n=10). В качестве диагностических параметров принимали отношения высот пиков полос поглощения (см–1/см–1): П1 — 1160/1165; П2 — 1165/1070; П3 — 1165/1150; П4 — 1165/1050; П5 — 1100/1050; П6 — 1025/1165. Эти параметры ИК-спектров являются значимыми для данной нозологии.
Результаты. Рассчитанные показатели продемонстрировали статистически значимую разницу параметров ИК-спектров для изучаемых нозологий (p<0,001) даже на небольших выборках, дополняя друг друга и позволяя пошагово исключать абсцесс и туберкулез легкого, ХОБЛ и пневмонию, рак, ИБС, ОНМК и ТЭЛА.
Представленные лепестковые диаграммы, построенные с учетом значений всех отношений высот пиков полос поглощения с диагностически значимыми максимумами, позволили визуализировать ИК-профили, сделав дифференцировку ТЭЛА и ее клинических аналогов не только более объективной и достоверной, но и более наглядной.
Заключение. Инфракрасная спектроскопия является потенциально эффективным методом дифференциальной диагностики ТЭЛА. Увеличение численности выборки позволит провести оценку чувствительности и специфичности данного метода исследования в сравнении с существующими стандартными схемами верификации легочной тромбоэмболии.
Введение
Широкая распространенность тромбоэмболии легочных артерий (ТЭЛА), ассоциированной с высокой частотой встречаемости факторов риска возникновения венозного тромбоза, множественные осложнения и значимая вероятность неблагоприятного исхода заболевания обусловливают совершенствование методов ее верификации. Существующие отечественные и мировые стандарты регламентируют определение вероятности ТЭЛА при острой боли в груди, потере сознания, одышке и кровохаркании, однако симптомы, часто выявляемые при легочной эмболии, являются также и проявлениями расслаивающей аневризмы грудного отдела аорты, ишемической болезни сердца (ИБС), пневмоторакса, туберкулеза, обструктивных, онкологических и гнойно-деструктивных заболеваний легких, острого нарушения мозгового кровообращения (ОНМК), а также межреберной невралгии при высокой выраженности болевого синдрома [1–4].
При попытке оценить вероятность ТЭЛА клинически часто случаются диагностические ошибки, которые становятся причиной позднего оказания специализированной помощи, гибели пациентов или формирования прогрессирующих осложнений, также ведущих к летальному исходу [5–8]. Так, несмотря на то, что в течение первых двух лет после эпизода симптомной ТЭЛА заболеваемость хронической постэмболической легочной гипертензией составляет 0,1–9,1% [9], в международном регистре зафиксировано, что 74,8% пациентов со стойким повышением давления в легочном стволе имели в анамнезе острую ТЭЛА [10], причем имеются данные и о более широком распространении этого синдрома — с встречаемостью у 5 человек на 1 млн. населения ежегодно [11].
Доказано [12–14], что развитие хронической постэмболической легочной гипертензии ухудшает не только качество жизни пациентов, но и прогноз заболевания, требует дорогостоящей пожизненной системной терапии или оперативного вмешательства в условиях искусственного кровообращения и гипотермии. Летальность и осложнения ложатся на здравоохранение и государство в целом дополнительным бременем экономических расходов, что, в частности, отчетливо продемонстрировано в недавних отечественных исследованиях и подтверждено зарубежными авторами [15–17].
Еще больше ситуацию усугубляет частое сочетание указанных заболеваний, так как онкопатология и поражение бронхолегочной и сердечно-сосудистой систем приводят к появлению гиперкоагуляции и замедлению кровотока, а при остро воспалительной реакции и деструктивном процессе — к поражению сосудистой стенки, т.е. формированию всех трех составляющих триады Вирхова — неотъемлемого компонента тромбообразования [18–20].
Предложены и продолжают разрабатываться методы и критерии дифференциальной диагностики монопатологии, среди которых наиболее активно развиваются лабораторные [21]. Одними из перспективных в этом направлении являются спектральные исследования, в частности инфракрасная (ИК) спектроскопия — раздел молекулярной оптической спектроскопии, изучающий спектры поглощения и отражения электромагнитного излучения в ИК-области, т.е. в диапазоне длин волн от 10–6 до 10–3 м. Этот объективный метод практически не требует дорогостоящих реактивов и расходных материалов при использовании и позволяет определить присутствие и динамику концентрации метаболитов, свидетельствуя о соответствующей патологии биохимического состава образца.
Целью исследования стало изучение возможностей ИК-спектроскопии в верификации ТЭЛА и ряда клинически сходных заболеваний.
Материалы и методы
Исследование проведено на базе клиник кафедры госпитальной хирургии им. Б.А. Королева совместно с кафедрой общей химии Приволжского исследовательского медицинского университета (Н. Новгород) в два этапа:
на первом этапе получали и сравнивали ИК-спектры сыворотки крови у 19 здоровых добровольцев и 30 пациентов с интраоперационно подтвержденной легочной тромбоэмболией;
на втором этапе получали и сравнивали ИК-спектры сыворотки крови при ТЭЛА и хронической обструктивной болезни легких (ХОБЛ) (n=10), пневмонии (n=10), туберкулезе (n=10), абсцессе (n=10) и раке легкого (n=10), ОНМК (n=10), ИБС (n=10).
Работа выполнена в соответствии с Хельсинкской декларацией (2013) и одобрена Этическим комитетом Приволжского исследовательского медицинского университета. От каждого пациента получено информированное согласие.
Забор крови для комплекса исследований проводили при поступлении пациентов утром из кубитальной вены, в объеме 5 мл, затем центрифугировали ее с частотой 1000 об./мин в течение 15 мин. Отделенную сыворотку в количестве 1,0 мл высушивали в сухожаровом шкафу в чашке Петри при температуре 25°С на протяжении 24 ч. Сухой остаток сыворотки измельчали и суспензировали в вазелиновом масле. Получение ИК-спектров высушенной сыворотки крови осуществляли на спектрофотометрах SPECORD 75 IR и М80 (Carl Zeiss, Германия) с фотометрической погрешностью 0,2%.
Сначала определяли высоту пиков полос поглощения с максимумами при 1165, 1160, 1150, 1100, 1070, 1050, 1025 см–1. Затем вычисляли значения отношений высот пиков полос поглощения (см–1/см–1): П1 — 1160/1165; П2 — 1165/1070; П3 — 1165/1150; П4 — 1165/1050; П5 — 1100/1050; П6 — 1025/1165.
Результаты и обсуждение
Результаты математической обработки ИК-спектров сыворотки крови здоровых добровольцев и больных ТЭЛА представили в виде лепестковых диаграмм (рис. 1).
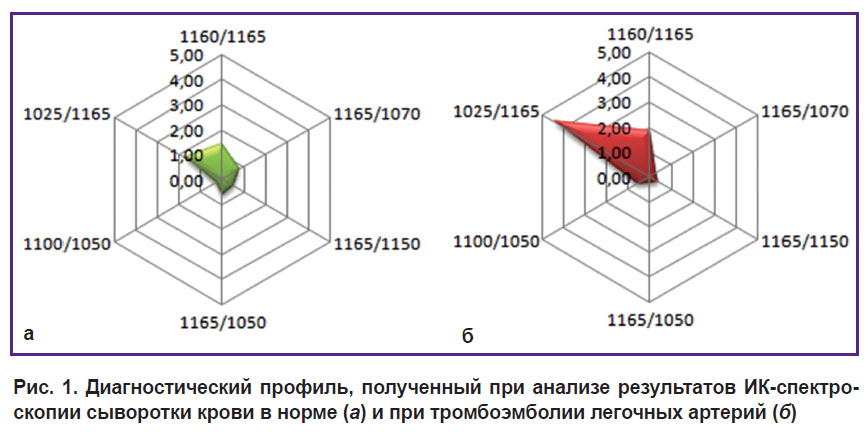
|
Рис. 1. Диагностический профиль, полученный при анализе результатов ИК-спектроскопии сыворотки крови в норме (а) и при тромбоэмболии легочных артерий (б) |
Полученные диагностически значимые ИК-спектры сыворотки крови позволили разработать способ диагностики ТЭЛА, основанный на дифференцировке молекулярных спектров сыворотки крови в области волновых чисел 1200–1000 см–1 (в ИК-диапазоне) [22].
Далее были получены и математически преобразованы в лепестковые диаграммы по тем же параметрам, что и для ТЭЛА, ИК-спектры сыворотки крови больных с ХОБЛ, пневмонией, туберкулезом, абсцессом, раком легкого, ОНМК, ИБС. Затем был проведен сравнительный анализ лепестковых диаграмм всех указанных нозологий с дифференциально-диагностическим профилем ТЭЛА.
Сравнение соотношений 1100/1050 и 1160/1165 демонстрирует разницу значений по всем изучаемым заболеваниям (p<0,001) и косвенно подтверждает наличие общих процессов в патогенезе всех указанных заболеваний (рис. 2).
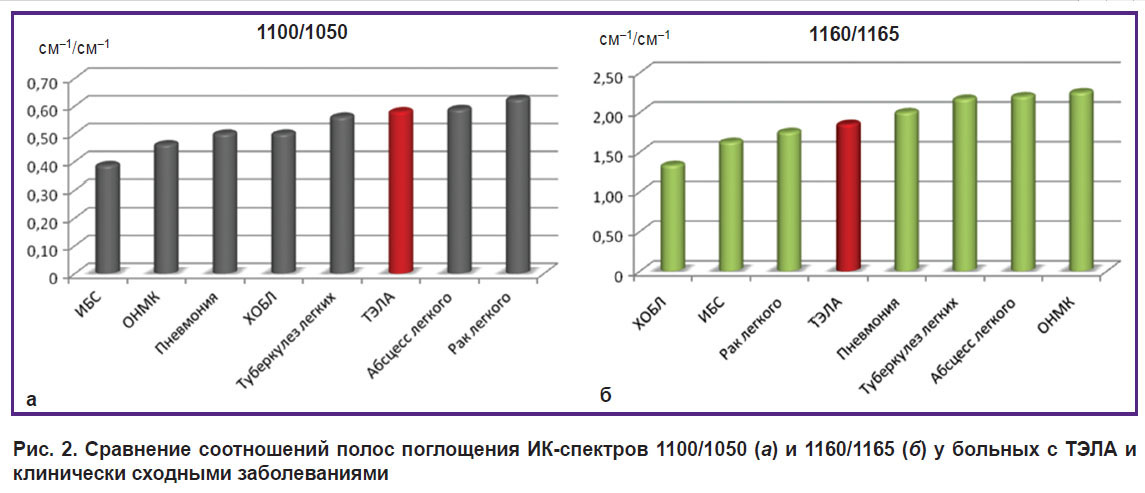
|
Рис. 2. Сравнение соотношений полос поглощения ИК-спектров 1100/1050 (а) и 1160/1165 (б) у больных с ТЭЛА и клинически сходными заболеваниями |
Разница соотношения 1025/1165 (рис. 3, а) была наиболее яркой для ИК-спектров сыворотки крови ИБС, ХОБЛ, ТЭЛА и ОНМК (p<0,001) и позволила дифференцировать абсцесс и туберкулез легкого (p<0,001), но была менее информативна для ХОБЛ и пневмонии, которые предпочтительнее было определять по соотношению 1165/1150, более типичному при хронической бронхообструкции (p<0,001) (рис. 3, б).
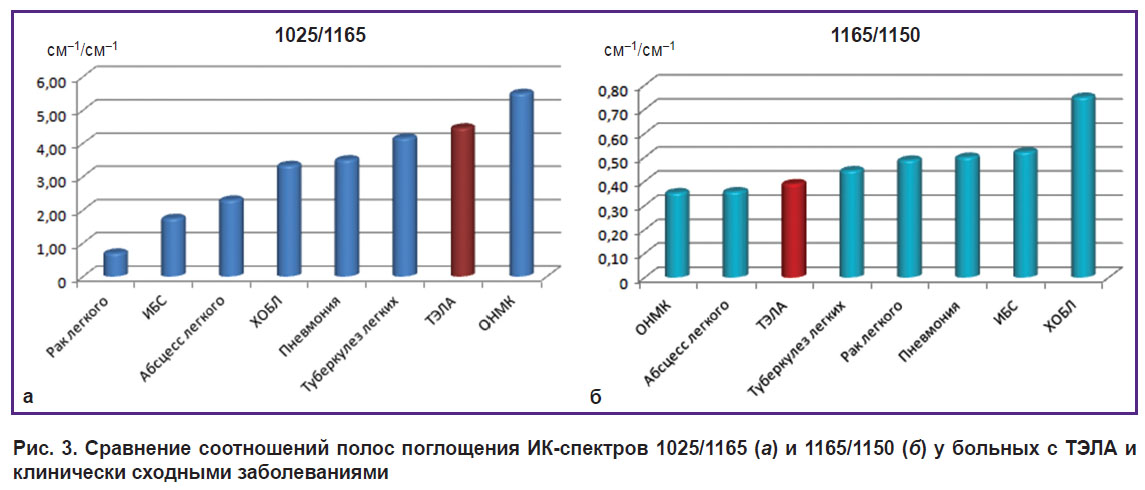
|
Рис. 3. Сравнение соотношений полос поглощения ИК-спектров 1025/1165 (а) и 1165/1150 (б) у больных с ТЭЛА и клинически сходными заболеваниями |
Высокое значение 1165/1050 фактически позволило подозревать наличие онкопатологии (p<0,001) (рис. 4).
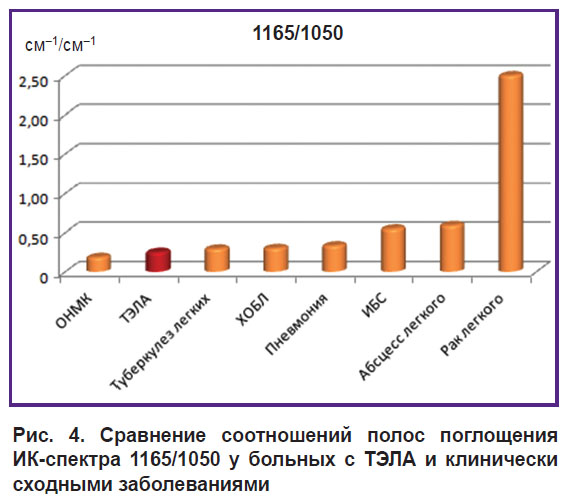
|
Рис. 4. Сравнение соотношений полос поглощения ИК-спектра 1165/1050 у больных с ТЭЛА и клинически сходными заболеваниями |
Соотношение 1165/1070 также показывало максимальное значение при раке легкого (p<0,001), но, в отличие от предыдущих графиков, наглядно демонстрировало разницу между ХОБЛ и пневмонией (p<0,001), позволило дифференцировать ТЭЛА и ИБС (p<0,001) (рис. 5).
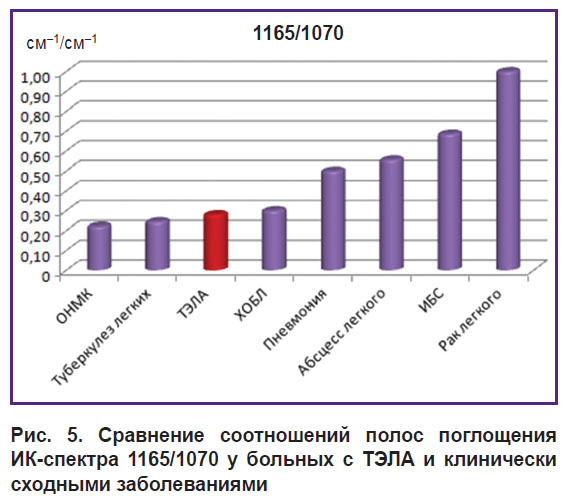
|
Рис. 5. Сравнение соотношений полос поглощения ИК-спектра 1165/1070у больных с ТЭЛА и клинически сходными заболеваниями |
Диаграмма, построенная с учетом всех параметров, стала наглядным дифференциальным диагностическим критерием для заболеваний, при верификации которых часто встречаются диагностические ошибки (рис. 6).
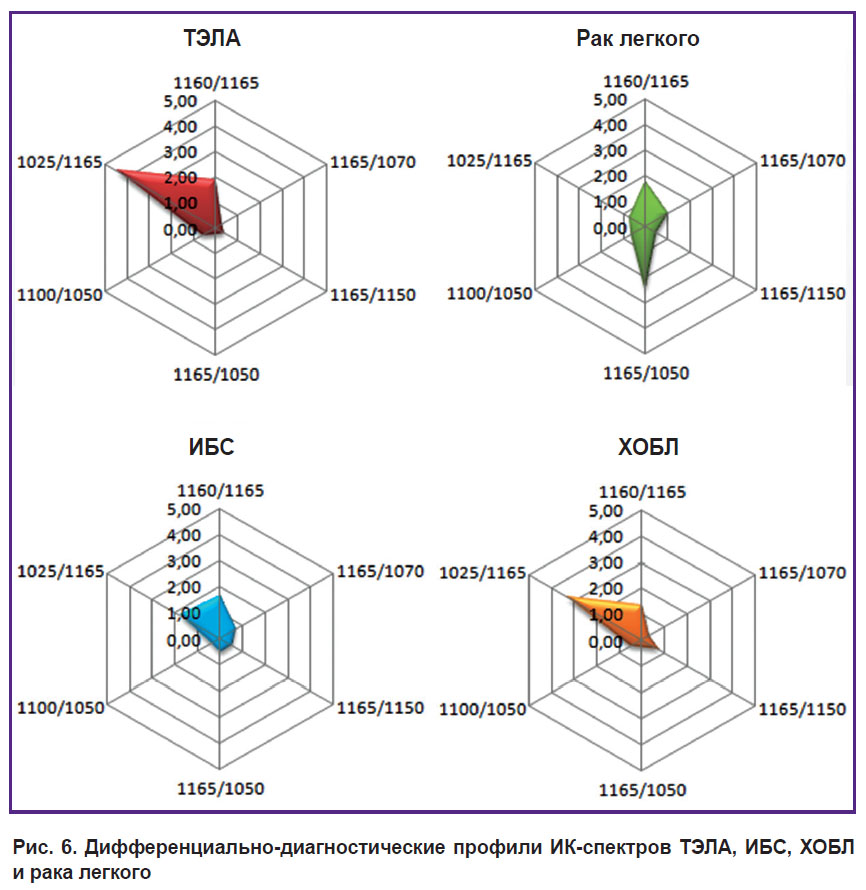
|
Рис. 6. Дифференциально-диагностические профили ИК-спектров ТЭЛА, ИБС, ХОБЛ и рака легкого |
Современные стандарты диагностики ТЭЛА регламентируют определение уровня D-димера, нормальные значения которого считаются значимым диагностическим критерием низкого риска тромбоэмболии, однако его уровень повышается при ДВС-синдроме, сепсисе и локальном воспалительном процессе, например при пневмонии, онкопатологии, недавнем оперативном вмешательстве или при наличии обширной гематомы, циррозе печени и инфаркте миокарда [23–24]. Диагностически значимые уровни мозгового или промозгового натрийуретических пептидов, а также тропонина I или Т являются маркерами в первую очередь сердечной недостаточности и также будут повышаться при ИБС, тяжелой ХОБЛ или двусторонней пневмонии с развитием правожелудочковой недостаточности [25–26], т.е. считаются критерием тяжести состояния, но при этом не позволяют верифицировать его этиологию [27].
В данной работе в основу дифференциальной диагностики ТЭЛА и клинически сходных заболеваний положены уникальные ИК-спектральные характеристики (положения максимумов полос, их полуширина, интенсивность) молекул, образующихся в ходе патологического метаболизма, инициированного ТЭЛА, поэтому полученные значения отличаются высоким уровнем индивидуальности, что и определяет их ценность при идентификации присутствия комбинаций органических соединений.
Несмотря на малый объем выборки по каждому заболеванию и большую неоднородность пациентов внутри каждой группы по степени выраженности основных клинических симптомов и данных лабораторных и инструментальных методов исследований, расчетные показатели продемонстрировали статистически значимую разницу ИК-спектров для изучаемых нозологий, дополняя друг друга и позволяя пошагово исключать абсцесс и туберкулез легкого, ХОБЛ и пневмонию, рак, ИБС, ОНМК и ТЭЛА.
Представленные лепестковые диаграммы, построенные с учетом значений всех отношений высот пиков полос поглощения с диагностически значимыми максимумами, позволили визуализировать ИК-профили, сделав дифференцировку ТЭЛА и ее клинических аналогов не только более объективной и достоверной, но и более наглядной.
Заключение
В ходе пилотной работы получены достоверные результаты, демонстрирующие потенциальную эффективность ИК-спектроскопии и, следовательно, целесообразность ее применения в дифференциальной диагностике ТЭЛА. Увеличение выборки позволит оценить чувствительность и специфичность данного метода исследования в сравнении с существующими стандартными схемами верификации легочной тромбоэмболии.
Финансирование исследования. Работа не поддерживалась никакими финансовыми источниками.
Конфликт интересов. Авторы подтверждают отсутствие конфликтов интересов.
Литература
- Багрова И.В., Кухарчик Г.А., Серебрякова В.И., Константинова И.В., Капутин М.Ю. Современные подходы к диагностике тромбоэмболии легочной артерии. Флебология 2012; 6(4): 35–42.
- Чучалин А.Г. Пульмонология. М: ГЭОТАР-Медиа; 2014; 800 с. URL: http://www.rosmedlib.ru/book/ISBN9785970427712.html.
- Черкасова Н.А., Сергеева Е.В. Дифференциальная диагностика при болях в грудной клетке. М: ГЭОТАР-Медиа; 2009.
- Jolobe O.M.P. Pulmonary embolism in the differential diagnosis of right ventricular myocardial infarction. Am J Emerg Med 2019; 37(8): 1591–1592, https://doi.org/10.1016/j.ajem.2019.05.059.
- Федченко Я.О., Протопопов А.В., Кочкина Т.А., Столяров Д.П., Константинов Е.П., Гавриков П.Г. Эффективность лечения тромбоэмболии легочной артерии в зависимости от сроков поступления больных в стационар. Международный журнал интервенционной кардиоангиологии 2010; 21: 33–36.
- Fang M.C., Fan D., Sung S.H., Witt D.M., Schmelzer J.R., Williams M.S., Yale S.H., Baumgartner C., Go A.S. Treatment and outcomes of acute pulmonary embolism and deep venous thrombosis: the CVRN VTE Study. Am J Med 2019; 132(12): 1450–1457.E1, https://doi.org/10.1016/j.amjmed.2019.05.040.
- O’Connell C., Montani D., Savale L., Sitbon O., Parent F., Seferian A., Bulifon S., Fadel E., Mercier O., Mussot S., Fabre D., Dartevelle P., Humbert M., Simonneau G., Jaïs X. Chronic thromboembolic pulmonary hypertension. La Presse Médicale 2015; 44(12 Pt 2): e409–e416, https://doi.org/10.1016/j.lpm.2015.10.010.
- Tudela P., Mòdol J.M., Rego M.J., Bonet M., Vilaseca B., Tor J. Error diagnóstico en urgencias: relación con el motivo de consulta, mecanismos y trascendencia clínica. Med Clin (Barc) 2005; 125(10): 366–370, https://doi.org/10.1157/13079168.
- Lang I.M., Pesavento R., Bonderman D., Yuan J.X.-J. Risk factors and basic mechanisms of chronic thromboembolic pulmonary hypertension: a current understanding. Eur Respir J 2013; 41(2): 462–468, https://doi.org/10.1183/09031936.00049312.
- Pepke-Zaba J., Delcroix M., Lang I., Mayer E., Jansa P., Ambroz D., Treacy C., D’Armini A.M., Morsolini M., Snijder R., Bresser P., Torbicki A., Kristensen B., Lewczuk J., Simkova I., Barberà J.A., de Perrot M., Hoeper M.M., Gaine S., Speich R., Gomez-Sanchez M.A., Kovacs G., Hamid A.M., Jaïs X., Simonneau G. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation 2011; 124(18): 1973–1981, https://doi.org/10.1161/circulationaha.110.015008.
- Pepke-Zaba J., Jansa P., Kim N.H., Naeije R., Simonneau G. Chronic thromboembolic pulmonary hypertension: role of medical therapy. Eur Respir J 2013; 41(4): 985–990, https://doi.org/10.1183/09031936.00201612.
- Yandrapalli S., Tariq S., Kumar J., Aronow W.S., Malekan R., Frishman W.H., Lanier G.M. Chronic thromboembolic pulmonary hypertension: epidemiology, diagnosis, and management. Cardiol Rev 2018; 26(2): 62–72, https://doi.org/10.1097/crd.0000000000000164.
- Nižňanský M., Ambrož D., Prskavec T., Jansa P., Lindner J. Surgical treatment of chronic thromboembolic pulmonary hypertension. Vnitr Lek 2019; 65(5): 353–358.
- Jenkins D., Madani M., Fadel E., D’Armini A.M., Mayer E. Pulmonary endarterectomy in the management of chronic thromboembolic pulmonary hypertension. Eur Respir Rev 2017; 26(143): 160111, https://doi.org/10.1183/16000617.0111-2016.
- Чазова И.Е., Мартынюк Т.В., Валиева З.С., Наконечников С.Н., Недогода С.В., Саласюк А.С., Таран И.Н., Грацианская С.Е. Оценка бремени хронической тромбоэмболической легочной гипертензии в Российской Федерации. Терапевтический архив 2018; 90(9): 101–109.
- Grosse S.D., Nelson R.E., Nyarko K.A., Richardson L.C., Raskob G.E. The economic burden of incident venous thromboembolism in the United States: a review of estimated attributable healthcare costs. Thromb Res 2016; 137: 3–10, https://doi.org/10.1016/j.thromres.2015.11.033.
- Kirson N.Y., Birnbaum H.G., Ivanova J.I., Waldman T., Joish V., Williamson T. Excess costs associated with patients with chronic thromboembolic pulmonary hypertension in a US privately insured population. Appl Health Econ Health Policy 2011; 9(6): 377–387, https://doi.org/10.2165/11592440-000000000-00000.
- Grobben R.B., Frima C., Nathoe H.M., Leiner T., Kwakkel-van Erp J.M., van Klei W.A., Peelen L.M., van Herwaarden J.A. Pulmonary embolism after endovascular aortic repair, a retrospective cohort study. Eur J Vasc Endovasc Surg 2019; 57(2): 304–310, https://doi.org/10.1016/j.ejvs.2018.08.054.
- Hyde Congo K., Tomás A., Laranjeira Á., Afonso D., Fragata J. Type B aortic dissection with retrograde intramural hematoma and pulmonary embolism. Rev Port Cir Cardiotorac Vasc 2018; 25(1–2): 73–76.
- Ruiz-Artacho P., Trujillo-Santos J., López-Jiménez L., Font C., Díaz-Pedroche M.D.C., Sánchez Muñoz-Torrero J.F., Peris M.L., Skride A., Maestre A., Monreal M.; RIETE Investigators. Clinical characteristics and outcomes of patients with lung cancer and venous thromboembolism. TH Open 2018; 2(2): e210–e217, https://doi.org/10.1055/s-0038-1656542.
- Ateş H., Ateş İ., Bozkurt B., Çelik H.T., Özol D., Yldrm Z. What is the most reliable marker in the differential diagnosis of pulmonary embolism and community-acquired pneumonia? Blood Coagul Fibrinolysis 2016; 27(3): 252–258, https://doi.org/10.1097/mbc.0000000000000391.
- Гордецов А.С., Красникова О.В., Немирова С.В., Медведев А.П. Способ диагностики тромбоэмболии легочных артерий. Патент РФ 2527346. 2014.
- Zhang Y., Zhou Q., Zou Y., Song X., Xie S., Tan M., Zhang G., Wang C. Risk factors for pulmonary embolism in patients preliminarily diagnosed with community-acquired pneumonia: a prospective cohort study. J Thromb Thrombolysis 2016; 41(4): 619–627, https://doi.org/10.1007/s11239-015-1275-6.
- Olson J.D., Adcock D.M., Bush T.A., de Moerloose P., Gardiner C., Ginyard V.R., Grimaux M., McMahan C.A., Prihoda T.J., Rico-Lazarowski A., Sales M., Stang L., Trumbull K., Van Cott E., Wissel T. Quantitative D-dimer for exclusion of venous thromboembolic disease; approved guideline. H-59A. Clinical and Laboratory Standards Institute; 2011.
- Zhang C., Jiang L., Xu L., Tian J., Liu J., Zhao X., Feng X., Wang D., Zhang Y., Sun K., Xu B., Zhao W., Hui R., Gao R., Yuan J., Song L. Implications of N-terminal pro-B-type natriuretic peptide in patients with three-vessel disease. Eur Heart J 2019; 40(41): 3397–3405, https://doi.org/10.1093/eurheartj/ehz394.
- Lin S.C., Tsai Y.J., Huang C.T., Kuo Y.W., Ruan S.Y., Chuang Y.C., Yu C.J. Prognostic value of plasma N-terminal pro B-type natriuretic peptide levels in pneumonia patients requiring intensive care unit admission. Respirology 2013; 18(6): 933–941, https://doi.org/10.1111/resp.12096.
- Mueller C., McDonald K., de Boer R.A., Maisel A., Cleland J.G.F., Kozhuharov N., Coats A.J.S., Metra M., Mebazaa A., Ruschitzka F., Lainscak M., Filippatos G., Seferovic P.M., Meijers W.C., Bayes-Genis A., Mueller T., Richards M., Januzzi J.L.J.; Heart Failure Association of the European Society of Cardiology. Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations. Eur J Heart Fail 2019; 21(6): 715–731, https://doi.org/10.1002/ejhf.1494.










