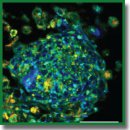
3D-модель опухолевого сфероида из краткосрочных культур клеток глиобластомы пациента и ее исследование методом метаболического флуоресцентного времяразрешенного имиджинга
Пациент-специфические in vitro модели опухолей являются перспективной платформой для изучения механизмов онкогенеза и персонифицированного подбора лекарственных препаратов. В случае глиальных опухолей мозга создание и использование таких моделей особенно актуально, так как эффективность лечения этих опухолей остается крайне неудовлетворительной.
Цель исследования — разработка 3D-модели опухолевого сфероида глиобластомы на основе операционного материала пациента и исследование ее метаболических особенностей методом флуоресцентной времяразрешенной микроскопии метаболических коферментов.
Материалы и методы. В работе использованы образцы опухолей пациентов с диагнозом «глиобластома, Grade IV». Для создания сфероидов из фрагментов опухолевой ткани выделены краткосрочные культуры, охарактеризованы морфологически и иммуноцитохимически и высажены в круглодонные низкоадгезивные планшеты. Количество клеток для посадки выбрано эмпирически. Проведено сравнение особенностей роста клеточных культур и сфероидов из глиобластом пациентов с библиотечной линией глиобластомы человека U373 MG. Визуализацию автофлуоресценции метаболических коферментов никотинамидадениндинуклеотида (фосфата) НАД(Ф)Н и флавинадениндинуклеотида (ФАД) в сфероидах осуществляли с помощью лазерного сканирующего микроскопа LSM 880 (Carl Zeiss, Германия) с FLIM-модулем (Becker & GmbH, Германия). Параметры затухания автофлуоресценции исследованы в условиях нормоксии и гипоксии (3,5% О2).
Результаты. Разработан оригинальный протокол культивирования 3D-сфероидов глиобластомы. Получены и охарактеризованы краткосрочные глиальные культуры из операционного материала пациентов. Выделенные клетки глиобластом имели веретенообразную морфологию с многочисленными отростками и выраженную зернистость цитоплазмы. Все культуры экспрессировали глиальный кислый фибриллярный белок GFAP. Подобрана оптимальная доза посева — 2000 клеток на лунку, приводящая к формированию сфероидов с плотной структурой и стабильным ростом в течение 7 дней. Методом FLIM установлено, что клетки сфероидов из материала пациентов имеют в целом схожий метаболизм со сфероидами из библиотечной линии глиобластомы, однако демонстрируют более выраженную метаболическую гетерогенность. При культивировании сфероидов в условиях гипоксии зарегистрирован более гликолитический тип метаболизма, что выражается в увеличении вклада свободной формы НАД(Ф)Н в затухание флуоресценции.
Заключение. Разработанная модель опухолевых сфероидов из глиобластомы пациентов с использованием краткосрочных культур в комбинации с методом FLIM-имиджинга может служить инструментом для исследования особенностей опухолевого метаболизма и разработки предиктивных тестов для оценки эффективности противоопухолевой терапии.
- Oronsky B., Reid T.R., Oronsky A., Sandhu N., Knox S.J. A review of newly diagnosed glioblastoma. Front Oncol 2020; 10: 574012, https://doi.org/10.3389/fonc.2020.574012.
- Zhang C., Jin M., Zhao J., Chen J., Jin W. Organoid models of glioblastoma: advances, applications and challenges. Am J Cancer Res 2020; 10(8): 2242–2257.
- da Hora C.C., Schweiger M.W., Wurdinger T., Tannous B.A. Patient-derived glioma models: from patients to dish to animals. Cells 2019; 8(10): 1177, https://doi.org/10.3390/cells8101177.
- Rybin M.J., Ivan M.E., Ayad N.G., Zeier Z. Organoid models of glioblastoma and their role in drug discovery. Front Cell Neurosci 2021; 15: 605255, https://doi.org/10.3389/fncel.2021.605255.
- Paolillo M., Comincini S., Schinelli S. In vitro glioblastoma models: a journey into the third dimension. Cancers (Basel) 2021; 13(10): 2449, https://doi.org/10.3390/cancers13102449.
- Haddad A.F., Young J.S., Amara D., Berger M.S., Raleigh D.R., Aghi M.K., Butowski N.A. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv 2021; 3(1): vdab100, https://doi.org/10.1093/noajnl/vdab100.
- Browning A.P., Sharp J.A., Murphy R.J., Gunasingh G., Lawson B., Burrage K., Haass N.K., Simpson M. Quantitative analysis of tumour spheroid structure. Elife 2021; 10: e73020, https://doi.org/10.7554/elife.73020.
- Han S.J., Kwon S., Kim K.S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int 2021; 21(1): 152, https://doi.org/10.1186/s12935-021-01853-8.
- Yuzhakova D.V., Shirmanova M.V., Klimenko V.V., Lukina M.M., Gavrina A.I., Komarova A.D., Gorbachev D.A., Sapogova N.V., Lukyanov K.A., Kamensky V.A. PDT with genetically encoded photosensitizer miniSOG on a tumor spheroid model: a comparative study of continuous-wave and pulsed irradiation. Biochim Biophys Acta Gen Subj 2021; 1865(12): 129978, https://doi.org/10.1016/j.bbagen.2021.129978.
- Perche F., Torchilin V.P. Cancer cell spheroids as a model to evaluate chemotherapy protocols. Cancer Biol Ther 2012; 13(12): 1205–1213, https://doi.org/10.4161/cbt.21353.
- Zhu Y., Kang E., Wilson M., Basso T., Chen E., Yu Y., Li Y.R. 3D tumor spheroid and organoid to model tumor microenvironment for cancer immunotherapy. Organoids 2022; 1(2): 149–167, https://doi.org/10.3390/organoids1020012.
- Hofmann S., Cohen-Harazi R., Maizels Y., Koman I. Patient-derived tumor spheroid cultures as a promising tool to assist personalized therapeutic decisions in breast cancer. Transl Cancer Res 2022; 11(1): 134–147, https://doi.org/10.21037/tcr-21-1577.
- Morelli M., Lessi F., Barachini S., Liotti R., Montemurro N., Perrini P., Santonocito O.S., Gambacciani C., Snuderl M., Pieri F., Aquila F., Farnesi A., Naccarato A.G., Viacava P., Cardarelli F., Ferri G., Mulholland P., Ottaviani D., Paiar F., Liberti G., Pasqualetti F., Menicagli M., Aretini P., Signore G., Franceschi S., Mazzanti C.M. Metabolic-imaging of human glioblastoma live tumors: a new precision-medicine approach to predict tumor treatment response early. Front Oncol 2022; 12: 969812, https://doi.org/10.3389/fonc.2022.969812.
- Martínez-Reyes I., Chandel N.S. Cancer metabolism: looking forward. Nat Rev Cancer 2021; 21(10): 669–680, https://doi.org/10.1038/s41568-021-00378-6.
- Läsche M., Emons G., Gründker C. Shedding new light on cancer metabolism: a metabolic tightrope between life and death. Front Oncol 2020; 10: 409, https://doi.org/10.3389/fonc.2020.00409.
- Chae H.S., Hong S.T. Overview of cancer metabolism and signaling transduction. Int J Mol Sci 2022; 24(1): 12, https://doi.org/10.3390/ijms24010012.
- Tong Y., Gao W.Q., Liu Y. Metabolic heterogeneity in cancer: an overview and therapeutic implications. Biochim Biophys Acta Rev Cancer 2020; 1874(2): 188421, https://doi.org/10.1016/j.bbcan.2020.188421.
- Kim J., DeBerardinis R.J. Mechanisms and implications of metabolic heterogeneity in cancer. Cell Metab 2019; 30(3): 434–446, https://doi.org/10.1016/j.cmet.2019.08.013.
- Kolenc O.I., Quinn K.P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxid Redox Signal 2019; 30(6): 875–889, https://doi.org/10.1089/ars.2017.7451.
- Shirshin E.A., Shirmanova M.V., Gayer A.V., Lukina M.M., Nikonova E.E., Yakimov B.P., Budylin G.S., Dudenkova V.V., Ignatova N.I., Komarov D.V., Yakovlev V.V., Becker W., Zagaynova E.V., Shcheslavskiy V.I., Scully M.O. Label-free sensing of cells with fluorescence lifetime imaging: the quest for metabolic heterogeneity. Proc Natl Acad Sci U S A 2022; 119(9): e2118241119, https://doi.org/10.1073/pnas.2118241119.
- Ouyang Y., Liu Y., Wang Z.M., Liu Z., Wu M. FLIM as a promising tool for cancer diagnosis and treatment monitoring. Nanomicro Lett 2021; 13(1): 133, https://doi.org/10.1007/s40820-021-00653-z.
- Blacker T.S., Mann Z.F., Gale J.E., Ziegler M., Bain A.J., Szabadkai G., Duchen M.R. Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nat Commun 2014; 5: 3936, https://doi.org/10.1038/ncomms4936.
- Skala M.C., Riching K.M., Bird D.K., Gendron-Fitzpatrick A., Eickhoff J., Eliceiri K.W., Keely P.J., Ramanujam N. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. J Biomed Opt 2007; 12(2): 024014, https://doi.org/10.1117/1.2717503.
- Alam S.R., Wallrabe H., Svindrych Z., Chaudhary A.K., Christopher K.G., Chandra D., Periasamy A. Investigation of mitochondrial metabolic response to doxorubicin in prostate cancer cells: an NADH, FAD and tryptophan FLIM assay. Sci Rep 2017; 7(1): 10451, https://doi.org/10.1038/s41598-017-10856-3.
- Boucherit N., Gorvel L., Olive D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol 2020; 11: 603640, https://doi.org/10.3389/fimmu.2020.603640.
- Hirschhaeuser F., Menne H., Dittfeld C., West J., Mueller-Klieser W., Kunz-Schughart L.A. Multicellular tumor spheroids: an underestimated tool is catching up again. J Biotechnol 2010; 148(1): 3–15, https://doi.org/10.1016/j.jbiotec.2010.01.012.
- Abdolahi S., Ghazvinian Z., Muhammadnejad S., Saleh M., Asadzadeh Aghdaei H., Baghaei K. Patient-derived xenograft (PDX) models, applications and challenges in cancer research. J Transl Med 2022; 20(1): 206, https://doi.org/10.1186/s12967-022-03405-8.
- Yoshida G.J. Applications of patient-derived tumor xenograft models and tumor organoids. J Hematol Oncol 2020; 13(1): 4, https://doi.org/10.1186/s13045-019-0829-z.
- Chen C., Lin W., Huang Y., Chen X., Wang H., Teng L. The essential factors of establishing patient-derived tumor model. J Cancer 2021; 12(1): 28–37, https://doi.org/10.7150/jca.51749.
- Aaberg-Jessen C., Nørregaard A., Christensen K., Pedersen C.B., Andersen C., Kristensen B.W. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. Int J Clin Exp Pathol 2013; 6(4): 546–560.
- Witusik-Perkowska M., Rieske P., Hułas-Bigoszewska K., Zakrzewska M., Stawski R., Kulczycka-Wojdala D., Bieńkowski M., Stoczyńska-Fidelus E., Grešner S.M., Piaskowski S., Jaskólski D.J., Papierz W., Zakrzewski K., Kolasa M., Ironside J.W., Liberski P.P. Glioblastoma-derived spheroid cultures as an experimental model for analysis of EGFR anomalies. J Neurooncol 2011; 102(3): 395–407, https://doi.org/10.1007/s11060-010-0352-0.
- Stadler M., Scherzer M., Walter S., Holzner S., Pudelko K., Riedl A., Unger C., Kramer N., Weil B., Neesen J., Hengstschläger M., Dolznig H. Exclusion from spheroid formation identifies loss of essential cell-cell adhesion molecules in colon cancer cells. Sci Rep 2018; 8(1): 1151, https://doi.org/10.1038/s41598-018-19384-0.
- Lukina M.M., Dudenkova V.V., Ignatova N.I., Druzhkova I.N., Shimolina L.E., Zagaynova E.V., Shirmanova M.V. Metabolic cofactors NAD(P)H and FAD as potential indicators of cancer cell response to chemotherapy with paclitaxel. Biochim Biophys Acta Gen Subj 2018; 1862(8): 1693–1700, https://doi.org/10.1016/j.bbagen.2018.04.021.
- Shirmanova M.V., Druzhkova I.N., Lukina M.M., Matlashov M.E., Belousov V.V., Snopova L.B., Prodanetz N.N., Dudenkova V.V., Lukyanov S.A., Zagaynova E.V. Intracellular pH imaging in cancer cells in vitro and tumors in vivo using the new genetically encoded sensor SypHer2. Biochim Biophys Acta 2015; 1850(9): 1905–1911, https://doi.org/10.1016/j.bbagen.2015.05.001.
- Pasch C.A., Favreau P.F., Yueh A.E., Babiarz C.P., Gillette A.A., Sharick J.T., Karim M.R., Nickel K.P., DeZeeuw A.K., Sprackling C.M., Emmerich P.B., DeStefanis R.A., Pitera R.T., Payne S.N., Korkos D.P., Clipson L., Walsh C.M., Miller D., Carchman E.H., Burkard M.E., Lemmon K.K., Matkowskyj K.A., Newton M.A., Ong I.M., Bassetti M.F., Kimple R.J., Skala M.C., Deming D.A. Patient-derived cancer organoid cultures to predict sensitivity to chemotherapy and radiation. Clin Cancer Res 2019; 25(17): 5376–5387, https://doi.org/10.1158/1078-0432.ccr-18-3590.
- Sharick J.T., Walsh C.M., Sprackling C.M., Pasch C.A., Pham D.L., Esbona K., Choudhary A., Garcia-Valera R., Burkard M.E., McGregor S.M., Matkowskyj K.A., Parikh A.A., Meszoely I.M., Kelley M.C., Tsai S., Deming D.A., Skala M.C. Metabolic heterogeneity in patient tumor-derived organoids by primary site and drug treatment. Front Oncol 2020; 10: 553, https://doi.org/10.3389/fonc.2020.00553.
- Park J.H., Lee H.K. Current understanding of hypoxia in glioblastoma multiforme and its response to immunotherapy. Cancers Basel 2022; 14(5): 1176, https://doi.org/10.3390/cancers14051176.
- Sebestyén A., Kopper L., Dankó T., Tímár J. Hypoxia signaling in cancer: from basics to clinical practice. Pathol Oncol Res 2021; 27: 1609802, https://doi.org/10.3389/pore.2021.1609802.
- Shirmanova M.V., Druzhkova I.N., Lukina M.M., Dudenkova V.V., Ignatova N.I., Snopova L.B., Shcheslavskiy V.I., Belousov V.V., Zagaynova E.V. Chemotherapy with cisplatin: insights into intracellular pH and metabolic landscape of cancer cells in vitro and in vivo. Sci Rep 2017; 7(1): 8911, https://doi.org/10.1038/s41598-017-09426-4.










