КНИ-биосенсор новой топологии для детекции маркера острого инфаркта миокарда — тропонина I
Перспективным устройством для детекции биологических молекул, в частности таких как тропонин I, является биосенсор на основе полевых транзисторов на структурах кремний-на-изоляторе (КНИ-биосенсор), который позволяет проводить анализ в режиме реального времени без использования меток.
Цель исследования — разработка конструкции КНИ-биосенсора для детекции маркера острого инфаркта миокарда — тропонина I.
Особенность биосенсора состояла в интеграции двух электродов заземления непосредственно на поверхность биосенсора, что эффективно уменьшало статический потенциал жидкого образца, а также сводило к минимуму физические поломки конструктивных элементов устройства.
Материалы и методы. Для специфической детекции маркера в качестве рецепторов использовали высокоспецифичный анти-тропонин I ДНК-аптамер. Иммобилизацию аптамера на поверхность биосенсора проводили методом физической адсорбции. Анализируемый диапазон целевого тропонина I составил 10–11–10–9 моль/л, что соответствует клиническому уровню белка в биологической пробе при остром инфаркте миокарда. В течение эксперимента поддерживалось постоянное напряжение — Vds=0,15 В.
Результаты. КНИ-биосенсор успешно обнаружил целевые молекулы тропонина I в концентрации 10–11 моль/л, время анализа занимало примерно 200–300 с на одну пробу. В процессе детекции выявлено заметное снижение тока биосенсора. Это свидетельствует о том, что образующийся комплекс «тропонин I + анти-тропонин I ДНК-аптамер» обладает отрицательным эффективным электрическим зарядом на границе раздела фаз «жидкая проба–нанопроволока».
Введение
По данным Всемирной организации здравоохранения, ишемическая болезнь сердца (ИБС) занимает ведущее место среди основных причин смертности [1]. Нарушение кровоснабжения сердечной мышцы может привести к развитию инфаркта миокарда (ИМ), вызванного атеросклеротическим поражением артерий и последующими некротическими процессами в сердечной ткани [2]. Степень поражения сердечной мышцы напрямую коррелирует со временем, прошедшим с момента начала заболевания и восстановления проходимости пораженных сосудов, поэтому своевременная и точная диагностика играет решающую роль в оказании оперативной помощи пациенту.
Одним из диагностических подходов для выявления заболевания является обнаружение молекулярных маркеров, связанных с ИМ. Главным маркером, измеряемым в крови пациентов, считается тропонин I (cTnI) [3]. Этот белок обладает высокой клинической чувствительностью к ИМ и демонстрирует практически исключительную специфичность к ткани миокарда [4–8]. Повышенные уровни cTnI в кровотоке указывают на гибель сократительных клеток миокарда [6]. Обычно нормальные концентрации cTnI в сыворотке составляют менее 0,6 нг/мл (приблизительно 2,5×10–11 М) [9, 10]. Незначительное повреждение миокарда можно наблюдать при концентрациях cTnI в диапазоне от 0,7 до 1,4 нг/мл, тогда как некротическое повреждение миокарда проявляется при концентрациях белка, превышающих 1,5 нг/мл [9].
Современным и перспективным методом детекции тропонина I является биосенсор на основе полевых транзисторов на структурах кремний-на-изоляторе (КНИ-биосенсор) [11–14], который позволяет проводить анализ в режиме реального времени без использования меток. Кроме того, на его основе можно создать портативный инструмент для мультикомплексного анализа различных биологических частиц (белков, вирусных частиц, нуклеиновых кислот и т.д.) [8, 11, 12, 15, 16].
КНИ-биосенсор включает в себя два основных компонента: рецепторный слой (содержит антитела, аптамеры, ферменты и т.д.) и трансдьюсер — полевой транзистор, состоящий из кремниевой нанопроволоки, расположенной между электродами истока и стока [9]. Слой рецептора обеспечивает биоспецифическое распознавание целевой молекулы: взаимодействие между рецептором и целевой молекулой генерирует химический или физический сигнал. Затем этот сигнал преобразуется в электрический выходной сигнал трансдьюсером [8, 11, 15, 17–19]. Широкое применение получили КНИ-биосенсоры, в которых электрод заземления вводится непосредственно в анализируемую жидкую пробу по принципу «сверху» для устранения случайного электрического потенциала, вызванного ионами и заряженными молекулами [15, 17, 18, 20–22].
На рис. 1 показаны вариант конструкции и электрическая принципиальная схема подключения КНИ-биосенсора [11, 13, 15, 18, 20, 23, 24].
Относительно недавно в качестве рецепторов было предложено использовать аптамеры [25–30]. Они представляют собой короткие синтетические одноцепочечные дезокси- или рибоолигонуклеотиды, которые имеют уникальную форму и могут избирательно связываться с соответствующей целевой молекулой [29–31]. Подобно антителам, аптамеры проявляют высокую аффинность связывания.
Использование КНИ-биосенсора для детекции cTnI и других биологических молекул осложнено рядом проблем, включая топологию и конструкцию биосенсора, оптимальные условия подготовки поверхности и вероятность того, что целевые молекулы адсорбируются на поверхность биосенсора [13, 15, 16, 20, 24, 32].
Цель исследования — разработка конструкции КНИ-биосенсора для детекции маркера острого инфаркта миокарда — тропонина I.
Материалы и методы
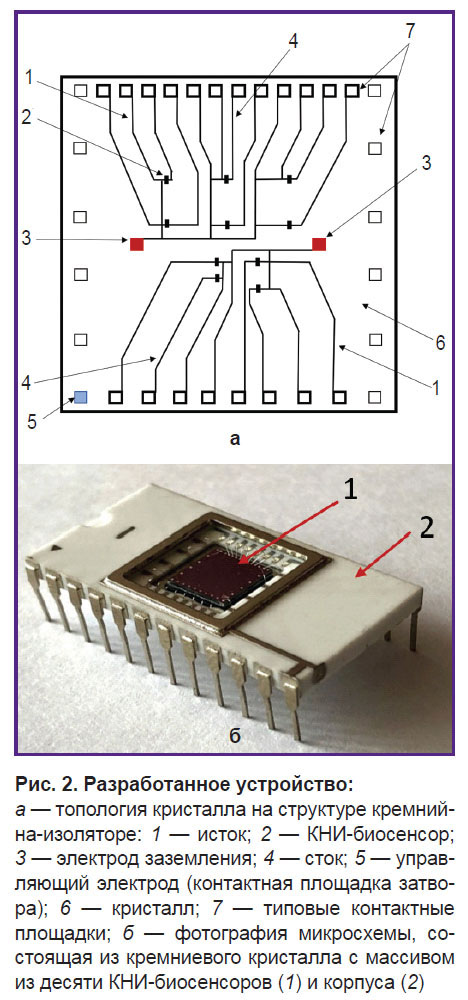
Структура КНИ-биосенсора. Разработана конструкция КНИ-биосенсора с двумя интегрированными электродами заземления на поверхности кристалла микросхемы. Топология кристалла и конструкция КНИ-биосенсора представлены на рис. 2 и 3 соответственно. Нестандартное изделие изготавливали на АО «Новосибирский завод полупроводниковых приборов Восток».
Массив из десяти КНИ-биосенсоров с n-типом проводимости сформирован на кремниевом кристалле размером 6×6 мм (рис. 2, а). Толщина слоя кремния (Si-SUB) составила 28–30 нм, слоя скрытого диэлектрика (SiO2) — 200 нм. Тыльная сторона кристалла приклеена к корпусу микросхемы, контакты осуществлены с помощью алюминиевых проводов. Нанопроволока (NW) биосенсора обладала следующими геометрическими характеристиками: высота (H) — от 20 до 30 нм, ширина (W) — 3 мкм и длина (L) — 10 мкм.
КНИ-биосенсоры подключены одним выходом к электроду заземления (3) и истоку (1). Второй выход подключен к контактным площадкам, выполняющим функцию стока, — 4 (см. рис. 2, а).
КНИ-биосенсоры подключены к источнику постоянного напряжения — Vds (см. рис. 3). Режим работы биосенсора — Vds=0,15 В.
Материалы. В работе использовалихлорид натрия (NaCl), хлорид калия (KCl), гидрофосфат динатрия (Na2HPO4), дигидрофосфат калия (KH2PO4), хлорид магния (MgCl2), этанол (C2H5OH) производства Sigma-Aldrich (США) и рекомбинантный сердечный тропонин I (cTnI) — HyTest (Финляндия).
Высокоспецифичный анти-тропонин I ДНК-аптамер (TnAp12t2) (5’-GGAAGACAAGACATCGGGAGGGAGGGAGGGCAGTCTAGTCTCATGTGTTTCCATGGTTC-3’) отобран методом SELEX с использованием биолюминесцентных репортеров для мониторинга обогащения ДНК-библиотек и оценки аффинности полученных кандидатных последовательностей [33]. Константа диссоциации (KD) комплекса «тропонин I + анти-тропонин I ДНК-аптамер» составила 6×10–9 моль/л [33].
Перед экспериментом аптамер термически денатурировали при 90°C в течение 5 мин в связывающем буфере (0,15 моль/л NaCl, 50 ммоль/л K-Na фосфатного буфера (рН=7,0) и 1 ммоль/л MgCl2). Затем аптамер ренатурировали при комнатной температуре в течение 15 мин. Растворы TnAp12t2 и cTnI разбавляли дистиллированной водой (рН=5,9) непосредственно перед экспериментом для снижения ионной силы и проводимости растворов [23, 34].
Измерение. Модификацию поверхности КНИ-биосенсора для создания рецепторного слоя осуществляли посредством физической адсорбции [35]. На начальном этапе поверхность биосенсора промывали 96% этанолом, затем дистиллированной водой. Далее на поверхность наносили 5 мкл TnAp12t2 (CA=10–8 моль/л) и инкубировали в течение нескольких минут [36]. Сигналы биосенсора регистрировали непрерывно (в режиме реального времени) на протяжении всего эксперимента. После внесения аптамера и стабилизации сигнала на поверхность добавляли 5 мкл cTnI в диапазоне концентраций CT=10–11–10–9 моль/л.
Сигналом КНИ-биосенсора служило изменение тока в цепи исток–сток (Ids) при адсорбции биологических молекул, таких как аптамеры или комплекс «тропонин I + анти-тропонин I ДНК-аптамер», на поверхность нанопроволоки. Ток измеряли с помощью амперметра PXIe 4163 (National Instruments, США). Напряжение в цепи исток–сток (Vds=0,15 В) поддерживали постоянным с помощью устройства PXI 4135 (National Instruments, США). Напряжение, подаваемое на подзатвор датчика, выбирали в диапазоне Vbg=0–30 В. Собранные данные визуализировали в виде временнóй зависимости тока исток–сток — Ids(t).
Результаты
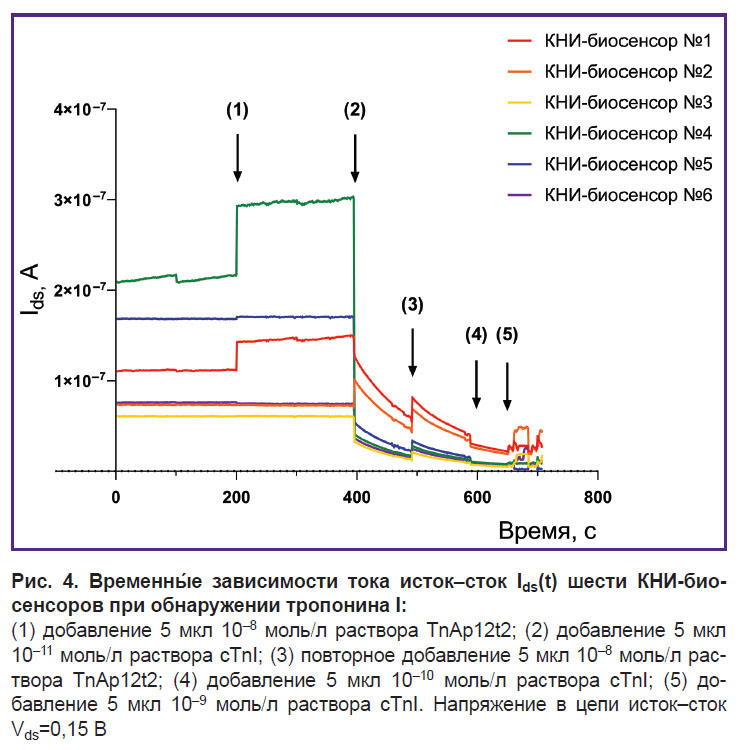
Временны´е зависимости тока исток–сток Ids(t) КНИ-биосенсоров представлены на рис. 4. Установлено, что ток шести КНИ-биосенсоров изменялся в ходе эксперимента. Другие четыре КНИ-биосенсора находились в режиме отсечки (режим полного закрытия) при заданных условиях в течение эксперимента, поэтому их кривые Ids(t) не представлены на рисунке.
Начальные токи биосенсоров различались в момент включения устройства (см. рис. 4). Зарегистрированные значения тока охватывали широкий диапазон: от Ids=2,1×10–7 А (КНИ-биосенсор №4, зеленая линия) до Ids=6,1×10–8 А (КНИ-биосенсор №3, желтая линия). В режиме холостого хода (без каких-либо биологических образцов на поверхности биосенсоров) в интервале времени 0–200 с большинство КНИ-биосенсоров демонстрировали стабильное значение Ids, за исключением КНИ-биосенсоров №1 (красная линия) и №4 (зеленая линия), которые показывали незначительный и заметный дрейф тока соответственно.
Добавление 5 мкл раствора TnAp12t2 (CA=10–8 моль/л) на поверхность кристалла в точке (1) вызвало увеличение тока только у КНИ-биосенсоров №1 и №4. Подобная реакция биосенсора с n-типом проводимости объясняется увеличением числа носителей заряда, в данном случае электронов, в объеме нанопроволоки. Это вызвано наличием положительного эффективного электрического заряда на границе раздела фаз «жидкий образец–нанопроволока». Поскольку буферный раствор не оказывал влияния на значения тока, положительный заряд связан с адсорбцией аптамера. Возможно, в условиях эксперимента (рН=5,9) положительный эффективный электрический заряд аптамера может быть обусловлен протонированием аденина (pK ~3,5), цитозина (pK ~4,2) или гуанина (pK ~2,1) [37–41]. Полученные экспериментальные результаты влияния адсорбции аптамера на величину тока КНИ-биосенсора согласуются с исследованием T. Farrow с соавт. [42].
Небольшой дрейф тока наблюдался в КНИ-биосенсорах №5 (синяя линия) и №6 (фиолетовая линия). С другой стороны, КНИ-биосенсоры №2 (оранжевая линия) и №3 (желтая линия) не показали существенных различий по сравнению с током, наблюдаемым в режиме холостого хода.
В интервале между точками (1) и (2) наблюдалась стабилизация сигнала. Однако в КНИ-биосенсорах №1 и №4 отмечен небольшой дрейф тока, что указывает на динамические процессы, происходящие на их поверхности. Значения остальных биосенсоров остались неизменными.
Добавление 5 мкл раствора cTnI (C1=10–11 моль/л) на поверхность кристалла в точке (2), которая содержала молекулы TnAp12t2, приводило к резкому уменьшению значений Ids в КНИ-биосенсорах №1, №3–6 в диапазоне от 10–1 до 3,8 А. Это указывает на наличие отрицательного эффективного электрического заряда на границе раздела фаз «жидкий образец–нанопроволока». Поскольку изолированная молекула тропонина (pI=9,3) в условиях данного эксперимента имела положительный электрический заряд, можно заключить, что образовавшийся комплекс «тропонин I + анти-тропонин I ДНК-аптамер» имеет отрицательный эффективный электрический заряд на границе раздела фаз [42–44].
Только Ids КНИ-биосенсора №2 увеличилась на 3×10–8 А. Увеличение значений Ids КНИ-биосенсора с n-типом проводимости возможно при возникновении положительного электрического заряда на поверхности нанопроволоки. Результаты нашего эксперимента и литературные данные [42–44] показывают, что увеличение значений Ids может быть вызвано адсорбцией аптамера (например, точка (1) на рис. 4) или изолированной молекулы тропонина (pI=9,3).
Во временнóм диапазоне между точками (2) и (3) значения Ids всех КНИ-биосенсоров демонстрировали общую тенденцию изменения.
В точке (3) на поверхность кристалла внесли раствор TnAp12t2 (CA=10–8 моль/л), что привело к увеличению тока всех КНИ-биосенсоров. Последующее введение 5 мкл раствора cTnI с концентрацией C2=10–10 моль/л в точке (4) привело к снижению Ids всех шести КНИ-биосенсоров в результате образования новых комплексов «тропонин I + анти-тропонин I ДНК-аптамер». В течение этого временнóго интервала биосенсоры находились в режиме отсечки, что соответствовало их низкой чувствительности. По этой причине изменения Ids, наблюдаемые в точках (3) и (4), были меньше, чем в точках (1) и (2).
Добавление 5 мкл раствора cTnI (C3=10–9 моль/л) в точке (5) привело к нестабильной работе КНИ-биосенсоров из-за скопления большого количества молекул на их поверхности.
Разброс значений Ids КНИ-биосенсоров может быть связан с технологией изготовления микросхем, которая сказывается на чувствительности биосенсоров. Основанием подобного вывода служит разброс значений Ids шести КНИ-биосенсоров в момент включения устройства и в режиме холостого хода, а также нахождения четырех КНИ-биосенсора в режиме отсечки.
Обсуждение
КНИ-биосенсор представляет собой перспективное аналитическое устройство для детекции целевых молекул без использования меток (флюоресцентных, люминесцентных). Он обладает высокой чувствительностью и способностью регистрировать сигнал в режиме реального времени [11]. Тем не менее существуют определенные факторы, усложняющие его применение. Одним из таких факторов является топология и конструкция биосенсора. В настоящей работе использован КНИ-биосенсор с электродами заземления, расположенными непосредственно на поверхности кристалла микросхемы (см. рис. 2, а). Десять КНИ-биосенсоров на кристалле увеличивают вероятность попадания целевых молекул на поверхность нанопроволоки, повышая достоверность результатов детекции.
Важной составляющей эффективной детекции с помощью биосенсора является наличие рецепторного слоя, а также возможность выбора вида рецепторов и метода их иммобилизации. В настоящее время для детекции cTnI преимущественно применяют моноклональные антитела. Синтетические последовательности нуклеиновых кислот (аптамеры) предоставляют альтернативный подход. По специфичности взаимодействия аптамеры сравнимы с антителами. Их можно получить с помощью эволюционного подхода in vitro (SELEX) без использования клеточных линий. Они могут восстанавливать свою активность после термической денатурации и ренатурации, проявляют высокую стабильность в жестких условиях эксплуатации. Более того, аптамеры можно синтезировать и модифицировать химическим путем [31, 42], что делает их более выгодными с точки зрения временны´х и материальных затрат. Аптамеры также способны связываться с целевыми молекулами в растворах с высокой ионной силой, что позволяет обнаруживать белки в неразбавленных биологических образцах, таких как сыворотка, кровь и т.д. [23, 42]. В исследовании разработан и использован в качестве рецептора высокоспецифичный анти-тропонин I ДНК-аптамер (TnAp12t2); константа диссоциации (KD) комплекса «тропонин I + анти-тропонин I ДНК-аптамер» составила 6×10–9 моль/л. Иммобилизацию аптамера проводили методом физической адсорбции, что позволило сохранить его пространственную конфигурацию и реакционную способность при одновременном сокращении времени подготовки биосенсора к работе.
В данной работе продемонстрировано определение сердечного тропонина I в клиническом диапазоне концентраций 10–11–10–9 моль/л с помощью разработанной конструкции КНИ-биосенсора в режиме реального времени без использования специальных меток. Установлено, что детекция одной пробы с помощью КНИ-биосенсора составляет примерно 200 с. Следует отметить, что высокие концентрации целевых молекул могут привести к выходу биосенсора в режим насыщения и неверным результатам (точка (5) на рис. 4). Обнаружение целевых молекул в низких концентрациях осложнено вероятностью их адсорбции на поверхности биосенсора. Например, добавление раствора аптамера на поверхность кристалла в точке (1) (см. рис. 4) не меняет значение Ids КНИ-биосенсоров №2, 3, 5 и 6. Предполагается, что в этом случае молекулы аптамера не адсорбируются на поверхности. Таким образом, вероятность адсорбции молекул-рецепторов или целевых молекул является ключевым фактором при проведении анализа посредством биосенсора [13, 32]. Теоретическое исследование процесса детекции молекул-мишеней с помощью КНИ-биосенсора обсуждается в ранее опубликованной статье [45].
Заключение
Разработанный КНИ-биосенсор позволяет осуществлять детекцию тропонина I без использования меток в режиме реального времени. Детекция одной пробы тропонина I с помощью КНИ-биосенсора занимает примерно 200 с. Чувствительность биосенсора — ~10–11 моль/л белка. Установлено, что иммобилизация аптамера методом физической адсорбции позволяет сохранять его реакционную способность. Высокоспецифичный анти-тропонин I ДНК-аптамер (TnAp12t2) проявил в условиях эксперимента положительный эффективный электрический заряд на разделе фаз «жидкая проба–нанопроволока». Комплекс «тропонин I + анти-тропонин I ДНК-аптамер» имел отрицательный эффективный электрический заряд на том же разделе.
Финансирование. Работа выполнена в рамках Государственного задания Роспотребнадзора ГЗ-21/21 и Государственного задания бюджетной темы «Изучение молекулярно-генетических и молекулярно-биологических механизмов развития распространенных терапевтических заболеваний в Сибири для совершенствования подходов к их ранней диагностике и профилактике», 2024–2028 гг. (FWNR-2024-0002), а также в рамках государственного задания Министерства науки и высшего образования РФ (проект NoFWES-2022-0002).
Конфликт интересов. У авторов нет конфликтов интересов.
Литература
- Всемирная организация здравоохранения. 10 ведущих причин смерти в мире. 9 декабря 2020 г. URL: https://www.who.int/ru/news-room/ fact-sheets/detail/the-top-10-causes-of-death.
- Снежицкий В.А., Ёрш И.Р., Голышко В.С., Литвинович С.Н. Инфаркт миокарда: патофизиологические механизмы развития, диагностическая стратегия и тактика лечения. Гродно: Гродненский государственный медицинский университет; 2015; 328 с.
- Pan T.M., Wang C.W., Weng W.C., Lai C.C., Lu Y.Y., Wang C.Y., Hsieh I.C., Wen M.S. Rapid and label-free detection of the troponin in human serum by a TiN-based extended-gate field-effect transistor biosensor. Biosens Bioelectron 2022; 201: 113977, https://doi.org/10.1016/j.bios.2022.113977.
- Ojha N., Dhamoon A.S. Myocardial infarction. Treasure Island (FL): StatPearls Publishing; 2022. URL: https://europepmc.org/article/nbk/nbk537076#_article-25460_s13_.
- Gerhardt W., Nordin G., Ljungdahl L. Can troponin T replace CK MBmass as “gold standard” for acute myocardial infarction (“AMI”)? Scand J Clin Lab Invest Suppl 1999; 230: 83–89, https://doi.org/10.1080/00365519909168331.
- Morrow D.A., Cannon C.P., Jesse R.L., Newby L.K., Ravkilde J., Storrow A.B., Wu A.H.B., Christenson R.H., Apple F.S., Francis G., Tang W.; National Academy of Clinical Biochemistry. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines: clinical characteristics and utilization of biochemical markers in acute coronary syndromes. Clin Chem 2007; 115(13): e356–e375, https://doi.org/10.1161/circulationaha.107.182882.
- Daubert M.A., Jeremias A. The utility of troponin measurement to detect myocardial infarction: review of the current findings. Vasc Health Risk Manag 2010; 6: 691–699, https://doi.org/10.2147/vhrm.s5306.
- Dhara K., Mahapatra D.R. Review on electrochemical sensing strategies for C-reactive protein and cardiac troponin I detection. Microchem J 2020; 156: 104857, https://doi.org/10.1016/j.microc.2020.104857.
- Kong T., Su R., Zhang B., Zhang Q., Cheng G. CMOS-compatible, label-free silicon-nanowire biosensors to detect cardiac troponin I for acute myocardial infarction diagnosis. Biosens Bioelectron 2012; 34(1): 267–272, https://doi.org/10.1016/j.bios.2012.02.019.
- Sharma S., Jackson P.G., Makan J. Cardiac troponins. J Clin Pathol 2004; 57(10): 1025–1026, https://doi.org/10.1136/jcp.2003.015420.
- Oliveira D.C.d.B., Costa F.H.M., da Silva J.A.F. The integration of field effect transistors to microfluidic devices. Micromachines (Basel) 2023; 14(4): 791, https://doi.org/10.3390/mi14040791.
- George Kerry R., Ukhurebor K.E., Kumari S., Maurya G.K., Patra S., Panigrahi B., Majhi S., Rout J.R., Rodriguez-Torres M.d.P., Das G., Shin H.S., Patra J.K. A comprehensive review on the applications of nano-biosensor-based approaches for non-communicable and communicable disease detection. Biomater Sci 2021; 9(10): 3576–3602, https://doi.org/10.1039/d0bm02164d.
- Tran D.P., Pham T.T.T., Wolfrum B., Offenhäusser A., Thierry B. CMOS-compatible silicon nanowire field-effect transistor biosensor: technology development toward commercialization. Materials (Basel) 2018; 11(5): 785, https://doi.org/10.3390/ma11050785.
- Kim K., Park C., Kwon D., Kim D., Meyyappan M., Jeon S., Lee J.S. Silicon nanowire biosensors for detection of cardiac troponin I (cTnI) with high sensitivity. Biosens Bioelectron 2016; 77: 695–701, https://doi.org/10.1016/j.bios.2015.10.008.
- De Moraes A.C.M., Kubota L.T. Recent trends in field-effect transistors-based immunosensors. Chemosensors 2016; 4(4): 20, https://doi.org/10.3390/chemosensors4040020.
- Generalov V.M., Naumova O.V., Fomin B.I., P’yankov S.A., Khlistun I.V., Safatov A.S., Zaitsev B.N., Zaitseva E.G., Aseev A.L. Detection of Ebola virus VP40 protein using a nanowire SOI biosensor. Optoelectron Instrum Data Process 2019; 55: 618–622, https://doi.org/10.3103/s875669901906013x.
- Patolsky F., Zheng G., Hayden O., Lakadamyali M., Zhuang X., Lieber C.M. Electrical detection of single viruses. Proc Natl Acad Sci U S A 2004; 101(39): 14017–14022, https://doi.org/10.1073/pnas.0406159101.
- Panahi A., Sadighbayan D., Forouhi S., Ghafar-Zadeh E. Recent advances of field-effect transistor technology for infectious diseases. Biosensor (Basel) 2021; 11(4): 103, https://doi.org/10.3390/bios11040103.
- Wadhera T., Kakkar D., Wadhwa G., Raj B. Recent advances and progress in development of the field effect transistor biosensor: a review. J Electron Mater 2019; 48: 7635–7646, https://doi.org/10.1007/s11664-019-07705-6.
- Sadighbayan D., Hasanzadeh M., Ghafar-Zadeh E. Biosensing based on field-effect transistors (FET): recent progress and challenges. Trends Analyt Chem 2020; 133: 116067, https://doi.org/10.1016/j.trac.2020.116067.
- Cetin Y., Aydinlik S., Gungor A., Kan T., Avsar T., Durdagi S. Review on in silico methods, high-throughput screening techniques, and cell culture based in vitro assays for SARS-CoV-2. Curr Med Chem 2020; 29(38): 5925–5948, https://doi.org/10.2174/0929867329666220627121416.
- Chiang P.L., Chou T.C., Wu T.H., Li C.C., Liao C.D., Lin J.Y., Tsai M.H., Tsai C.C., Sun C.J., Wang C.H., Fang J.M., Chen Y. T. Nanowire transistor-based ultrasensitive virus detection with reversible surface functionalization. Chem Asian J 2012; 7(9): 2073–2079, https://doi.org/10.1002/asia.201200222.
- Thriveni G., Ghosh K. Advancement and challenges of biosensing using field effect transistors. Biosensors (Basel) 2022; 12(8): 647, https://doi.org/10.3390/bios12080647.
- Bulgakova A., Berdyugin A., Naumova O., Fomin B., Pyshnyi D., Chubarov A., Dmitrienko E., Lomzov A. Solution pH effect on drain-gate characteristics of SOI FET biosensor. Electronics 2023; 12(3): 777, https://doi.org/10.3390/electronics12030777.
- Vance S.A., Sandros M.G. Zeptomole detection of C-reactive protein in serum by a nanoparticle amplified surface plasmon resonance imaging aptasensor. Sci Rep 2014; 4: 5129, https://doi.org/10.1038/srep05129.
- Yang X., Wang Y., Wang K., Wang Q., Wang P., Lin M., Chena N., Tan Y. DNA aptamer-based surface plasmon resonance sensing of human C-reactive protein. RSC Adv 2014; 4(58): 30934–30937, https://doi.org/10.1039/c4ra05011h.
- Lin M.C., Nawarak J., Chen T.Y., Tsai H.Y., Hsieh J.F., Sinchaikul S., Chen S.T. Rapid detection of natriuretic peptides by a microfluidic LabChip analyzer with DNA aptamers: application of natriuretic peptide detection. Biomicrofluidics 2009; 3(3): 34101, https://doi.org/10.1063/1.3194283.
- Pur M.R.K., Hosseini M., Faridbod F., Ganjali M.R. Highly sensitive label-free electrochemiluminescence aptasensor for early detection of myoglobin, a biomarker for myocardial infarction. Microchim Acta 2017; 184: 3529–3537, https://doi.org/10.1007/s00604-017-2385-y.
- Jo H., Her J., Lee H., Shim Y.B., Ban C. Highly sensitive amperometric detection of cardiac troponin I using sandwich aptamers and screen-printed carbon electrodes. Talanta 2017; 165: 442–448, https://doi.org/10.1016/j.talanta.2016.12.091.
- Negahdary M., Behjati-Ardakani M., Sattarahmady N., Yadegari H., Heli H. Electrochemical aptasensing of human cardiac troponin I based on an array of gold nanodumbbells — applied to early detection of myocardial infarction. Sens Actuators B Chem 2017; 252: 62–71, https://doi.org/10.1016/j.snb.2017.05.149.
- Chandola C., Kalme S., Casteleijn M.G., Urtti A., Neerathilingam M. Application of aptamers in diagnostics, drug-delivery and imaging. J Biosci 2016; 41(3): 535–561, https://doi.org/10.1007/s12038-016-9632-y.
- Squires T.M., Messinger R.J., Manalis S.R. Making it stick: convection, reaction and diffusion in surface-based biosensors. Nat Biotechnol 2008; 26(4): 417–426, https://doi.org/10.1038/nbt1388.
- Krasitskaya V.V., Goncharova N.S., Biriukov V.V., Bashmakova E.E., Kabilov M.R., Baykov I.K., Sokolov A.E., Frank L.A. The Ca2+-regulated photoprotein obelin as a tool for SELEX monitoring and DNA aptamer affinity evaluation. Photochem Photobiol 2020; 96(5): 1041–1046, https://doi.org/10.1111/php.13274.
- Stern E., Wagner R., Sigworth F.J., Breaker R., Fahmy T.M., Reed M.A. Importance of the Debye screening length on nanowire field effect transistor sensors. Nano Lett 2007; 7(11): 3405–3409, https://doi.org/10.1021/nl071792z.
- Генералов В.М., Наумова О.В., Пьянков С.А., Колосова И.В., Сафатов А.С., Зайцев Б.Н., Зайцева Э.Г., Буряк Г.А., Черемискина А.А., Филатова Н.А., Асеев А.Л. Индикация вируса осповакцины с помощью нанопроволочного КНИ-биосенсора. Автометрия 2021; 57(1): 42–49, https://doi.org/10.15372/aut20210105.
- Ocaña C., del Valle M. A comparison of four protocols for the immobilization of an aptamer on graphite composite electrodes. Microchim Acta 2014; 181: 355–363, https://doi.org/10.1007/s00604-013-1126-0.
- Tan S.Y., Acquah C., Tan S.Y., Ongkudon C.M., Danquah M.K. Characterisation of charge distribution and stability of aptamer-thrombin binding interaction. Process Biochem 2017; 60: 42–51, https://doi.org/10.1016/j.procbio.2017.06.003.
- Kantor C.R., Schimmel P.R. Biophysical chemistry: part I: the conformation of biological macromolecules. 1st edition. W.H. Freeman and Company; 1980.
- Ravindranathan S., Butcher S.E., Feigon J. Adenine protonation in domain B of the hairpin ribozyme. Biochemistry 2000; 39(51): 16026–16032, https://doi.org/10.1021/bi001976r.
- Кочетков Н.К., Будовский Э.П., Свердлов Е.Д., Симукова Н.К., Турчинский М.Ф., Шибаев В.Н. Органическая химия нуклеиновых кислот. М: Химия; 1970.
- Шабарова З.А., Богданов А.А. Химия нуклеиновых кислот и их компонентов. М: Химия; 1978; с. 584.
- Farrow T., Laumier S., Sandall I., van Zalinge H. An aptamer-functionalized Schottky-field effect transistor for the detection of proteins. Biosensors (Basel) 2022; 12(5): 347, https://doi.org/10.3390/bios12050347.
- Filatov V.L., Katrukha A.G., Bulargina T.V., Gusev N.B. Troponin: structure, properties, and mechanism of functioning. Biochemistry (Mosc) 1999; 64: 969–985.
- Сердечный тропонин I. HyTest; 2019. URL: https://hytest.ru/sites/ 5cd13840ff4f702c0cbc4c8d/assets/5da43ec3fd7fb419e85444c7/ Troponin_Booklet_2019.pdf.
- Generalov V., Cheremiskina A., Glukhov A., Grabezhova V., Kruchinina M., Safatov A. Investigation of limitations in the detection of antibody+ antigen complexes using the silicon-on-insulator field-effect transistor biosensor. Sensors (Basel) 2023; 23(17): 7490, https://doi.org/10.3390/s23177490.