Хемилюминесценция, индуцированная реакцией Фентона, — математическое моделирование процесса; особенности, параметры и условия применения для биомедицинских исследований
Цель исследования — математическое моделирование процесса хемилюминесценции, индуцированной реакцией Фентона; выявление особенностей, параметров и условий применения реакции Фентона для биомедицинских исследований.
Материалы и методы. Выполнен расчет импульса хемилюминесценции, возникающей в реакции Фентона, на основе численного решения системы 19 дифференциальных уравнений, описывающих процесс. Расчет выполнен без каких-либо упрощающих предположений. Учитывались 25 возможных реакций в растворе Фентона (перекись водорода и раствор двухвалентного железа) и 7 реакций цепного окисления органического вещества RH. Система дифференциальных уравнений решалась с помощью пакета программ MathCad 14. Экспериментально характеристики импульса свечения измерялись биохемилюминометром БХЛ-07 (Россия). Использовали дистиллированную воду; реагенты: [Fe2+] в концентрации 10−4 и 10−3 моль/л, [H2O2] в концентрации 10−4 и 10−3 моль/л; биологические субстраты: альбумин 50 г/л, плазму крови, эритроциты и цельную кровь интактных самцов крыс линии Вистар.
Результаты. Рассчитаны расходование двухвалентного железа и форма импульсов хемилюминесценции, возникающих в реакции Фентона, выходы хемилюминесценции (светосуммы) с гипотетическим органическим веществом RH при разных значениях констант скоростей реакций инициирования, продолжения и обрыва цепи в зависимости от концентрации вещества RH. Время регистрации — 30 с. Установлено, что во всех случаях светосумма (интенсивность хемилюминесценции) характеризуется максимумом, который достигается при определенных концентрациях RH. Положение максимума зависит от свойств вещества. В некоторых условиях цепная реакция окисления может развиваться, гидроперекись ROOH образуется, но свечение при этом не возникает. Формы импульса излучения, полученные в расчете, подтверждаются экспериментально. В исследованиях с биологическими субстратами и органическими веществами показатель светосуммы хемилюминесценции, индуцированной реакцией Фентона, стабилен при концентрации компонентов [Fe2+]=10−3 моль/л, [H2O2]=10−3 моль/л, pH=2.
Первое сообщение о реакции Фентона, возникающей при смешивании растворов металлов переменной валентности, в частности двухвалентного железа и перекиси водорода, опубликовано в 1894 г. Реакция интересна тем, что в ней генерируется самый сильный окислитель — гидроксильный радикал OH·, способный окислять любое органическое вещество. Одно из применений реакции Фентона — исследование хемилюминесценции биологических субстратов. Хемилюминесценция как метод исследования стала широко использоваться с тех пор, как были созданы высокочувствительные биохемилюминометры. Возможности применения хемилюминесценции, в том числе возникающей в реакции Фентона, рассмотрены в работе [1].
В биомедицинских исследованиях с помощью биохемилюминометра записывается интенсивность хемилюминесценции непосредственно после смешивания всех компонентов (биологической пробы, растворов Fe2+ и H2O2). Время измерения 30–60 с. Такой вариант исследований хемилюминесценции с помощью реакции Фентона применялся во многих работах [2–5]. В частности, в работе [2] для анализа используются полный выход зарегистрированного излучения S (светосумма), максимальная интенсивность свечения Imax и тангенс угла наклона заднего фронта импульса излучения tgα. Этим параметрам придается определенный смысл, хотя оценки связи данных характеристик импульса излучения со свойствами цепной реакции окисления в литературе нет. В работе [3] сообщается, что реакция Фентона приводит к образованию неустойчивого тетроксида, распадающегося с выделением кванта света. Под термином «тетроксид», видимо, подразумевался комплекс (Fe2+Fe23+)O42– (тетроксид трижелеза). Такой комплекс может образовываться, так как Fe2+ — исходное вещество, а Fe3+ — продукт реакции. Тетроксид трижелеза — это стабильный минерал, магнетит, который никакого вклада в свечение не дает [6]. Образование соединений железа с более высокой степенью окисления, чем Fe3+ в реакции Фентона, не известно. Поэтому вопрос о механизме образования свечения требует более детального рассмотрения.
В работе [7] сообщается о разработанной программе «Кинетика» для математического моделирования кинетики сложных систем реакций. С помощью этой программы успешно исследовалась антиоксидантная активность веществ. В модели предполагается, что свечение возникает при взаимодействии двух радикалов LOO· (L — липид). Количество уравнений, которые могут быть решены с помощью этой программы, ограничено, поэтому для конкретной задачи приходится вводить упрощающие предположения.
В работе [8] разработана модель процессов в реакции Фентона, учитывающая все возможные реакции между продуктами, а также схема образования свечения как в самой реакции Фентона, так и в инициированной гидроксильными радикалами цепной реакции. Некоторые характеристики проверены экспериментально в самой работе [8] и при исследовании прооксидантных и антиоксидантных свойств аскорбиновой кислоты [9].
В настоящее время накоплен большой справочный материал о константах скоростей реакций радикалов между собой и с конкретными веществами. Детально изучены характеристики цепных реакций, инициируемых в пробах органического вещества гидроксильными радикалами. Поэтому есть возможность точно рассчитать характеристики импульса свечения и его связь с особенностями цепной реакции окисления.
Цель исследования — математическое моделирование и расчет характеристик импульса хемилюминесценции, возникающей непосредственно в реакции Фентона и в реакции с гипотетическим органическим веществом RH; выявление особенностей, параметров и условий применения реакции Фентона для биомедицинских исследований.
Материалы и методы. Регистрацию свечения в реакции Фентона осуществляли с помощью биохемилюминометра БХЛ-07 (Россия). Чувствительность прибора составляла ~200 фотонов/с. Калибровку прибора выполняли перед началом работы по эталонному источнику света (люминесцирующее урановое стекло ЖС-19) [10]. Кювета для реактивов имела объем 2 мл, диаметр — 1 см. Использовались реактивы: раствор FeSO4 в концентрации 10-3 и 10-4 моль/л в кислой среде pH=2, раствор перекиси водорода в концентрации 10-3 и 10-4 моль/л. Кислую среду для растворов железа получали путем добавления серной кислоты в связи с тем, что в нейтральной среде двухвалентное железо нестабильно.
Состав пробы: 0,4 мл раствора FeSO4; 0,4 мл растворителя (дистиллированная вода, раствор Хенкса); 0,1 мл испытываемого вещества или исследуемого биологического субстрата (в холостой пробе — 0,1 мл растворителя); 0,2 мл перекиси водорода. После введения перекиси кюветное отделение переводили в рабочее положение: измерительная камера затемнялась и кювета устанавливалась напротив катода фотоэлектронного умножителя (ФЭУ). Регистрация излучения начиналась автоматически, до начала регистрации проходило не более 1 с. Время регистрации — 30 с. Фон (шумовой ток ФЭУ) вычитался автоматически. Записывалась зависимость интенсивности излучения от времени. Прибор описывает амплитуду сигнала в максимуме — Imax, светосумму — S — за весь период измерения и тангенс угла наклона заднего фронта импульса излучения — tgα. Непосредственно измеряемой БХЛ-07 величиной люминесценции является напряжение, поэтому показатели S и Imax измерялись в милливольтах (относительных единицах). В качестве анализируемого вещества использовали раствор альбумина 50 г/л, в качестве биологических субстратов — гепаринизированную цельную кровь, плазму крови, эритроциты крыс самцов линии Вистар. Плазму крови и эритроциты получали после декапитации и центрифугирования в течение 10 мин при 3000 об./мин. Экспериментально в течение 30 с измеряли светосумму хемилюминесценции холостой пробы S0 и используемых в работе альбумина, эритроцитов, плазмы и цельной крови S в различных концентрациях (разведениях) в 10–15 повторах. Измерения начинали с регистрации светосуммы S вещества в исходной концентрации, далее его последовательно разбавляли раствором Хенкса в 10 раз, получали светосуммы при концентрациях 1, 10-1, 10-2, … 10-10. Для оценки спектрального диапазона излучения использовали светофильтры: синий (полоса пропускания 410–590 нм) и красный (полоса пропускания 590–750 нм).
Расчет процесса, инициированного реакцией Фентона, осуществляли численным решением уравнений химической кинетики. Учитывали поглощение дистиллированной водой углекислого газа из воздуха и внешний радиационный фон [11]. Составляли 19 дифференциальных уравнений, описывающих накопление и расход следующих веществ и активных частиц: Fe2+, Fe3+, H2O2, HO2-, O2, HO2·, OH·, O2·-, 1O2 (синглетный кислород), 21O2 (димер синглетного кислорода), HCO3-, CO3·-, RH (условное испытываемое вещество), R·, ROO·, ROOH, ROOR, RO·, R-R [8]. Учитывали как частицы, принимающие участие в холостой реакции Фентона, так и частицы, образующиеся в ходе цепного процесса, инициированного реакцией Фентона в биологическом субстрате. Расчет проводили для времени реакции 60 и 30 с. Систему 19 дифференциальных уравнений решали численно с помощью пакета MathCad 14. Проводили дополнительную проверку решения на устойчивость, так как решение системы уравнений (даже двух) является неустойчивой (некорректной) задачей. Это означает, что в принципе могут существовать условия, когда бесконечно малое изменение начальных условий приводит к бесконечно большим изменениям решения.
Решением системы уравнений являлась зависимость концентрации каждого вещества и активной частицы от времени, прошедшего с начала реакции. Задача моделирования заключалась в исследовании свойств процесса хемилюминесценции на основе известных характеристик реакций, происходящих в системе. Варьирование в широких пределах исходных параметров и концентрации реагентов дает возможность выявить закономерности, которые можно наблюдать в эксперименте, и планировать постановку эксперимента. Теория цепных реакций изучалась почти 100 лет, характеристики всех реакций хорошо изучены. Поэтому поставленная задача может быть решена точно.
Результаты и обсуждение
Особенности протекания реакции Фентона. Начальная стадия описывается реакцией:

Константа скорости данной реакции k1=56 л(моль·с)-1. Для получения стабильных результатов основным условием протекания этой реакции является кислая среда, pH=2. В нейтральной среде железо быстро окисляется кислородом воздуха (Fe2+→Fe3+) и величина концентрации исходно используемого раствора двухвалентного железа уменьшается. Кроме того, с ростом pH константа скорости реакции Фентона уменьшается, т.е. меняются характеристики реакции. Значение константы скорости k1=56 л(моль·с)-1, используемое в расчете [8], приведено в справочной литературе для pH=2. Все стадии продолжения реакции рассмотрены в работе [8]. При приготовлении рН необходимо добавление именно серной кислоты, так как в соляной кислоте присутствуют ионы хлора, которые окисляются гидроксильными радикалами.
Реакция Фентона используется как источник гидроксильных радикалов OH·. Вторичными продуктами реакции являются радикалы HO2·, O2·- и синглетный кислород 1O2. Образование ион-радикала O2·- обеспечивает протекание обратной реакции:

В реакции O2·- с ионом водорода образуется синглетный кислород:

Синглетный кислород является основным светящимся агентом, который образуется в реакции и может быть зарегистрирован ФЭУ. Полностью образование свечения в реакции Фентона описывается схемой, включающей 25 реакций [8]. Сюда входят реакции с бикарбонатами, которые накапливаются в воде в результате растворения углекислого газа, содержащегося в воздухе, а также образование активных частиц под действием внешнего радиационного фона [11]. Многие промежуточные продукты, возникающие после реакции (1) и инициированные гидроксильными радикалами, могут образовываться в возбужденных состояниях, но энергия этих состояний соответствует УФ-диапазону. Спектр излучения, испускаемого такими состояниями, приведен в работе [12]. Максимум спектра — при длине волны ~300 нм, выше 380 нм излучения практически нет. Поэтому фотоны, снимающие возбуждение с этих состояний, не могут быть зарегистрированы ФЭУ, у которого спектральный диапазон чувствительности начинается с 400 нм.
Распад самого синглетного кислорода сопровождается испусканием фотона с длиной волны 1260 нм, который также не регистрируется ФЭУ. Этот прибор регистрирует хемилюминесценцию процесса образования и распада димера синглетного кислорода:

Основная длина волны образующегося при этом излучения λ=630 нм. Наблюдаются также менее интенсивные линии 480, 535 и 580 нм, связанные с переходами из разных состояний синглетного кислорода. Интенсивность свечения димера синглетного кислорода в красной области спектра мала, поэтому в работе [12] это излучение и не было зарегистрировано, так как максимум испускания димера синглетного кислорода ~300 нм. В работе [13] для усиления светового выхода использовался люминол, хотя чувствительность современных люминометров достаточна, чтобы регистрировать только излучение димера синглетного кислорода.
При экспериментальном исследовании спектрального диапазона излучения хемилюминесценции выявлено, что в случае установки синего светофильтра выход регистрируемого излучения не превышал 5% от исходного (без фильтра); красный светофильтр не снижал выход излучения более чем на 10%. Полученные результаты подтверждают, что излучение хемилюминесценции, индуцируемой реакцией Фентона, находится в спектральной области, соответствующей линиям испускания димера синглетного кислорода.
На выход свечения оказывает влияние качество воды. Во-первых, активные частицы образуются в воде под действием внешнего радиационного фона [11]. Время установления стационарной концентрации таких частиц составляет ~30 мин. Во-вторых, поглощаемый водой углекислый газ также влияет на свечение, увеличивая его. Количество поглощенного углекислого газа растет с увеличением времени выдержки дистиллированной воды на воздухе. Поэтому для получения стабильных результатов следует использовать свежую воду, но выдержанную после дистилляции не менее 30 мин.
Регистрация хемилюминесценции биологических субстратов имеет определенные особенности. В обычной спектроскопии регистрируемый сигнал создает световую вспышку, намного превышающую по амплитуде фон. Сигнал выделяется из фона с помощью амплитудной дискриминации. В биохимической реакции испускается один фотон, который выбивает на катоде ФЭУ один электрон. Этот электрон никак не отличается от электронов, испускаемых катодом в результате фоновых тепловых шумов. Отличить эффект от фона можно только по изменению количества электронов, испускаемых катодом. Эффект хемилюминесценции биологического субстрата может считаться значимым только в случае, если он превышает флюктуации шумов ФЭУ. Отсюда к ФЭУ предъявляются серьезные требования: шум должен быть минимальным и стабильным. Вычитание фона осуществляется на БХЛ-07 автоматически. Измерения показали [8], что среднеквадратичные флюктуации шума биохемилюминометра БХЛ-07 составляют от 200 до 500 импульсов в секунду в зависимости от состояния прибора, что соответствует выходному напряжению (интенсивности хемилюминесценции) I~1мВ. Эффект хемилюминесценции исследуемой пробы может быть зарегистрирован только при условии, что поток излучения, попадающего на катод ФЭУ, будет превышать ~200 с-1 (~0,5 мВ).
Выбор концентрации реагентов. Во время реакции Фентона Fe2+ расходуется, при интенсивном снижении его концентрации реакция практически прекращается, поэтому концентрация двухвалентного железа определяет продолжительность реакции. При исходной концентрации [Fe2+]=10-3 моль/л через 60 с концентрация двухвалентного железа уменьшается в 10 раз [14] и реакция практически прекращается. Время, в течение которого можно регистрировать хемилюминесценцию, определяется характеристиками измеряющего прибора. Для биохемилюминометра БХЛ-07 выбрано время регистрации 30 с. За 30 с концентрация Fe2+ уменьшается примерно в 3 раза, реакция еще не прекращается, поэтому концентрацию [Fe2+]=10-3 моль/л для рассматриваемых условий эксперимента можно принять в качестве рабочей.
Для оценки времени реакции Фентона можно пользоваться приближенным соотношением [14]:

где k1=56 л(моль·с)-1 — константа скорости реакции (1). Точный расчет времени реакции при условии, что концентрация [Fe2+]≥[H2O2], дает значение τ~6 с при [Fe2+]=10-2 моль/л; τ~60 с при [Fe2+]=10-3 моль/л; τ~600 с при [Fe2+]=10-4 моль/л [14]. Если концентрация [Fe2+]<[H2O2], то большой вклад дает обратная реакция (2) восстановления двухвалентного железа ион-радикалом O2·-, и скорость реакции будет зависеть от концентрации перекиси. Но так как перекись водорода может расходоваться не только в реакции (1), но и в реакциях с анализируемыми органическими веществами, то результаты могут быть нестабильны. Поэтому режим [Fe2+]<[H2O2] лучше не использовать.
Концентрация перекиси водорода в реакции Фентона определяет интенсивность хемилюминесценции, свечение растет с увеличением концентрации [8, 14]. Однако при этом уменьшается длительность вспышки излучения и переднего фронта импульса. При [H2O2]=10-1 моль/л основная доля излучения высвечивается за время, меньшее 0,1 с [14]. Переходные процессы, связанные с переводом кюветы с исследуемой пробой в измерительное положение, занимают не менее нескольких десятых долей секунды, поэтому при [H2O2]=10-1 моль/л регистрируется только «хвост» излучения, его малая часть. Чтобы регистрировать практически всю хемилюминесценцию реакции Фентона в течение 30–60 с, концентрация перекиси должна быть [H2O2]≤[Fe2+]. В работе [8] рассчитана и подтверждена экспериментально оптимальная концентрация перекиси водорода для дистиллированной воды, она составила [H2O2]=10-4 моль/л.
Когда реакция Фентона осуществляется в растворе, содержащем биологические и органические субстраты, ситуация меняется. Перекись водорода будет в первую очередь взаимодействовать с анализируемым органическим веществом, так как константа скорости реакции с железом мала и константы скорости других реакций перекиси с компонентами пробы могут оказаться намного больше [15, 16]. Таким образом, перекись водорода будет преимущественно расходоваться в других реакциях (не с двухвалентным железом) — в этом случае следует выбирать бóльшую ее концентрацию. Концентрация перекиси зависит и от конструктивных особенностей применяемого люминометра. Для БХЛ-07 при концентрации органических веществ, характерных для крови, можно рекомендовать выбор концентрации перекиси водорода [H2O2]~10-3 моль/л.
Оценить правильность выбора концентрации реагентов можно по форме импульса хемилюминесценции. Форма импульсов, полученных экспериментально при разных концентрациях [Fe2+] и [H2O2] (рис. 1), показывает, что при концентрациях [Fe2+]=10-3 моль/л и [H2O2]=10-4 моль/л (рис. 1, а) свечение — слабое и оно быстро заканчивается (практически через 2 с). При концентрациях [Fe2+]=10-4 моль/л и [H2O2]=10-3 моль/л (рис. 1, б) свечение также слабое, но оно не заканчивается за 30 с, так как при уменьшении [Fe2+] время реакции увеличивается — см. соотношение (5). При значении концентрации реагентов, которые выбраны нами в качестве рабочих ([Fe2+]=[H2O2]=10-3 моль/л, рис. 1, в), свечение почти в 4 раза интенсивнее и реакция продолжается с заметной вероятностью все 30 с. Как было отмечено выше, с повышением концентрации реагентов сокращается длительность импульса и его переднего фронта. При этом значительная часть информации (светосумма) теряется, и результаты могут быть недостоверными. Поэтому в данной работе измерения хемилюминесценции, индуцированной реакцией Фентона, при концентрациях реагентов более 10-3 моль/л не проводились.
Таким образом, для исследований концентрации реагентов — как раствора двухвалентного железа, так и перекиси водорода — более 10-3 моль/л не могут быть рекомендованы.
Расчет свечения, возникающего в реакции Фентона с биологической пробой. Для оценки окислительной способности вещества в него вводят реактив Фентона и измеряют выход возникающей хемилюминесценции (светосуммы S). Обозначим как S0 светосумму, регистрируемую в реакции Фентона без анализируемой пробы. С пробой светосумма S может увеличиться, уменьшиться или остаться неизменной (относительно S0) в зависимости от свойств биологического субстрата. Гидроксильные радикалы, возникающие в реакции Фентона, взаимодействуют с органическими веществами пробы, инициируя цепную реакцию окисления. Рассмотрим, как характеристики органического вещества, содержащегося в пробе, и свойства образующихся промежуточных продуктов влияют на интенсивность хемилюминесценции.
Типичную схему цепного окисления органического вещества RH гидроксильными радикалами можно представить последовательностью следующих реакций (k1–k10 — константы средней скорости реакций (6)–(15)).
Инициирование:

Продолжение цепи:

Обрыв цепи, образование синглетного кислорода:

Реакции синглетного кислорода:

Образование малоактивных продуктов:

Некоторые вещества могут окисляться по механизму, имеющему особенности на стадиях продолжения цепи, в частности это относится к окислению аскорбиновой кислоты [9]. Но большинство органических веществ окисляются по рассматриваемому ниже механизму.
Все реакции от (6) до (15) являются реакциями второго порядка. Скорость такой реакции равна произведению концентраций реагентов в степени их стехиометрических коэффициентов, умноженному на константу скорости. Все стехиометрические коэффициенты в рассмотренных случаях равны единице. На примере скорости реакции образования радикалов ROO· запишем одно такое уравнение. Радикалы ROO· образуются в реакции (7) и расходуются в реакциях (8) и (9):

Как установлено в данной работе и было показано в работе [8], хемилюминесценция в реакции Фентона обусловлена распадом димера синглетного кислорода. Синглетный кислород образуется как в самом растворе Фентона (холостая проба) — реакция (3), так и при окислении органического вещества RH в реакции (9), при этом скорость образования синглетного кислорода увеличивается по сравнению со скоростью холостого раствора Фентона без биологической пробы. Хемилюминесценция возникает при распаде димера синглетного кислорода. При расчете за интенсивность хемилюминесценции принимали скорость образования димера синглетного кислорода, поскольку он распадается практически мгновенно:

Первой стадией реакции является инициирование с образованием свободного радикала R· — реакция (6). Константа скорости этой реакции для разных веществ меняется в широких пределах и может достигать значения k1=1010 л(моль·с)-1. В присутствии кислорода образуется радикал ROO· — реакция (7). В отсутствие кислорода цепное окисление невозможно. Основная стадия продолжения цепи — реакция (8), в которой расходуется молекула исходного вещества и образуется радикал R·. Эта реакция — медленная, ее константа скорости в пределах 1–60 л(моль·с)-1, она является лимитирующей стадией, которая определяет скорость процесса цепного окисления. В этой реакции образуется гидроперекись, появление которой рассматривается как признак цепного окисления. Обрыв цепи при взаимодействии радикалов ROO· приводит к появлению синглетного кислорода 1O2 — реакция (9). Таким образом, образование радикалов ROO· и их рекомбинация с образованием синглетного кислорода увеличивают интенсивность хемилюминесценции в реакции Фентона при анализе биологических образцов. Однако возможен случай, когда константа скорости реакции (8) аномально большая и при анализе субстрата свечение будет снижаться. Этот случай рассмотрен ниже.
Вероятность образования димера синглетного кислорода мала, константа скорости реакции (10) равна k5=0,1 л(моль·с)-1, что намного порядков меньше константы скорости реакции (11). Однако такой скорости реакции достаточно, чтобы регистрировать свечение высокочувствительным биохемилюминометром. Гидроперекись может взаимодействовать с двухвалентным железом — реакция (12), но константа скорости этой реакции мала, поэтому она не играет существенной роли. Другим каналом реакции обрыва цепи является взаимодействие радикалов R· и RO· между собой — реакции (13), (14), (15). В этих реакциях образуются малоактивные соединения, не влияющие на свечение. В реакциях (14), (15) расходуются радикалы R·, которые далее не будут участвовать в реакции продолжения цепи (7). Но так как концентрация радикалов R· намного меньше концентрации растворенного кислорода (если в пробу проникает кислород воздуха), то скорость реакций (14), (15) намного меньше скорости реакции (2), что не влияет на интенсивность хемилюминесценции. Поэтому далее при анализе факторов, влияющих на выход свечения, рассматривались только реакции (6)–(9).
Для оценки зависимости интенсивности хемилюминесценции в реакции Фентона при разных концентрациях субстрата от величины констант скорости отдельных стадий цепного окисления выполнены расчеты отношения S/S0 светосумм исследуемого вещества S относительно светосуммы холостого раствора Фентона S0 (табл. 1–4). В каждой таблице варьируется в широких пределах одна из констант, другие константы выбраны как наиболее характерные. Максимальное значение концентрации пробы 100 моль/л выбрано исходя из того, что самые легкие органические вещества не могут иметь концентрацию больше этого значения. В случае высокомолекулярного вещества, которым является белок, например альбумин, молярная концентрация белка (альбумина) с молекулярной массой M~69 кДа не является концентрацией окисляющегося вещества [RH]. Каждая молекула белка содержит много фрагментов, которые могут окисляться, и их концентрация намного превышает мольную концентрацию самого белка.
В табл. 1 варьируется константа скорости реакции (6) — k1 — в пределах от 102 до 1010 л(моль·с)-1. По приведенным данным видно, что при k1=102 свечение вообще не возникает, с ростом k1 свечение появляется и растет. Максимума свечение достигает не при максимальной концентрации пробы, а при существенно меньшей. Свечение остается заметным при концентрации пробы 10-4–10-5 моль/л, и оно больше, чем при максимально возможной концентрации пробы. С ростом константы k1 положение максимума свечения смещается в сторону меньших концентраций пробы и выход свечения увеличивается.
В табл. 2 приводится рассчитанная зависимость свечения от константы скорости реакции (7) — k2. Видно, что при малом значении константы свечение не возникает и увеличивается с ростом k2. При больших значениях k2 максимум свечения может не достигаться, свечение монотонно увеличивается с ростом концентрации [RH].
В табл. 3 приводятся рассчитанные значения S/S0 при разных значениях константы скорости реакции (8) — k3. Видно, что свечение максимально при минимальном значении k3. Связано это с тем, что в реакции (8) образуется гидроперекись, которая свечения не дает. С ростом k3 свечение уменьшается и совсем пропадает. Это обстоятельство следует особо подчеркнуть, так как при относительно большом значении k3 перекисное окисление идет, гидроперекись ROOH накапливается, но свечение не возникает и, соответственно, не может быть зарегистрировано.
В табл. 4 приведены результаты расчетов для реакции (9) — k4. В этой реакции образуется основной светящийся агент — синглетный кислород, поэтому с ростом k4 свечение увеличивается.
Процесс хемилюминесценции в реакции Фентона можно охарактеризовать следующим образом. В большинстве случаев для конкретного анализируемого вещества существует концентрация, при которой наблюдается максимальное свечение. Как видно из таблиц 1–4, при варьировании в широких пределах констант k1–k4 оказывается, что интенсивность хемилюминесценции сильно меняется, меняется и положение максимума. При увеличении концентрации вещества в пробе (после максимума) свечение уменьшается и может совсем не регистрироваться. При уменьшении концентрации ниже максимума свечение также способно уменьшаться. Отсутствие свечения не может служить признаком того, что вещество инертно, так как при других, даже меньших концентрациях, свечение может возникнуть (см. табл. 2–4). Значения концентраций, при которых наблюдается максимум свечения, сильно различаются. В нашей работе исследовалось в эксперименте свечение пробы при разных разведениях. Можно сказать, что для смеси веществ с разной молярной концентрацией (разной молекулярной массой) максимум свечения для вещества с большой молекулярной массой (маленькой молярной концентрацией) будет наблюдаться при меньшем разведении, чем для вещества с относительно малой молекулярной массой и большой мольной концентрацией.
Таким образом, выявлено, что свечение как непосредственно в растворе Фентона, так и в биологическом образце обусловлено димером синглетного кислорода, который образуется после реакции радикалов ROO· между собой. Поэтому наличие хемилюминесценции биологической пробы в реакции Фентона устанавливает факт образования радикалов ROO·, а также факт, что они с заметной вероятностью взаимодействуют между собой, и при этом другие реакции расходования радикалов ROO·, не приводящие к свечению, расходуют не все эти радикалы. Разная величина S/S0 при разведении проб (снижении концентрации) до концентрации, когда свечение максимально, означает только то, что у проб разные константы скоростей — k1–k4. Отсутствие свечения может означать, что окисление пробы идет без образования светящихся продуктов, их скорость образования мала или радикалы ROO· гибнут в реакциях, не приводящих к образованию люминесцирующих продуктов. Образование гидроперекисей при этом все равно может происходить. Утверждать, что окисление не идет совсем, нельзя, так как существует очень мало веществ, которые не окисляются гидроксильными продуктами. Прямым доказательством того, что перекисное окисление не имеет места, является отсутствие гидроперекисей ROOH, которые можно идентифицировать химическими методами.
Из сказанного следует, что использование только таких показателей индуцированной реакцией Фентона хемилюминесценции, как S и Imax, при произвольно выбранной концентрации пробы, для характеристики интенсивности перекисного окисления липидов или интенсивности свободнорадикальных процессов в биологическом субстрате не корректно.
Так как в результате цепной реакции, индуцированной реакцией Фентона, образуются гидроперекиси ROOH и возникает хемилюминесценция, то способность субстрата к окислению характеризуется концентрацией накопившихся гидроперекисей и зарегистрированной светосуммой, однако только светосумма не позволяет дать полную оценку способности субстрата к окислению.
Расход двухвалентного железа и форма импульса излучения. С помощью той же программы [8] мы рассчитывали концентрации компонентов, участвующих в реакции, и форму импульса свечения при разных значениях констант скорости реакций цепного окисления. Время регистрации 60 с. Расход основного реагента, двухвалентного железа, представлен на рис. 2, а. Видно, что за 60 с концентрация железа уменьшается в ~10 раз, т.е. через 60 с скорость инициирования (образования радикалов OH·) уменьшается на порядок.
Рассчитанные формы импульсов свечения представлены на рис. 2, б и 1, в. Видно, что спада интенсивности свечения за время 30 с, в течение которого экспериментально регистрировалась хемилюминесценция, может не наблюдаться (рис. 2, в). Характеристики импульса свечения (длительность переднего фронта, величина свечения в максимуме, положение и ширина максимума) определяются константами скорости реакций k1–k4.
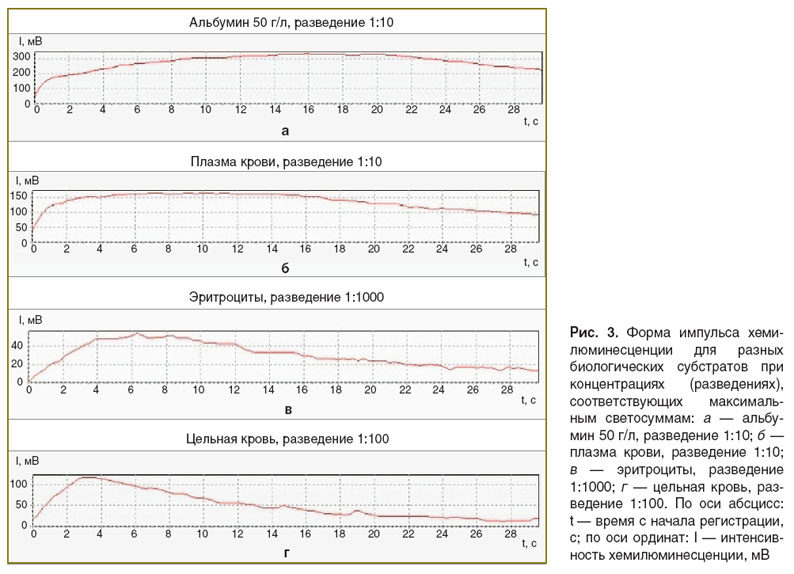
Экспериментально наблюдаемая форма импульса, регистрируемая биохемилюминометром, для разных проб при концентрациях, соответствующих максимуму свечения, представлена на рис. 3. Излучение холостого раствора Фентона без биологической пробы практически заканчивается за 30 с (см. рис. 1, в). При наличии биологической пробы люминесценция в течение 30 с заканчивается не всегда. В ряде случаев, как, например, для альбумина и плазмы крови, через 30 с интенсивность свечения остается на уровне 60–70% от максимального значения. Возможны случаи, когда свечение через 30 с только выходит на плато (см. рис. 2, в). Поэтому установить связь между характеристиками заднего фронта импульса хемилюминесценции и характеристиками процесса окисления не представляется возможным.
На основании полученных экспериментальных данных и результатов расчета кинетики процесса хемилюминесценции, индуцированной реакцией Фентона, использование в качестве критерия окислительной способности тангенса угла наклона заднего фронта импульса хемилюминесценции, который применяется в ряде работ [3, 4], не корректно.
Какой параметр хемилюминесценции, индуцируемой реакцией Фентона, характеризует окислительную способность исследуемого вещества? При изучении хемилюминесценции, индуцированной реакцией Фентона, получаем светосумму S для испытываемого вещества. Чтобы исключить факторы, связанные с чувствительностью аппаратуры, делим эту светосумму на светосумму S0 холостого раствора Фентона, где в роли пробы выступает растворитель (вода, фосфатный буфер, физиологический раствор, раствор Хенкса и т.д.). Величина S0 характеризует состояние прибора и реакцию Фентона (растворы железа и перекиси водорода), и в идеале в процессе эксперимента эти параметры не меняются. Именно поэтому в ходе исследования хемилюминесценции необходимо анализировать отношение S/S0. На рис. 4, а приведены значения S/S0 для альбумина в начальной концентрации 50 г/л и для последовательных разведений альбумина. Из приведенных данных следует, что максимальная величина S/S0 достигается при разведении в 10 раз (разведение –1). При увеличении разведения светосумма уменьшается. Для исходного вещества, концентрация которого в 10 раз больше, чем при разведении 10-1, значение светосуммы ниже.
Рассмотрим зависимость светосуммы от концентрации гипотетического вещества RH (рис. 4, д). Значения констант скорости реакций для данного случая k1=106, k2=105, k3=10, k4=104 л(моль·с)-1.
Начальная концентрация [RH]=100 моль/л. Максимальная светосумма получается при концентрации, которая в 100 раз меньше исходной (разведение –2).
Предположим, что есть один многокомпонентный биологический субстрат, светосумма которого Sx1, и второй многокомпонентный биологический субстрат со светосуммой Sx2. Светосуммы различны, но что можно сказать про окислительную способность проб? Исходя из расчетных и экспериментальных данных — практически ничего, так как, сравнивая только величины Sx1 и Sx2, невозможно узнать, какой концентрации субстрата соответствует максимально возможная светосумма хемилюминесценции. Из рис. 4 (а–д) видно, что с увеличением концентрации вещества в пробе светосумма сначала может расти, достигает максимума, затем уменьшается. В отдельных случаях она может оказаться меньше светосуммы холостого раствора Фентона, S/S0<1 (см. табл. 2–4). Используя показатели хемилюминесценции исследуемой биологической пробы в разных концентрациях, можно получить концентрацию, при которой светосумма максимальна. Максимальная светосумма для биологических и органических субстратов в зависимости от состояния субстрата (констант скорости реакций k1–k4) может быть достигнута при разных концентрациях (разведениях) вещества (см. табл. 1–4). Поэтому окислительную способность вещества характеризуют концентрация, при которой наблюдается максимальная светосумма, и значение этой светосуммы.
Заключение. Проведенное исследование позволяет сделать следующие выводы:
1. Оптимальные концентрации перекиси водорода и двухвалентного железа для регистрации хемилюминесценции, индуцированной реакцией Фентона, при использовании биохемилюминометра БХЛ-07 составляют: [H2O2]=10-3 моль/л, [Fe2+]=10-3 моль/л при значении pH=2.
2. Раствор двухвалентного железа необходимо готовить в кислой среде pH=2 (при добавлении серной кислоты), так как в нейтральной среде железо быстро окисляется кислородом воздуха.
3. Хемилюминесценция, индуцированная реакцией Фентона, как для дистиллированной воды, так и для биологической пробы обусловлена распадом димера синглетного кислорода и находится в красной области спектра.
4. Показатель S/S0 исследуемого многокомпонентного биологического субстрата имеет максимум люминесценции при определенном значении концентрации (разведении).
5. Положение максимума люминесценции и максимальной светосуммы определяется значением констант скорости реакций инициирования, продолжения и обрыва цепи k1–k4.
6. Измерение хемилюминесценции в реакции Фентона позволяет оценивать окислительную способность испытываемого вещества. Использование в качестве критериев окислительной способности вещества таких параметров, как максимальная интенсивность свечения Imax и тангенс угла наклона заднего фронта импульса свечения tgα, при произвольно выбранной концентрации не корректно.
7. Характеристикой окислительной способности испытываемого вещества при изучении хемилюминесценции, индуцированной реакцией Фентона, является концентрация (разведение), при которой регистрируется максимальная светосумма S/S0.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.