Изучение аллергизирующих свойств радиофармпрепарата «Наноколлоид,99mТc–Al2O3» в эксперименте
Цель исследования — в эксперименте оценить аллергизирующие свойства нового наноколлоидного препарата на основе меченного технецием-99m гамма-оксида алюминия для сцинтиграфического и интраоперационного выявления «сторожевых» лимфатических узлов.
Материалы и методы. Выполнена серия экспериментов с участием 80 морских свинок, 30 мышей линии Balb/c, 40 мышей линии CBA/CaLac и 70 аутбредных мышей обоего пола. Для исследования аллергенности препарат вводили подкожно, внутримышечно, внутривенно, внутрикожно в различных дозах курсом и однократно. Изучение аллергизирующих свойств радиофармпрепарата проводили согласно «Методическим рекомендациям по оценке аллергизирующих свойств лекарственных средств».
Результаты. Введение радиофармпрепарата «Наноколлоид,99mTc–Al2O3» не приводило к усилению интенсивности системной реакции анафилаксии у животных опытных групп по сравнению с контролем. Однократное введение мышам не вызывало реакции воспаления на Конканавалин А у животных опытных групп. При иммунизации морских свинок препаратом у них не выявили аллергической реакции замедленного типа. При исследовании сенсибилизирующего действия препарата путем 20 накожных аппликаций не наблюдали развития покраснения или отека кожи на месте нанесения исследуемого препарата.
Заключение. Радиофармпрепарат «Наноколлоид,99mTc–Al2O3» в изученных дозировках и в выбранных условиях эксперимента не обладает аллергизирующими свойствами.
«Сторожевые» лимфатические узлы представляют собой первые лимфатические узлы на пути оттока лимфы от злокачественной опухоли. Полагают, что если они не поражены метастатическим процессом, все остальные регионарные лимфоузлы остаются интактными [1, 2]. Повсеместное внедрение технологий выявления «сторожевых» лимфоузлов позволит улучшить качество жизни большому количеству больных [1–5]. Оптимальным методом выявления таких узлов является использование меченных технецием-99m коллоидных наноматериалов для сцинтиграфического или радиометрического определения локализации узла с последующим его экспресс-гистологическим исследованием [6, 7].
Следует отметить, что короткоживущий технеций-99m на сегодняшний день является наиболее востребованным радионуклидом для проведения диагностических исследований практически во всех областях медицины. Радиофармпрепараты (РФП) на его основе используются более чем в 87% всех радионуклидных исследований, проводимых с целью выявления различных заболеваний и оценки состояния живых систем. Это, в первую очередь, обусловлено его ядерно-физическими характеристиками: относительно коротким временем полураспада Т1/2 (6,02 ч) и энергией γ-излучения (0,1405 МэВ), обеспечивающими малую экспозиционную дозу и вместе с тем достаточную проникающую способность для проведения радиометрических измерений. Кроме того, богатая координационная химия технеция позволяет получать на его основе различные простые и сложные биологически активные комплексные соединения с заданными свойствами [8–10]. На сегодняшний день технеций-99m является наиболее доступным радионуклидом для ядерной медицины, что связано с возможностью его получения непосредственно в медицинских учреждениях из 99Мо/99mТс-генераторов.
Основными предпосылками для использования оксида алюминия в качестве носителя метки технеция-99m является его низкая токсичность в сочетании с хорошими адсорбционными свойствами, доступностью и низкой стоимостью.
Радиофармпрепарат «Наноколлоид,99mТс–Al2O3» — новый отечественный препарат, разработанный в Томском политехническом университете (Россия) для диагностики «сторожевых» лимфатических узлов у онкологических больных.
Цель исследования — экспериментальное изучение аллергизирующих свойств нового отечественного радиофармпрепарата — наноколлоида на основе меченного технецием-99m гамма-оксида алюминия для визуализации «сторожевых» лимфатических узлов.
Материалы и методы. В экспериментах было использовано 80 морских свинок обоего пола массой 250–300 г 6–8-недельного возраста, 30 мышей линии Balb/c, 40 мышей линии CBA/CaLac и 70 аутбредных мышей обоего пола 6–8-недельного возраста c массой тела 18–22 г.
Содержание экспериментальных животных и проведение исследования осуществляли в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.).
Терапевтическая доза (ТД) РФП была определена как 0,09 мл/кг для мышей и 0,04 мл/кг — для морских свинок. Используемые в экспериментах дозы соответствовали рекомендуемым для введения человеку, пересчет для введения животным производился по Freireich.
Для исследования аллергенности препарат применяли подкожно, внутримышечно, внутривенно, внутрикожно в различных дозах курсом и однократно. Животным контрольной группы соответствующего пола и возраста вводили растворитель (изотонический раствор натрия хлорида) в эквивалентной дозе.
Изучение аллергизирующих свойств РФП проводили согласно «Методическим рекомендациям по оценке аллергизирующих свойств лекарственных средств» [11].
Аллергизирующие свойства препарата были оценены при помощи следующих методик:
1. Реакция общей анафилаксии (анафилактический шок) у морских свинок. Используемые животные (n=30, по 15 самцов и самок) — половозрелые конвенциональные морские свинки. Масса самцов — 270–300 г, самок — 250–280 г, возраст — 8 нед. Сенсибилизацию выполняли введением исследуемого препарата трехкратно парентерально: первая инъекция — подкожно, две последующие — внутримышечно через день в объеме 1 и 10 ТД (n=20). Контрольной группе (n=10) вводили изотонический раствор натрия хлорида в объеме 2 мл/кг по такой же схеме. Анафилактогенные свойства препарата выявляли путем внутривенного его введения на 14-е сутки после последнего сенсибилизирующего применения. Тестирующее внутривенное введение исследуемого препарата выполняли в суммарной сенсибилизирующей дозе, т.е. 0,12 и 1,2 мл/кг. Контролем служили несенсибилизированные морские свинки, которым препарат вводили внутривенно в дозе 0,12 мл/кг. Учет интенсивности анафилактической реакции проводили по методу W.O. Weigle.
2. Конъюнктивальная проба на морских свинках. Животным опытной группы (n=20) предварительно провели сенсибилизацию путем подкожного введения РФП в дозах 0,04 и 0,4 мл/кг в течение 5 дней. Тест заключался в закапывании в левый глаз каждого животного 20 мкл 0,01% раствора РФП (доза, не вызывающая раздражающего действия у интактных животных), в правый глаз — изотонического раствора натрия хлорида в том же объеме. Оценку состояния конъюнктивы глаза проводили через 15 мин и через 24–48 ч. 10 интактных морских свинок составили контрольную группу.
3. Реакция гиперчувствительности замедленного типа на мышах. Аутбредных мышей (n=20) сенсибилизировали однократно путем внутрикожного введения в основание хвоста 60 мкл эмульсии 10 мМ раствора РФП в полном адъюванте Фрейнда в соотношении 1:1. Для приготовления эмульсии использовали раствор Хенкса. Контрольных животных (n=20) сенсибилизировали эмульсией с адъювантом Фрейнда и раствором Хенкса по той же схеме, что и в опыте.
Для выявления сенсибилизации через 5 сут мышам в подушечку задней лапы вводили 40 мкл 10 мМ раствора РФП в растворе Хенкса. Через 6 и 24 ч после инъекции интенсивность реакции ГЗТ оценивали по индексу реакции (ИР), который вычисляли индивидуально для каждого животного по формуле:

где Моп — масса «опытной» лапы; Мк — масса «контрольной» лапы.
4. Активная кожная анафилаксия на мышах. Мышей линии Balb/c (n=20) сенсибилизировали путем введения РФП трехкратно парентерально: первая инъекция — подкожно, две последующие — внутримышечно через день в объеме 1 и 10 ТД. Разрешающее введение РФП осуществляли через 14 дней после последней сенсибилизирующей инъекции в двукратных разведениях 0,01% раствора препарата внутрикожно — 15 мкл (при доведении до объема 30 мкл изотонического раствора натрия хлорида) и 30 мкл. Через 20 мин мышам внутривенно вводили 0,5 мл 1% раствора синего Эванса. Через 30 мин животных выводили из эксперимента в СО2-камере и определяли размеры синего пятна на внутренней стороне кожи в месте введения препарата. Разрешенные к применению инъекции РФП и синего Эванса вводили также контрольным животным (n=10), которым в дни сенсибилизации опытных групп вводили только растворитель (физиологический раствор).
5. Непрямая реакция дегрануляции тучных клеток. По окончании 5-дневного курса введения мышам линии CBA/CaLac (n=40) препарата в объеме 1 и 10 ТД животных декапитировали в СО2-камере и получали сыворотку крови, которую затем тестировали на способность вызывать дегрануляцию тучных клеток в присутствии специфического антигена (изучаемый препарат). Для получения тучных клеток интактным животным после декапитации вводили внутрибрюшинно 4–5 мл раствора Хенкса без фенолового красного, после легкого массажа брюшной стенки в течение 1–1,5 мин собирали экссудат в силиконизированную пробирку. Препараты готовили на обезжиренных предметных стеклах, окрашенных 0,3% спиртовым раствором нейтрального красного и высушенных при комнатной температуре. С одной стороны предметного стекла смешивали 0,03 мл взвеси тучных клеток, 0,03 мл сыворотки подопытного животного и 0,03 мл 0,01% раствора препарата (опыт), с другой стороны — 0,03 мл взвеси тучных клеток, 0,03 мл сыворотки подопытного животного и 0,03 мл раствора Хенкса (контроль). Далее препараты покрывали покровными стеклами, затем инкубировали 15 мин в термостате при 37°С. Препараты изучали под микроскопом с увеличением 20.
Оценку результатов проводили с использованием дифференциального способа учета, подсчитывали показатель дегрануляции тучных клеток (ПДТК) по формуле:

где а, b, с, d — количество дегранулированных клеток соответственно степени дегрануляции (слабо выраженной, умеренной, резкой и степени полностью дегранулированных клеток).
6. Реакция воспаления на Конканавалин А. Опыты проводили на аутбредных мышах (n=20) массой 18–22 г. РФП вводили животным подкожно в двух объемах 1 и 10 ТД однократно. Мышам контрольной группы (n=10) аналогичным образом вводили изотонический раствор натрия хлорида в объеме 10 мл/кг. Через 3 ч после введения препарата или растворителя мышам опытных и контрольной групп субплантарно вводили Конканавалин А в дозе 100 мкг/20 г массы тела, в контрлатеральную конечность — тот же объем изотонического раствора натрия хлорида. Через 1 ч мышей декапитировали, определяли массу лап и подсчитывали ИР воспаления по формуле:

где Моп — масса стопы задней лапы, в подушечку которой вводили Конканавалин А; Мк — масса стопы задней лапы, в подушечку которой вводили изотонический раствор натрия хлорида.
7. Метод накожных аппликаций на морских свинках. Изучение сенсибилизирующего действия РФП проводили путем 20 повторных накожных аппликаций размером 2×2 см по 5 раз в неделю на участок боковой поверхности туловища морских свинок (n=10). Наносили по 3 капли 0,01% раствора РФП. Первое тестирование выполняли после 10 аппликаций, второе — после 20. 10 интактных морских свинок составили контрольную группу.
Полученные в ходе исследования данные обрабатывали методом вариационной статистики. Для каждой выборки вычисляли среднее арифметическое (Х), ошибку среднего арифметического (m). Проверку на нормальность распределения проводили с помощью критерия Шапиро–Уилка. Сравнение выборочных средних осуществляли по t-критерию Стьюдента в случае нормального распределения или по критерию Крускалла–Уоллиса для К-несвязанных выборок (К>2) в случае распределения, отличающегося от нормального.
Результаты и обсуждение
Реакция общей анафилаксии (анафилактический шок). Тестирующее внутривенное введение РФП не приводило к развитию анафилактической реакции у морских свинок. Анафилактический индекс как в контрольных, так и в опытных группах животных обоего пола был менее 1,0 (табл. 1).
|
|
Конъюнктивальная проба. Конъюнктивальный тест не выявил признаков покраснения конъюнктивы или слезного протока глаз морских свинок как у самцов, так и у самок, что свидетельствует об отсутствии повышенной чувствительности к препарату.
Реакция гиперчувствительности замедленного типа на мышах. Статистически значимых различий индекса реакции гиперчувствительности замедленного типа в опытных группах, получавших РФП с адъювантом Фрейнда, как у мышей-самцов, так и у мышей-самок по сравнению с контрольными группами не наблюдалось через 6 и 24 ч исследования (табл. 2).
 Таблица 2. Влияние радиофармпрепарата, введенного с адъювантом Фрейнда, на интенсивность реакции гиперчувствительности замедленного типа у аутбредных мышей ( Таблица 2. Влияние радиофармпрепарата, введенного с адъювантом Фрейнда, на интенсивность реакции гиперчувствительности замедленного типа у аутбредных мышей (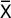 ±m) ±m)
|
Активная кожная анафилаксия на мышах. После внутрикожного введения разрешающей инъекции 0,01% раствора РФП мышам линии Balb/c диаметр окрашенного пятна статистически значимо не отличался в опытных группах с использованием различных доз препарата как у самцов, так и у самок по сравнению с соответствующими значениями в группах контроля (табл. 3).
 Таблица 3. Влияние радиофармпрепарата в дозах 0,09 мл/кг и 0,9 мл/кг на активную кожную анафилаксию у мышей линии Balb/c ( Таблица 3. Влияние радиофармпрепарата в дозах 0,09 мл/кг и 0,9 мл/кг на активную кожную анафилаксию у мышей линии Balb/c (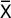 ±m) ±m)
|
Непрямая реакция дегрануляции тучных клеток. Сыворотка, полученная от мышей линии CBA/CaLac обоего пола, которым вводили РФП курсом, не вызывала статистически значимого изменения показателя дегрануляции тучных клеток по сравнению с контроль- ной группой как в присутствии, так и в отсутствии исследуемого препарата (табл. 4).
 Таблица 4. Влияние курсового введения радиофармпрепарата в дозах 0,09 и 0,9 мл/кг на реакцию дегрануляции тучных клеток мышей линии CBA/CaLac ( Таблица 4. Влияние курсового введения радиофармпрепарата в дозах 0,09 и 0,9 мл/кг на реакцию дегрануляции тучных клеток мышей линии CBA/CaLac (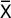 ±m) ±m)
|
Реакция воспаления на Конканавалин А у мышей. Введение РФП аутбредным мышам обоего пола не влияло на ИР воспаления на Конканавалин А (табл. 5).
 Таблица 5. Влияние однократного введения радиофармпрепарата в дозах 0,09 и 0,9 мл/кг на индекс реакции воспаления на Конканавалин А у аутбредных мышей ( Таблица 5. Влияние однократного введения радиофармпрепарата в дозах 0,09 и 0,9 мл/кг на индекс реакции воспаления на Конканавалин А у аутбредных мышей (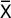 ±m) ±m)
|
Метод накожных аппликаций. При исследовании сенсибилизирующего действия РФП путем накожных аппликаций не наблюдалось развития покраснения или отека кожи на месте нанесения исследуемого препарата как после 10, так и после 20 аппликаций, реакция кожи в опытных группах (самцы и самки) не отличалась от реакции в контрольных.
Таким образом, при изучении аллергизирующих свойств РФП «Наноколлоид,99mТс–Al2O3» в экспериментах на разных животных не выявлено статистически значимых различий результатов в контрольных и опытных группах при использовании в экспериментах как самцов, так и самок. Исследуемый препарат не вызывает реакции общей анафилаксии (анафилактический шок), не влияет на активную кожную анафилаксию, на псевдоаллергическую реакцию воспаления на Конканавалин А у мышей и на непрямую реакцию дегрануляции тучных клеток у мышей. Препарат, введенный с адъювантом Фрейнда, не усиливает воспаление в реакции гиперчувствительности замедленного типа. У всех экспериментальных животных отсутствует повышенная чувствительность к исследуемому препарату.
Заключение. Радиофармпрепарат «Наноколлоид,99mTc-Al2O3» в изученных дозировках и в выбранных условиях экспериментов не обладает аллергизирующими свойствами.
Финансирование. Работа выполнена при поддержке федеральной целевой программы «ФАРМА-2020» (2011–2014 гг.) «Доклинические исследования нового лимфотропного радиофармацевтического препарата на основе меченного технецием-99m гамма-оксида алюминия».
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Чернов В.И., Синилкин И.Г., Ширяев С.В. Радионуклидное выявление сторожевых лимфатических узлов. В кн.: Национальное руководство по радионуклидной диагностике. Под ред. Лишманова Ю.Б., Чернова В.И. Томск: STT; 2010; с. 336–343.
- Paredes P., Vidal-Sicart S., Zanón G., Pahisa J., Fernández P.L., Velasco M., Santamaría G., Ortín J., Duch J., Pons F. Clinical relevance of sentinel lymph node in the internal mammary chain in breast cancer patients. Eur J Nucl Med Mol Imaging 2005; 32(11): 1283–1287, http://dx.doi.org/10.1007/s00259-005-1867-z.
- Канаев С.В., Новиков С.Н., Жукова Л.А., Зотова О.В., Семиглазов В.Ф., Криворотько П.В. Использование данных радионуклидной визуализации индивидуальных путей лимфооттока от новообразований молочной железы для планирования лучевой терапии. Вопросы онкологии 2011; 57(5): 616–621.
- Чернов В.И., Афанасьев С.Г., Синилкин А.А. Радионуклидные методы исследования в выявлении «сторожевых» лимфатических узлов. Сибирский онкологический журнал 2008; 4: 5–10.
- Schauer A.J., Becker W., Reiser M., Possinger K. The sentinel lymph node concept. Springer Verlag, Heidelberg Berlin New York; 2005, http://dx.doi.org/10.1007/b137529.
- Афанасьев С.Г., Августинович А.В., Чернов В.И., Синилкин И.Г. Возможность определения сторожевых узлов у больных раком желудка. Сибирский онкологический журнал 2009; 34(4): 27–32.
- Maza S., Valencia R., Geworski L., Zander A., Guski H., Winzer K.J., Munz D.L. Peritumoural versus subareolar administration of technetium-99m nanocolloid for sentinel lymph node detection in breast cancer: preliminary results of a prospective intra-individual comparative study. Eur J Nucl Med Mol Imaging 2003; 30(11): 651–688, http://dx.doi.org/10.1007/s00259-003-1128-y.
- Jurisson S.S., Lydon J.D. Potential technetium small molecule radiopharmaceuticals. Chem Rev 1999; 99(9): 2205–2218, http://dx.doi.org/10.1021/cr980435t.
- Baishya R., Nayak D.K., Karmakar S., Chattopadhyay S., Sachdeva S.S., Sarkar B.R., Ganguly S., Debnath M.C. Synthesis and evaluation of technetium-99m-labeled bioreductive pharmacophores conjugated with amino acids and peptides for tumor imaging. Chem Biol Drug Des 2015; 85(4): 504–517, http://dx.doi.org/10.1111/cbdd.12437.
- Geskovski N., Kuzmanovska S., Simonoska Crcarevska M., Calis S., Dimchevska S., Petrusevska M., Zdravkovski P., Goracinova K. Comparative biodistribution studies of technetium-99 m radiolabeled amphiphilic nanoparticles using three different reducing agents during the labeling procedure. J Labelled Comp Radiopharm 2013; 56(14): 689–695, http://dx.doi.org/10.1002/jlcr.3097.
- Руководство по проведению доклинических исследований лекарственных средств. Часть I. М: «Гриф и К»; 2012; 944 с.











