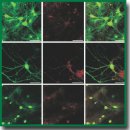
Сравнительный анализ действия фотосенсибилизаторов фотосенс, фотодитазин и гиперицин на клетки глиомы и первичные нейрональные культуры in vitro
Цель исследования — сравнить эффекты воздействия фотосенсибилизаторов фотосенс, фотодитазин и гиперицин на первичные культуры клеток головного мозга и оценить их токсическое действие на нормальные нервные клетки и клетки глиомы с целью выбора препарата с оптимальными для лечения глиом свойствами.
Материалы и методы. Оценка цитотоксичности препаратов фотосенс (ГНЦ «НИОПИК», Россия), фотодитазин («Вета-гранд», Россия), гиперицин (Merck KGaA; Sigma-Aldrich, Германия) выполнена на первичных культурах клеток гиппокампа эмбрионов мышей линии C57BL/6 (18-й день гестации). На 14-й день культивирования исследуемые фотосенсибилизаторы добавляли в среду культивирования в концентрациях 0,1; 1; 10; 50 и 100 мкМ. Культуры помещали в условия СО2-инкубатора с защитой от прямых солнечных лучей. Жизнеспособность первичных культур оценивали через 3 и 7 сут после добавления тестируемых соединений. С применением метода конфокальной микроскопии проводили анализ скорости поступления и субклеточной локализации фотосенсибилизаторов в клетки первичных нейрональных культур. Статистический анализ выполняли в программе SigmaPlot 11.0 (Systat Software Inc., США) с помощью пакета ANOVA.
Результаты. Проанализированы спектры поглощения и флюоресценции исследуемых фотосенсибилизаторов. Фотосенс и фотодитазин показали наличие в спектре максимумов поглощения в коротковолновой и длинноволновой областях спектра. Для гиперицина характерен сложный спектр поглощения с множеством максимумов как в сине-фиолетовой, так и в оранжево-красной областях. Оценка жизнеспособности показала, что высокие концентрации фотосенсибилизаторов оказывают сильное токсическое действие на клетки нервной системы. Наиболее выраженное действие — у фотодитазина. Наименьшей скоростью накопления в клетках нервной системы обладает фотосенс. Установлено, что фотосенс и гиперицин, обладающие высоким фототоксическим действием на клетки глиомы, демонстрируют сравнительно низкую темновую токсичность для нормальных клеток нервной системы.
Заключение. Наименее токсичными для нервной ткани, но эффективно проникающими в клетки опухоли являются фотосенсибилизаторы гиперицин и фотосенс. Эти свойства позволяют считать их перспективными фотодинамическими агентами для практического применения.
- Ostrom Q.T., Gittleman H., Xu J., Kromer C., Wolinsky Y., Kruchko C., Barnholtz-Sloan J.S. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2009–2013. Neuro Oncol 2016; 18(suppl_5): v1–v75, https://doi.org/10.1093/neuonc/now207.
- Ostrom Q.T., Gittleman H., Liao P., Vecchione-Koval T., Wolinsky Y., Kruchko C., Barnholtz-Sloan J.S. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2010–2014. Neuro Oncol 2017; 19(suppl_5): v1–v88, https://doi.org/10.1093/neuonc/nox158.
- Cohen A.L., Colman H. Glioma biology and molecular markers. In: Raizer J., Parsa A. (editors). Current understanding and treatment of gliomas. Cancer treatment and research. Vol. 163. Springer, Cham; 2015; p. 15–30, https://doi.org/10.1007/978-3-319-12048-5_2.
- Кубасова И.Ю., Вакуловская Е.Г., Ермакова К.В., Смирнова З.С. Флюоресцентная диагностика и фотодинамическая терапия при лечении злокачественных опухолей головного мозга. Российский биотерапевтический журнал 2006; 5(4): 54–67.
- Lacroix M., Abi-Said D., Fourney D.R., Gokaslan Z.L., Shi W., DeMonte F., Lang F.F., McCutcheon I.E., Hassenbusch S.J., Holland E., Hess K., Michael C., Miller D., Sawaya R. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg 2001; 95(2): 190–198, https://doi.org/10.3171/jns.2001.95.2.0190.
- Jiang H., Cui Y., Liu X., Ren X., Lin S. Patient-specific resection strategy of glioblastoma multiforme: choice based on a preoperative scoring scale. Ann Surg Oncol 2017; 24(7): 2006–2014, https://doi.org/10.1245/s10434-017-5843-1.
- Sarkaria J.N., Hu L.S., Parney I.F., Pafundi D.H., Brinkmann D.H., Laack N.N., Giannini C., Burns T.C., Kizilbash S.H., Laramy J.K., Swanson K.R., Kaufmann T.J., Brown P.D., Agar N.Y.R., Galanis E., Buckner J.C., Elmquist W.F. Is the blood-brain barrier really disrupted in all glioblastomas? A critical assessment of existing clinical data. Neuro Oncol 2018; 20(2): 184–191, https://doi.org/10.1093/neuonc/nox175.
- Kang J.H., Adamson C. Novel chemotherapeutics and other therapies for treating high-grade glioma. Expert Opin Investig Drugs 2015; 24(10): 1361–1379, https://doi.org/10.1517/13543784.2015.1048332.
- de Paula L.B., Primo F.L., Tedesco A.C. Nanomedicine associated with photodynamic therapy for glioblastoma treatment. Biophys Rev 2017; 9(5): 761–773, https://doi.org/10.1007/s12551-017-0293-3.
- Di Carlo D.T., Cagnazzo F., Benedetto N., Morganti R., Perrini P. Multiple high-grade gliomas: epidemiology, management, and outcome. A systematic review and meta-analysis. Neurosurg Rev 2019; 42(2): 263–275, https://doi.org/10.1007/s10143-017-0928-7.
- Kaneko S., Fujimoto S., Yamaguchi H., Yamauchi T., Yoshimoto T., Tokuda K. Photodynamic therapy of malignant gliomas. Prog Neurol Surg 2018; 32: 1–13, https://doi.org/10.1159/000469675.
- Li M., Deng H., Peng H., Wang Q. Functional nanoparticles in targeting glioma diagnosis and therapies. J Nanosci Nanotechnol 2014; 14(1): 415–432, https://doi.org/10.1166/jnn.2014.8757.
- Krysko D.V., Garg A.D., Kaczmarek A., Krysko O., Agostinis P., Vandenabeele P. Immunogenic cell death and DAMPs in cancer therapy. Nat Rev Cancer 2012; 12(12): 860–875, https://doi.org/10.1038/nrc3380.
- Halliwell B., Gutteridge J.M.C. Free radicals in biology and medicine. Clarendon Press, Oxford; 2007; 888 p.
- Fingar V.H. Vascular effects of photodynamic therapy. J Clin Laser Med Surg 1996; 14(5): 323–328, https://doi.org/10.1089/clm.1996.14.323.
- Бывальцев В.А., Степанов И.А., Кичигин А.И. Анализ результатов применения флуоресцентной навигации с 5-аминолевулиновой кислотой в хирургии глиом высокой степени злокачественности. Сибирский онкологический журнал 2018; 17(2): 18–26, https://doi.org/10.21294/1814-4861-2018-17-2-18-26.
- Couldwell W.T., Surnock A.A., Tobia A.J., Cabana B.E., Stillerman C.B., Forsyth P.A., Appley A.J., Spence A.M., Hinton D.R., Chen T.C. A phase 1/2 study of orally administered synthetic hypericin for treatment of recurrent malignant gliomas. Cancer 2011; 117(21): 4905–4915, https://doi.org/10.1002/cncr.26123.
- Garg A.D., Krysko D.V., Vandenabeele P., Agostinis P. Extracellular ATP and P2X7 receptor exert context-specific immunogenic effects after immunogenic cancer cell death. Cell Death Dis 2016; 7: e2097, https://doi.org/10.1038/cddis.2015.411.
- Zavadskaya T.S. Photodynamic therapy in the treatment of glioma. Exp Oncol 2015; 37(4): 234–241, https://doi.org/10.31768/2312-8852.2015.37(4):234-241.
- Medyanik I.А., Volovik М.G., Dydykin А.V., Yashin К.S., Kulakova К.V., Bugrov S.N., Karyakin N.N. Intraoperational thermal control of perifocal edema in photodynamic therapy of malignant brain tumors. Sovremennye tehnologii v medicine 2016; 8(3): 82–90, https://doi.org/10.17691/stm2016.8.3.09.
- Vedunova M., Sakharnova T., Mitroshina E., Perminova M., Pimashkin A., Zakharov Y., Dityatev A., Mukhina I. Seizure-like activity in hyaluronidase-treated dissociated hippocampal cultures. Front Cell Neurosci 2013; 7(149), https://doi.org/10.3389/fncel.2013.00149.
- Vedunova M.V., Mishchenko T.A., Mitroshina E.V., Mukhina I.V. TrkB-mediated neuroprotective and antihypoxic properties of brain-derived neurotrophic factor. Oxid Med Cell Longev 2015; 2015: 453901, https://doi.org/10.1155/2015/453901.
- Buytaert E., Dewaele M., Agostinis P. Molecular effectors of multiple cell death pathways initiated by photodynamic therapy. Biochim Biophys Acta 2007; 1776(1): 86–107, https://doi.org/10.1016/j.bbcan.2007.07.001.<
- Agostinis P., Berg K., Cengel K.A., Foster T.H., Girotti A.W., Gollnick S.O., Hahn S.M., Hamblin M.R., Juzeniene A., Kessel D., Korbelik M., Moan J., Mroz P., Nowis D., Piette J., Wilson B.C., Golab J. Photodynamic therapy of cancer: an update. CA Cancer J Clin 2011; 61(4): 250–281, https://doi.org/10.3322/caac.20114.
- Wank M., Schilling D., Schmid T.E., Meyer B., Gempt J., Barz M., Schlegel J., Liesche F., Kessel K.A., Wiestler B., Bette S., Zimmer C., Combs S.E. Human glioma migration and infiltration properties as a target for personalized radiation medicine. Cancers 2018; 10(11): 456, https://doi.org/10.3390/cancers10110456.
- de Leeuw C.N., Vogelbaum M.A. Supratotal resection in glioma: a systematic review. Neuro Oncol 2019; 21(2): 179–188, https://doi.org/10.1093/neuonc/noy166.
- Николлс Дж.Г., Мартин А.Р., Валлас Б.Дж., Фукс П.А. От нейрона к мозгу. М: Изд-во Либроком; 2012; 672 с.
- Singh A., Kukreti R., Saso L., Kukreti S. Oxidative stress: a key modulator in neurodegenerative diseases. Molecules 2019; 24(8): 1583, https://doi.org/10.3390/molecules24081583.
- Márquez J., Alonso F.J., Matés J.M., Segura J.A., Martín-Rufián M., Campos-Sandoval J.A. Glutamine addiction in gliomas. Neurochem Res 2017; 42(6): 1735–1746, https://doi.org/10.1007/s11064-017-2212-1.
- Rivera J.F., Sridharan S.V., Nolan J.K., Miloro S.A., Alam M.A., Rickus J.L., Janes D.B. Real-time characterization of uptake kinetics of glioblastoma vs. astrocytes in 2D cell culture using microelectrode array. Analyst 2018; 143(20): 4954–4966, https://doi.org/10.1039/c8an01198b.
- Брилкина А.А., Дубасова Л.В., Балалаева И.В., Орлова А.Г., Сергеева Е.А., Катичев А.Р., Шахова Н.М. Исследование внутриклеточного распределения фотосенсибилизаторов трех типов в опухолевых клетках человека методом лазерной сканирующей микроскопии. Технологии живых систем 2011; 8(8): 32–39.
- Castano A.P., Demidova T.N., Hamblin M.R. Mechanisms in photodynamic therapy: part two-cellular signaling, cell metabolism and modes of cell death. Photodiagnosis Photodyn Ther 2005; 2(1): 1–23, https://doi.org/10.1016/s1572-1000(05)00030-x.
- Garg A.D., Krysko D.V., Vandenabeele P., Agostinis P. Hypericin-based photodynamic therapy induces surface exposure of damage-associated molecular patterns like HSP70 and calreticulin. Cancer Immunol Immunother 2012; 61(2): 215–221, https://doi.org/10.1007/s00262-011-1184-2.
- Mishchenko T., Mitroshina E., Balalaeva I., Krysko O., Vedunova M., Krysko D.V. An emerging role for nanomaterials in increasing immunogenicity of cancer cell death. Biochim Biophys Acta Rev Cancer 2019; 1871(1): 99–108, https://doi.org/10.1016/j.bbcan.2018.11.004.
- Li W., Yang J., Luo L., Jiang M., Qin B., Yin H., Zhu C., Yuan X., Zhang J., Luo Z., Du Y., Li Q., Lou Y., Qiu Y., You J. Targeting photodynamic and photothermal therapy to the endoplasmic reticulum enhances immunogenic cancer cell death. Nat Commun 2019; 10(1): 3349, https://doi.org/10.1038/s41467-019-11269-8.
- Hirschberg H., Berg K., Peng Q. Photodynamic therapy mediated immune therapy of brain tumors. Neuroimmunol Neuroinflamm 2018; 5, https://doi.org/10.20517/2347-8659.2018.31.










