Композитный тканеинженерный сосудистый протез малого диаметра на основе поликапролактона и полиуретана с ростовыми факторами и атромбогенным лекарственным покрытием: структурные и физико-механические характеристики
Существует растущая потребность в синтетических сосудистых протезах малого диаметра (<6 мм) для шунтирующих операций, поскольку большинство представленных в настоящее время изделий демонстрируют неприемлемую частоту тромбообразования в преклинических испытаниях. Собственная разработка композитного сосудистого протеза основана на нетканом полимерном материале с атромбогенной активностью, антианевризматическим усилением и функциональной активностью, направленной на стимулирование образования сосудистой неоткани в локации имплантации сосудистого протеза.
Цель исследования — изучить морфологию поверхности, физические и механические характеристики тканеинженерных сосудистых протезов малого диаметра на основе поликапролактона (PCL) и полиуретана (PU) с ростовыми факторами и атромбогенным лекарственным покрытием.
Материалы и методы. Композитные сосудистые протезы на основе PCL и PU с миксом ростовых факторов (GFmix) изготовлены методом электроспиннинга. Гидрогелевое покрытие с илопростом (Ilo) и гепарином (Hep) сформировано посредством комплексообразования через поливинилпирролидон. В роли групп сравнения выступили многослойные сосудистые протезы аналогичного компонентного состава и нетканые матриксы на основе 12% PCL и 12% PU. Структуру поверхности изучали методом сканирующей электронной микроскопии на микроскопе S-3400N (Hitachi, Япония). Физические свойства поверхности определяли методом краевого угла смачивания. Механические свойства изделий оценивали на универсальной испытательной машине серии Z (Zwick/Roell, Германия). Статистическую обработку проводили в программе GraphPad Prism 8.
Результаты. Новая технология изготовления композитного PU/PCL/GFmix/Ilo/Hep-протеза исключила расслоение стенки изделия. Структура внутренней поверхности состояла из переплетенных микро- (толщина — 1,34 [1,15; 2,28] мкм) и нановолокон (толщина — 790,0 [604,0; 853,5] нм), а также взаимопроникающих пор разного диаметра (5,4 [3,8; 8,4] мкм). Процесс формирования лекарственного покрытия не повлиял на волокна и не запаял поры, поверхность сохранила гидрофильные свойства (θ=68,61±11,85°). Напряжение (3,45 [3,17; 4,03] МПа) и модуль Юнга (4,88 [3,95; 5,80] МПа) PU/PCL/GFmix/Ilo/Hep были более приближены к внутренней грудной артерии человека в сравнении с многослойным аналогом. PU/PCL/GFmix/Ilo/Hep-протезы отличались снижением излишней эластичности до 118,0 [111,0; 125,0]% в сравнении с многослойными PCL/PU/GFmix/Ilo/Hep-протезами (р=0,043).
Заключение. Композитный функционально активный сосудистый протез PU/PCL/GFmix/Ilo/Hep обладает улучшенными характеристиками и, соответственно, комплаенсом, что в свою очередь увеличит шансы высокой проходимости в преклинических испытаниях.
Введение
Сосудистые заболевания — одна из ведущих причин инвалидности и смертности в мире. Стандартным лечением тяжелых сосудистых заболеваний является шунтирование с использованием аутологичных артерий или вен, однако их применение ограничено вследствие ряда факторов [1–3]. Основные синтетические материалы для сосудистой реконструкции кровеносных сосудов, такие как Gortex, Dacrone, ePTFE (d>6 мм), подвержены гиперплазии неоинтимы, кальцификации и бактериальной инфекции, что приводит к снижению проходимости данных протезов и высокому риску полной несостоятельности в долгосрочном периоде [4–6]. В качестве заменителей сосудов малого диаметра (d<6 мм) эти материалы совершенно не пригодны из-за их стремительного тромбоза [7–9]. Некоторые натуральные коммерческие трансплантаты, такие как Artegraft®, ProCol®, Omniflow II®, представляют собой биосинтетические протезы на основе бычьих сосудов и применяются в качестве шунтов для диализа и замены сосудов большого диаметра. Данные альтернативы также имеют ключевые ограничения, препятствующие их применению в шунтирующих операциях на сосудах малого калибра: несоответствие механических свойств, риск аневризмообразования и/или тромбозов, аллергические реакции и отторжения [10, 11].
На данный момент не создано эффективного синтетического сосудистого протеза малого диаметра для клинического применения. Перспективным кандидатом представляется тканеинженерный сосудистый трансплантат, изготовленный с использованием новых методов материаловедения, а также инженерии и клеточной биологии. Его преимущества по сравнению с аутотрансплантатами включают неинвазивное хирургическое вмешательство во время подготовки протеза, неограниченную доступность и возможность создания изделий индивидуальных размеров. Однако существующие разработки далеки от удовлетворительных. В силу ряда нерешенных вопросов продолжается поиск материалов для изготовления сосудистых протезов малого диаметра [12–15]. Большинство кандидатов таких протезов получают методом электроспиннинга или 3D-печати из полимерного раствора, что позволяет создать волокнистый пористый нетканый материал наподобие естественного внеклеточного матрикса. Низкая скорость кровотока в малокалиберных сосудах обусловливает высокий риск тромбообразования, с которым сталкиваются исследователи на этапе тестирования своих изделий на крупной животной модели [16]. Для преодоления данной проблемы и ряда других тканеинженерные сосудистые протезы можно наделить функциональной активностью: например, стимулированием эндотелизации; привлечением клеток, синтезирующих компоненты внеклеточного матрикса; антимикробным и антитромботическим потенциалом; также возможно усилить каркас для предупреждения аневризмообразования [17–19].
Предлагаемая нами новая технология создания функционально активного сосудистого протеза имеет несколько особенностей. Первая — это композитная основа из поликапролактона (PCL) и полиуретана (PU). PCL отличается достаточно высокой прочностью и эластичностью и подвергается биодеградации в течение 2–3 лет. При этом постепенная биорезорбция PCL обеспечит возможность полноценного ремоделирования протеза за счет замещения полимерного трубчатого каркаса собственными клетками и тканями пациента [20]. Присутствие PCL в составе каркаса способствует адаптивному росту протеза после его имплантации в сосудистое русло. PU представляет собой синтетический полимер — эластомер с высокой биосовместимостью и прекрасными механическими свойствами, который отличается повышенной стабильностью в биологических системах и используется в биомедицинской промышленности. Введение этого полимера в состав полимерного каркаса протеза будет способствовать приведению физико-механических свойств протеза к аналогичным свойствам нативных артериальных сосудов малого диаметра и обеспечит устойчивость его стенок к аневризматическому расширению за счет крайне низкой скорости гидролитической деградации [21–23]. Использование комбинации данных полимеров придаст сосудистому протезу высокую прочность и износостойкость, эластичность и устойчивость к изгибу. После имплантации протеза в сосудистое русло будет предотвращена возможность формирования аневризм стенки протеза в процессе его функционирования в сосудистом русле с сохранением возможности полноценного ремоделирования.
Вторая особенность — стимуляция процесса ремоделирования протеза после имплантации в сосудистое русло с использованием ангиогенных факторов, к которым относится сосудистый эндотелиальный фактор роста (VEGF), основной фактор роста фибробластов (bFGF) и хемоаттрактантная молекула — фактор стромальных клеток 1 альфа (SDF-1α). VEGF запускает эндотелизацию за счет активирования миграции, пролиферации, выживания и дифференцировки эндотелиальных клеток. bFGF стимулирует миграцию, пролиферацию и выживание как эндотелиальных, так и гладкомышечных клеток. SDF-1α способствует привлечению клеток-предшественников костномозгового происхождения из кровотока в зону локации протеза [24].
Третья особенность — поверхностное модифицирование протезов атромбогенными лекарственными препаратами (илопрост (Ilo) и гепарин (Hep)) для предупреждения тромбоза просвета имплантированных сосудистых протезов в раннем послеоперационном периоде [25].
На каждом этапе изготовления тканеинженерного сосудистого протеза необходимо контролировать качество материала, так как проведение дополнительных модифицирующих процедур затрагивает изменение его изначальных характеристик. В настоящей статье представлены данные сравнения in vitro новой технологии изготовления однослойного композитного функционально активного сосудистого протеза с предыдущей разработкой многослойного протеза, основанного на таком же компонентном составе.
Цель исследования — оценить структуру поверхности, физические и механические характеристики композитного тканеинженерного сосудистого протеза малого диаметра на основе поликапролактона и полиуретана с ростовыми факторами и атромбогенным лекарственным покрытием и сравнить с многослойным аналогом.
Материалы и методы
Изготовление PCL- и PU-матриксов. Методом электроспиннинга (Nanon-01A; MECC, Япония) из растворов 12% PCL (Sigma-Aldrich, США) и 12% PU (Tecoflex EG-80A; Lubrizol Advanced Materials, США) в хлороформе изготавливали матриксы, исходя из следующих параметров: игла — 22 G, напряжение — 20 кВ, скорость подачи раствора — 0,5 мл/ч; скорость вращения коллектора — 200 об./мин; время очистки иглы — 30 с.
Изготовление многослойных сосудистых протезов PCL/GFmix/PU/Ilo/Hep (d=4 мм). На первом этапе протезы изготавливали послойно методом электроспиннинга из полимерного раствора в хлороформе (АО «Вектон», Россия). 1-й (внутренний) слой: 12% PCL + 1% Plu (Sigma-Aldrich, США) c введением VEGF («СайСторЛаб», Россия). 2-й слой: 12% PCL + 1% Plu (Sigma-Aldrich, США) c введением bFGF («СайСторЛаб», Россия) и SDF-1α (Cloud-Сlone Сorp., США). Параметры: игла — 22 G, напряжение — 22 кВ, скорость вращения коллектора — 200 об./мин, скорость подачи раствора — 0,5 мл/ч, время очистки иглы — 30 с, расстояние от иглы до намоточного коллектора — 15 см. 3-й слой — 12% PU в хлороформе. Параметры повторяют вышеописанные за исключением напряжения, оно равнялось 20 кВ.
На втором этапе формировали лекарственное покрытие с Ilo и Hep посредством комплексообразования через поливинилпирролидон (PVP) [26].
Изготовление композитных однослойных сосудистых протезов PCL/PU/GFmix/Ilo/Hep (d=4 мм). На первом этапе протезы изготавливали методом электроспиннинга из полимерного раствора в хлороформе — 8% PCL + 5%PU + 1% Plu c одномоментным введением комплекса ростовых факторов (GFmix: VEGF, bFGF и SDF-1α). Параметры электроспиннинга: напряжение — 22 кВ, скорость вращения коллектора — 200 об./мин, скорость подачи раствора — 0,5 мл/ч, время очистки иглы — 30 с, расстояние от иглы до намоточного коллектора — 15 см.
Второй этап полностью соответствует вышеописанному.
Ультраструктура поверхности. Оценку структуры поверхности слоя проводили на сканирующем электронном микроскопе S-3400N (Hitachi, Япония) в условиях высокого вакуума при ускоряющем напряжении 10 кВ. Перед исследованием образцы протезов размером 0,5×0,5 см подвергали золото-палладиевому напылению (EM ACE200; Leica Mikrosysteme GmbH, Австрия) с получением покрытия толщиной 15 нм.
Физические и механические свойства. Для оценки гидрофильных/гидрофобных свойств определяли краевой угол смачивания на полимерных материалах методом сидячей капли с использованием прибора Drop Shape Analyzer DSA25 (KRÜSS GmbH, Германия) при комнатной температуре. Угол контакта был рассчитан из пяти изображений в программе ImageJ (NIH, США) для каждого типа полимерного материала.
Испытания по установлению механических свойств материала проводили на универсальной испытательной машине серии Z (Zwick/Roell, Германия) с использованием датчика с номинальной силой 50 Н и пределом допустимой погрешности ±1%, скорость перемещения траверсы при испытании — 50 мм/мин. Предел прочности материала оценивали как максимальное напряжение при растяжении (МПа) до начала разрушения. Поскольку исследуемые биологические образцы и протезы имели существенное различие по толщине и, как следствие, площади поперечного сечения, в качестве альтернативного критерия прочности использовали абсолютное значение максимальной силы, приложенной к образцу до начала разрушения (Fmax, Н). Упруго-деформативные свойства материала оценивали по относительному удлинению до начала разрушения образца (%) и модулю Юнга (МПа), который определяли в диапазонах физиологического давления (80–120 мм рт.ст.). Оценку механических свойств протезов проводили в сравнении с внутренней грудной артерией человека.
Статистическая обработка данных. Статистическую обработку результатов выполняли в программе GraphPad Prism 8 (GraphPad Software, США). Характер распределения данных в выборках оценивали по критериям Колмогорова–Смирнова и Шапиро–Уилка. Количественные данные представляли в виде среднего ± σ или медианы и квартильного размаха (Me [25%; 75%]). Статистически значимые различия между независимыми группами оценивали с использованием критерия Краскела–Уоллиса с коррекцией результатов с учетом множественности сравнения методом FDR. Статистически значимыми различия принимали при p<0,05 во всех тестах.
Результаты
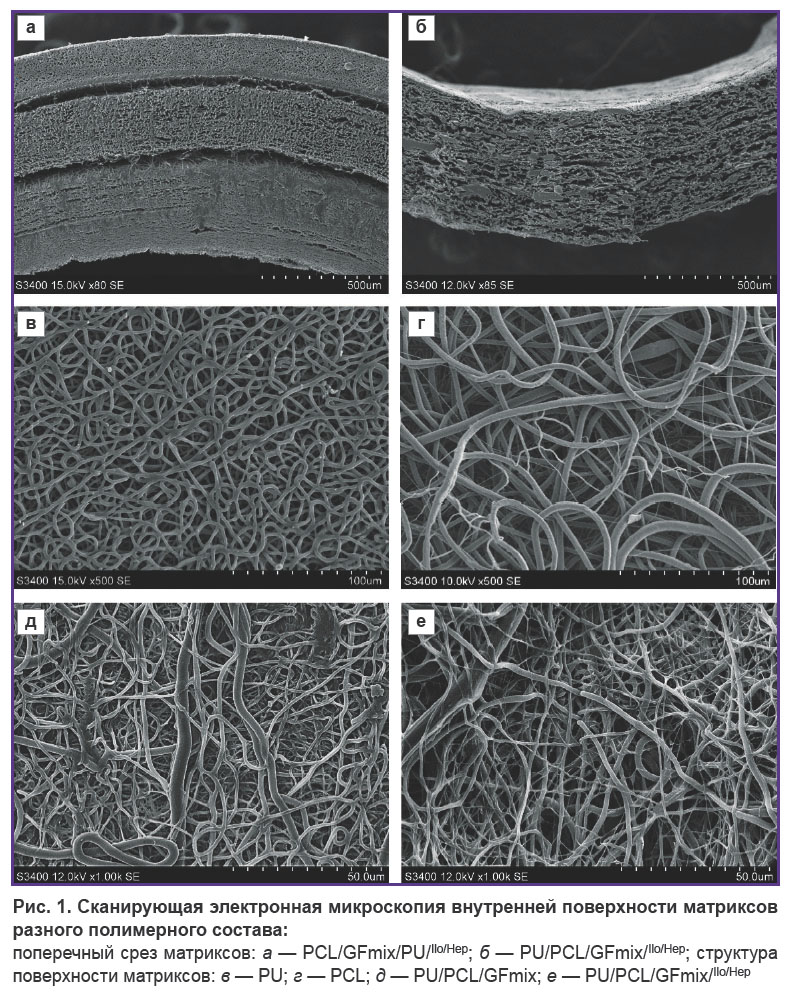
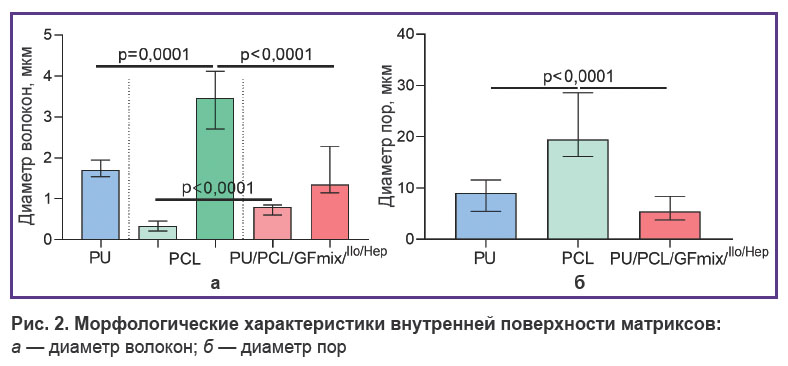
Структура поверхности материалов. Изначальный вариант изготовления многослойного сосудистого протеза с внешним PU-усилением методом электроспиннинга отличился отслоением как внешнего PU-слоя, так и сплошным радиальным расслоением PU/GFmix-основы в силу поэтапного формирования 1/3 изделия с инкорпорированием VEGF и 2/3 — с bFGF + SDF-1α (рис. 1, а). Концепция объединения PU, PCL и трех дифференцировочных факторов в единый раствор позволила создать тканеинженерный протез без расслоения его стенки (рис. 1, б). PU/PCL/GFmix-матрикс обладал особенностями каждого монокомпонентного материала: внутренняя поверхность состояла из переплетенных микро- (толщина — 1,34 [1,15; 2,28] мкм) и нановолокон (толщина — 790,0 [604,0; 853,5] нм) неупорядоченной витиеватой направленности с наличием пор разного диаметра (5,4 [3,8; 8,4] мкм), частично уплотненных сетями тесно переплетенных нановолокон. Добавление PU к PCL привело к статистически значимому снижению диаметра пор в 3,6 раза (р<0,0001) в сравнении с PCL-поверхностью (19,5 [16,2; 28,6] мкм). Пористость PCL/PU/GFmix-стенки составила не менее 50% (рис. 1, в–д; рис. 2). Сшивка PVP со сложноэфирными группами PCL в условиях атмосферы аргона при гамма-облучении и дальнейшая обработка миксом лекарств с высушиванием не повлияли на структуру волокон и не запаяли поры (рис. 1, е).
|
Рис. 2. Морфлогические характеристики внутренней поверхности матриксов: а — диаметр волокон; б — диаметр пор |
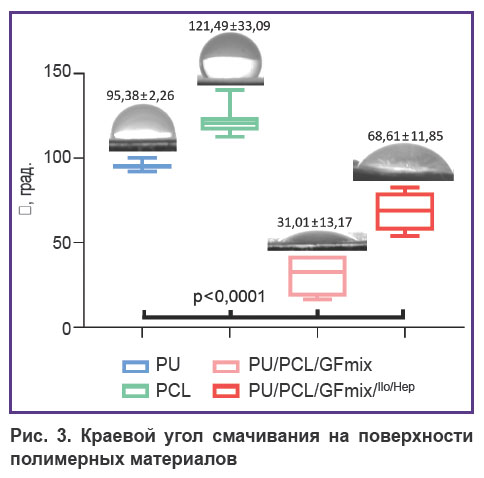
Физические характеристики поверхности материалов. Определение краевого угла смачиваемости выявило существенное повышение гидрофильности композитного материала PU/PCL/GFmix (θ=31,01±13,17°) в сравнении с монокомпонентными аналогами (р<0,0001). Формирование лекарственного покрытия способствовало статистически значимому снижению гидрофильности в 2,2 раза (р<0,0001); средний угол соприкосновения с водой составил 68,61±11,85° (рис. 3), однако данную модифицированную поверхность можно считать достаточно гидрофильной.
|
Рис. 3. Краевой угол смачивания на поверхности полимерных материалов |
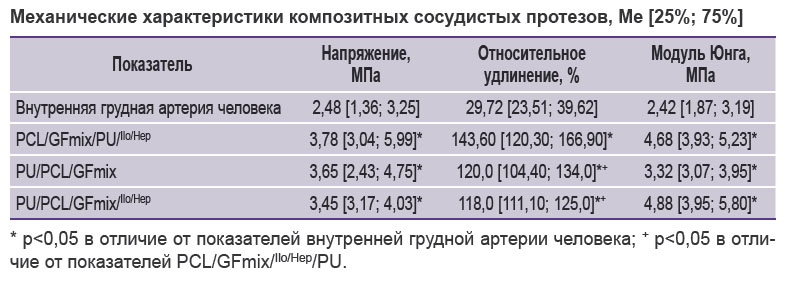
Механические характеристики композитных сосудистых протезов. Установлено, что создание лекарственного покрытия на PU/PCL/GFmix-протезах значимо не повлияло на механические характеристики изделия. Удалось приблизить показатели напряжения и жесткости протезов PU/PCL/GFmix/Ilo/Hep к внутренней грудной артерии человека в сравнении с PCL/GFmix/PU/Ilo/Hep-протезами, в которых полиуретан выступил в роли внешнего усиливающего слоя. Стоит также отметить, что композитные PU/PCL/GFmix/Ilo/Hep-протезы отличались статистически значимым снижением излишней эластичности до 118,0 [111,0; 125,0]% в сравнении с показателем PCL/GFmix/PU/Ilo/Hep-протезов (р=0,043) (см. таблицу).
|
Механические характеристики композитных сосудистых протезов, Me [25%; 75%] |
Обсуждение
При создании тканеинженерного сосудистого протеза малого диаметра нужно учитывать множество факторов для достижения его эффективного функционирования в сосудистом русле пациента. Необходимо, чтобы протез обладал приближенными биомеханическими характеристиками к нативной артерии для соответствующего комплаенса в гемодинамических условиях и предупреждения гиперплазии неоинтимы. Данного эффекта можно добиться регулированием параметров электроспиннинга или других методов получения нетканых материалов. Современный тренд разработок сосудистых протезов — придание им функциональной активности, направленной на решение основных проблем, комплексно связанных с эффективной проходимостью в долгосрочном периоде и с минимизацией необходимости замены протеза. При условии низкого кровотока и более высокого сопротивления [27] в малокалиберных сосудах существует высокий риск раннего тромбообразования протеза в данной проекции имплантации, поэтому исследователи модифицируют их разными методами: уменьшение пор на внутренней поверхности и создание антитромботических слоев, которые могут вызывать спонтанную эндотелизацию или местно высвобождать лекарственные вещества, блокирующие прикрепление тромбоцитов и формирование тромба. Одновременно с проблемой проходимости необходимо решать задачу гармонизации ремоделирования искусственного матрикса. Это можно обеспечить привлечением на поверхность и в толщу стенки изделия ряда клеток: эндотелиальных и фибробластов соответственно. Имплантация полимерных тканеинженерных протезов в сосудистое русло мелким и крупным лабораторным животным позволяет оценить новообразованную ткань, как правило, состоящую из подобия структур нативной сосудистой ткани: неоинтимы, неомедии, неоадвентиции и фрагментов полимерного каркаса [28]. Такая неоткань подвержена аневризмообразованию, что мы наблюдали в собственных экспериментах на модели овцы [29]. Усиление каркаса сосудистого протеза, устойчивого к биорезорбции, также является актуальной задачей при создании данного класса медицинских изделий.
Собственная разработка функционально активного нетканого сосудистого протеза малого диаметра на основе поликапролактона и полиуретана с инкорпорированием микса ростовых факторов (VEGF, bFGF, SDF-1α) позволила получить протез с высокопористой структурой без расслоения его стенки. Формирование гидрофильного гидрогелевого покрытия (θ=68,61±11,85°) методом радиационной полимеризации PVP с дальнейшим комплексообразованием c Ilo и Hep не повлияло на механические свойства конечного изделия. Композитные PU/PCL/GFmix/Ilo/Hep-протезы по механическим характеристикам были более приближены к нативной артерии, чем многослойные PCL/GFmix/PU/Ilo/Hep-протезы и другие наши ранние разработки [30] за счет технологии изготовления: заменили полимерную составляющую, а именно — полигидроксибутират/валерат на полиуретан; вместо послойного инкорпорирования ростовых факторов использовали микс в едином полимерном растворе с добавлением стабилизатора эмульсии — Pluronic. Такая технология позволила получить новый перспективный сосудистый протез малого диаметра.
Заключение
Композитный функционально активный сосудистый протез PU/PCL/GFmix/Ilo/Hep обладает улучшенными характеристиками и, соответственно, комплаенсом, что в свою очередь может увеличить шансы высокой проходимости при имплантации крупным лабораторным животным в преклинических испытаниях.
Финансирование. Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках Соглашения о предоставлении из федерального бюджета грантов в форме субсидий в соответствии с пунктом 4 статьи 78.1 Бюджетного кодекса Российской Федерации №075-15-2022-1202 от 30 сентября 2022 г., заключенного в целях реализации Распоряжения Правительства Российской Федерации от 11 мая 2022 г. №1144-р.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Литература
- Tinica G., Chistol R.O., Enache M., Leon Constantin M.M., Ciocoiu M., Furnica C. Long-term graft patency after coronary artery bypass grafting: effects of morphological and pathophysiological factors. Anatol J Cardiol 2018; 20(5): 275–282, https://doi.org/10.14744/AnatolJCardiol.2018.51447.
- Virani S.S., Alonso A., Benjamin E.J., Bittencourt M.S., Callaway C.W., Carson A.P., Chamberlain A.M., Chang A.R., Cheng S., Delling F.N., Djousse L., Elkind M.S.V., Ferguson J.F., Fornage M., Khan S.S., Kissela B.M., Knutson K.L., Kwan T.W., Lackland D.T., Lewis T.T., Lichtman J.H., Longenecker C.T., Loop M.S., Lutsey P.L., Martin S.S., Matsushita K., Moran A.E., Mussolino M.E., Perak A.M., Rosamond W.D., Roth G.A., Sampson U.K.A., Satou G.M., Schroeder E.B., Shah S.H., Shay C.M., Spartano N.L., Stokes A., Tirschwell D.L., VanWagner L.B., Tsao C.W.; American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics — 2020 Update: a report from the American Heart Association. Circulation 2020; 141(9): e139–e596, https://doi.org/10.1161/CIR.0000000000000757.
- Pashneh-Tala S., MacNeil S., Claeyssens F. The tissue-engineered vascular graft-past, present, and future. Tissue Eng Part B Rev 2016; 22(1): 68–100, https://doi.org/10.1089/ten.teb.2015.0100.
- Lejay A., Bratu B., Kuntz S., Neumann N., Heim F., Chakfé N. Calcification of synthetic vascular grafts: a systematic review. EJVES Vasc Forum 2023; 60: 1–7, https://doi.org/10.1016/j.ejvsvf.2023.05.013.
- Yu L., Newton E.R., Gillis D.C., Sun K., Cooley B.C., Keith A.N., Sheiko S.S., Tsihlis N.D., Kibbe M.R. Coating small-diameter ePTFE vascular grafts with tunable poly(diol-co-citrate-co-ascorbate) elastomers to reduce neointimal hyperplasia. Biomater Sci 2021; 9(15): 5160–5174, https://doi.org/10.1039/d1bm00101a.
- Zhang B., Xu Y., Ma S., Wang L., Liu C., Xu W., Shi J., Qiao W., Yang H. Small-diameter polyurethane vascular graft with high strength and excellent compliance. J Mech Behav Biomed Mater 2021; 121: 104614, https://doi.org/10.1016/j.jmbbm.2021.104614.
- Moreno M.J., Ajji A., Mohebbi-Kalhori D., Rukhlova M., Hadjizadeh A., Bureau M.N. Development of a compliant and cytocompatible micro-fibrous polyethylene terephthalate vascular scaffold. J Biomed Mater Res B Appl Biomater 2011; 97(2): 201–214, https://doi.org/10.1002/jbm.b.31774.
- Кривкина Е.О., Антонова Л.В. Результаты долгосрочной проходимости биодеградируемых сосудистых протезов малого диаметра с атромбогенным лекарственным покрытием на модели овцы. Комплексные проблемы сердечно-сосудистых заболеваний 2021; 10(2): 36–39, https://doi.org/10.17802/2306-1278-2021-10-2S-36-39.
- Lee K.S., Kayumov M., Emechebe G.A., Kim D.W., Cho H.J., Jeong Y.J., Lee D.W., Park J.K., Park C.H., Kim C.S., Obiweluozor F.O., Jeong I.S. A comparative study of an anti-thrombotic small-diameter vascular graft with commercially available e-PTFE graft in a porcine carotid model. Tissue Eng Regen Med 2022; 19(3): 537–551, https://doi.org/10.1007/s13770-021-00422-4.
- Lin C.H., Hsia K., Ma H., Lee H., Lu J.H. In vivo performance of decellularized vascular grafts: a review article. Int J Mol Sci 2018; 19(7): 2101, https://doi.org/10.3390/ijms19072101.
- van de Laar B.C., van Heusden H.C., Pasker-de Jong P.C., van Weel V. Omniflow II biosynthetic grafts versus expanded polytetrafluoroethylene grafts for infrainguinal bypass surgery. A single-center retrospective analysis. Vascular 2022; 30(4): 749–758, https://doi.org/10.1177/17085381211029815.
- Antonova L.V., Sevostyanova V.V., Mironov A.V., Krivkina E.O., Velikanova E.A., Matveeva V.G., Glushkova T.V., Elgudin Ya.L., Barbarash L.S. In situ vascular tissue remodeling using biodegradable tubular scaffolds with incorporated growth factors and chemoattractant molecules. Complex Issues of Cardiovascular Diseases 2018; 7(2): 25–36, https://doi.org/10.17802/2306-1278-2018-7-2-25-36.
- Tan W., Boodagh P., Selvakumar P.P., Keyser S. Strategies to counteract adverse remodeling of vascular graft: a 3D view of current graft innovations. Front Bioeng Biotechnol 2023; 10: 1097334, https://doi.org/10.3389/fbioe.2022.1097334.
- Xie X., Wu Q., Liu Y., Chen C., Chen Z., Xie C., Song M., Jiang Z., Qi X., Liu S., Tang Z., Wu Z. Vascular endothelial growth factor attenuates neointimal hyperplasia of decellularized small-diameter vascular grafts by modulating the local inflammatory response. Front Bioeng Biotechnol 2022; 10: 1066266, https://doi.org/10.3389/fbioe.2022.1066266.
- Zhang Q., Bosch-Rué È., Pérez R.A., Truskey G.A. Biofabrication of tissue engineering vascular systems. APL Bioeng 2021; 5(2): 021507, https://doi.org/10.1063/5.0039628.
- Antonova L.V., Sevostianova V.V., Silnikov V.N., Krivkina E.O., Velikanova E.A., Mironov A.V., Shabaev A.R., Senokosova E.A., Khanova M.Y., Glushkova T.V., Akentieva T.N., Sinitskaya A.V., Markova V.E., Shishkova D.K., Lobov A.A., Repkin E.A., Stepanov A.D., Kutikhin A.G., Barbarash L.S. Comparison of the patency and regenerative potential of biodegradable vascular prostheses of different polymer compositions in an ovine model. Int J Mol Sci 2023; 24(10): 8540, https://doi.org/10.3390/ijms24108540.
- Antonova L.V., Silnikov V.N., Sevostyanova V.V., Yuzhalin A.E., Koroleva L.S., Velikanova E.A., Mironov A.V., Godovikova T.S., Kutikhin A.G., Glushkova T.V., Serpokrylova I.Y., Senokosova E.A., Matveeva V.G., Khanova M.Y., Akentyeva T.N., Krivkina E.O., Kudryavtseva Y.A., Barbarash L.S. Biocompatibility of small-diameter vascular grafts in different modes of RGD modification. Polymers (Basel) 2019; 11(1): 174, https://doi.org/10.3390/polym11010174.
- Ding K., Yu X., Wang D., Wang X., Li Q. Small diameter expanded polytetrafluoroethylene vascular graft with differentiated inner and outer biomacromolecules for collaborative endothelialization, anti-thrombogenicity and anti-inflammation. Colloids Surf B Biointerfaces 2023; 229: 113449, https://doi.org/10.1016/j.colsurfb.2023.113449.
- Matsushita H., Hayashi H., Nurminsky K., Dunn T., He Y., Pitaktong I., Koda Y., Xu S., Nguyen V., Inoue T., Rodgers D., Nelson K., Johnson J., Hibino N. Novel reinforcement of corrugated nanofiber tissue-engineered vascular graft to prevent aneurysm formation for arteriovenous shunts in an ovine model. JVS Vasc Sci 2022; 3: 182–191, https://doi.org/10.1016/j.jvssci.2022.01.002.
- Siddiqui N., Asawa S., Birru B., Baadhe R., Rao S. PCL-based composite scaffold matrices for tissue engineering applications. Mol Biotechnol 2018; 60(7): 506–532, https://doi.org/10.1007/s12033-018-0084-5.
- Kucinska-Lipka J., Gubanska I., Janik H., Sienkiewicz M. Fabrication of polyurethane and polyurethane based composite fibres by the electrospinning technique for soft tissue engineering of cardiovascular system. Mater Sci Eng C Mater Biol Appl 2015; 46: 166–176, https://doi.org/10.1016/j.msec.2014.10.027.
- Tatai L., Moore T.G., Adhikari R., Malherbe F., Jayasekara R., Griffiths I., Gunatillake P.A. Thermoplastic biodegradable polyurethanes: the effect of chain extender structure on properties and in-vitro degradation. Biomaterials 2007; 28(36): 5407–5417, https://doi.org/10.1016/j.biomaterials.2007.08.035.
- Hergenrother R.W., Wabers H.D., Cooper S.L. Effect of hand segment chemistry and strain on the stability of polyurethanes: in vivo biostability. Biomaterials 1993; 14(6): 449–458, https://doi.org/10.1016/0142-9612(93)90148-u.
- Antonova L.V., Sevostyanova V.V., Mironov A.V., Krivkina E.O., Velikanova E.A., Matveeva V.G., Glushkova T.V., Elgudin Ya.L., Barbarash L.S. In situ vascular tissue remodeling using biodegradable tubular scaffolds with incorporated growth factors and chemoattractant molecules. Complex Issues of Cardiovascular Diseases 2018; 7(2): 25–36, https://doi.org/10.17802/2306-1278-2018-7-2-25-36.
- Matsuzaki Y., Miyamoto S., Miyachi H., Iwaki R., Shoji T., Blum K., Chang Y.C., Kelly J., Reinhardt J.W., Nakayama H., Breuer C.K., Shinoka T. Improvement of a novel small-diameter tissue-engineered arterial graft with heparin conjugation. Ann Thorac Surg 2021; 111(4): 1234–1241, https://doi.org/10.1016/j.athoracsur.2020.06.112.
- Антонова Л.В., Севостьянова В.В., Резвова М.А., Кривкина Е.О., Кудрявцева Ю.А., Барбараш О.Л., Барбараш Л.С. Технология изготовления функционально активных биодеградируемых сосудистых протезов малого диаметра с лекарственным покрытием. Патент RU 2702239C1. 2019.
- Rickel A.P., Deng X., Engebretson D., Hong Z. Electrospun nanofiber scaffold for vascular tissue engineering. Mater Sci Eng C Mater Biol Appl 2021; 129: 112373, https://doi.org/10.1016/j.msec.2021.112373.
- Zhao L., Li X., Yang L., Sun L., Mu S., Zong H., Li Q., Wang F., Song S., Yang C., Zhao C., Chen H., Zhang R., Wang S., Dong Y., Zhang Q. Evaluation of remodeling and regeneration of electrospun PCL/fibrin vascular grafts in vivo. Mater Sci Eng C Mater Biol Appl 2021; 118: 111441, https://doi.org/10.1016/j.msec.2020.111441.
- Antonova L.V., Krivkina E.O., Sevostianova V.V., Mironov A.V., Rezvova M.A., Shabaev A.R., Tkachenko V.O., Krutitskiy S.S., Khanova M.Y., Sergeeva T.Y., Matveeva V.G., Glushkova T.V., Kutikhin A.G., Mukhamadiyarov R.A., Deeva N.S., Akentieva T.N., Sinitsky M.Y., Velikanova E.A., Barbarash L.S. Tissue-engineered carotid artery interposition grafts demonstrate high primary patency and promote vascular tissue regeneration in the ovine model. Polymers (Basel) 2021; 13(16): 2637, https://doi.org/10.3390/polym13162637.
- Антонова Л.В., Кривкина Е.О., Сильников В.Н., Груздева О.В., Резвова М.А., Акентьева Т.Н., Глушкова Т.В., Ткаченко В.О., Сахарова В.М., Барбараш Л.С. Оценка биосовместимости и антимикробных свойств биодеградируемых сосудистых протезов различного полимерного состава с атромбогенным и противомикробным лекарственным покрытием. Вестник трансплантологии и искусственных органов 2021; 23(2): 122–136, https://doi.org/10.15825/1995-1191-2021-2-122-136.