Исследование неосновных хромофоров биотканей методом оптической диффузионной спектроскопии (обзор)
Оптическая диффузионная спектроскопия (ОДС) — быстро развивающийся неинвазивный метод оптической диагностики тканей, в основе которого лежит зондирование объекта исследования оптическим излучением видимого и(или) ближнего инфракрасного диапазона длин волн и регистрация диффузно-рассеянного тканью света. Из полученного с помощью ОДС сигнала можно извлечь обширную информацию о биохимическом составе тканей благодаря наличию в них поглощающих свет соединений — хромофоров. На сегодняшний день ОДС широко применяется для регистрации основных хромофоров, таких как дезоксигенированный (Hb) и оксигенированный (HbO2) гемоглобин, вода, липиды и меланин. Содержание Hb и HbO2 в биотканяхпредставляет большой интерес для клинических исследований, так как с их помощью можно оценить оксигенацию и выявить гипоксию. Однако также в биотканях присутствуют менее освещенные в литературе хромофоры — неосновные, которые тоже вносят вклад в спектр поглощения: различные глобины (метгемоглобин, карбоксигемоглобин, миоглобин и др.), а также цитохромы и цитохром-c-оксидаза. Регистрация неосновных хромофоров с помощью ОДС затруднена тем, что их вклад в поглощение существенно ниже основных поглотителей, а их парциальные спектры слабо изучены. Однако совместный мониторинг основных и неосновных хромофоров позволит одновременно проводить исследование метаболических процессов в сосудистых, внутриклеточных и митохондриальных компартментах тканей и тем самым существенно расширить область применения ОДС. В обзоре проведен анализ литературных источников, содержащих информацию об исследовании неосновных хромофоров биоткани методом ОДС, рассмотрены основные хромофоры и возможность совместной регистрации основных и неосновных хромофоров методом ОДС.
Введение
На сегодняшний день оптические методы измерения физиологических показателей биологических тканей пользуются большой популярностью в фундаментальных и клинических исследованиях благодаря неинвазивности, относительно низкой стоимости и компактности аппаратуры, а также высокой информативности. Состав тканей может быть определен оптическими спектроскопическими методами, основанными на комбинационном рассеянии (рамановская спектроскопия) [1] и упругом рассеянии (оптические диффузионные методы) [2, 3], а также флуоресцентными методами [4]. В рамановской спектроскопии и флуоресцентных методах уровень регистрируемого сигнала довольно низкий, что ограничивает глубину исследования при использовании этих подходов, в то время как в оптических диффузионных методах уровень сигнала и, соответственно, глубина исследования гораздо выше.
Оптическая диффузионная спектроскопия (ОДС) — неинвазивный метод диагностики, позволяющий производить мониторинг биохимического состояния тканей. ОДС широко применяется для исследования гемодинамики мозга (fNIRS) [5, 6], диагностики и мониторинга злокачественных опухолей [7–10] и их микроокружения [11], оценки тяжести рубца и ответа келоида на терапию [12], для ранней диагностики пролежней [13], оценки состояния ожоговой раны [14] и др., а также для решения задач, не связанных с биомедицинской диагностикой (например, для оценки свежести мяса [15], исследования почвы [16] и т.д.). В основе данного метода лежит зондирование объекта широкополосным излучением оптического и(или) ближнего инфракрасного диапазона длин волн, регистрация диффузно рассеянного тканью света и решение обратной задачи — восстановление концентраций хромофоров ткани [17, 18]. Регистрируемый с помощью ОДС сигнал несет информацию о рассеянии, связанном с микроструктурой ткани, и поглощении, связанном с ее биохимическим составом [19]. Восстановление концентраций различных хромофоров возможно благодаря тому, что их парциальные спектры поглощения различны.
На точность реконструкции концентраций хромофоров влияет множество факторов. Так, например, трудно разделить хромофоры с близкими спектрами поглощения (как, например, спектры гемоглобина и миоглобина); отделить поглощение хромофора, дающего малый вклад в регистрируемый сигнал, на фоне хромофора с высоким показателем поглощения. Традиционно используемые для реконструкции модели распространения света в тканях, основанные на решении уравнения переноса излучения в диффузионном приближении, имеют существенные ограничения для близко расположенных источника и детектора и(или) высокого показателя поглощения, что приводит к необходимости использования уточненных моделей. Литературные данные о спектрах поглощения разных хромофоров также могут иметь значительный разброс, что снижает точность реконструкции. В связи с этим исследователи чаще всего ограничиваются лишь основными хромофорами в решении обратной задачи ОДС — окси- и дезоксигемоглобином (HbO2 и Hb), поскольку они вносят наибольший вклад в поглощение света. Однако данные о концентрации этих хромофоров уже позволяют решать множество различных задач, включая исследование степени оксигенации тканей и кровенаполнение. Реже встречаются работы, в которых оценивается содержание воды для исследования отека [20] и меланина для диагностики меланомы [21]. Изучение концентраций неосновных хромофоров, таких как метгемоглобин (MetHb), миоглобин, карбоксигемоглобин (HbCO), цитохромы и цитохром-с-оксидаза, методом ОДС в литературе встречается гораздо реже, хотя данные о содержании этих хромофоров могут быть не менее важными для решения множества медико-биологических задач. Сложность оценки содержания неосновных хромофоров в ткани связана с незначительным вкладом в поглощение из-за низкой концентрации. Для их учета требуются высокочувствительные измерения спектра диффузного отражения тканей предпочтительно в широком диапазоне длин волн, а также включение этих хромофоров в модели диффузного рассеяния. Кроме того, данные о парциальных спектрах поглощения этих хромофоров часто очень ограничены по точности и диапазону длин волн, в которых проводились лабораторные измерения.
В данной статье проанализированы литературные источники, содержащие информацию о неосновных хромофорах биотканей. Кроме того, в обзор были включены данные об основных хромофорах биотканей (вода, липиды, меланин и гемоглобин), а также о возможности их совместного исследования с неосновными хромофорами. Особое внимание уделено статьям, в которых рассматривается измерение концентрации неосновных хромофоров методом ОДС. Даны также краткие сведения о технологии ОДС в перспективе использования регистрации неосновных хромофоров.
Поиск литературы проводили в базах PubMed, Scopus, РИНЦ по ключевым словам: absorption, bilirubin, chromophores, cytochrome c, diffuse reflectance spectroscopy, melanin, methemoglobin, near-infrared spectroscopy, oxygen saturation, scattering, гемоглобин, меланин, метгемоглобин, миоглобин, оксигенация, оптическая диффузионная спектроскопия, спектр поглощения, цитохромы, цитохром-с-оксидаза.
Диагностика биотканей методом оптической диффузионной спектроскопии
Для ОДС используются различные конфигурации источников, облучающих ткань, и детекторов, регистрирующих диффузно рассеянное тканью излучение. Эти детекторы могут быть расположены «на просвет», «на отражение» или иметь круговую конфигурацию. Просветная или круговая конфигурация обычно применяется для определенных локализаций, в которых проводится исследование (например, молочная железа [22], суставы рук [23], ступней [24] и др.). Такая конфигурация позволяет «собирать» данные о поглощении тканей с большого объема, включая глубоко расположенные ткани, такие как опухоли и суставы. Большую глубину проникновения света (до нескольких сантиметров) может обеспечить лишь терапевтическое окно прозрачности тканей (700–1000 нм), в котором поглощение тканей минимально. Однако в данном диапазоне количество хромофоров тканей, вносящих существенный вклад в поглощение, ограничено преимущественно гемоглобином, водой и липидами. Поглощение неосновных хромофоров довольно сложно выделить из-за их малого вклада в поглощение и отсутствия выраженных пиков в спектре.
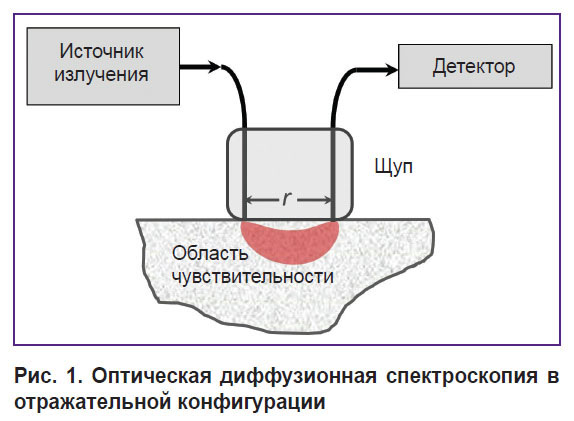
В системах для ОДС в отражательной конфигурации (спектроскопия диффузного отражения, diffuse reflectance spectroscopy) чаще всего используется контактный оптоволоконный зонд, имеющий одно излучающее и одно регистрирующее волокно (рис. 1). Расстояние между источником и детектором можно варьировать в зависимости от уровня сигнала и желаемой глубины исследования. Так, при ОДС-исследовании с использованием видимого диапазона длин волн расстояние между источником и детектором составляет не более 5 мм из-за сильного затухания света в ткани. Тем не менее именно видимый диапазон длин волн наиболее интересен с точки зрения регистрации неосновных тканевых хромофоров. Могут применяться и более сложные конфигурации с использованием нескольких источников и детекторов для получения спектроскопических данных на разных глубинах [25] или уменьшения влияния аппаратных функций на результат измерений (рациометрический подход, метод самокалибровки [19, 26]).
|
Рис. 1. Оптическая диффузионная спектроскопия в отражательной конфигурации |
При исследовании биотканей методом ОДС проводится регистрация многократно рассеянной диффузной компоненты света. Ослабление данной компоненты в зависимости от расстояния источник–детектор r происходит преимущественно по экспоненциальному закону с коэффициентом экстинкции µeff, который определяется коэффициентами поглощения µa и транспортного рассеяния µ’s следующим образом:

Наиболее распространенной аналитической моделью диффузно рассеянного света является решение уравнения переноса излучения в диффузионном приближении для полубесконечной однородно рассеивающей и поглощающей среды с учетом направленности источника излучения [27]. Существуют также уточненные модели, учитывающие, например, диаграмму приема волокна детектора [28] или особенности формы индикатрисы рассеяния [29], что важно, когда источник и детектор пространственно перекрываются.
Коэффициент экстинкции для однородно рассеивающей и поглощающей ткани можно оценить, измерив интенсивность диффузно рассеянного света на двух расстояниях источник–детектор. Допустимо использовать измерения с одним расстоянием источник–детектор, однако при этом требуется калибровка системы ОДС на модельной среде (фантомах биоткани).
Коэффициент поглощения µa, входящий в коэффициент экстинкции (1), можно рассматривать как взвешенную сумму спектров поглощения эндогенных хромофоров исследуемой ткани [30]:

где Ci — концентрация i-го хромофора, а µia(λ) — показатель поглощения i-го хромофора на заданной длине волны λ. Из формулы (2) следует, что максимальное число хромофоров, которое может быть восстановлено из ОДС-измерений, соответствует числу спектральных линий, на которых производится измерение. Однако даже большое количество спектральных линий в ОДС, реализуемых с использованием широкополосного излучения и спектрометра, не гарантирует восстановления большого количества хромофоров. Одной из причин этого ограничения является то, что величина диффузного рассеяния зависит как от коэффициента поглощения, так и от коэффициента рассеяния, спектр которого неизвестен.
Аппаратное разделение показателей рассеяния и поглощения возможно временными методами (модуляционный или времяпролетный) [31–33]. Временные методы широко применяются для больших расстояний источник–детектор (несколько сантиметров), где при пролете между источником и детектором фотон в результате многократных актов рассеяния успевает пройти достаточное расстояние, чтобы измерить его временную задержку. Однако для видимого диапазона длин волн, где расстояние источник–детектор мало, необходимо использовать очень высокую частоту модуляции (несколько гигагерц), что технически слишком сложно реализовать.
Метод SFDI (spatial frequency domain imaging) представляет собой более перспективный подход для разделения коэффициентов поглощения µa и µ’s в видимом диапазоне длин волн. Однако, как и в случае с временным подходом, для его реализации необходимо большое количество источников излучения на разных длинах волн, а также конфигуратор изображений (как правило, специализированная матрица DLP — digital light processing). Это делает метод технически сложным, дорогостоящим и требующим значительного времени измерений (на каждой длине волны необходимо получить как минимум три изображения для каждой пространственной частоты).
Чаще всего спектр рассеяния для решения обратной задачи ОДС либо берется из литературных данных исходя из типа исследуемой ткани, либо параметризуется небольшим числом параметров, учитывая его монотонный спад с увеличением длины волны. Так, наиболее полная параметрическая формула для спектра показателя транспортного рассеяния включает две компоненты — рэлеевскую, имеющую зависимость 4-й степени от длины волны, описывающую рассеяние на частицах меньше длины волны, и компоненту, характеризующую рассеяние на крупных частицах со степенным показателем b<4 [18, 34], который зависит от среднего размера этих частиц:
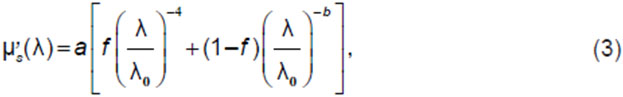
где a — это приведенный коэффициент рассеяния при λ0=500 нм, f — доля рэлеевского рассеяния. Предполагается, что рэлеевское рассеяние доминирует в видимом оптическом диапазоне, тогда как рассеяние Ми (рассеяние на крупных частицах) преобладает в ближнем инфракрасном (ИК) диапазоне [19]. Так, для видимого диапазона длин волн часто используется только рэлеевская компонента рассеяния, в то время как для ближнего ИК-диапазона в качестве спектра рассеяния может применяться либо константа, либо слабая зависимость от длины волны.
Отметим, что при реализации метода ОДС с помощью широкополосного излучения и спектрометра для учета большего количества хромофоров предпочтительно использовать как можно более широкий спектр регистрации, потому что чем больше пиков поглощения разных хромофоров попадет в регистрируемый спектр ОДС, тем точнее удастся определить их концентрации. На практике спектральная полоса исследования ОДС обычно ограничена диапазоном 450–1000 нм. В области коротковолнового излучения ограничение связано с высоким поглощением таких хромофоров, как меланин и гемоглобин, а область длинноволнового излучения ограничена чувствительностью кремниевых детекторов. Для регистрации излучения в диапазоне NIR-II используются спектрометры с другим типом матрицы, обычно InGaAs. Такие системы стоят дороже, однако позволяют получать более достоверную информацию о концентрациях липидов и воды [35].
Таким образом, обратную задачу ОДС — восстановление концентраций хромофоров Ci по измеренному диффузному спектру — можно решать совместно с определением параметров спектра рассеяния a, f, b, входящих в формулу (3) [36]. Данный подход является наиболее простым для оценки концентраций неосновных хромофоров в широком диапазоне длин волн (видимый — ближний ИК-диапазон). Применение технологии SFDI позволит повысить точность измерений путем независимой оценки µa и µ’s на разных длинах волн, однако данный метод сложнее технически реализовать.
Хромофоры биотканей
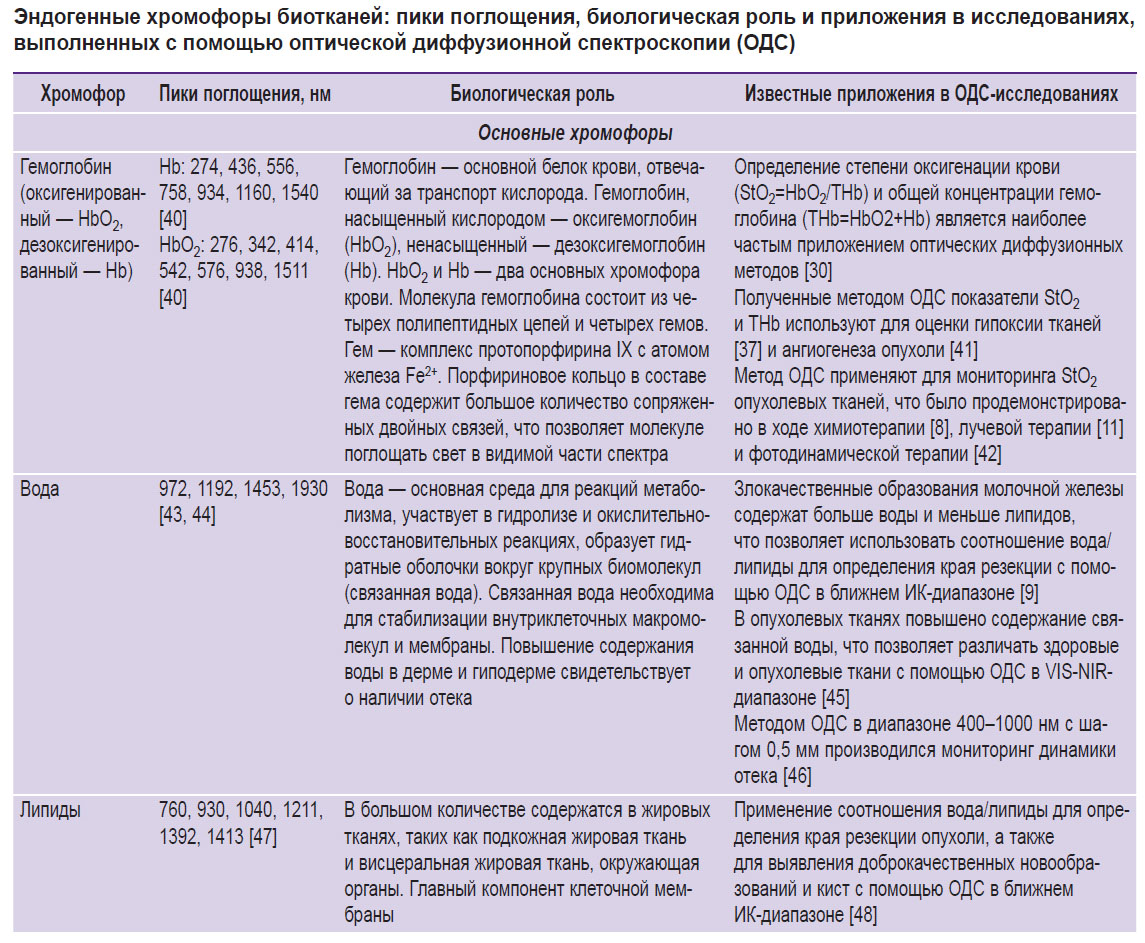
В тканях человека и животных существует множество различных поглощающих свет хромофоров [37–70]. К наиболее изученным относят Hb и HbO2, а также воду и липиды [37, 38]. В видимом и ближнем инфракрасном диапазоне длин волн, где проводятся ОДС-измерения, данные хромофоры вносят наибольший вклад в поглощение света (см. формулу (2)) и, соответственно, хорошо регистрируются с помощью ОДС (см. таблицу).
|
Эндогенные хромофоры биотканей: пики поглощения, биологическая роль и приложения в исследованиях, выполненных с помощью оптической диффузионной спектроскопии (ОДС) |
Спектры ДНК и большинства полипептидов находятся преимущественно в ультрафиолетовой области. В частности, в ультрафиолетовом диапазоне поглощают ароматические аминокислоты — триптофан, тирозин и в меньшей степени — фенилаланин, в результате чего большинство белков поглощают свет с длиной волны 280 нм [39]. Таким образом, ДНК и полипептиды не вносят существенного вклада в поглощение и не регистрируются с помощью ОДС в видимом и ближнем ИК-диапазонах.
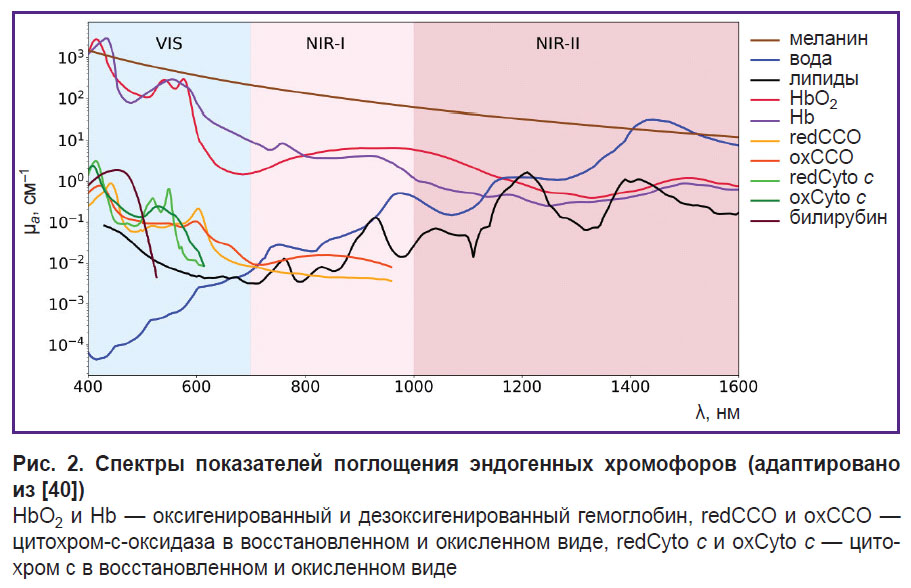
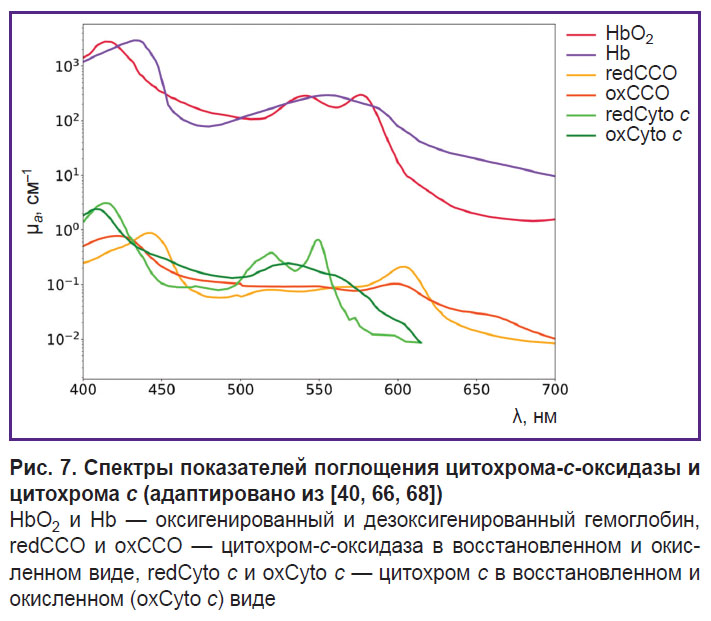
На рис. 2 представлены спектры основных (HbO2, Hb, воды, меланина, липидов) и некоторых неосновных (цитохрома-с-оксидазы, цитохрома с) хромофоров. Как видно из рисунка, спектры поглощения этих хромофоров различны, что делает потенциально возможным оценку их концентраций по измеренному с помощью ОДС спектру диффузного рассеяния ткани [13].
Основные хромофоры биологических тканей
Вода. Вода является одним из наиболее распространенных биологических веществ в организме, участвует в гидролизе и окислительно-восстановительных реакциях. Вода составляет от 60 до 80% массы живой клетки и относится к основным хромофорам биоткани. В видимом диапазоне длин волн коэффициент поглощения воды незначителен, однако в ближней ИК-области спектра вода имеет несколько пиков поглощения [7] (см. рис. 2). Соотношение воды и липидов при раке молочной железы может предоставить важную информацию о структуре опухоли. Например, было отмечено, что злокачественные образования молочной железы содержат больше воды, но меньше липидов, чем нормальная ткань [71]. В исследовании D. Veluponnar и соавт. [9] показано, что поглощение в области ближнего ИК-диапазона, связанное с соотношением жира и воды в ткани, дает возможность применять ОДС для оценки края резекции во время операции при раке молочной железы.
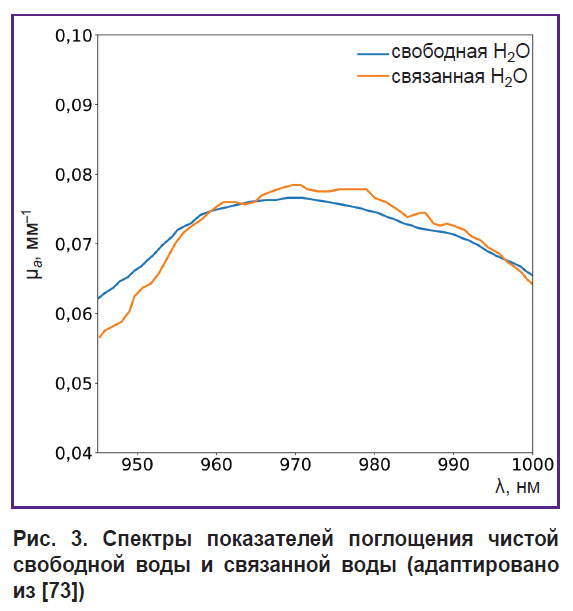
Другим приложением ОДС является оценка связанной и свободной воды в тканях. Связанная вода, образующая за счет сил электростатического притяжения гидратные оболочки вокруг биополимеров [72], необходима для стабилизации внутриклеточных макромолекул и мембраны, а также для диффузии веществ через мембрану.Фракция связанной воды вносит небольшие изменения в форму спектра поглощения воды внутри тканей (рис. 3), сдвигая максимум поглощения воды на несколько нанометров [73]. Данный аспект был использован для дифференциации злокачественных тканей рака молочной железы от нормальных. С помощью ОДС в VIS-NIR-диапазоне S.H. Chung с соавт. [45] установили, что в опухолевых тканях молочной железы значительно повышено содержание связанной воды, в отличие от здоровой ткани.
|
Рис. 3. Спектры показателей поглощения чистой свободной воды и связанной воды (адаптировано из [73]) |
Липиды. В организме человека липиды в большом количестве содержатся в жировых тканях, таких как подкожная жировая ткань и висцеральная жировая ткань, окружающая органы. Например, плотный слой жировой ткани окружает тело молочной железы. Кроме того, липиды — главный компонент клеточной мембраны. Как и вода, липиды являются основными поглощающими хромофорами в ближнем ИК-диапазоне длин волн [74]. Наличие липидов в образце коррелирует с узким пиком в районе 1211 нм на спектре поглощения [47] (см. рис. 2).
Ткани с высоким содержанием мембранных органелл в клетках (митохондрий, лизосом) демонстрируют рэлеевское рассеяние в связи с высокой плотностью липидных мембран, из-за чего b и f в уравнении (3) возрастают [75, 76].
Соотношение воды и липидов в тканях молочной железы может быть использовано не только для мониторинга и резекции злокачественных образований, но также с целью обнаружения доброкачественных новообразований и кист [48].
Важно отметить, что свойства и функции липидов напрямую зависят от жирных кислот, входящих в их состав. В свою очередь сами жирные кислоты отличаются длиной цепи и наличием двойных связей в своей структуре. Различают насыщенные, мононенасыщенные и полиненасыщенные жирные кислоты. Обычно подкожная жировая ткань взрослого человека включает 21, 46, 33% насыщенных, мононенасыщенных и полиненасыщенных жирных кислот соответственно. Вариации в этом соотношении приводят к небольшим изменениям в спектре поглощения липидов. Например, образец, состоящий на 42, 46 и 12% из насыщенных, мононенасыщенных и полиненасыщенных жирных кислот соответственно, показывает дополнительный пик поглощения при 1170 нм [47].
Для уверенного разделения липидов и воды предпочтительно использовать спектральный диапазон NIR-II, в котором спектральные пики поглощения воды и липидов расходятся (см. рис. 2). В диапазоне NIR-I спектральные пики поглощения липидов (930 нм) и воды (975 нм) слабо разделимы [77, 78].
Меланин. Это эндогенный пигмент, нерастворимый высокомолекулярный полимер, отвечающий за цвет глаз, волос и кожи. Он вырабатывается пигментными клетками меланоцитами в цитоплазматических органеллах — меланосомах. В эпидермисе меланоциты транспортируют меланосомы в кератиноциты через дендритные отростки [79]. Меланин играет важную роль в гомеостазе кожи, обеспечивая поглощение вредного ультрафиолетового излучения в диапазоне от 320 до 400 нм [80]. Меланин кожи делится на два основных типа: черно-коричневый эумеланин и красно-желтый феомеланин.
Количественное определение меланина неинвазивными методами имеет важное значение для клинических исследований. Избыток или недостаток меланина является индикатором различных заболеваний. В частности, объективные измерения количественного содержания меланина в тканях могут предоставить важную информацию при дифференциации меланомы от доброкачественных пигментных новообразований, а также для оценки пигментных заболеваний и мониторинга ответа на терапию [81].
В литературе существует ряд примеров использования метода ОДС in vivo для количественной оценки содержания меланина в тканях с целью диагностики меланомы [50–52]. Например, с помощью ОДС была показана тенденция к увеличению содержания эумеланина в тканях при переходе от стадии диспластического невуса к инвазивной меланоме, в то время как содержание феомеланина в этом процессе падает [51].
Отметим, что спектр показателя поглощения меланина демонстрирует монотонный спад с увеличением длины волны, как и показатель транспортного рассеяния, поэтому его реконструкция затруднена в ОДС-системах, не использующих аппаратное разделение показателей рассеяния и поглощения.
Гемоглобин. Молекула гемоглобина состоит из четырех полипептидных цепей и четырех гемов. Порфириновое кольцо в составе гема содержит большое количество сопряженных двойных связей, что позволяет молекуле поглощать свет в видимой части спектра. Белковая часть молекулы — глобин, имеет две α- и две β-субъединицы. Гем — комплекс протопорфирина IX с атомом железа Fe2+. Данные атомы железа в состоянии Fe2+ способны связываться с кислородом [82].
Гемоглобин может быть насыщен молекулами кислорода — оксигемоглобин (HbO2) — и ненасыщен — дезоксигемоглобин (Hb). HbO2 и Hb — два основных хромофора крови, спектры которых представлены на рис. 2. Определение степени оксигенации крови является наиболее частым приложением оптических диффузионных методов. Так, пульсоксиметрия позволяет вычислять степень оксигенации артериальной крови, используя различия в спектрах поглощения в видимом диапазоне (500–600 нм) в отражательной конфигурации (различные фитнес-браслеты, смарт-часы) и применяя различия в поглощении гемоглобинов в ближнем ИК-диапазоне длин волн (700–900 нм) в пульсоксиметрах с просветной конфигурацией [83]. В ОДС также исследуется степень оксигенации крови, однако, в отличие от пульсоксиметрии, данные ОДС дают усредненные значения оксигенации в тканях [30, 84–86], т.е. принципиально отличаются от данных, получаемых методом пульсоксиметрии.
В клинических исследованиях Hb и HbO2 представляют большой интерес, так как с их помощью можно получить информацию об общей концентрации гемоглобина (THb=HbO2+Hb) и уровне оксигенации крови (StO2=HbO2/THb) [30]. Полученные экспериментально значения StO2 используют для оценки гипоксии тканей [37] и ангиогенеза опухоли [41]. Гипоксия вызывает резистентность опухоли к стандартной терапии и способствует формированию агрессивного фенотипа [87]. Поэтому своевременный мониторинг сатурации опухоли может иметь большое значение для корректировки лечения. Применение ОДС для мониторинга уровня сатурации опухолевых тканей продемонстрировано при химиотерапии [8], лучевой терапии [11], фотодинамической терапии [42].
Неосновные хромофоры биологических тканей
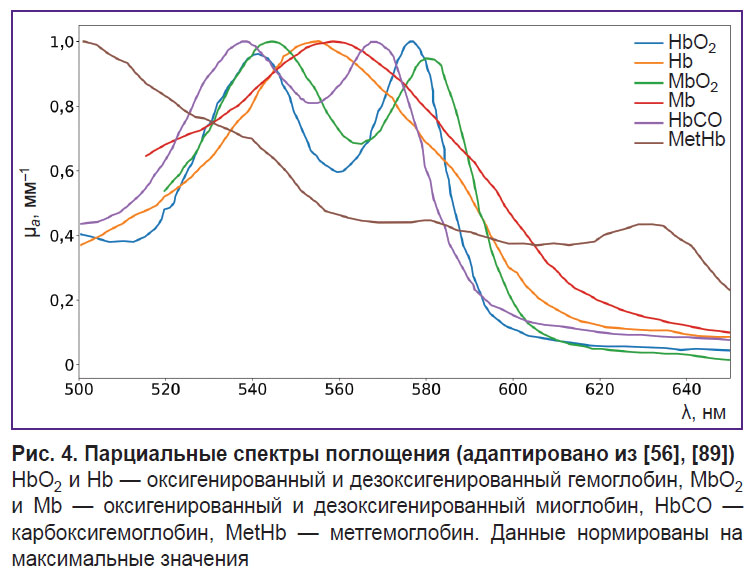
Кроме перечисленных основных форм гемоглобина, в крови человека также присутствуют производные формы (MetHb, HbCO и т.д.), мониторинг которых имеет большое значение при исследовании различных патологий [88]. Стоит отметить, что спектры поглощения разных форм гемоглобина могут существенно отличаться [56, 89, 90], что позволяет разделять их с помощью ОДС (рис. 4).
Карбоксигемоглобин. Карбоксигемоглобин (HbCO) образуется при связывании молекулы гемоглобина с оксидом углерода. Уровень HbCO повышается при воздействии монооксида углерода (CO), поскольку CO имеет в 200–300 раз большее сродство к гемоглобину, чем кислород [91]. Насыщение крови HbCO является важным физиологическим показателем при отравлении угарным газом. Кроме того, в ранних исследованиях методом электрокардиографии было отмечено, что присутствие CO во вдыхаемом воздухе во время физической активности может оказывать неблагоприятное воздействие на пациентов с сердечно-сосудистыми заболеваниями, даже в условиях малых концентраций [92]. Таким образом, мониторинг концентрации HbCO в тканях может представлять интерес в клинических исследованиях.
Спектр поглощения HbCO подробно не изучен, обнаружено два пика в видимой области, близких к пикам поглощения HbO2 и MbO2 [56] (см. рис. 4), что усложняет реконструкцию HbCO в ОДС.
Карбаминогемоглобин. Карбаминогемоглобин, или карбгемоглобин (HbCO2), является формой гемоглобина, связанной с диоксидом углерода CO2, которая образуется в результате связывания CO2 c концевой α-аминогруппой каждой из четырех белковых цепей глобина. Е. Dervieux с соавт. [93] выделили HbCO2 и Hb из крови человека и измерили их спектры поглощения в двух диапазонах — 235–600 и 600–1000 нм. Результаты показали, что спектры поглощения HbCO2 и Hb очень близки и практически накладываются друг на друга. В связи с этим концентрацию HbCO2 в тканях трудно определить неинвазивными оптическими методами.
Метгемоглобин. Метгемоглобин (MetHb) — это дисфункциональная форма гемоглобина, в которой двухвалентный ион железа Fe2+ заменяется трехвалентным Fe3+.За восстановление MetHb до гемоглобина отвечает фермент цитохром-b5-редуктаза. В норме содержание MetHb в крови человека составляет всего 1–2%.
Так как MetHb не способен связывать кислород, он также не может переносить кислород к тканям. Повышение MetHb в крови приводит к цианозу, гипоксии тканей и метгемоглобинемии, несмотря на возможный нормальный уровень общего гемоглобина [61, 62]. Уровень MetHb традиционно оценивается биохимическими методами, например с помощью высокоэффективной жидкостной хроматографии или электрофореза [94]. Повышенный уровень MetHb обнаружен у пациентов с сепсисом, младенцев с тяжелым метаболическим ацидозом (синдром синего ребенка) и лиц с редкими врожденными метаболическими аномалиями, такими как дефицит глюкозофосфатдегидрогеназы [95].
Поскольку нитрит-ион NO2– окисляет Fe2+ до Fe3+, образование MetHb в организме может происходить в результате отравления нитратами. Отмечено, что метгемоглобинемия может быть приобретенной в ходе воздействия различных лекарственных препаратов (таких как бензокаин, дапсон, сульфаниламиды и производные нитратов) или других химических соединений, являющихся сильными окислителями [61]. Поэтому содержание MetHb в биоткани является важным клиническим показателем.
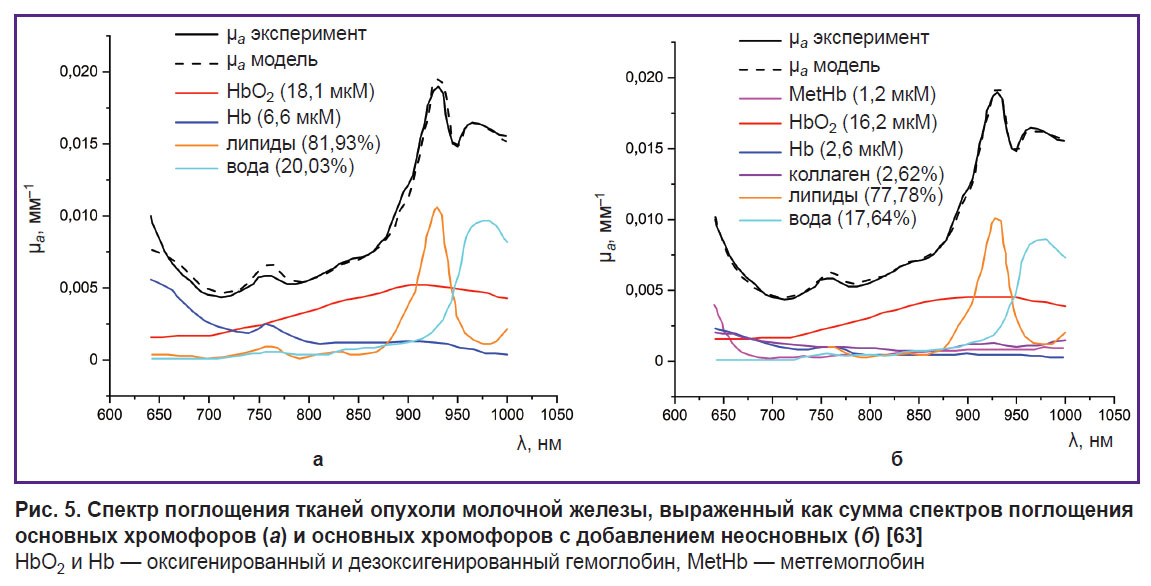
MetHb имеет пик поглощения около 630 нм, что делает его заметным на фоне других глобинов [95] (см. рис. 4). S. Vasudevan с соавт. [63] в исследовании тканей молочной железы с помощью ОДС в ближнем ИК-диапазоне (640–1000 нм) показали, что учет MetHb в спектре поглощения тканевых хромофоров наряду с HbO2 и Hb, водой, липидами и коллагеном позволил существенно уменьшить невязку между модельным и измеренным спектрами поглощения (рис. 5), что косвенно говорит о корректности учета MetHb и его присутствии в ткани.В данной работе также установлено, что концентрация MetHb в опухолевых тканях выше, чем в нормальных тканях молочной железы. Поскольку концентрация MetHb в здоровых тканях крайне мала, это дает возможность использовать MetHb в качестве онкомаркера.
Другим популярным приложением в исследованиях методом ОДС является мониторинг ожоговой раны. С помощью ОДС в VIS-NIR-диапазоне (400–1000 нм) с шагом 10 нм зарегистрировано повышение содержания MetHb в результате изменения гемодинамики кожи во время ожога [14]. В исследовании F. Khatun с соавт. [88] был разработан метод совместной количественной оценки меланина, HbO2 и Hb, а также MetHb в тканях модели крыс с метгемоглобинемией, после чего эта методика была примененадля классификации ожогов по степени тяжести, а также для оценки глубины ожога у крыс [96].
Миоглобин. Это кислород- и железосвязывающий белок, в изобилии содержащийся в миоцитах сердца и скелетных мышцах человека и других млекопитающих. В отличие от гемоглобина, миоглобин в своем составе несет только один гем и одну полипептидную цепь. В норме функция миоглобина заключается в обратимом связывании кислорода и облегчении диффузии кислорода из кровеносных капилляров в митохондрии мышц [97]. Главный интерес в доклинических и клинических исследованиях миоглобина представляет количественная характеристика насыщения миоглобина кислородом (sO2-Mb) [98].
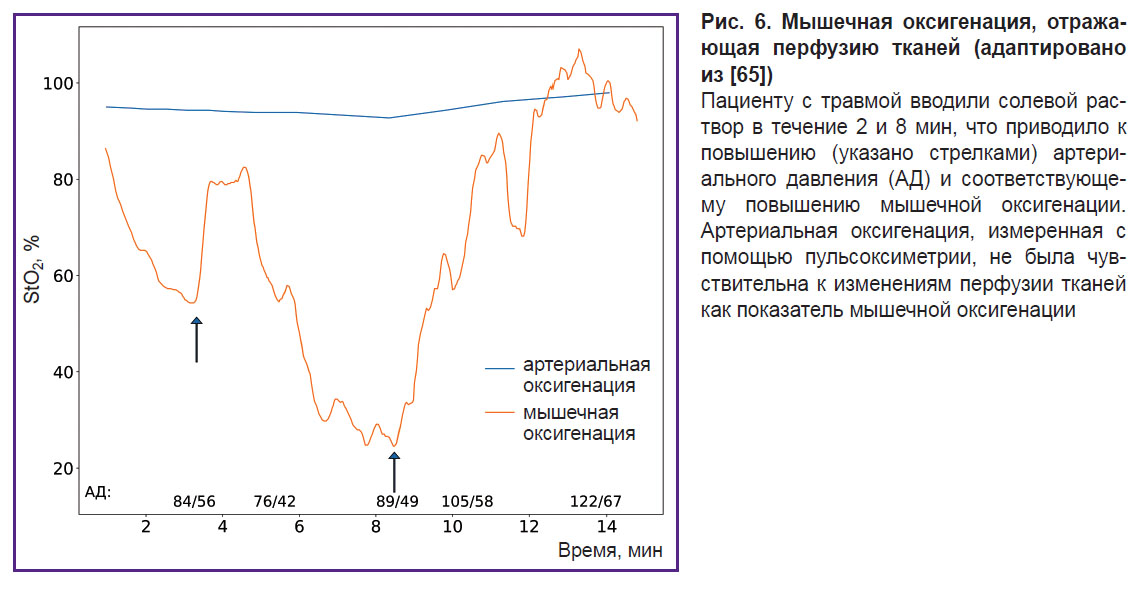
В исследовании, проведенном методом ОДС в видимом и ближнем ИК-диапазоне (540–800 нм), L.S. Arakaki с соавт. [65] ввели показатель мышечной оксигенации, который представляет собой процент оксигенированных миоглобина и гемоглобина от общего количества миоглобина и гемоглобина в ткани. Результаты показали, что совместное измерение уровня оксигенации гемоглобина и миоглобина способствует более точному измерению мышечной оксигенации по сравнению с измерением только артериальных компонентов (рис. 6).
Метмиоглобин. Окисленной формой миоглобина является метмиоглобин. В живой мышечной ткани концентрация метмиоглобина крайне мала из-за присутствия фермента метмиоглобинредуктазы, который в присутствии кофактора NADH и кофермента цитохрома b4 преобразует Fe3+ в простетической группе гема метмиоглобина в Fe2+ нормального миоглобина. Так как метмиоглобин не восстанавливается в мертвых тканях до миоглобина, процесс его непрерывного окисления является причиной потемнения мяса по мере хранения [99]. Чтобы продлить срок хранения продукта, крайне важно обнаружить образование и накопление метмиоглобина, а также измерить оксигенацию мяса. В частности, с помощью ОДС была проведена оценка соотношения метмиоглобина и оксигенации мяса свинины и говядины [15].
Билирубин. Гем, высвобождающийся во время гибели эритроцитов в селезенке, под действием гем-оксигеназы превращается в биливердин с образованием свободного иона железа Fe3+ и монооксида углерода CO. Биливердин состоит их четырех пиррольных колец, соединенных в линейную цепочку. Под воздействием биливердинредуктазы биливердин превращается в свободный (неконъюгированный) билирубин. Свободный билирубин плохо растворяется в воде и транспортируется кровотоком в виде комплекса с белком плазмы крови — альбумином [39]. Одна молекула альбумина способна связывать две молекулы билирубина. С кровотоком неконъюгированный билирубин переносится в печень. Далее метаболизм билирубина происходит в гепатоцитах печени, где он превращается в билирубиндиклюкоронид (связанный билирубин). Этот компонент является важной частью желчи и секретируется в тонкий кишечник. Связанный билирубин хорошо растворим в воде и нерастворим в жирах [100].
На фоне повышенного гемолиза эритроцитов, а также при ухудшении работы печени или закупорке желчевыводящих протоков концентрация билирубина в крови возрастает. Билирубин является антиоксидантом в тканях млекопитающих, поэтому, когда его концентрация в сыворотке превышает концентрацию связывающего его белка — сывороточного альбумина, развивается билирубиновая интоксикация, приводящая к гипербилирубинемии или желтухе [100]. Считается, что у большинства младенцев гипербилирубинемия представляет собой нормальное временное состояние, называемым физиологической желтухой. Однако у некоторых младенцев, особенно недоношенных, гипербилирубинемия способна привести к накоплению билирубина в мозговой ткани, что может стать причиной необратимого повреждения мозга, называемого ядерной желтухой [101]. Поэтому рекомендуется тщательно контролировать уровень билирубина в сыворотке при желтухе новорожденных, особенно в первые 24 ч [102].
Таким образом, билирубин является важным хромофором для оценки состояния здоровья при желтухе новорожденных, циррозе печени и гепатите. Традиционно уровень различных форм билирубина в крови оценивается инвазивными биохимическими методами, при этом определяется содержание билирубина в сыворотке. Однако в некоторых случаях с этой целью могут применяться неинвазивные оптические методы. Концентрация билирубина, измеренная неинвазивными методами, называется транскутантной [55].
Максимум поглощения билирубина находится в диапазоне 400–500 нм (см. рис. 2). В работе A. Banerjee и соавт. [55] методом ОДС в диапазоне 400–700 нм исследовали содержание билирубина, HbO2 и Hb, а также показатель оксигенации крови у 4668 новорожденных, гестационный срок которых составлял от 28 до 40 нед. Аналогичные показатели были измерены инвазивными биохимическими методами. Значения, полученные двумя разными методами, имели высокую степень корреляции, в частности для билирубина r=0,88.
Популярным приложением ОДС также является мониторинг злокачественных опухолей. R. Nachabé с соавт. [43] исследовали коэффициент поглощения желчи в здоровых и опухолевых тканях печени методом ОДС. В работе была использована установка с двумя спектрометрами, которые различают свет в диапазоне от 400 до 1100 нм и от 800 до 1700 нм. Кроме того, в модели рассеяния света были учтены основные хромофоры, такие как вода, липиды, HbO2 и Hb. Результаты показали, что включение желчи в модель реконструкции позволило существенно уменьшить невязку между модельным и измеренным спектрами поглощения здоровых тканей печени. Кроме того, авторы обнаружили, что опухолевые ткани печени содержат примерно в пять раз меньше желчи, чем здоровые, и это дает возможность использовать неинвазивные методики для классификации здоровых и онкологических тканей во время абляции.
Цитохромы и цитохромоксидаза. Как было сказано раннее, концентрации HbO2 и Hb позволяют оценить кровенаполнение и степень оксигенации ткани, в то время как с помощью регистрации цитохромов и цитохромоксидазы можно осуществлять мониторинг окислительного метаболизма митохондрий внутри тканей [103].
Цитохромы — это белки с железосодержащей простетической группой — гемом. Благодаря системе сопряженных двойных связей в структуре гема, пики поглощения цитохромов находятся в видимой области спектра. В митохондриях содержатся три класса цитохомов: a, b, c. Каждый класс цитохромов имеет свой спектр поглощения. Например, пик поглощения цитохрома a сдвинут в длинноволновую область — около 600 нм, цитохрома b — около 560 нм, а цитохрома c — 550 нм [39].
Цитохром c является важным компонентом дыхательной цепи митохондрий. Из-за того, что цитохром c подвержен как окислению (oxCyto c), так и восстановлению (redCyto c), он может нести информацию об уровне митохондриальной оксигенации [37]. В работе [104] установлено, что измеренные в тканях сердца свиньи спектры поглощения oxCyto c и redCyto c отличаются (рис. 7). Исследования цитохрома c методом ОДС в литературе широко не освещены из-за наложения спектров поглощения цитохрома и гемоглобина.При попытке разделить хромофоры в исследовании на сердце свиньи методом ОДС in vivo было обнаружено оптическое «окно» примерно от 540 до 585 нм, которое позволило регистрировать миоглобин и цитохром c без помех со стороны HbO2 и Hb [67].
Среди компонентов дыхательной цепи митохондрий наибольшее внимание в ОДС-исследованиях уделено цитохром-c-оксидазе. Например, учет цитохром-c-оксидазы в модели распространения света в тканях повысил качество реконструкции других хромофоров [69].
Цитохром-c-оксидаза, комплекс IV — фермент, относящийся к группе оксидоредуктаз. Комплекс локализован во внутренней мембране митохондрий и представлен в виде гомодимера, каждый мономер которого состоит из 13 субъединиц. Субъединица I содержит два гема — a и a3, а также ион меди CuB. Гем a3 и CuB образуют двухъядерный Fe–Cu-центр, присоединяющий электроны от гема a и передающий их на молекулярный кислород, находящийся в центре связывания гема a3. Субъединица II содержит два иона меди, которые связаны с двумя остатками цистеина через –SH-группы, а также образуют двухъядерный центр CuA.
Каждый из перечисленных центров может существовать в окисленном или восстановленном состоянии и имеет разные спектры поглощения. Несмотря на то, что доминирующим хромофором в ближнем инфракрасном диапазоне является центр CuA, другие окислительно-восстановительные центры цитохрома могут так же способствовать формированию результирующего спектра поглощения цитохрома-с-оксидазы [104]. Например, было установлено, что полностью окисленный двухъядерный центр a3/CuB демонстрирует пик поглощения на 655 нм.
Цитохром-с-оксидаза — конечный комплекс дыхательной цепи митохондрий, который катализирует перенос электронов от цитохрома c к молекулярному кислороду, восстанавливая последний до воды [105]. Существует предположение, что одновременный мониторинг окислительно-восстановительного состояния цитохрома-с-оксидазы (oxCCO/redCCO) и гемоглобина может предоставить дополнительную информацию о гемодинамике, оксигенации и метаболизме тканей [104]. Методом ОДС в диапазоне от 650 до 100 нм J. Lee с соавт. [70] провели совместную регистрацию общего гемоглобина, HbO2 и Hb, а также oxCCO и redCCO в мышечных тканях модельных животных при отравлении цианидом. Результаты исследования показали, что изменения сигнала окислительно-восстановительного состояния цитохрома-с-оксидазы можно обнаружить in vivo и отличить от изменений сигнала HbO2 и Hb.
Было также показано, что мониторинг цитохрома-с-оксидазы с помощью ОДС в ближнем ИК коррелирует с другими показателями метаболизма, включая показатели, полученные с помощью более инвазивных методов, таких как церебральный микродиализ [106] или магнитно-резонансная спектроскопия [107]. В частности, M.M. Tisdall с соавт. [106] исследовали эффект гипербарической кислородной терапии после черепно-мозговой травмы (ЧМТ). Так как при ЧМТ наблюдаются нарушение аэробного метаболизма и дисфункция митохондрий, в работе проводился мониторинг концентрации окисленной цитохром-с-оксидазы с помощью ОДС в ближнем ИК-диапазоне (650 и 980 нм). Результаты показали, что изменение концентрации oxCCO коррелировало с изменениями оксигенации мозговой ткани (r=0,57; p=0,005) [106].
Одним из наиболее интересных приложений ОДС может быть совместная регистрация основных и нескольких неосновных хромофоров. Установлено, что специфический для мышц белок, связывающий O2, — миоглобин, локализованный в митохондриях, взаимодействует с комплексом IV дыхательной цепи. Данное утверждение позволяет предположить, что миоглобин может быть фактором, регулирующим митохондриальное дыхание [108].
Совместная регистрация миоглобина, HbO2, сатурации и цитохрома-с-оксидазы методом ОДС in vivo может дать комплексное представление о физиологическом состоянии биоткани. L.S. Arakaki с соавт. [109] in vitro определили спектры поглощения гема aa3цитохрома-с-оксидазы, HbO2 и Hb, а также окси- и дезоксимиоглобина в диапазоне 600–850 нм, после чего применили метод ОДС для совместного мониторинга цитохрома-с-оксидазы с основными и неосновными хромофорами в эксперименте in vivo на мышечной ткани передней конечности кролика во время ишемии. Акцент в работе был сделан на спектре поглощения гема aa3 цитохром-c-оксидазы. Оценку редокс-статуса гема aa3, а также оксигенации гемоглобина и миоглобина in vivo также проводили в диапазоне 600–850 нм. Результаты показали, что при ишемии передней конечности кролика сначала происходит десатурация гемоглобина, затем миоглобина, а в последнюю очередь происходит восстановление гема аа3. Для решения проблемы перекрывающихся спектров исследуемых хромофоров авторы взяли вторую производную по длине волны от полученного в эксперименте in vitro спектра поглощения. По мнению авторов данной работы, поглощение во вторых производных Hb и Mb, а также oxССOaa3 и redCCOaa3 определено лучше, чем в исходных спектрах.
Заключение
Благодаря наличию в биотканях светопоглощающих соединений — хромофоров — методы ОДС широко используются для диагностики и мониторинга различных патологий. Среди основных хромофоров биотканей выделяют воду, липиды, меланин, окси- и дезоксигемоглобин. В частности, с помощью мониторинга содержания воды в исследуемом объекте можно обнаружить наличие отека, а по соотношению липидов и воды в опухоли возможно определить край резекции. Мониторинг окси- и дезоксигемоглобина позволяет установить степень оксигенации тканей, выявить гипоксию, оценить эффективность противоопухолевой терапии и т.д. Показатель содержания меланина в ткани является важным критерием при диагностике стадий меланомы.
Кроме основных хромофоров, в биотканях присутствуют неосновные — билирубин, различные глобины (карбоксигемоглобин, метгемоглобин, миоглобин и др.), а также цитохромы и цитохром-c-оксидаза. Комплексноеисследование основных и неосновных хромофоров тканей дает возможность одновременного мониторинга метаболических процессов в сосудистых, внутриклеточных и митохондриальных компартментах. Данный подход будет полезен не только в физиологических исследованиях метаболизма тканей, но и в клинических исследованиях, когда подача кислорода к тканям нарушена. Например, он может быть использован для оценки редокс-статуса цитохрома-c-оксидазы с целью мониторинга терапии после черепно-мозговой травмы, мониторинга метгемоглобина при оценке глубины ожоговой раны in vivo, оценки оксигенации миоглобина в тканях для наблюдения за метаболизмом мышц после травмы, а также для ряда других приложений, не рассмотренных на данный момент в литературе. Кроме того, стоит упомянуть, что учет неосновных хромофоров в модели рассеяния света в тканях позволяет улучшить реконструкцию других хромофоров из зарегистрированного методом ОДС сигнала.
Вклад авторов. К.А. Былинская — сбор материала, написание текста, подготовка иллюстраций; В.В. Перекатова — редактирование, подготовка иллюстраций; И.В. Турчин — сбор материала, написание текста, редактирование, ответственность за целостность всех частей статьи, утверждение окончательного варианта статьи.
Финансирование. Поддержано НЦМУ «Центр фотоники» при финансировании Министерства науки и высшего образования РФ, соглашение №075-15-2022-316.
Конфликт интересов отсутствует.
Литература
- Movasaghi Z., Rehman S., Rehman I.U. Raman spectroscopy of biological tissues. Appl Spectrosc Rev 2007; 42(5): 493–541, https://doi.org/10.1080/05704920701551530.
- Xie S., Li H., Zheng W., Chia T.-C., Lee S., Huang Z. Principles and techniques for measuring optical parameters of biotissue. Lasers in medicine and dentistry: diagnostics and treatment 1996; 2887: 92–102, https://doi.org/10.1117/12.251937.
- Hoshi Y., Yamada Y. Overview of diffuse optical tomography and its clinical applications. J Biomed Opt 2016; 21(9): 091312, https://doi.org/10.1117/1.JBO.21.9.091312.
- Potapova E.V., Shupletsov V.V., Dremin V.V., Zherebtsov E.A., Mamoshin A.V., Dunaev A.V. In vivo time-resolved fluorescence detection of liver cancer supported by machine learning. Lasers Surg Med 2024; 56(10): 836–844, https://doi.org/10.1002/lsm.23861.
- Fritsch C., Ruzicka T. Fluorescence diagnosis and photodynamic therapy in dermatology from experimental state to clinic standard methods. J Environ Pathol Toxicol Oncol 2006; 25(1–2): 425–439, https://doi.org/10.1615/jenvironpatholtoxicoloncol.v25.i1-2.270.
- Khilov A.V., Sergeeva E.A., Kurakina D.A., Turchin I.V., Kirillin M.Yu. Analytical model of fluorescence intensity for the estimation of fluorophore localisation in biotissue with dual-wavelength fluorescence imaging. Quantum Electronics 2021; 51(2): 95–103, https://doi.org/10.1070/qel17503.
- de Boer L.L., Molenkamp B.G., Bydlon T.M., Hendriks B.H., Wesseling J., Sterenborg H.J., Ruers T.J. Fat/water ratios measured with diffuse reflectance spectroscopy to detect breast tumor boundaries. Breast Cancer Res Treat 2015; 152(3): 509–518, https://doi.org/10.1007/s10549-015-3487-z.
- Druzhkova I., Bylinskaya K., Plekhanov A., Kostyuk A., Kirillin M., Perekatova V., Khilov A., Orlova A., Polozova A., Komarova A., Lisitsa U., Sirotkina M., Shirmanova M., Turchin I. Effects of FOLFOX chemotherapy on tumor oxygenation and perfused vasculature: an in vivo study by optical techniques. J Biophotonics 2024, https://doi.org/10.1002/jbio.202400339.
- Veluponnar D., de Boer L.L., Dashtbozorg B., Jong L.S., Geldof F., Guimaraes M.D.S., Sterenborg H.J.C.M., Vrancken-Peeters M.T.F.D., van Duijnhoven F., Ruers T. Margin assessment during breast conserving surgery using diffuse reflectance spectroscopy. J Biomed Opt 2024; 29(4): 045006, https://doi.org/10.1117/1.JBO.29.4.045006.
- Skyrman S., Burström G., Lai M., Manni F., Hendriks B., Frostell A., Edström E., Persson O., Elmi-Terander A. Diffuse reflectance spectroscopy sensor to differentiate between glial tumor and healthy brain tissue: a proof-of-concept study. Biomed Opt Express 2022; 13(12): 6470–6483, https://doi.org/10.1364/BOE.474344.
- Jules A., Means D., Troncoso J.R., Fernandes A., Dadgar S., Siegel E.R., Rajaram N. Diffuse reflectance spectroscopy of changes in tumor microenvironment in response to different doses of radiation. Radiat Res 2022; 198(6): 545–552, https://doi.org/10.1667/RADE-21-00228.1.
- Hsu C.K., Tzeng S.Y., Yang C.C., Lee J.Y., Huang L.L., Chen W.R., Hughes M., Chen Y.W., Liao Y.K., Tseng S.H. Non-invasive evaluation of therapeutic response in keloid scar using diffuse reflectance spectroscopy. Biomed Opt Express 2015; 6(2): 390–404, https://doi.org/10.1364/BOE.6.000390.
- Schelkanova I., Pandya A., Muhaseen A., Saiko G., Douplik A. Early optical diagnosis of pressure ulcers. In: Meglinski I. (editor). Biophotonics for medical applications. Woodhead Publishing; 2015; p. 347–375, https://doi.org/10.1016/B978-0-85709-662-3.00013-0.
- Parvez M.A., Yashiro K., Nagahama Y., Tsunoi Y., Saitoh D., Sato S., Nishidate I. In vivo visualization of burn depth in skin tissue of rats using hemoglobin parameters estimated by diffuse reflectance spectral imaging. J Biomed Opt 2024; 29(2): 026003, https://doi.org/10.1117/1.JBO.29.2.026003.
- Nguyen T., Kim S., Kim J.G. Diffuse reflectance spectroscopy to quantify the met-myoglobin proportion and meat oxygenation inside of pork and beef. Food Chem 2019; 275: 369–376, https://doi.org/10.1016/j.foodchem.2018.09.121.
- Rossel R.A.V., Behrens T., Ben-Dor E., Chabrillat S., Demattê J.A.M., Ge Y., Gomez C., Guerrero C., Peng Y., Ramirez-Lopez L., Shi Z., Stenberg B., Webster R., Winowiecki L., Shen Z. Diffuse reflectance spectroscopy for estimating soil properties: a technology for the 21st century. European Journal of Soil Science 2022; 73(4): e13271, https://doi.org/10.1111/ejss.13271.
- Beschastnov V.V., Ryabkov М.G., Pavlenko I.V., Bagryantsev М.V., Dezortsev I.L., Kichin V.V., Baleyev М.S., Maslennikova А.V., Orlova А.G., Kleshnin М.S., Turchin I.V. Current methods for the assessment of oxygen status and biotissue microcirculation condition: diffuse optical spectroscopy (review). Sovremennye tehnologii v medicine 2018; 10(4): 183, https://doi.org/10.17691/stm2018.10.4.22.
- Turchin I.V. Methods of biomedical optical imaging: from subcellular structures to tissues and organs. Physics-Uspekhi 2016; 59(5): 487–501, https://doi.org/10.3367/ufne.2015.12.037734.
- Perekatova V., Kostyuk A., Kirillin M., Sergeeva E., Kurakina D., Shemagina O., Orlova A., Khilov A., Turchin I. VIS-NIR diffuse reflectance spectroscopy system with self-calibrating fiber-optic probe: study of perturbation resistance. Diagnostics (Basel) 2023; 13(3): 457, https://doi.org/10.3390/diagnostics13030457.
- Budylin G.S., Davydov D.A., Zlobina N.V., Baev A.V., Artyushenko V.G., Yakimov B.P., Shirshin E.A. In vivo sensing of cutaneous edema: a comparative study of diffuse reflectance, Raman spectroscopy and multispectral imaging. J Biophotonics 2022; 15(1): e202100268, https://doi.org/10.1002/jbio.202100268.
- Li S., Ardabilian M., Zine A. Quantitative analysis of skin using diffuse reflectance for non-invasive pigments detection. In: Proceedings of the 16th International Joint Conference on Computer Vision, Imaging and Computer Graphics Theory and Applications (VISIGRAPP 2021). Vol. 4. 2021; p. 604–614, https://doi.org/10.5220/0010326806040614.
- Chae E.Y., Kim H.H., Sabir S., Kim Y., Kim H., Yoon S., Ye J.C., Cho S., Heo D., Kim K.H., Bae Y.M., Choi Y.W. Development of digital breast tomosynthesis and diffuse optical tomography fusion imaging for breast cancer detection. Sci Rep 2020; 10(1): 13127, https://doi.org/10.1038/s41598-020-70103-0.
- Zhang Q., Jiang H. Three-dimensional diffuse optical imaging of hand joints: system description and phantom studies. Opt Lasers Eng 2005; 43: 1237–1251, https://doi.org/10.1016/j.optlaseng.2004.12.007.
- Hoi J.W., Kim H.K., Fong C.J., Zweck L., Hielscher A.H. Non-contact dynamic diffuse optical tomography imaging system for evaluating lower extremity vasculature. Biomed Opt Express 2018; 9(11): 5597–5614, https://doi.org/10.1364/BOE.9.005597.
- Kurakina D., Perekatova V., Sergeeva E., Kostyuk A., Turchin I., Kirillin M. Probing depth in diffuse reflectance spectroscopy of biotissues: a Monte Carlo study. Laser Phys Lett 2022; 19: 035602, https://doi.org/10.1088/1612-202X/ac4be8.
- Blaney G., Sassaroli A., Fantini S. Dual-slope imaging in highly scattering media with frequency-domain near-infrared spectroscopy. Opt Lett 2020; 45(16): 4464–4467, https://doi.org/10.1364/OL.394829.
- Farrell T.J., Patterson M.S., Wilson B. A diffusion theory model of spatially resolved, steady-state diffuse reflectance for the noninvasive determination of tissue optical properties in vivo. Med Phys 1992; 19(4): 879–888, https://doi.org/10.1118/1.596777.
- Sergeeva E., Kurakina D., Turchin I., Kirillin M. A refined analytical model for reconstruction problems in diffuse reflectance spectroscopy. J Innov Opt Health Sci 2024; 17(05): 2342002, https://doi.org/10.1142/S1793545823420026.
- Post A.L., Faber D.J., Sterenborg H.J.C.M., van Leeuwen T.G. Subdiffuse scattering and absorption model for single fiber reflectance spectroscopy. Biomed Opt Express 2020; 11(11): 6620–6633, https://doi.org/10.1364/BOE.402466.
- Orlova A., Perevalova Y., Pavlova K., Orlinskaya N., Khilov A., Kurakina D., Shakhova M., Kleshnin M., Sergeeva E., Turchin I., Kirillin M. Diffuse optical spectroscopy monitoring of experimental tumor oxygenation after red and blue light photodynamic therapy. Photonics 2022; 9(1): 19, https://doi.org/10.3390/PHOTONICS9010019.
- Sekar S., Lanka P., Farina A., Mora A.D., Andersson-Engels S., Taroni P., Pifferi A. Broadband time domain diffuse optical reflectance spectroscopy: a review of systems, methods, and applications. Appl Sci 2019; 9(24): 5465, https://doi.org/10.3390/app9245465.
- Gioux S., Mazhar A., Cuccia D.J. Spatial frequency domain imaging in 2019: principles, applications, and perspectives. J Biomed Opt 2019; 24(7): 1–18, https://doi.org/10.1117/1.JBO.24.7.071613.
- Zhou X., Xia Y., Uchitel J., Collins-Jones L., Yang S., Loureiro R., Cooper R.J., Zhao H. Review of recent advances in frequency-domain near-infrared spectroscopy technologies [Invited]. Biomed Opt Express 2023; 14(7): 3234–3258, https://doi.org/10.1364/BOE.484044.
- van Veen R.L., Sterenborg H.J., Pifferi A., Torricelli A., Chikoidze E., Cubeddu R. Determination of visible near-IR absorption coefficients of mammalian fat using time- and spatially resolved diffuse reflectance and transmission spectroscopy. J Biomed Opt 2005; 10(5): 054004, https://doi.org/10.1117/1.2085149.
- Nogueira M.S., Maryam S., Amissah M., Lu H., Lynch N., Killeen S., O’Riordain M., Andersson-Engels S. Evaluation of wavelength ranges and tissue depth probed by diffuse reflectance spectroscopy for colorectal cancer detection. Sci Rep 2021; 11(1): 798, https://doi.org/10.1038/s41598-020-79517-2.
- Turchin I., Beschastnov V., Peretyagin P., Perekatova V., Kostyuk A., Orlova A., Koloshein N., Khilov A., Sergeeva E., Kirillin M., Ryabkov M. Multimodal optical monitoring of auto- and allografts of skin on a burn wound. Biomedicines 2023; 11(2): 351, https://doi.org/10.3390/biomedicines11020351.
- Bydlon T.M., Nachabé R., Ramanujam N., Sterenborg H.J., Hendriks B.H. Chromophore based analyses of steady-state diffuse reflectance spectroscopy: current status and perspectives for clinical adoption. J Biophotonics 2015; 8(1-2): 9–24, https://doi.org/10.1002/jbio.201300198.
- Jacques S.L. Optical properties of biological tissues: a review. Phys Med Biol 2013; 58(11): R37–R61. Corrected and republished from: Phys Med Biol 2013; 58(14): 5007–5008, https://doi.org/10.1088/0031-9155/58/11/R37.
- Nelson D.L., Cox M.M. Lehninger Biochemie. Springer Berlin Heidelberg, Berlin, Heidelberg; 2001.
- Assorted Spectra. URL: https://omlc.org/spectra/index.html.
- Wada H., Yoshizawa N., Ohmae E., Ueda Y., Yoshimoto K., Mimura T., Nasu H., Asano Y., Ogura H., Sakahara H., Goshima S. Water and lipid content of breast tissue measured by six-wavelength time-domain diffuse optical spectroscopy. J Biomed Opt 2022; 27(10): 105002, https://doi.org/10.1117/1.JBO.27.10.105002.
- Efendiev K., Alekseeva P., Linkov K., Shiryaev A., Pisareva T., Gilyadova A., Reshetov I., Voitova A., Loschenov V. Tumor fluorescence and oxygenation monitoring during photodynamic therapy with chlorin e6 photosensitizer. Photodiagnosis Photodyn Ther 2024; 45: 103969, https://doi.org/10.1016/j.pdpdt.2024.103969.
- Nachabé R., Evers D.J., Hendriks B.H., Lucassen G.W., van der Voort M., Wesseling J., Ruers T.J. Effect of bile absorption coefficients on the estimation of liver tissue optical properties and related implications in discriminating healthy and tumorous samples. Biomed Opt Express 2011; 2(3): 600–614, https://doi.org/10.1364/BOE.2.000600.
- Meineke G., Hermans M., Klos J., Lenenbach A., Noll R. A microfluidic opto-caloric switch for sorting of particles by using 3D-hydrodynamic focusing based on SLE fabrication capabilities. Lab Chip 2016; 16(5): 820–828, https://doi.org/10.1039/c5lc01478f.
- Chung S.H., Cerussi A.E., Klifa C., Baek H.M., Birgul O., Gulsen G., Merritt S.I., Hsiang D., Tromberg B.J. In vivo water state measurements in breast cancer using broadband diffuse optical spectroscopy. Phys Med Biol 2008; 53(23): 6713–6727, https://doi.org/10.1088/0031-9155/53/23/005.
- Davydov D.A., Budylin G.S., Baev A.V., Vaypan D.V., Seredenina E.M., Matskeplishvili S.T., Evlashin S.A., Kamalov A.A., Shirshin E.A. Monitoring the skin structure during edema in vivo with spatially resolved diffuse reflectance spectroscopy. J Biomed Opt 2023; 28(5): 057002, https://doi.org/10.1117/1.JBO.28.5.057002.
- Nachabé R., Hendriks B.H., Desjardins A.E., van der Voort M., van der Mark M.B., Sterenborg H.J. Estimation of lipid and water concentrations in scattering media with diffuse optical spectroscopy from 900 to 1,600 nm. J Biomed Opt 2010; 15(3): 037015, https://doi.org/10.1117/1.3454392.
- Pifferi A., Taroni P., Torricelli A., Messina F., Cubeddu R., Danesini G. Four-wavelength time-resolved optical mammography in the 680–980-nm range. Opt Lett 2003; 28(13): 1138–1140, https://doi.org/10.1364/ol.28.001138.
- Absorption spectrum of melanin. URL: https://www.cl.cam.ac.uk/~jgd1000/melanin.html.
- Zonios G., Dimou A., Bassukas I., Galaris D., Tsolakidis A., Kaxiras E. Melanin absorption spectroscopy: new method for noninvasive skin investigation and melanoma detection. J Biomed Opt 2008; 13(1): 014017, https://doi.org/10.1117/1.2844710.
- Marchesini R., Bono A., Carrara M. In vivo characterization of melanin in melanocytic lesions: spectroscopic study on 1671 pigmented skin lesions. J Biomed Opt 2009; 14(1): 014027, https://doi.org/10.1117/1.3080140.
- Lim L., Nichols B., Migden M.R., Rajaram N., Reichenberg J.S., Markey M.K., Ross M.I., Tunnell J.W. Clinical study of noninvasive in vivo melanoma and nonmelanoma skin cancers using multimodal spectral diagnosis. J Biomed Opt 2014; 19(11): 117003, https://doi.org/10.1117/1.JBO.19.11.117003.
- Bilirubin. URL: https://omlc.org/spectra/PhotochemCAD/html/119.html.
- Doumas B.T., Wu T.W., Jendrzejczak B. Delta bilirubin: absorption spectra, molar absorptivity, and reactivity in the diazo reaction. Clin Chem 1987; 33(6): 769–774.
- Banerjee A., Bhattacharyya N., Ghosh R., Singh S., Adhikari A., Mondal S., Roy L., Bajaj A., Ghosh N., Bhushan A., Goswami M., Ahmed A.S.A., Moussa Z., Mondal P., Mukhopadhyay S., Bhattacharyya D., Chattopadhyay A., Ahmed S.A., Mallick A.K., Pal S.K. Non-invasive estimation of hemoglobin, bilirubin and oxygen saturation of neonates simultaneously using whole optical spectrum analysis at point of care. Sci Rep 2023; 13(1): 2370, https://doi.org/10.1038/s41598-023-29041-w.
- Cruz-Landeira A., Bal M.J., Quintela O., López-Rivadulla M. Determination of methemoglobin and total hemoglobin in toxicological studies by derivative spectrophotometry. J Anal Toxicol 2002; 26(2): 67–72, https://doi.org/10.1093/jat/26.2.67.
- Sekar S.K., Bargigia I., Mora A.D., Taroni P., Ruggeri A., Tosi A., Pifferi A., Farina A. Diffuse optical characterization of collagen absorption from 500 to 1700 nm. J Biomed Opt 2017; 22(1): 15006, https://doi.org/10.1117/1.JBO.22.1.015006.
- Nazarov D.A., Denisenko G.M., Budylin G.S., Kozlova E.A., Lipina M.M., Lazarev V.A., Shirshin E.A., Tarabrin M.K. Diffuse reflectance spectroscopy of the cartilage tissue in the fourth optical window. Biomed Opt Express 2023; 14(4): 1509–1521, https://doi.org/10.1364/BOE.483135.
- Taroni P., Quarto G., Pifferi A., Ieva F., Paganoni A.M., Abbate F., Balestreri N., Menna S., Cassano E., Cubeddu R. Optical identification of subjects at high risk for developing breast cancer. J Biomed Opt 2013; 18(6): 060507, https://doi.org/10.1117/1.JBO.18.6.060507.
- Martínez-Mancera F., Hernandez-Lopez J. In vitro observation of direct electron transfer of human haemoglobin molecules on glass/tin-doped indium oxide electrodes. J Mex Chem Soc 2015; 59(4), https://doi.org/10.29356/jmcs.v59i4.87.
- Amenhotep Z.D. Hematology and coagulation. In: Self-assessment Q and A in clinical laboratory science, III. Elsevier; 2021; p. 295–313, https://doi.org/10.1016/b978-0-12-822093-1.00025-9.
- Mentzer W.C., Glader B.E. Erythrocyte disorders in infancy. In: Taeusch H.W., Ballard R.A., Gleason C.A. (editors). Avery’s diseases of the newborn. W.B. Saunders; 2005; р. 1180–1214, https://doi.org/10.1016/B978-072169347-7.50079-2.
- Vasudevan S., Campbell C., Liu F., O’Sullivan T.D. Broadband diffuse optical spectroscopy of absolute methemoglobin concentration can distinguish benign and malignant breast lesions. J Biomed Opt 2021; 26(6): 065004, https://doi.org/10.1117/1.JBO.26.6.065004.
- Barham P., Skibsted L.H., Bredie W.L., Frøst M.B., Møller P., Risbo J., Snitkjaer P., Mortensen L.M. Molecular gastronomy: a new emerging scientific discipline. Chem Rev 2010; 110(4): 2313–2365, https://doi.org/10.1021/cr900105w.
- Arakaki L.S., Schenkman K.A., Ciesielski W.A., Shaver J.M. Muscle oxygenation measurement in humans by noninvasive optical spectroscopy and locally weighted regression. Anal Chim Acta 2013; 785: 27–33, https://doi.org/10.1016/j.aca.2013.05.003.
- Wang L., Santos E., Schenk D., Rabago-Smith M. Kinetics and mechanistic studies on the reaction between cytochrome c and tea catechins. Antioxidants (Basel) 2014; 3(3): 559–568, https://doi.org/10.3390/antiox3030559.
- Arai A.E., Kasserra C.E., Territo P.R., Gandjbakhche A.H., Balaban R.S. Myocardial oxygenation in vivo: optical spectroscopy of cytoplasmic myoglobin and mitochondrial cytochromes. Am J Physiol 1999; 277(2): H683–H697, https://doi.org/10.1152/ajpheart.1999.277.2.H683.
- Bhattacharya M., Dutta A. Computational modeling of the photon transport, tissue heating, and cytochrome c oxidase absorption during transcranial near-infrared stimulation. Brain Sci 2019; 9(8): 179, https://doi.org/10.3390/brainsci9080179.
- Lindbergh T., Häggblad E., Ahn H., Göran Salerud E., Larsson M., Strömberg T. Improved model for myocardial diffuse reflectance spectra by including mitochondrial cytochrome aa3, methemoglobin, and inhomogenously distributed RBC. J Biophotonics 2011; 4(4): 268–276, https://doi.org/10.1002/jbio.201000048.
- Lee J., Kim J.G., Mahon S.B., Mukai D., Yoon D., Boss G.R., Patterson S.E., Rockwood G., Isom G., Brenner M. Noninvasive optical cytochrome c oxidase redox state measurements using diffuse optical spectroscopy. J Biomed Opt 2014; 19(5): 055001, https://doi.org/10.1117/1.JBO.19.5.055001.
- Cerussi A., Shah N., Hsiang D., Durkin A., Butler J., Tromberg B.J. In vivo absorption, scattering, and physiologic properties of 58 malignant breast tumors determined by broadband diffuse optical spectroscopy. J Biomed Opt 2006; 11(4): 044005, https://doi.org/10.1117/1.2337546.
- Khan M.I.H., Karim M.A. Cellular water distribution, transport, and its investigation methods for plant-based food material. Food Res Int 2017; 99(Pt 1): 1–14, https://doi.org/10.1016/j.foodres.2017.06.037.
- Yang C.C., Yen Y.Y., Hsu C.K., Cheng N.Y., Tzeng S.Y., Chou S.J., Chang J.M., Tseng S.H. Investigation of water bonding status of normal and psoriatic skin in vivo using diffuse reflectance spectroscopy. Sci Rep 2021; 11(1): 8901, https://doi.org/10.1038/s41598-021-88530-y.
- Akter S., Hossain Md.G., Nishidate I., Hazama H., Awazu K. Medical applications of reflectance spectroscopy in the diffusive and sub-diffusive regimes. J Infrared Spectrosc 2018; 26(6): 337–350, https://doi.org/10.1177/0967033518806637.
- Beauvoit B., Evans S.M., Jenkins T.W., Miller E.E., Chance B. Correlation between the light scattering and the mitochondrial content of normal tissues and transplantable rodent tumors. Anal Biochem 1995; 226(1): 167–174, https://doi.org/10.1006/abio.1995.1205.
- Wilson J.D., Cottrell W.J., Foster T.H. Index-of-refraction-dependent subcellular light scattering observed with organelle-specific dyes. J Biomed Opt 2007; 12(1): 014010, https://doi.org/10.1117/1.2437765.
- Blaney G., Bottoni M., Sassaroli A., Fernandez C., Fantini S. Broadband diffuse optical spectroscopy of two-layered scattering media containing oxyhemoglobin, deoxyhemoglobin, water, and lipids. J Innov Opt Health Sci 2022; 15(3): 2250020, https://doi.org/10.1142/s1793545822500201.
- Lam J.H., Tu K.J., Kim S. Narrowband diffuse reflectance spectroscopy in the 900–1000 nm wavelength region to quantify water and lipid content of turbid media. Biomed Opt Express 2021; 12(6): 3091–3102, https://doi.org/10.1364/BOE.425451.
- Bhagavan N.V. Protein and amino acid metabolism. In: Medical biochemistry. Academic Press; 2002; p. 331–363, https://doi.org/10.1016/b978-012095440-7/50019-6.
- Maranduca M.A., Branisteanu D., Serban D.N., Branisteanu D.C., Stoleriu G., Manolache N., Serban I.L. Synthesis and physiological implications of melanic pigments. Oncol Lett 2019; 17(5): 4183–4187, https://doi.org/10.3892/ol.2019.10071.
- Kalia S., Zhao J., Zeng H., McLean D., Kollias N., Lui H. Melanin quantification by in vitro and in vivo analysis of near-infrared fluorescence. Pigment Cell Melanoma Res 2018; 31(1): 31–38, https://doi.org/10.1111/pcmr.12624.
- Gell D.A. Structure and function of haemoglobins. Blood Cells Mol Dis 2018; 70: 13–42, https://doi.org/10.1016/j.bcmd.2017.10.006.
- Chan E.D., Chan M.M., Chan M.M. Pulse oximetry: understanding its basic principles facilitates appreciation of its limitations. Respir Med 2013; 107(6): 789–799, https://doi.org/10.1016/j.rmed.2013.02.004.
- Orlova A.G., Kirillin M.Y., Volovetsky A.B., Shilyagina N.Y., Sergeeva E.A., Golubiatnikov G.Y., Turchin I.V. Diffuse optical spectroscopy monitoring of oxygen state and hemoglobin concentration during SKBR-3 tumor model growth. Laser Phys Lett 2016; 14: 015601, https://doi.org/10.1088/1612-202X/AA4FC1.
- Diaz P.M., Jenkins S.V., Alhallak K., Semeniak D., Griffin R.J., Dings R.P.M., Rajaram N. Quantitative diffuse reflectance spectroscopy of short-term changes in tumor oxygenation after radiation in a matched model of radiation resistance. Biomed Opt Express 2018; 9(8): 3794–3804, https://doi.org/10.1364/BOE.9.003794.
- Cochran J.M., Busch D.R., Leproux A., Zhang Z., O’Sullivan T.D., Cerussi A.E., Carpenter P.M., Mehta R.S., Roblyer D., Yang W., Paulsen K.D., Pogue B., Jiang S., Kaufman P.A., Chung S.H., Schnall M., Snyder B.S., Hylton N., Carp S.A., Isakoff S.J., Mankoff D., Tromberg B.J., Yodh A.G. Tissue oxygen saturation predicts response to breast cancer neoadjuvant chemotherapy within 10 days of treatment. J Biomed Opt 2018; 24(2): 1–11, https://doi.org/10.1117/1.JBO.24.2.021202.
- Brown J.M., Wilson W.R. Exploiting tumour hypoxia in cancer treatment. Nat Rev Cancer 2004; 4(6): 437–447, https://doi.org/10.1038/nrc1367.
- Khatun F., Aizu Y., Nishidate I. Transcutaneous monitoring of hemoglobin derivatives during methemoglobinemia in rats using spectral diffuse reflectance. J Biomed Opt 2021; 26(3): 033708, https://doi.org/10.1117/1.JBO.26.3.033708.
- Arakaki L.S., Burns D.H., Kushmerick M.J. Accurate myoglobin oxygen saturation by optical spectroscopy measured in blood-perfused rat muscle. Appl Spectrosc 2007; 61(9): 978–985, https://doi.org/10.1366/000370207781745928.
- Baranoski G.V., Chen T.F., Kimmel B.W., Miranda E., Yim D. On the noninvasive optical monitoring and differentiation of methemoglobinemia and sulfhemoglobinemia. J Biomed Opt 2012; 17(9): 97005, https://doi.org/10.1117/1.JBO.17.9.097005.
- Niemann M.J., Sørensen H., Siebenmann C., Lundby C., Secher N.H. Carbon monoxide reduces near-infrared spectroscopy determined ‘total’ hemoglobin: a human volunteer study. Scand J Clin Lab Invest 2017; 77(4): 259–262, https://doi.org/10.1080/00365513.2017.1299209.
- Allred E.N., Bleecker E.R., Chaitman B.R., Dahms T.E., Gottlieb S.O., Hackney J.D., Pagano M., Selvester R.H., Walden S.M., Warren J. Short-term effects of carbon monoxide exposure on the exercise performance of subjects with coronary artery disease. N Engl J Med 1989; 321(21): 1426–1432. Corrected and republished from: N Engl J Med 1990; 322(14): 1019, https://doi.org/10.1056/NEJM198911233212102.
- Dervieux E., Bodinier Q., Uhring W., Théron M. Measuring hemoglobin spectra: searching for carbamino-hemoglobin. J Biomed Opt 2020; 25(10): 105001, https://doi.org/10.1117/1.JBO.25.10.105001.
- Da-Silva S.S., Sajan I.S., Underwood J.P. 3rd. Congenital methemoglobinemia: a rare cause of cyanosis in the newborn — a case report. Pediatrics 2003; 112(2): e158–e161, https://doi.org/10.1542/peds.112.2.e158.
- Lee J., El-Abaddi N., Duke A., Cerussi A.E., Brenner M., Tromberg B.J. Noninvasive in vivo monitoring of methemoglobin formation and reduction with broadband diffuse optical spectroscopy. J Appl Physiol (1985) 2006; 100(2): 615–622, https://doi.org/10.1152/japplphysiol.00424.2004.
- Parvez M.A., Yashiro K., Tsunoi Y., Saitoh D., Sato S., Nishidate I. In vivo monitoring of hemoglobin derivatives in a rat thermal injury model using spectral diffuse reflectance imaging. Burns 2024; 50(1): 167–177, https://doi.org/10.1016/j.burns.2023.07.006.
- Wilson M.T., Reeder B.J. Myoglobin. In: Encyclopedia of respiratory medicine. Academic Press; 2006; p. 73–76, https://doi.org/10.1016/B0-12-370879-6/00250-7.
- Lin L., Yao J., Li L., Wang L.V. In vivo photoacoustic tomography of myoglobin oxygen saturation. J Biomed Opt 2016; 21(6): 61002, https://doi.org/10.1117/1.JBO.21.6.061002.
- Denzer M.L., Piao D., Pfeiffer M., Mafi G., Ramanathan R. Novel needle-probe single-fiber reflectance spectroscopy to quantify sub-surface myoglobin forms in beef psoas major steaks during retail display. Meat Sci 2024; 210: 109439, https://doi.org/10.1016/j.meatsci.2024.109439.
- Гемолитическая болезнь плода и новорожденного: диагностика, лечение, профилактика. Под ред. Володина Н.Н. M; 2021.
- Groenendaal F., van der Grond J., de Vries L.S. Cerebral metabolism in severe neonatal hyperbilirubinemia. Pediatrics 2004; 114(1): 291–294, https://doi.org/10.1542/peds.114.1.291.
- Rubaltelli F.F., Gourley G.R., Loskamp N., Modi N., Roth-Kleiner M., Sender A., Vert P. Transcutaneous bilirubin measurement: a multicenter evaluation of a new device. Pediatrics 2001; 107(6): 1264–1271, https://doi.org/10.1542/peds.107.6.1264.
- Gibson A.P., Hebden J.C., Arridge S.R. Recent advances in diffuse optical imaging. Phys Med Biol 2005; 50(4): R1–R43, https://doi.org/10.1088/0031-9155/50/4/r01.
- Bale G., Elwell C.E., Tachtsidis I. From Jöbsis to the present day: a review of clinical near-infrared spectroscopy measurements of cerebral cytochrome-c-oxidase. J Biomed Opt 2016; 21(9): 091307, https://doi.org/10.1117/1.JBO.21.9.091307.
- Michel H., Behr J., Harrenga A., Kannt A. Cytochrome c oxidase: structure and spectroscopy. Annu Rev Biophys Biomol Struct 1998; 27: 329–356, https://doi.org/10.1146/annurev.biophys.27.1.329.
- Tisdall M.M., Tachtsidis I., Leung T.S., Elwell C.E., Smith M. Increase in cerebral aerobic metabolism by normobaric hyperoxia after traumatic brain injury. J Neurosurg 2008; 109(3): 424–432, https://doi.org/10.3171/JNS/2008/109/9/0424.
- Shin’oka T., Nollert G., Shum-Tim D., du Plessis A., Jonas R.A. Utility of near-infrared spectroscopic measurements during deep hypothermic circulatory arrest. Ann Thorac Surg 2000; 69(2): 578–583, https://doi.org/10.1016/s0003-4975(99)01322-3.
- Yamada T., Takakura H., Jue T., Hashimoto T., Ishizawa R., Furuichi Y., Kato Y., Iwanaka N., Masuda K. Myoglobin and the regulation of mitochondrial respiratory chain complex IV. J Physiol 2016; 594(2): 483–495, https://doi.org/10.1113/JP270824.
- Arakaki L.S., Ciesielski W.A., Thackray B.D., Feigl E.O., Schenkman K.A. Simultaneous optical spectroscopic measurement of hemoglobin and myoglobin saturations and cytochrome aa3 oxidation in vivo. Appl Spectrosc 2010; 64(9): 973–979, https://doi.org/10.1366/000370210792434387.