Оценка эффективности воздействия «усиленных» естественных киллеров, нокаутных по генам CISH и B2M, на жизнеспособность и метаболический статус клеток 3D-сфероидов глиобластомы пациентов
Одним из альтернативных подходов к лечению глиобластомы выступает клеточная иммунотерапия на основе естественных, или натуральных, киллеров (NK-клеток). Для усиления их цитотоксического эффекта на опухолевые клетки с помощью генно-инженерных технологий создаются новые NK-клеточные линии.
Цель исследования — оценить эффективность влияния «усиленных» NK-клеток на ранние метаболические перестройки и жизнеспособность клеток глиобластомы пациента на модели опухолевых сфероидов.
Материалы и методы. В исследовании использованы первичная культура глиобластомы человека GBM7-Luc2-mKate2, библиотечная линия NK-клеток человека YT дикого типа (YTwt), а также созданные нами линии со сверхэкспрессией белка VAV1 и нокаутированные либо по гену CISH (YT–Vav1+CISH–/–), либо по гену B2M (YT–Vav1+B2M–/–). Опухолевые сфероиды формировали в круглодонных низкоадгезивных планшетах. Иммунные клетки добавляли к сфероидам в количестве 100 тыс. клеток на 1 сфероид, и на нескольких временны´х точках оценивали жизнеспособность сфероидов путем флуоресцентного окрашивания с использованием набора живые/мертвые клетки, а также проводили визуализацию автофлуоресценции метаболического кофермента никотинамидадениндинуклеотида (фосфата) — НАД(Ф)Н — в сфероидах с использованием лазерного сканирующего микроскопа LSM 880 (Carl Zeiss, Германия) с приставкой FLIM (Becker & Hickl GmbH, Германия).
Результаты. Установлено, что параметры затухания автофлуоресценции кофермента НАД(Ф)Н в клетках глиобластомы человека существенно изменяются при воздействии как YT–Vav1+CISH–/–, так и YT–Vav1+B2M–/–, что указывает на возникновение раннего метаболического сдвига в опухолевых клетках в сторону менее агрессивного окислительного фенотипа, и это согласуется с увеличением фракции погибших и снижением фракции живых клеток в составе сфероида.
Заключение. Полученные данные об усиленной цитотоксической активности новых модифицированных NK-клеточных линий в отношении сфероидов глиобластомы человека имеют важное значение для понимания механизмов взаимодействия опухолевых и иммунных клеток и развития адоптивной клеточной терапии глиобластомы.
Введение
Среди существующих подходов к лечению злокачественных опухолей одной из многообещающих стратегий является иммунотерапия, направленная на активацию иммунной системы против опухолевых клеток [1, 2]. Иммунотерапия уже доказала свою эффективность в отношении целого ряда онкологических заболеваний, и сейчас усилия ученых направлены на развитие персонализированных подходов и расширение спектра локализаций для ее применения. Особый интерес представляет разработка иммунотерапии глиобластом — наиболее агрессивной формы опухолей головного мозга. До сих пор это остается сложной задачей, что связано с наличием гематоэнцефалического барьера, а также иммуносупрессивного опухолевого микроокружения, которые затрудняют достижение положительного противоопухолевого ответа [3, 4].
Перспективным направлением клеточной противоопухолевой иммунотерапии считается использование естественных, или натуральных, киллеров (natural killer cells, NK-клеток). Эти клетки представляют собой компонент врожденного иммунитета и выполняют ключевую роль в распознавании и уничтожении клеток, инфицированных вирусами, а также опухолевых клеток. NK-клетки функционально подобны CD8+ Т-лимфоцитам, однако в отличие от них способны узнавать и воздействовать на патологические клетки без дополнительной сенсибилизации антигенами [5, 6].
Цитотоксическая активность NK-клеток находится под контролем ингибирующих и активирующих рецепторов на их поверхности. Как правило, цитотоксическая активность NK-клеток, проникающих в опухоль, низкая из-за влияния различных иммуносупрессирующих факторов и регуляторных Т-клеток. Для усиления противоопухолевой активности NK-клеток используются генно-инженерные технологии, а именно введение генетических конструкций для повышения экспрессии сигнальных белков, участвующих в активации клеток, и нокаут генов, связанных с инактивацией их цитотоксичности [7–9]. Предполагается, что комбинация таких модификаций NK-клеток может обеспечить наиболее выраженный цитотоксический эффект.
Ранее [10] нами были созданы две модифицированные клеточные линии с повышенной цитотоксичностью на основе NK-подобных клеток человека YT со сверхэкспрессией белка VAV1 и нокаутированных по генам CISH либо B2M. Белок VAV1 — член семейства факторов обмена гуаниновых нуклеотидов (guanine nucleotide exchange factors), одна из функций которого — позитивная регуляция опосредованной NK-клетками цитотоксичности [11]. Ген CISH кодирует цитокин-индуцируемый белок CIS, содержащий SH2-группу (cytokine-inducible SH2-containing protein). Продукт этого гена является негативным регулятором цитотоксичности NK-клеток, понижающим их чувствительность к интерлейкину 15 (IL-15) [12]. Ген B2M кодирует белок β2-микроглобулин — компонент легкой цепи главного комплекса гистосовместимости класса I (MHC I). Нокаут гена B2M приводит к нарушению структуры MHC I NK-клеток, благодаря чему эти клетки становятся незаметными для Т-лимфоцитов хозяина, тем самым открывая перспективы широкого применения аллогенных NK-клеток в клинике [13].
В нашем предыдущем исследовании [10] продемонстрировано, что модифицированные линии NK-клеток элиминируют клетки первичной глиобластомы в монослойной культуре эффективнее, нежели клетки дикого типа.
Цель исследования — оценить эффективность воздействия «усиленных» NK-клеток на ранние метаболические перестройки и жизнеспособность клеток глиобластомы пациента на трехмерной модели опухолевых сфероидов.
Опухолевые сфероиды представляют собой сферические многоклеточные агрегаты c гетерогенной структурой и таким образом выступают более сложной клеточной моделью, чем стандартная монослойная культура. За счет своей пространственной организации сфероид моделирует трехмерную архитектуру тканей с характерными межклеточными взаимодействиями и плотными контактами, градиентами кислорода и питательных веществ, различной пролиферативной, метаболической активностью и жизнеспособностью клеток. Сфероиды и им подобные многоклеточные структуры (например, экспланты, органоиды), полученные из материала опухоли пациентов, признаны адекватными моделями для доклинического тестирования и персонализированного подбора противоопухолевой терапии [14].
Традиционно ответ опухолевых клеток на терапию в in vitro системах оценивается по жизнеспособности клеток и их пролиферативной активности с использованием колориметрических методов, флуоресцентных красителей или иммуноцитохимии. В качестве перспективного метода анализа клеточного ответа на терапию рассматривается флуоресцентная времяразрешенная микроскопия (fluorescence lifetime imaging microscopy, FLIM) в режиме регистрации автофлуоресценции кофермента НАД(Ф)Н [15, 16]. Данный метод позволяет оценивать метаболический статус живых клеток без дополнительного окрашивания и деструкции, в динамике, с учетом межклеточной гетерогенности. В основе «метаболического» FLIM лежит анализ времени жизни (затухания) флуоресценции НАД(Ф)Н, которое отличается для различных форм кофермента — свободной и связанной с белками, нефосфорилированной и фосфорилированной. Метаболические перестройки, которые сопровождают снижение пролиферации или предшествуют гибели клеток после воздействия, неизбежно приводят к изменениям параметров затухания флуоресценции НАД(Ф)Н [17, 18].
Таким образом, исследование терапевтической эффективности «усиленных» NK-клеток на пациент-специфичных опухолевых сфероидах с оценкой раннего ответа методом FLIM представляет собой инновационный аспект изучения описанной проблемы.
Материалы и методы
Клеточные культуры. Для создания опухолевых сфероидов была использована полученная ранее первичная культура глиобластомы пациента GBM7-Luc2-mKate2 [19]. Для наращивания необходимого количества опухолевые клетки культивировали в питательной среде DMEM («ПанЭко», Россия) по отработанному нами ранее протоколу [20].
В работе использованы библиотечная линия NK-подобных клеток человека дикого типа (YTwt), любезно предоставленная А.В. Филатовым (лаборатория иммунохимии, Институт иммунологии, Москва), а также созданные нами на этой базе модифицированные линии со сверхэкспрессией белка VAV1 и нокаутированные либо по гену CISH (YT–Vav1+CISH–/–), либо по гену B2M (YT–Vav1+B2M–/–) [10].
Линии NK-подобных клеток YT культивировали в тех же условиях, что и опухолевые клетки, но с обязательным добавлением в питательную среду IL-2 (НПК «Биотех», Россия) и IL-15 (Sino Biological, Китай) в концентрации 1 мкл на 1 мл среды. При пассировании клетки центрифугировали 5 мин при 300 g, осадок ресуспендировали в питательной среде.
Получение опухолевых сфероидов. Опухолевые 3D-сфероиды получали путем высевания на 96-луночные низкоадгезивные круглодонные планшеты (Corning, США) в концентрации 2000 клеток на лунку в объеме 200 мкл питательной среды [20]. Морфологию сфероидов оценивали с использованием инвертированного микроскопа DM IL LED (Leica Microsystems, Германия).
На 4-й день роста сфероиды переносили с помощью дозатора на специальные планшеты с черными стенками и со стеклянным дном (Gibco, США) в количестве 1 сфероид на лунку в питательной среде DMEM без фенолового красного (Gibco, США) для проведения последующих анализов методами флуоресцентной микроскопии.
Клетки YTwt, YT–Vav1+CISH–/– либо YT–Vav1+B2M–/– добавляли к сфероидам в количестве 100 тыс. на 1 сфероид согласно предварительно разработанному протоколу [10].
Оценка жизнеспособности сфероидов путем флуоресцентного окрашивания. Для исследования механизмов гибели опухолевых клеток после инкубации с NK-клетками сфероиды окрашивали с использованием набора живые/мертвые клетки (live/dead assay) (ab 176750; Abcam, Великобритания). В соответствии с протоколом производителя выполняли окраску смесью растворов: Nuclear Green DCS1 — для некротических/поздних апоптотических клеток и CytoCalcein Violet 450 — для жизнеспособных клеток. Флуоресцентные изображения сфероидов получали на инвертированном микроскопе Leica DM IL LED (Leica Microsystems, Германия) с фильтрами YFP (Ex: BP 500/20, Em: BP 535/30) — для некротических/поздних апоптотических клеток и CFP (Ex: BP 436/20, Em: BP 480/40) — для жизнеспособных клеток. Окрашенную фракцию жизнеспособных и некротических/поздних апоптотических клеток в сфероиде рассчитывали в процентах с помощью программы ImageJ (National Institutes of Health, США).
Флуоресцентная микроскопия и FLIM. Исследования проводили на лазерном сканирующем конфокальном микроскопе LSM 880 (Carl Zeiss, Германия). В качестве источника возбуждения служил фемтосекундный Ti:Sa-лазер (Spectra Physics, США) с частотой следования импульсов 80 МГц и длительностью 120 фс с перестраиваемой длиной волны в диапазоне 690–1040 нм. Изображения были получены с использованием масляно-иммерсионного объектива 40×/1.3. Во время эксперимента сфероиды находились при температуре 37°С и 5% СО2. Возбуждение флуоресценции красного белка mKate2 в опухолевых клетках сфероидов осуществляли на длине волны 543 нм, сигнал принимали на длине волны 650 нм.
Детекцию времен жизни флуоресценции осуществляли с помощью FLIM-модуля, основанного на время-коррелированном счете единичных фотонов TCSPC (Becker & Hickl, Германия). Возбуждение флуоресценции кофермента НАД(Ф)Н выполняли в двухфотонном режиме на длине волны 750 нм, сигнал принимали в диапазоне длин волн 450–490 нм. Мощность возбуждающего излучения составляла 7 мВт. Количество фотонов в пикселе — не менее 5000, время сбора фотонов — около 60 с.
Параметры затухания флуоресценции оценивали в программе SPCImage (Becker & Hickl GmbH, Германия). Затухание аппроксимировали биэкспоненциальной функцией, используя метод наименьших квадратов, при этом достоверность аппроксимации хи-квадрат составляла от 0,8 до 1,2. Рассчитывали следующие параметры затухания:  1 — короткая компонента времени жизни,
1 — короткая компонента времени жизни,  2 — длинная компонента времени жизни, α1 — процентный вклад короткой компоненты, α2 — процентный вклад длинной компоненты,
2 — длинная компонента времени жизни, α1 — процентный вклад короткой компоненты, α2 — процентный вклад длинной компоненты,  m — средневзвешенное время жизни (
m — средневзвешенное время жизни ( m=α1∙
m=α1∙ 1+α2∙
1+α2∙ 2)/(α1+α2). Короткое время жизни флуоресценции НАД(Ф)Н
2)/(α1+α2). Короткое время жизни флуоресценции НАД(Ф)Н  1 (0,3–0,5 нс) соответствует его свободной форме, которая образуется в процессе гликолиза. Длинное время жизни флуоресценции НАД(Ф)Н
1 (0,3–0,5 нс) соответствует его свободной форме, которая образуется в процессе гликолиза. Длинное время жизни флуоресценции НАД(Ф)Н  2 (1,2–2,5 нс) соответствует его связанной с белками форме, вклад которой коррелирует с активностью митохондриального дыхания.
2 (1,2–2,5 нс) соответствует его связанной с белками форме, вклад которой коррелирует с активностью митохондриального дыхания.
Анализ проводили поклеточно в области цитоплазмы отдельных клеток сфероидов. Для каждого воздействия и контроля без воздействия были получены изображения 4–10 сфероидов. В каждом сфероиде было проанализировано по 15–20 клеток.
Статистический анализ. Для сравнительного анализа данных и их графического отображения применяли программное обеспечение GraphPad Prism 8.4.3 (GraphPad Software, США). Проверку данных на нормальность распределения проводили с использованием критерия Шапиро–Уилка (при p≥0,05 распределение считалось нормальным). Поскольку критерий Шапиро–Уилка выявил ненормальность распределения, для оценки статистически значимых отличий между исследуемыми группами применяли непараметрический критерий Манна–Уитни, при p≤0,05 различия считали статистически значимыми.
Результаты
Анализ жизнеспособности опухолевых сфероидов глиобластомы человека после воздействия «усиленными» NK-клетками
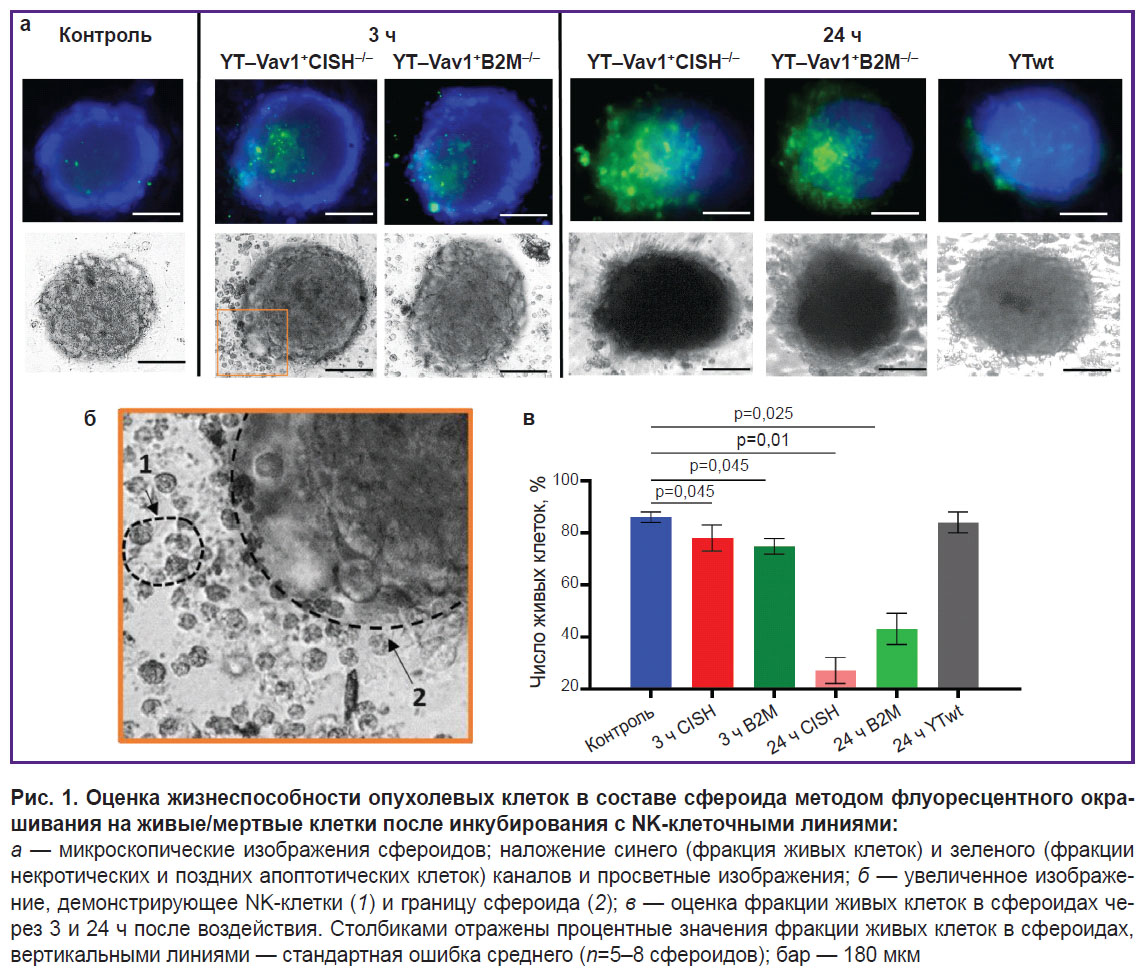
Оценку цитотоксичности «усиленных» NK-клеток в отношении опухолевых сфероидов глиобластомы человека проводили путем анализа морфологического состояния сфероидов по данным просветной микроскопии и флуоресцентного окрашивания с помощью набора живые/мертвые клетки через 3 и 24 ч после добавления иммунных клеток.
Сфероиды контрольной группы (без добавления иммунных клеток) имели шарообразную форму и плотную структуру с четкой и ровной границей. Они состояли в основном из фракции живых клеток (~86%). Некротические клетки составляли порядка ~14% и наблюдались только в центральной зоне сфероида (рис. 1).
Инкубация сфероидов с немодифицированной линией NK-клеток YTwt в течение 24 ч не приводила к видимым изменениям морфологии сфероида. Плотная структура сфероида сохранялась, на границе сфероидов наблюдалось небольшое количество открепившихся клеток. Фракция жизнеспособных клеток не отличалась от интактного контроля (~84%).
При инкубации с модифицированными линиями NK-клеток YT–Vav1+CISH–/– и YT–Vav1+B2M–/– сфероиды через 3 ч утрачивали компактную структуру, по краю наблюдалось открепление опухолевых клеток. Флуоресцентной микроскопией показано увеличение фракции погибших клеток в составе сфероида (~21% для YT–Vav1+CISH–/– и ~25% для YT–Vav1+B2M–/–) и соответственно снижение фракции живых клеток (~78% для YT–Vav1+CISH–/– и ~74% для YT–Vav1+B2M–/–; p=0,045 по сравнению с контролем). На изображениях световой микроскопии популяция NK-клеток видна в окружении опухолевого сфероида (и на границе с ним). NK-клетки имели типичную для них морфологию — округлые клетки с выраженной зернистой цитоплазмой.
Через 24 ч после начала воздействия сфероиды демонстрировали признаки разрушения. На границе сфероидов наблюдалось выраженное открепление клеток в местах контакта с иммунными клетками, сфероид становился более вытянутым и менее плотным в связи с потерей межклеточных контактов. Фракция погибших опухолевых клеток увеличивалась до ~71% в случае использования YT–Vav1+CISH–/– и до ~58% в случае YT–Vav1+B2M–/– (p=0,01 и p=0,025 соответственно по сравнению с контролем без воздействия).
Таким образом, оценка жизнеспособности сфероидов глиобластомы человека после воздействия модифицированными NK-клеточными линиями продемонстрировала усиленную цитотоксичность клеток YT–Vav1+CISH–/– и YT–Vav1+B2M–/– по сравнению со стандартной немодифицированной линией YTwt, что согласуется с экспериментами, проведенными на монослойной культуре глиобластомы человека ранее [10].
Оценка метаболического статуса клеток опухолевых сфероидов после воздействия «усиленными» NK-клетками методом FLIM-микроскопии
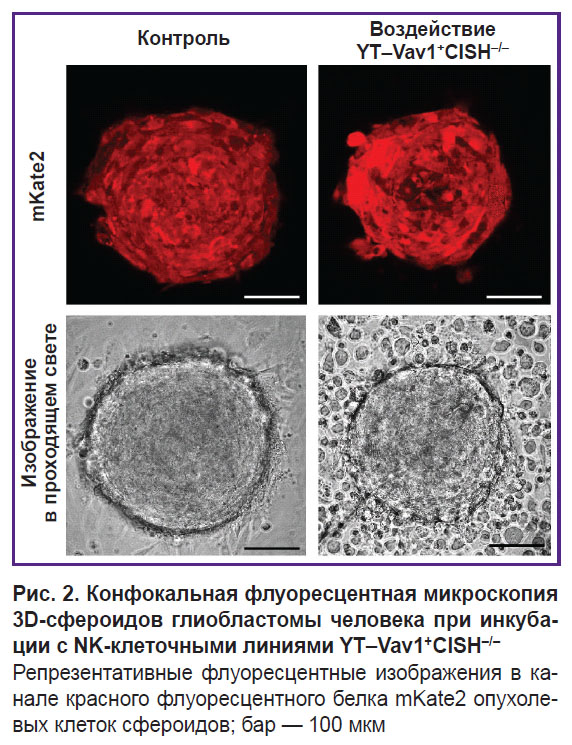
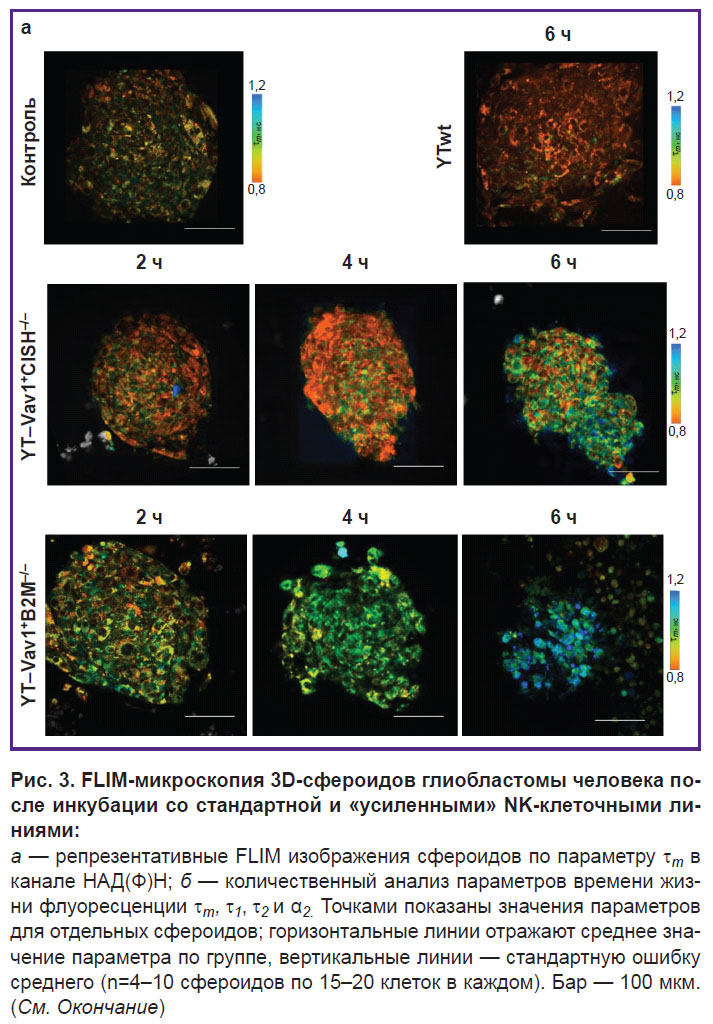
С использованием FLIM-микроскопии получены изображения автофлуоресценции кофермента НАД(Ф)Н в клетках сфероидов глиобластомы пациента и проанализированы параметры времени жизни. Для исследования влияния NK-клеток на метаболизм опухолевых клеток анализ проведен через 6 ч инкубации с линией «дикого» типа YTwt, а также через 2, 4 и 6 ч после добавления нокаутных линий YT–Vav1+CISH–/– или YT–Vav1+B2M–/–. Для идентификации опухолевых клеток в составе сфероида получены флуоресцентные конфокальные изображения сфероидов без добавления и с добавлением NK-клеточных линий в канале флуоресценции красного белка mKate2 (рис. 2).
Воздействие на опухолевые сфероиды клетками YTwt. В контроле (без воздействия на сфероиды иммунными клетками) отмечались типичные значения времени жизни флуоресценции НАД(Ф)Н: короткая компонента  1 ~0,33 нс, длинная компонента
1 ~0,33 нс, длинная компонента  2 ~2,1 нс, вклады короткой и длинной компонент α1 и α2 ~77 и 22% соответственно, среднее время жизни
2 ~2,1 нс, вклады короткой и длинной компонент α1 и α2 ~77 и 22% соответственно, среднее время жизни  m ~0,76 нс. После 6 ч инкубации с немодифицированными NK-клетками YTwt наблюдалось статистически значимое снижение параметра
m ~0,76 нс. После 6 ч инкубации с немодифицированными NK-клетками YTwt наблюдалось статистически значимое снижение параметра  m до 0,7±0,01 нс (p=0,008) за счет уменьшения относительного вклада связанной формы НАД(Ф)Н α2 до 20,9±0,2% (p=0,005) (рис. 3). Снижение вклада связанной формы НАД(Ф)Н может указывать на усиление гликолиза в опухолевых клетках, что в свою очередь ассоциируется с сохранением и усилением агрессивного фенотипа клеток глиобластомы, несмотря на терапевтическое воздействие.
m до 0,7±0,01 нс (p=0,008) за счет уменьшения относительного вклада связанной формы НАД(Ф)Н α2 до 20,9±0,2% (p=0,005) (рис. 3). Снижение вклада связанной формы НАД(Ф)Н может указывать на усиление гликолиза в опухолевых клетках, что в свою очередь ассоциируется с сохранением и усилением агрессивного фенотипа клеток глиобластомы, несмотря на терапевтическое воздействие.
Воздействие на опухолевые сфероиды NK-клетками YT–Vav1+CISH–/– и YT–Vav1+B2M–/–. В опухолевых сфероидах, на которые воздействовали нокаутными YT–Vav1+CISH–/– NK-клетками, были выявлены выраженные изменения всех параметров времени жизни. Уже через 2 ч инкубации увеличивались значения параметров  1 с 0,33±0,01 до 0,36±0,01 нс (p=0,019);
1 с 0,33±0,01 до 0,36±0,01 нс (p=0,019);  2 с 2,1±0,6 до 2,2±0,9 нс; α2 с 22,8±0,10 до 25,9±0,9%;
2 с 2,1±0,6 до 2,2±0,9 нс; α2 с 22,8±0,10 до 25,9±0,9%;  m с 0,76±0,02 до 0,83±0,20 нс (p=0,019). На 4-й час инкубирования значения
m с 0,76±0,02 до 0,83±0,20 нс (p=0,019). На 4-й час инкубирования значения  1 и
1 и  m сохранялись на том же уровне, изменения
m сохранялись на том же уровне, изменения  2 становились статистически значимыми (2,3±0,5 нс; p=0,021). На 6-й час значение
2 становились статистически значимыми (2,3±0,5 нс; p=0,021). На 6-й час значение  1 выросло до 0,37±0,10 нс (p=0,017),
1 выросло до 0,37±0,10 нс (p=0,017),  2 — до 2,5±0,9 нс (p=0,02), α2 — до 24,2±0,5%, за счет чего происходило возрастание и среднего времени жизни
2 — до 2,5±0,9 нс (p=0,02), α2 — до 24,2±0,5%, за счет чего происходило возрастание и среднего времени жизни  m — до 0,88±0,20 нс (p=0,001 по сравнению с контролем без воздействия).
m — до 0,88±0,20 нс (p=0,001 по сравнению с контролем без воздействия).
При инкубировании сфероидов глиобластомы человека с нокаутными NK-клетками YT–Vav1+B2M–/– также наблюдалось постепенное возрастание всех параметров времени жизни флуоресценции на протяжении 6 ч. Через 2 ч инкубирования значительные изменения претерпевал параметр α2, для которого наблюдалось статистически значимое возрастание значений с 22,8±0,1 до 25,8±0,4% (p=0,03), за счет чего увеличивалось среднее время жизни  m — с 0,76±0,02 до 0,82±0,04 нс (p=0,024). На 4-й час воздействия обнаружено статистически значимое увеличение
m — с 0,76±0,02 до 0,82±0,04 нс (p=0,024). На 4-й час воздействия обнаружено статистически значимое увеличение  1 — с 0,33±0,01 до 0,36±0,03 нс (p=0,014) по сравнению с контрольными сфероидами. Через 6 ч инкубации сфероидов с иммунными клетками все параметры времени жизни демонстрировали более высокие значения по сравнению с интактным контролем, что отразилось в наиболее высоких значениях
1 — с 0,33±0,01 до 0,36±0,03 нс (p=0,014) по сравнению с контрольными сфероидами. Через 6 ч инкубации сфероидов с иммунными клетками все параметры времени жизни демонстрировали более высокие значения по сравнению с интактным контролем, что отразилось в наиболее высоких значениях  m — 1,02±0,06 нс (p=0,004). Следует отметить, что при воздействии клетками YT–Vav1+B2M–/– разброс значений внутри групп сфероидов на каждую временную точку был ниже, чем при воздействии клетками YT–Vav1+CISH–/–; это свидетельствует о большей воспроизводимости и стабильности метаболических нарушений.
m — 1,02±0,06 нс (p=0,004). Следует отметить, что при воздействии клетками YT–Vav1+B2M–/– разброс значений внутри групп сфероидов на каждую временную точку был ниже, чем при воздействии клетками YT–Vav1+CISH–/–; это свидетельствует о большей воспроизводимости и стабильности метаболических нарушений.
Таким образом, воздействие модифицированными NK-клетками на сфероиды глиобластомы человека оказывает выраженный цитотоксический эффект, который сопровождается метаболическими перестройками на клеточном уровне, регистрируемыми с помощью метода FLIM кофермента НАД(Ф)Н.
Обсуждение
Иммунотерапия демонстрирует высокий потенциал в качестве метода лечения глиобластомы. Активно развивается адоптивная клеточная терапия, которая заключается в получении иммунных клеток от пациента, культивировании их in vitro для увеличения количества, дальнейшей модификации и во введении в организм для борьбы с опухолью. В качестве противоопухолевого агента для адоптивной клеточной терапии перспективно выглядят NK-клетки благодаря их способности распознавать и уничтожать злокачественные клетки без антигенспецифической активации. Однако, несмотря на высокий терапевтический потенциал, эффективность нативных NK-клеток низка в связи с иммунносупрессивным микроокружением опухолей, поэтому сейчас активно разрабатываются методики «усиления» цитотоксичности NK-клеток для преодоления механизмов уклонения от иммунного надзора. Для этого применяются различные технологии клеточной трансформации, например создание химерного антигенного рецептора или нокаутирование конкретных генов, ответственных за снижение цитотоксичности NK-клеток [21]. На данный момент в доклинических исследованиях продемонстрирована высокая эффективность NK-терапии «усиленными» клетками для различных видов онкологических заболеваний, включая лейкемию, лимфому, миелому, рак яичников [22]. В то же время лечение NK-клетками солидных опухолей, в частности глиобластомы [23], вызывает определенные трудности, поэтому создание новых эффективных линий NK-клеток и изучение их цитотоксичности остается актуальным направлением исследований.
Наиболее широко используемым цитокином для терапии NK-клетками в клинических исследованиях является IL-15. При этом рецептор IL-15 экспрессируется как на NK-клетках, так и на CD8+ T-клетках, но, что важно, не на регуляторных T-клетках [24]. Последнее обеспечивает ключевое преимущество их применения по сравнению с терапией на основе IL-2 [25]. В печати появляется все больше данных о том, что экзогенное введение IL-15 предотвращает потерю эффекторных функций NK-клеток в микроокружении опухоли.
Однако непрерывное лечение человеческими NK-клетками с помощью IL-15 может вызвать истощение этих клеток, поэтому необходимо тщательно продумывать как схему лечения, так и способ введения, чтобы достичь максимальной пользы для пациентов [26].
Ранее [10] нам удалось получить нокаутные линии по гену CISH, позволившие повысить цитотоксичность NK-клеток без добавления в культуру экзогенного IL-15. Эксперименты показали, что NK-клетки с нокаутом по гену CISH более эффективно воздействовали на монослой культуры первичной глиобластомы человека.
Кроме того, методом метаболического флуоресцентного времяразрешенного имиджинга получены ценные данные по особенностям опухолевого метаболизма на модели 3D-сфероидов глиобластомы человека [20]. Объединение результатов дало возможность оценить эффективность модифицированных NK-клеточных линий YT–Vav1+CISH–/– и YT–Vav1+B2M–/– в условиях, приближенных к развитию опухолевых процессов в организме человека.
В настоящей работе проведена оценка противоопухолевой активности модифицированных NK-клеточных линий YT–Vav1+CISH–/– и YT–Vav1+B2M–/– на модели 3D-опухолевых сфероидов глиобластомы пациента. Фокус работы был направлен на исследование ранних метаболических перестроек в опухолевых клетках при NK-терапии оптическим методом FLIM. На данный момент метаболические аспекты NK-терапии в целом изучены слабо. Преимущество FLIM по сравнению с биохимическими, иммуноцитохимическими и молекулярно-генетическими методами оценки клеточного метаболического статуса состоит в возможности динамических наблюдений за живыми клетками с (суб)клеточным разрешением.
Установлено, что все параметры затухания автофлуоресценции кофермента НАД(Ф)Н в клетках глиобластомы человека при воздействии модифицированными NK-клетками YT–Vav1+CISH–/– и YT–Vav1+B2M–/– существенно меняются; это указывает на перестройку метаболического статуса опухолевых клеток и согласуется с данными об увеличении фракции погибших и снижении фракции живых клеток в составе сфероида и, соответственно, об эффективном ответе на терапевтическое воздействие. В типичном случае рост вклада связанной формы НАД(Ф)Н α2 в клетках ассоциирован с усилением митохондриального дыхания. В одном из наших исследований [20] методом FLIM мы показали, что относительные вклады α1 и α2 НАД(Ф)Н адекватно отражают метаболические перестройки в сфероидах первичной глиобластомы пациентов в ответ на снижение содержания кислорода в их микроокружении. В исследовании [18] мы обнаружили сильную корреляцию между НАД(Ф)Н α2 и выживаемостью, а также пролиферативной активностью опухолевых клеток, выделенных из глиом различных пациентов при химиотерапии темозоломидом. Увеличение вклада НАД(Ф)Н α2 в опухолевых клетках в результате переключения на более окислительный метаболизм является характерной реакцией на различные виды цитотоксической химиотерапии, что было показано in vitro и in vivo в многочисленных работах нашей группы и исследованиях других лабораторий [27–31].
Помимо изменений относительного вклада связанной формы НАД(Ф)Н α2 воздействие NK-клетками на опухолевые клетки также вызывало увеличение абсолютных значений времен жизни флуоресценции, свободной и связанной с белком форм НАД(Ф)Н, —  1 и
1 и  2. Хотя время затухания флуоресценции различных флуорофоров подвержено воздействию разных факторов, таких как рН, температура, вязкость локального микроокружения, в случае НАД(Ф)Н влияние этих факторов в диапазоне физиологических значений несущественно. Недавнее исследование A. Song и соавт. [32] показало, что время жизни свободной формы НАД(Ф)Н
2. Хотя время затухания флуоресценции различных флуорофоров подвержено воздействию разных факторов, таких как рН, температура, вязкость локального микроокружения, в случае НАД(Ф)Н влияние этих факторов в диапазоне физиологических значений несущественно. Недавнее исследование A. Song и соавт. [32] показало, что время жизни свободной формы НАД(Ф)Н  1 зависит от размера общего пула окисленной (НАД+) и восстановленной (НАДН) форм кофермента:
1 зависит от размера общего пула окисленной (НАД+) и восстановленной (НАДН) форм кофермента:  1 увеличивается при снижении пула и снижается при увеличении. Время жизни связанной с ферментом формы НАД(Ф)Н
1 увеличивается при снижении пула и снижается при увеличении. Время жизни связанной с ферментом формы НАД(Ф)Н  2 зависит от конкретного фермента в том или ином метаболическом пути [33].
2 зависит от конкретного фермента в том или ином метаболическом пути [33].
Активность многих ключевых ферментов метаболических путей глюкозы, включая НАД(Ф)Н-связывающие белки, изменяется при развитии глиобластомы [34]. Недавние работы с использованием метода FLIM указывают на взаимосвязь НАД(Ф)Н  2 и митохондриальной активности клеток. C.S. Morrow с соавт. [35] продемонстрировали, что НАД(Ф)Н
2 и митохондриальной активности клеток. C.S. Morrow с соавт. [35] продемонстрировали, что НАД(Ф)Н  2 значительно увеличивается в процессе старения клеток. В работе T. Sanchez и соавт. [36] установлено выраженное снижение
2 значительно увеличивается в процессе старения клеток. В работе T. Sanchez и соавт. [36] установлено выраженное снижение  1 и
1 и  2 при тяжелой митохондриальной дисфункции. Показано, что повышенная митохондриальная активность является одним из признаков окислительного фенотипа опухоли. Это позволяет предположить, что рост НАД(Ф)Н
2 при тяжелой митохондриальной дисфункции. Показано, что повышенная митохондриальная активность является одним из признаков окислительного фенотипа опухоли. Это позволяет предположить, что рост НАД(Ф)Н  2 при воздействии «усиленными» NK-клетками также ассоциирован с метаболическим сдвигом в сторону окислительного фосфорилирования. Полученные данные согласуются с нашим предыдущим исследованием [18] по воздействию темозоломида на клетки глиобластомы пациентов, где мы также наблюдали рост
2 при воздействии «усиленными» NK-клетками также ассоциирован с метаболическим сдвигом в сторону окислительного фосфорилирования. Полученные данные согласуются с нашим предыдущим исследованием [18] по воздействию темозоломида на клетки глиобластомы пациентов, где мы также наблюдали рост  1 и
1 и  2 НАД(Ф)Н при терапевтическом воздействии.
2 НАД(Ф)Н при терапевтическом воздействии.
Метаболическое перепрограммирование, а именно активация гликолиза, является важной биологической особенностью глиобластомы. Активно протекающий аэробный гликолиз используется не только для ускоренной продукции молекул АТФ, но также для синтеза метаболических интермедиатов, необходимых для поддержания быстрого роста и пролиферации глиобластомы. Перепрограммирование клеточного метаболизма тесно связано с изменениями в сигнальных путях, в частности PI3K-Akt-mTOR, активация которого в клетках глиобластомы усиливает поглощение клетками молекул глюкозы, а также изменяет активность некоторых ферментов, вовлеченных в гликолиз, для удовлетворения повышенных потребностей клетки в энергии [33]. Сдвиг метаболического баланса опухолевых клеток в сторону окислительного фосфорилирования в результате лечения рассматривается как благоприятный фактор и ассоциирован с переходом к менее агрессивному фенотипу. При окислительном статусе опухоли наблюдаются усиление потребления кислорода, благодаря чему опухоль становится более уязвимой к условиям гипоксии; снижение продукции лактата, что делает микроокружение опухоли более благоприятным для действия эффекторных Т-клеток и натуральных киллеров; усиление митохондриальной активности; а также ослабление биосинтеза нуклеотидов и липидов и снижение пролиферативной активности опухолевых клеток [37].
Важно отметить, что библиотечная линия NK-клеток дикого типа YTwt в отличие от модифицированных линий не продемонстрировала выраженного цитотоксического влияния на клетки глиобластомы. При этом данные FLIM выявили снижение значения НАД(Ф)Н α2, ассоциированное скорее всего с усилением гликолиза и более агрессивным фенотипом. Одной из возможных причин низкой цитотоксической активности немодифицированных NK-клеток, установленной в нашем исследовании, может быть короткое время сокультивирования. Так, в работе M.A. Heinrich и соавт. [38] показано разрушение сфероидов библиотечной линии глиобластомы человека U87MG лишь спустя 5 дней и более инкубации с NK-клетками.
Таким образом, новые модифицированные NK-клеточные линии YT–Vav1+CISH–/– и YT–Vav1+B2M–/– демонстрируют большую цитотоксическую активность в отношении сфероидов первичной глиобластомы пациентов по сравнению со стандартной линией, вызывая ранние метаболические перестройки и выраженное снижение жизнеспособности опухолевых клеток.
Заключение
Проведенная оценка эффективности новых модифицированных NK-клеточных линий Vav1+CISH–/– и YT–Vav1+B2M–/– на модели опухолевых 3D-сфероидов глиобластомы человека путем анализа жизнеспособности клеток глиобластомы с помощью флуоресцентного окрашивания, а также анализа их метаболического статуса с помощью инновационного метода FLIM продемонстрировала высокую цитотоксическую активность «усиленных» NK-клеточных линий по сравнению с немодифицированной стандартной линией. Показаны ранние (через 2 ч) метаболические перестройки в клетках глиобластомы в сторону окислительного статуса под действием новых модифицированных линий, предшествующие клеточной гибели. Полученные результаты имеют важное значение для понимания механизмов взаимодействия клеток глиобластомы с NK-клетками и развития адоптивной клеточной терапии глиобластомы.
Финансирование исследования. Работа проведена при поддержке гранта Российского научного фонда №22-64-00057.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Lim M., Xia Y., Bettegowda C., Weller M. Current state of immunotherapy for glioblastoma. Nat Rev Clin Oncol 2018; 15(7): 422–442, https://doi.org/10.1038/s41571-018-0003-5.
- Mahmoud A.B., Ajina R., Aref S., Darwish M., Alsayb M., Taher M., AlSharif S.A., Hashem A.M., Alkayyal A.A. Advances in immunotherapy for glioblastoma multiforme. Front Immunol 2022; 13: 944452, https://doi.org/10.3389/fimmu.2022.944452.
- Liu Y., Zhou F., Ali H., Lathia J.D., Chen P. Immunotherapy for glioblastoma: current state, challenges, and future perspectives. Cell Mol Immunol 2024; 21(12): 1354–1375, https://doi.org/10.1038/s41423-024-01226-x.
- Mamessier E., Sylvain A., Thibult M.L., Houvenaeghel G., Jacquemier J., Castellano R., Gonçalves A., André P., Romagné F., Thibault G., Viens P., Birnbaum D., Bertucci F., Moretta A., Olive D. Human breast cancer cells enhance self tolerance by promoting evasion from NK cell antitumor immunity. J Clin Invest 2011; 121(9): 3609–3622, https://doi.org/10.1172/JCI45816.
- Suen W.C., Lee W.Y., Leung K.T., Pan X.H., Li G. Natural killer cell-based cancer immunotherapy: a review on 10 years completed clinical trials. Cancer Invest 2018; 36(8): 431–457, https://doi.org/10.1080/07357907.2018.1515315.
- Cooksey L.C., Friesen D.C., Mangan E.D., Mathew P.A. Prospective molecular targets for natural killer cell immunotherapy against glioblastoma multiforme. Cells 2024; 13(18): 1567, https://doi.org/10.3390/cells13181567.
- Bryceson Y.T., Chiang S.C., Darmanin S., Fauriat C., Schlums H., Theorell J., Wood S.M. Molecular mechanisms of natural killer cell activation. J Innate Immun 2011; 3(3): 216–226, https://doi.org/10.1159/000325265.
- da Silva L.H.R., Catharino L.C.C., da Silva V.J., Evangelista G.C.M., Barbuto J.A.M. The war is on: the immune system against glioblastoma-how can NK cells drive this battle? Biomedicines 2022; 10(2): 400, https://doi.org/10.3390/biomedicines10020400.
- Malmberg K.J., Carlsten M., Björklund A., Sohlberg E., Bryceson Y.T., Ljunggren H.G. Natural killer cell-mediated immunosurveillance of human cancer. Semin Immunol 2017; 31: 20–29, https://doi.org/10.1016/j.smim.2017.08.002.
- Yusubalieva G.M., Dashinimaev E.B., Gorchakov A.A., Kulemzin S.V., Brovkina O.A., Kalinkin A.A., Vinokurov A.G., Shirmanova M.V., Baklaushev V.P. Enhanced natural killers with CISH and B2M gene knockouts reveal increased cytotoxicity in glioblastoma primary cultures. Mol Biol 2022; 56: 770–779, https://doi.org/10.1134/S0026893322050156.
- Chan G., Hanke T., Fischer K.D. Vav-1 regulates NK T cell development and NK cell cytotoxicity. Eur J Immunol 2001; 31(8): 2403–2410, https://doi.org/10.1002/1521-4141(200108)31:8 2403::aid-immu24033.0.co;2-o.
- Delconte R.B., Kolesnik T.B., Dagley L.F., Rautela J., Shi W., Putz E.M., Stannard K., Zhang J.G., Teh C., Firth M., Ushiki T., Andoniou C.E., Degli-Esposti M.A., Sharp P.P., Sanvitale C.E., Infusini G., Liau N.P., Linossi E.M., Burns C.J., Carotta S., Gray D.H., Seillet C., Hutchinson D.S., Belz G.T., Webb A.I., Alexander W.S., Li S.S., Bullock A.N., Babon J.J., Smyth M.J., Nicholson S.E., Huntington N.D. CIS is a potent checkpoint in NK cell-mediated tumor immunity. Nat Immunol 2016; 17(7): 816–824, https://doi.org/10.1038/ni.3470.
- Höglund P., Glas R., Ménard C., Kåse A., Johansson M.H., Franksson L., Lemmonier F., Kärre K. Beta2-microglobulin-deficient NK cells show increased sensitivity to MHC class I-mediated inhibition, but self tolerance does not depend upon target cell expression of H-2Kb and Db heavy chains. Eur J Immunol 1998; 28(1): 370–378, https://doi.org/10.1002/(SICI)1521-4141(199801)28:01%3C370::AID-IMMU370%3E3.0.CO;2-W.
- Mitrakas A.G., Tsolou A., Didaskalou S., Karkaletsou L., Efstathiou C., Eftalitsidis E., Marmanis K., Koffa M. Applications and advances of multicellular tumor spheroids: challenges in their development and analysis. Int J Mol Sci 2023; 24(8): 6949, https://doi.org/10.3390/ijms24086949.
- Щеславский В.И., Ширманова М.В., Ельцов A., Беккер В. Люминесцентная микроскопия на основе многопараметрического время-коррелированного счета фотонов. Успехи биологической химии 2019; 59: 103–138.
- Multimodal optical diagnostics of cancer. Tuchin V.V., Popp J., Zakharov V. (editors). Cham: Springer International Publishing; 2020.
- Druzhkova I., Komarova A., Nikonova E., Baigildin V., Mozherov A., Shakirova Y., Lisitsa U., Shcheslavskiy V., Ignatova N., Shirshin E., Shirmanova M., Tunik S. Monitoring the intracellular pH and metabolic state of cancer cells in response to chemotherapy using a combination of phosphorescence lifetime imaging microscopy and fluorescence lifetime imaging microscopy. Int J Mol Sci 2023; 25(1): 49, https://doi.org/10.3390/ijms25010049.
- Yuzhakova D.V., Sachkova D.A., Shirmanova M.V., Mozherov A.M., Izosimova A.V., Zolotova A.S., Yashin K.S. Measurement of patient-derived glioblastoma cell response to temozolomide using fluorescence lifetime imaging of NAD(P)H. Pharmaceuticals (Basel) 2023; 16(6): 796, https://doi.org/10.3390/ph16060796.
- Yuzhakova D., Kiseleva E., Shirmanova M., Shcheslavskiy V., Sachkova D., Snopova L., Bederina E., Lukina M., Dudenkova V., Yusubalieva G., Belovezhets T., Matvienko D., Baklaushev V. Highly invasive fluorescent/bioluminescent patient-derived orthotopic model of glioblastoma in mice. Front Oncol 2022; 12: 897839, https://doi.org/10.3389/fonc.2022.897839.
- Yuzhakova D.V., Lukina M.M., Sachkova D.A., Yusubalieva G.M., Baklaushev V.P., Mozherov A.M., Dudenkova V.V., Gavrina A.I., Yashin K.S., Shirmanova M.V. Development of a 3D tumor spheroid model from the patient’s glioblastoma cells and its study by metabolic fluorescence lifetime imaging. Sovremennye tehnologii v medicine 2023; 15(2): 28–38, https://doi.org/10.17691/stm2023.15.2.03.
- Tao J.H., Zhang J., Li H.S., Zhou Y., Guan C.X. Nature killer cell for solid tumors: current obstacles and prospective remedies in NK cell therapy and beyond. Crit Rev Oncol Hematol 2025; 205: 104553, https://doi.org/10.1016/j.critrevonc.2024.104553.
- Chu J., Gao F., Yan M., Zhao S., Yan Z., Shi B., Liu Y. Natural killer cells: a promising immunotherapy for cancer. J Transl Med 2022; 20(1): 240, https://doi.org/10.1186/s12967-022-03437-0
- Feldman L., Brown C., Badie B. Chimeric antigen receptor (CAR) T cell therapy for glioblastoma. Neuromolecular Med 2022; 24(1): 35–40, https://doi.org/10.1007/s12017-021-08689-5.
- Rautela J., Huntington N.D. IL-15 signaling in NK cell cancer immunotherapy. Curr Opin Immunol 2017; 44: 1–6, https://doi.org/10.1016/j.coi.2016.10.004.
- Ahmadzadeh M., Rosenberg S.A. IL-2 administration increases CD4+ CD25(hi) Foxp3+ regulatory T cells in cancer patients. Blood 2006; 107(6): 2409–2414, https://doi.org/10.1182/blood-2005-06-2399.
- Felices M., Lenvik A.J., McElmurry R., Chu S., Hinderlie P., Bendzick L., Geller M.A., Tolar J., Blazar B.R., Miller J.S. Continuous treatment with IL-15 exhausts human NK cells via a metabolic defect. JCI Insight 2018; 3(3): e96219, https://doi.org/10.1172/jci.insight.96219.
- Lukina M.M., Dudenkova V.V., Shimolina L.E., Snopova L.B., Zagaynova E.V., Shirmanova M.V. In vivo metabolic and SHG imaging for monitoring of tumor response to chemotherapy. Cytometry A 2019; 95(1): 47–55, https://doi.org/10.1002/cyto.a.23607.
- Lukina M.M., Dudenkova V.V., Ignatova N.I., Druzhkova I.N., Shimolina L.E., Zagaynova E.V., Shirmanova M.V. Metabolic cofactors NAD(P)H and FAD as potential indicators of cancer cell response to chemotherapy with paclitaxel. Biochim Biophys Acta Gen Subj 2018; 1862(8): 1693–1700, https://doi.org/10.1016/j.bbagen.2018.04.021.
- Shirmanova M.V., Druzhkova I.N., Lukina M.M., Dudenkova V.V., Ignatova N.I., Snopova L.B., Shcheslavskiy V.I., Belousov V.V., Zagaynova E.V. Chemotherapy with cisplatin: insights into intracellular pH and metabolic landscape of cancer cells in vitro and in vivo. Sci Rep 2017; 7(1): 8911, https://doi.org/10.1038/s41598-017-09426-4.
- Shah A.T., Demory Beckler M., Walsh A.J., Jones W.P., Pohlmann P.R., Skala M.C. Optical metabolic imaging of treatment response in human head and neck squamous cell carcinoma. PLoS One 2014; 9(3): e90746, https://doi.org/10.1371/journal.pone.0090746.
- Alam S.R., Wallrabe H., Svindrych Z., Chaudhary A.K., Christopher K.G., Chandra D., Periasamy A. Investigation of mitochondrial metabolic response to doxorubicin in prostate cancer cells: an NADH, FAD and tryptophan FLIM assay. Sci Rep 2017; 7(1): 10451, https://doi.org/10.1038/s41598-017-10856-3.
- Song A., Zhao N., Hilpert D.C., Perry C., Baur J.A., Wallace D.C., Schaefer P.M. Visualizing subcellular changes in the NAD(H) pool size versus redox state using fluorescence lifetime imaging microscopy of NADH. Commun Biol 2024; 7(1): 428, https://doi.org/10.1038/s42003-024-06123-7.
- Zhao J., Ma X., Gao P., Han X., Zhao P., Xie F., Liu M. Advancing glioblastoma treatment by targeting metabolism. Neoplasia 2024; 51: 100985, https://doi.org/10.1016/j.neo.2024.100985.
- Principles of fluorescence spectroscopy. Lakowicz J.R. (editor). Boston: Springer US; 2006.
- Morrow C.S., Yao P., Vergani-Junior C.A., Anekal P.V., Llopis P.M., Miller J.W., Benayoun B.A., Mair W.B. Endogenous mitochondrial NAD(P)H fluorescence can predict lifespan. Commun Biol 2024; 7: 1551, https://doi.org/10.1038/s42003-024-07243-w.
- Sanchez T., Wang T., Pedro M.V., Zhang M., Esencan E., Sakkas D., Needleman D., Seli E. Metabolic imaging with the use of fluorescence lifetime imaging microscopy (FLIM) accurately detects mitochondrial dysfunction in mouse oocytes. Fertil Steril 2018; 110(7): 1387–1397, https://doi.org/10.1016/j.fertnstert.2018.07.022.
- Yang J., Shay C., Saba N.F., Teng Y. Cancer metabolism and carcinogenesis. Exp Hematol Oncol 2024; 13(1): 10, https://doi.org/10.1186/s40164-024-00482-x.
- Heinrich M.A., Huynh N.T., Heinrich L., Prakash J. Understanding glioblastoma stromal barriers against NK cell attack using tri-culture 3D spheroid model. Heliyon 2024; 10(3): e24808, https://doi.org/10.1016/j.heliyon.2024.e24808.