Выбор оптимальной методики для получения различных форм биосовместимых ксенодермальных материалов
Цель исследования — подбор оптимальной методики создания хирургических биоматериалов на основе дермы свиньи и оценка их биологической безопасности.
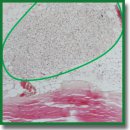
Материалы и методы. Для создания ксенодермальных биоматериалов использованы образцы нативной кожи поросенка породы Ландрас возрастом 4 мес. Обработку дермы проводили солевым (протокол №1), перекисно-щелочным (протокол №2) и щелочным (протокол №3) растворами. Полученные образцы окрашивали гематоксилином и эозином, а также флуоресцентным красителем DAPI, проводили количественный анализ ДНК и оценивали цитотоксичность методом LIVE/DEAD. Подкожную имплантацию/инъекцию образцов биоматериалов выполняли лабораторным животным — самцам крыс породы Wistar (n=30) возрастом 6 мес, массой тела 260±20 г — с эксплантацией на 14-е сутки эксперимента. Гистологические срезы окрашивали гематоксилином и эозином. Компьютерную морфометрию проводили с помощью программы GraphPad Prism v. 6.04.
Результаты. Полученные по трем протоколам образцы хирургических материалов обладали различными физическими характеристиками: после обработки по протоколу №1 дерма приобретала плотную структуру и белый цвет; по протоколу №2 — прозрачную и плотную структуру; по протоколу №3 — прозрачную гелеобразную структуру. Результаты гистологического анализа показали оксифильность и потерю структуры внеклеточного матрикса всех образцов, а окрашивание DAPI — разрушение клеточных ядер. Тем не менее количество ДНК в образцах, обработанных по протоколу №1, не соответствовало признанному критерию качества децеллюляризации (50 нг на 1 мг сухого веса). На основании этого дальнейшая оценка цитотоксичности in vitro и in vivo проводилась только для образцов, полученных по протоколам №2 и №3. По результатам анализа LIVE/DEAD оба образца не обладали токсичностью по отношению к клеткам. На 14-е сутки после подкожной имплантации образцов у животных не обнаруживалось признаков нагноения и иммунного отторжения.
Заключение. Для получения хирургических материалов в форме биопластических покрытий рекомендуется использовать щелочно-перекисную обработку дермы, а для получения гидрогелевых покрытий — щелочной гидролиз.
- Brocke T., Barr J. The history of wound healing. Surg Clin North Am 2020; 100(4): 787–806, https://doi.org/10.1016/j.suc.2020.04.004.
- Ушмаров Д.И., Гуменюк С.Е., Гуменюк А.С., Гайворонская Т.В., Караблина С.Я., Поморцев А.В., Сотниченко А.С., Мелконян К.И., Григорьев Т.Е. Сравнительная оценка многофункциональных раневых покрытий на основе хитозана: многоэтапное рандомизированное контролируемое экспериментальное исследование. Кубанский научный медицинский вестник 2021; 28(3): 78–96, https://doi.org/10.25207/1608-6228-2021-28-3-78-96.
- Chattopadhyay S., Raines R.T. Collagen-based biomaterials for wound healing. Biopolymers 2014; 101(8): 821–833, https://doi.org/10.1002/bip.22486.
- Choi J.S., Oh S.H., Kim Y.M., Lim J.Y. Hyaluronic acid/alginate hydrogel containing hepatocyte growth factor and promotion of vocal fold wound healing. Tissue Eng Regen Med 2020; 17(5): 651–658, https://doi.org/10.1007/s13770-020-00280-6.
- Li R., Xu J., Rao Z., Deng R., Xu Y., Qiu S., Long H., Zhu Q., Liu X., Bai Y., Quan D. Facilitate angiogenesis and neurogenesis by growth factors integrated decellularized matrix hydrogel. Tissue Eng Part A 2021; 27(11–12): 771–787, https://doi.org/10.1089/ten.tea.2020.0227.
- Кузнецова Т.А., Беседнова Н.Н., Усов В.В., Андрюков Б.Г. Биосовместимые и биодеградируемые раневые покрытия на основе полисахаридов из морских водорослей (обзор литературы). Вестник хирургии имени И.И. Грекова 2020; 179(4): 109–115, https://doi.org/10.24884/0042-4625-2020-179-4-109-115.
- Шехтер А.Б., Гуллер А.Е., Истранов Л.П., Истранова Е.В., Бутнару Д.В., Винаров А.З., Захаркина О.Л., Курков А.В., Кантимеров Д.Ф., Антонов Е.Н., Марисов Л.В., Глыбочко П.В. Морфология коллагеновых матриксов для тканевой инженерии (биосовместимость, биодеградация, тканевая реакция). Архив патологии 2015; 77(6): 29–38, https://doi.org/10.17116/patol201577629-38.
- Hussey G.S., Dziki J.L., Badylak S.F. Extracellular matrix-based materials for regenerative medicine. Nat Rev Mater 2018; 3(7): 159–173, https://doi.org/10.1038/s41578-018-0023-x.
- Keane T.J., Badylak S.F. The host response to allogeneic and xenogeneic biological scaffold materials. J Tissue Eng Regen Med 2015; 9(5): 504–511, https://doi.org/10.1002/term.1874.
- Ivanov A.N., Saveleva M.S., Kozadaev M.N., Matveeva O.V., Salkovskiy Yu.E., Lyubun G.P., Gorin D.A., Norkin I.A. New approaches to scaffold biocompatibility assessment. BioNanoScience 2019; 9(2): 395–405, https://doi.org/10.1007/s12668-019-00613-3.
- Terzini M., Bignardi C., Castagnoli C., Cambieri I., Zanetti E.M., Audenino A.L. Ex vivo dermis mechanical behavior in relation to decellularization treatment length. Open Biomed Eng J 2016; 10: 34–42, https://doi.org/10.2174/1874120701610010034.
- Saghizadeh M., Winkler M.A., Kramerov A.A., Hemmati D.M., Ghiam C.A., Dimitrijevich S.D., Sareen D., Ornelas L., Ghiasi H., Brunken W.J., Maguen E., Rabinowitz Y.S., Svendsen C.N., Jirsova K., Ljubimov A.V. A simple alkaline method for decellularizing human amniotic membrane for cell culture. PloS One 2013; 8(11): e79632, https://doi.org/10.1371/journal.pone.0079632.
- Rieder E., Steinacher-Nigisch A., Weigel G. Human immune-cell response towards diverse xenogeneic and allogeneic decellularized biomaterials. Int J Surg 2016; 36(Pt A): 347–351, https://doi.org/10.1016/j.ijsu.2016.06.042.
- Rodrigues F.T., Martins V.C.A., Plepis A.M.G. Porcine skin as a source of biodegradable matrices: alkaline treatment and glutaraldehyde crosslinking. Polímeros 2010; 20(2): 92–97, https://doi.org/10.1590/s0104-14282010005000013.
- Антипова Л.В., Сторублевцев С.А. Способ получения коллагеновой основы с асептическими свойствами. Патент РФ 2739396. 2020.
- Crapo P.M., Gilbert T.W., Badylak S.F. An overview of tissue and whole organ decellularization processes. Biomaterials 2011; 32(12): 3233–3243, https://doi.org/10.1016/j.biomaterials.2011.01.057.
- Lange P., Greco K., Partington L., Carvalho C., Oliani S., Birchall M.A., Sibbons P.D., Lowdell M.W., Ansari T. Pilot study of a novel vacuum-assisted method for decellularization of tracheae for clinical tissue engineering applications. J Tissue Eng Regen Med 2017; 11(3): 800–811, https://doi.org/10.1002/term.1979.
- Keane T.J., Swinehart I., Badylak S.F. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods 2015; 84: 25–34, https://doi.org/10.1016/j.ymeth.2015.03.005.
- Li D., Sun W.Q., Wang T., Gao Y., Wu J., Xie Z., Zhao J., He C., Zhu M., Zhang S., Wang P., Mo X. Evaluation of a novel tilapia-skin acellular dermis matrix rationally processed for enhanced wound healing. Mater Sci Eng C Mater Biol Appl 2021; 127: 112202, https://doi.org/10.1016/j.msec.2021.112202.
- Hoganson D.M., O’Doherty E.M., Owens G.E., Harilal D.O., Goldman S.M., Bowley C.M., Neville C.M., Kronengold R.T., Vacanti J.P. The retention of extracellular matrix proteins and angiogenic and mitogenic cytokines in a decellularized porcine dermis. Biomaterials 2010; 31(26): 6730–6737, https://doi.org/10.1016/j.biomaterials.2010.05.019.
- Gilbert T.W., Freund J.M., Badylak S.F. Quantification of DNA in biologic scaffold materials. J Surg Res 2009; 152(1): 135–139, https://doi.org/10.1016/j.jss.2008.02.013.
- Leow-Dyke S.F., Rooney P., Kearney J.N. Evaluation of copper and hydrogen peroxide treatments on the biology, biomechanics, and cytotoxicity of decellularized dermal allografts. Tissue Eng Part C Methods 2016; 22(3): 290–300, https://doi.org/10.1089/ten.tec.2015.0271.
- Биштаков Р.Б., Гарифуллина Р.А., Садыкова Г.У., Ломакин С.П. О коллагене и гидролизатах коллагена дермы. Столица науки 2021; 2: 23–27. URL: https://ftp.scientific-capital.ru/feb2021/0022021.pdf#page=24.
- Schwarz S., Koerber L., Elsaesser A.F., Goldberg-Bockhorn E., Seitz A.M., Dürselen L., Ignatius A., Walther P., Breiter R., Rotter N. Decellularized cartilage matrix as a novel biomatrix for cartilage tissue-engineering applications. Tissue Eng Part A 2012; 18(21–22): 2195–2209, https://doi.org/10.1089/ten.tea.2011.0705.
- Калмыкова Н.В., Демьяненко И.А., Шевлягина Н.В., Андреевская С.Г., Суслов А.П. Сравнительный анализ эффективности простого и многокомпонентного методов щелочной децеллюляризации на примере очистки волокнистого внеклеточного матрикса дермы. Морфологические ведомости 2016; 24(4): 36–45.
- Fernández-Pérez J., Ahearne M. The impact of decellularization methods on extracellular matrix derived hydrogels. Sci Rep 2019; 9(1): 14933, https://doi.org/10.1038/s41598-019-49575-2.
- Bordbar S., Lotfi Bakhshaiesh N., Khanmohammadi M., Sayahpour F.A., Alini M., Baghaban Eslaminejad M. Production and evaluation of decellularized extracellulеar matrix hydrogel for cartilage regeneration derived from knee cartilage. J Biomed Mater Res A 2020; 108(4): 938–946, https://doi.org/10.1002/jbm.a.36871.










