Редокс-чувствительные флуоресцентные наночастицы для биовизуализации злокачественных новообразований
Использование флуоресцентных редокс-чувствительных наночастиц в современной биомедицине обеспечивает высокую чувствительность и точность в биовизуализации. Наночастицы интересны тем, что способны долго циркулировать в крови, где уровень глутатиона относительно низкий, и разрушаться в клетках опухоли, высвобождая загруженные красители или лекарства.
Цель исследования — разработка новых наночастиц на основе тритиоциануровой кислоты для биовизуализации злокачественных новообразований и изучение их возможностей.
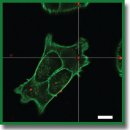
Материалы и методы. Наночастицы были получены путем поликонденсации тритиоциануровой кислоты с помощью йода. Для их характеризации использовали сканирующую и просвечивающую электронную микроскопию, загрузку флуоресцентных красителей оценивали спектрофотометрически. Влияние наночастиц на жизнеспособность клеточных линий 4Т1 и A549, а также взаимодействие их с клетками изучали с помощью конфокальной лазерной сканирующей микроскопии. Распределение наночастиц в тканях и органах модельных мышей BALB/c с привитой опухолью проводили методом флуоресцентной визуализации.
Результаты. Размер синтезированных частиц, по данным сканирующей микроскопии, составил 100±20 нм. Изотерма адсорбции показала, что возможно достижение адсорбции 0,27 мг флуоресцентного красителя RhB на 1 мг наночастиц. Продемонстрировано усиленное высвобождение запакованного флуоресцентного красителя в присутствии глутатиона и ацетилцистеина. Частицы не оказали значимого влияния на жизнеспособность клеток 4Т1 и А549. После интратуморального введения они обеспечили более интенсивный флуоресцентный сигнал в зоне опухоли по сравнению с простым раствором флуоресцентного красителя.
Заключение. Разработанная система наночастиц на основе тритиоциануровой кислоты продемонстрировала высокую эффективность для применения в биовизуализации злокачественных новообразований и потенциально — в целевой доставке терапевтических агентов.
- Wolfbeis O.S. An overview of nanoparticles commonly used in fluorescent bioimaging. Chem Soc Rev 2015; 44(14): 4743–4768, https://doi.org/10.1039/c4cs00392f.
- Li W., Kaminski Schierle G.S., Lei B., Liu Y., Kaminski C.F. Fluorescent nanoparticles for super-resolution imaging. Chem Rev 2022; 122(15): 12495–12543, https://doi.org/10.1021/acs.chemrev.2c00050.
- Lian W., Litherland S.A., Badrane H., Tan W., Wu D., Baker H.V., Gulig P.A., Lim D.V., Jin S. Ultrasensitive detection of biomolecules with fluorescent dye-doped nanoparticles. Anal Biochem 2004; 334(1): 135–144, https://doi.org/10.1016/j.ab.2004.08.005.
- Roy S., Bag N., Bardhan S., Hasan I., Guo B. Recent progress in NIR-II fluorescence imaging-guided drug delivery for cancer theranostics. Adv Drug Deliv Rev 2023; 197: 114821, https://doi.org/10.1016/j.addr.2023.114821.
- Al-Thani A.N., Jan A.G., Abbas M., Geetha M., Sadasivuni K.K. Nanoparticles in cancer theragnostic and drug delivery: a comprehensive review. Life Sci 2024; 352: 122899, https://doi.org/10.1016/j.lfs.2024.122899.
- Li Y., Chen Q., Pan X., Lu W., Zhang J. New insight into the application of fluorescence platforms in tumor diagnosis: from chemical basis to clinical application. Med Res Rev 2023; 43(3): 570–613, https://doi.org/10.1002/med.21932.
- Wang K., Du Y., Zhang Z., He K., Cheng Z., Yin L., Dong D., Li C., Li W., Hu Z., Zhang C., Hui H., Chi C., Tian J. Fluorescence image-guided tumour surgery. Nature Reviews Bioengineering 2023; 1(3): 161–179, https://doi.org/10.1038/s44222-022-00017-1.
- Shi Q., Xu J., Xu H., Wang Q., Huang S., Wang X., Wang P., Hu F. Polystyrene-based matrix to enhance the fluorescence of aggregation-induced emission luminogen for fluorescence-guided surgery. Small 2024; 20(22): e2309589, https://doi.org/10.1002/smll.202309589.
- Sutton P.A., van Dam M.A., Cahill R.A., Mieog S., Polom K., Vahrmeijer A.L., van der Vorst J. Fluorescence-guided surgery: comprehensive review. BJS Open 2023; 7(3): zrad049, https://doi.org/10.1093/bjsopen/zrad049.
- Bortot B., Mangogna A., Di Lorenzo G., Stabile G., Ricci G., Biffi S. Image-guided cancer surgery: a narrative review on imaging modalities and emerging nanotechnology strategies. J Nanobiotechnology 2023; 21(1): 155, https://doi.org/10.1186/s12951-023-01926-y.
- Ali M.K., Javaid S., Afzal H., Zafar I., Fayyaz K., Ain Q.U., Rather M.A., Hossain M.J., Rashid S., Khan K.A., Sharma R. Exploring the multifunctional roles of quantum dots for unlocking the future of biology and medicine. Environ Res 2023; 232: 116290, https://doi.org/10.1016/j.envres.2023.116290.
- Hang Y., Wang A., Wu N. Plasmonic silver and gold nanoparticles: shape- and structure-modulated plasmonic functionality for point-of-caring sensing, bio-imaging and medical therapy. Chem Soc Rev 2024; 53(6): 2932–2971, https://doi.org/10.1039/d3cs00793f.
- Farinha P., Coelho J.M.P., Reis C.P., Gaspar M.M. A comprehensive updated review on magnetic nanoparticles in diagnostics. Nanomaterials (Basel) 2021; 11(12): 3432, https://doi.org/10.3390/nano11123432.
- Ansari M.A., Shoaib S., Chauhan W., Gahtani R.M., Hani U., Alomary M.N., Alasiri G., Ahmed N., Jahan R., Yusuf N., Islam N. Nanozymes and carbon-dots based nanoplatforms for cancer imaging, diagnosis and therapeutics: current trends and challenges. Environ Res 2024; 241: 117522, https://doi.org/10.1016/j.envres.2023.117522.
- Hossain M.K., Khan M.I., El-Denglawey A. A review on biomedical applications, prospects, and challenges of rare earth oxides. Applied Materials Today 2021; 24: 101104, https://doi.org/10.1016/j.apmt.2021.101104.
- Ng K.K., Zheng G. Molecular interactions in organic nanoparticles for phototheranostic applications. Chem Rev 2015; 115(19): 11012–11042, https://doi.org/10.1021/acs.chemrev.5b00140.
- Chen M., Liu D., Liu F., Wu Y., Peng X., Song F. Recent advances of redox-responsive nanoplatforms for tumor theranostics. J Control Release 2021; 332: 269–284, https://doi.org/10.1016/j.jconrel.2021.02.030.
- Zhu C., Hu W., Wu H., Hu X. No evident dose-response relationship between cellular ROS level and its cytotoxicity — a paradoxical issue in ROS-based cancer therapy. Sci Rep 2014; 4: 5029, https://doi.org/10.1038/srep05029.
- Tobwala S., Fan W., Hines C.J., Folk W.R., Ercal N. Antioxidant potential of Sutherlandia frutescens and its protective effects against oxidative stress in various cell cultures. BMC Complement Altern Med 2014; 14: 271, https://doi.org/10.1186/1472-6882-14-271.










